Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.25 no.3 Trujillo set./dic. 2018
http://dx.doi.org/10.22497/arnaldoa.253.25303
ARTÍCULOS ORIGINALES
Cactaceae del distrito de Atiquipa y del Área de Conservación Privada Lomas de Atiquipa: aspectos taxonómicos, ecológicos y de distribución
Cactaceae of the district of Atiquipa and of the Lomas of Atiquipa Private Conservation Area: taxonomic, ecological and distribution aspects
Anthony Pauca1, 2, Carmelo Talavera1,3, Francisco Villasante1,3, Johana Quispe1, Marcelina Laura1
1. Instituto de Ciencia y Gestión Ambiental de la Universidad Nacional de San Agustín de Arequipa. Calle San Agustín 108, Arequipa, PERÚ
2. Instituto Científico Michael Owen Dillon (IMOD). Los Arces 339, Cayma, Arequipa, PERÚ. Correo: gpaucat@unsa.edu.pe
3. Universidad Nacional de San Agustín de Arequipa, Departamento Académico de Biología. Daniel Alcides Carrión s/n La Pampilla, Arequipa, PERÚ
Resumen
La familia Cactaceae es un grupo de plantas suculentas que presenta dificultades en su taxonomía. La importancia ecológica radica en que cumplen un papel fundamental en el mantenimiento de los ecosistemas áridos, brindando servicios ecosistémicos tales como la protección del suelo contra la erosión e infiltración de agua, actuando como nodrizas, brindando alimento y cobijo a animales. Se realizaron visitas de campo desde el año 2013 hasta el 2016, abarcando desde los 0 hasta los 2900 m de altitud. En campo se anotaron características morfológicas y ecológicas, y se tomaron fotografías de cada especie y sus hábitats. Para determinar y describir las especies se usaron los datos registrados en campo, se revisaron muestras del Herbario Sur Peruano (HSP) y del Herbarium Areqvipense (HUSA) y se consultó bibliografía especializada. Se determinaron 15 géneros y 20 especies, donde 13 y 8 especies son endémicas de Perú y Arequipa, respectivamente. Se observó que las flores son visitadas en su mayoría por murciélagos, aves e insectos; su floración se presenta generalmente al término de la época húmeda, tanto en la comunidad de lomas como en las vertientes occidentales. La mayor diversidad de cactus se distribuye desde los 600 hasta los 1200 m, donde la humedad es escasa y los suelos presentan bajo contenido orgánico. Adicionalmente, se incluye una clave dicotómica para los géneros y especies presentes en el distrito de Atiquipa y en el Área de Conservación Privada Lomas de Atiquipa.
Palabras clave: Cactoideae, ecosistemas costeros, interacciones, Opuntioideae.
Abstract
The Cactaceae family is a group of succulent plants that presents difficulties in their taxonomy. Their ecological importance is related to their fundamental role in the maintenance of arid ecosystems, providing ecosystem services such as soil protection against erosion and water infiltration, acting as nurses, providing food and shelter to animals. Field visits were conducted from 2013 to 2016, ranging from 0 to 2900 m of altitude. In the field, morphological and ecological characteristics were recorded, and photographs of each species and their habitats were taken. To determine and describe the species, the data recorded in the field were used, samples from the South Peruvian Herbarium (HSP) and the Herbarium Areqvipense (HUSA) were reviewed and specialized bibliography was consulted. We determined 15 genera and 20 species, where 13 and 8 species are endemic to Peru and Arequipa respectively. We observed that the flowers are visited mostly by bats, birds and insects; their flowering usually occurs at the end of the wet season, both in the hillside community and in the western slopes. The greatest diversity of cactus is distributed from 600 to 1200 m, where humidity is scarce and soils have low organic content. Additionally, a dichotomous key is included for the genera and species present in the district of Atiquipa and in the Lomas de Atiquipa Private Conservation Area.
Keywords: Cactoideae, coastal ecosystems, interactions, Opuntioideae.
Introducción
La familia Cactaceae es endémica del continente Americano, su origen probable se dio en el Oligoceno hace 30- 35 millones de años en los Andes centrales de Sudamérica. Más adelante, hace 5 a 10 millones de años, durante el Plioceno tardío hacia el Mioceno, se diversificó en Norteamérica, este de Brasil, y las zonas áridas y semiáridas al suroeste de los Andes en los países de Perú, Bolivia, Chile y Argentina (Anderson, 2001; Wallace & Dickie, 2002; Arakaki et al., 2011).
Perú al considerarse como uno de los centros de diversidad de cactáceas, presenta un número considerable de especies, de las cuales muchas son endémicas. Algunos autores refieren la presencia de 37-40 géneros y 172-262 especies (Rauh, 1958; Ritter, 1981; Brako & Zarucchi, 1993; Anderson, 2001; Hunt et al., 2006; Ostolaza, 2011; Ostolaza, 2014), y para el caso de endemismos se indica 6-11 géneros y 186-199 especies (Brako & Zarucchi, 1993; Arakaki et al., 2006). Para el departamento de Arequipa existen 15-20 géneros y 42-55 taxones (Backeberg, 1958-1962; Ritter, 1981; Brako & Zarucchi, 1993;Ostolaza, 2014; Pauca & Quipuscoa, 2017) de los cuales 20 son endémicos (Arakaki et al., 2006; Pauca & Quipuscoa, 2017).
Según la clasificación de Galán de Mera et al. (2009, 2010), el departamento de Arequipa presenta cinco pisos bioclimáticos y seis intervalos de humedad; los pisos bioclimáticos en un orden ascendente de altitud corresponden al termotropical, mesotropical, supratropical, orotropical y criorotropical. En el caso del distrito de Atiquipa sus pisos bioclimáticos corresponden al termotropical y mesotropical, siendo los intervalos de humedad hiperárido, ultrahiperárido, árido y árido-semiárido. El piso termotropical se encuentra aproximadamente desde los 0 hasta los 2100 m, abarcando las zonas muy próximas a la costa, las lomas costeras, el tablazo desértico y parte de las vertientes occidentales; además se caracteriza por la escasa humedad que va desde los 0 hasta los 300 mm de lluvia y un alto índice de termicidad (it) de 490-730. Sin embargo, en Atiquipa se presenta una situación especial, ya que sus lomas pueden presentar precipitaciones de 300 a 500 mm, lo que se clasifica como un ombroclima seco. La vegetación característica de este piso corresponde a plantas herbáceas, tales como Nolana spathulata, Palaua dissecta, Palaua weberbaueri, Tillandsia purpurea, y cactus como Islaya islayensis y Neoraimondia arequipensis (Galán de Mera et al., 2009; Galán de Mera et al., 2010). El piso mesotropical se encuentra desde los 2100 hasta los 3100 m, se caracteriza por presentar precipitaciones de 30 hasta 300 mm y un índice de termicidad (it) de 320-490. En este piso se encuentran las vertientes occidentales, que se caracterizan por sus suelos mayormente alcalinos y de poca profundidad, el agua es retenida en pocas cantidades, por lo que durante las lluvias de verano se presenta una fuerte escorrentía. La vegetación predominante es de tipo arbustivo, donde las especies indicadoras corresponden a suculentas, tales como: Armatocereus riomajensis, Corryocactus aureus y Euphorbia apurimacensis (Galán de Mera et al., 2009; Galán de Mera et al., 2010; Mostacero et al., 2007; Sociedad Geográfica de Lima, 1990).
Las cactáceas cumplen un rol ecológico importante dentro de sus ecosistemas, y que nosotros las caracterizamos como "ejes principales" de los ecosistemas áridos, ya que brindan alimento a través del néctar y frutos a distintos mamíferos, aves e insectos. Sus tallos son usados como refugio por algunas aves, y actúan como nodrizas, facilitando las condiciones necesarias para la germinación de las semillas, y desarrollo de las plántulas (Ostolaza, 2014; Ceroni et al., 2007; Novoa et al., 2003; Sahley, 1996). Las cactáceas también brindan otros servicios ecosistémicos, como por ejemplo, la protección del suelo por medio de sus raíces fibrosas, impidiendo la erosión, o cuando se las encuentra en altas densidades, áreas conocidas como "bosques de cactus", que tienen un gran potencial para ser aprovechados como atractivo turístico. Debido a estas consideraciones, es imprescindible entender la diversidad, distribución y ecología de las cactáceas, para poder proponer y emprender medidas para su conservación, como también incentivar investigaciones relacionadas a esta familia que es tan diversa.
Materiales y métodos
Área de estudio
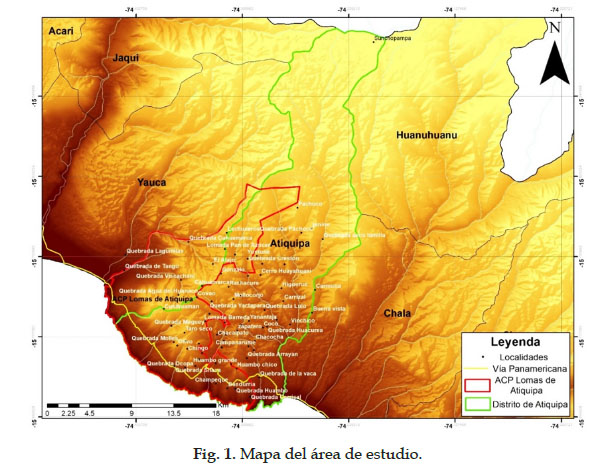
La zona de estudio corresponde al distrito de Atiquipa y el Área de Conservación Privada (ACP) Lomas de Atiquipa, localizados en la provincia de Caravelí, en el departamento de Arequipa. Se sitúa entre los 15º40’ y 15º50´ de LS, y los 74º18´ y 74°30’ de LO. Posee una franja costera de aproximadamente 20 km que en su mayoría son acantilados y dos playas arenosas. Por encima del litoral, se localizan algunas llanuras con ligera pendiente, las cuales son atravesadas por cauces secos, que en época muy húmeda transportan agua hacia el mar. Al finalizar estas pequeñas llanuras, se levantan los cerros pertenecientes a la cordillera costera, que en época invernal, gracias a las neblinas y algunas precipitaciones provenientes del océano, se cubren de vegetación. Pasando la cordillera costera se encuentra la franja desértica, la cual es atravesada por quebradas y algunas elevaciones. Cerca a los 2300 m se presenta una gran cantidad de rocas, lo que incluso se puede asemejar a un batolito. Posterior a esta formación, existe una planicie que se extiende hasta los 2900 m, cuyo suelo es arenoso con presencia de rocas dispersas. Esta llanura es atravesada por cursos de agua secos, los cuales en su cauce presentan gran cantidad de arena.
Metodología
Se realizaron visitas de campo desde el año 2013 hasta el 2016, abarcando desde los 0 hasta los 2900 m. In situ, se observaron y anotaron características del hábito, caracteres de flores y frutos, número de costillas, número de espinas, especies acompañantes, fecha de floración, de fructificación y visitantes florales. El registro de los visitantes florales se realizó mediante observación directa sobre los individuos que se encontraron en floración, el tiempo de observación se realizó en intervalos de 10 a 30 minutos por cada individuo. Además, se registró con un GPS, las coordenadas geográficas y la altitud, se tomaron fotografías de cada especie y sus hábitats. Para la determinación y descripción de los taxones, se analizaron los datos registrados en campo, se revisaron muestras depositadas en el Herbario Sur Peruano (HSP) y el Herbarium Areqvipense (HUSA) y se consultó bibliografía especializada. Finalmente, se elaboró una clave taxonómica del tipo dicotómico para la determinación de los especímenes.
Resultados
Se registró un total de 20 especies, agrupadas en 15 géneros y 2 subfamilias.
1. Subfamilia Opuntioideae
1.1. Cumulopuntia tumida F. Ritter
Diagnosis: Arbustivo. Tallos esféricos u ovoides, de 6.5 de diámetro y hasta 10 cm de largo. Areolas de 6 mm de diámetro, con 0 a 8 espinas de hasta 4.5 m de largo, algunas veces con 1-3 espinas centrales. Flores amarillas, diurnas, de 2.4-2.6 cm de largo y 2.4-7 cm de diámetro en la antesis; areolas del pericarpelo con hasta 4 espinas de 0.35-0.55 cm de largo; numerosos estambres; estilo de 1.95 cm de largo, 5 ramas estigmáticas. Fruto globular achatado, amarillo verdoso, de 2.5-3 cm de diámetro. Semillas reniformes, cremas.
Ecología y distribución: endémica de Perú y Arequipa. En la comunidad de lomas se encuentran de 90 hasta 1200 m y en las vertientes occidentales de Atiquipa desde los 2500 hasta los 2600 m. En las lomas se localizan en las faldas, a sotavento de los cerros y en la cima de los cerros Cusihuamán y Cahuamarca, en laderas y fondo de quebradas secas, en ambientes altamente soleados durante todo el año, sobre suelos más o menos arenosos, guijarrosos y rocosos. Es una especie poco tolerante a ambientes húmedos. Se presenta en forma de cojines laxos y como individuos aislados. Los visitantes florales son en su mayoría aves de la familia Trochilidae (colibríes) e insectos del orden Coleóptera e Himenóptera. En las vertientes occidentales, las poblaciones se encuentran sobre planicies de suelos arenosos con algunas rocas al piedemonte andino, en ambientes completamente soleados durante todo el año y con escasas precipitaciones en verano. Florece durante toda la primavera pudiendo alcanzar gran parte del verano austral.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Cerro Cusihuamán. 15°45’16.59’’ S – 74°24’44.66’’ O, 1217 m, 17 de mayo del 2014, A. Pauca 387 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Cerro Cahuamarca 15°43’45.1’’ S – 74°22’13.3’’ O, 1267 m, 5 de mayo del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 173 (HUSA).
1.2. Cylindropuntia rosea (DC.) Backeb.
Diagnosis: Arbustivo, de hasta 60 cm de alto. Tallos cilíndricos de 1.6-2.5 cm de diámetro verdes grisáceos. Areolas de 0.7-5 mm de diámetro, blanco-amarillentas. Espinas 7-10, rojizas-amarillentas, hasta grises, de 1-4 cm de largo, cubiertas con un estuche papiráceo. Flores de color rosado, de 3.8-4 cm de largo; androceo con numerosos estambres; gineceo con ovario ínfero, estilo y estigma de color verde. Fruto bacciforme, umbilicado, amarillento. Semillas lenticulares, negruzcas.
Ecología y distribución: Especie introducida. Se le encuentra en las zonas más secas de las lomas de Atiquipa, entre los 1000 a 1250 m, en los cerros Cusihuamán y Cahuamarca. Sus poblaciones se ubican en ambientes soleados, completamente despejados durante todo el año con escasas a nulas precipitaciones; sobre suelos arenosos, guijarrosos y rocosos. Florece al final del periodo invernal y fructifica durante la primavera; sus flores son visitadas por himenópteros, las areolas de los tallos producen una sustancia azucarada la cual es aprovechada por formícidos (hormigas). Se trata de una especie con escasos tamaños poblacionales y restringidos solo a la parte alta de los cerros.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Cerro Cusihuamán. 15°45’9.86’’ S – 74°24’16.74’’ O, 1235 m, 15 de diciembre del 2013, A. Pauca 378 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Cusihuamán. 15°45’2.3’’ S – 74°23’53.3’’ O, 1210 m, 19de noviembre del 2005, M. Laura Q., L. Villegas P., V. Ccasa A., J, Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 181 (HUSA).
1.3. Opuntia pestifer Britton & Rose
Diagnosis: Arbustivo, de hasta 40 cm de alto. Tallos cilíndricos, teretes, rticulados, de 4.5-6.5 cm de largo y 1.4-1.6 cm de diámetro. Areolas de 2 mm de diámetro. De 5 a 8 espinas, de hasta 1 cm de largo, parduzcas, posteriormente grises. Flores amarillas, de 3-5 cm de diámetro en la antesis; androceo con numerosos estambres; estilo cilíndrico, amarillento, 5 estigmas amarillentos los cuales presentan un estructura unguiliforme en la parte apical. Fruto bacciforme, verdoso- amarillento, umbilicado, con pequeñas espinas y gloquídios.
Ecología y distribución: Distribuida en Ecuador, Perú y Bolivia. En las comunidades de lomas se encuentran en los alrededores y dentro del bosque de tara, desde los 400 hasta los 900 m, en las quebradas de Taro seco, Huayahuani, Ratonera y Ávalos. Ocupa ambientes degradados, parcialmente soleados, sobre suelos de ladera arcillosos y con presencia de rocas de tamaño regular y puede soportar condiciones húmedas. Florece al final de la estación húmeda y su floración es de corta duración, sus flores son visitadas por himenópteros. Se presentan como individuos escasos y aislados.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Ávalos. 15°45’41’’ S – 74°22’42.8’’ O, 920 m, 21 de febrero del 2005, M. M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 169 (HUSA).
1.4. Opuntia stricta (Haw.) Haw.
Diagnosis: Arbustivo. Tallos aplanados de hasta 30 cm de largo y 13 cm de diámetroetro. Areolas con pelos, gloquídios y espinas. De 2-8 espinas de hasta 5 cm de largo. Flores amarillas o rosadas-naranjadas, de 7.1 cm de largo y 5 cm de diámetroen la antesis; androceo con numerosos estambres; estilo inserto, 5 ramas estigmáticas. Fruto ovoide de 4 cm de diámetro, color rojo. Semillas globosas, arilo de color rojo-violáceo.
Ecología y distribución: Especie procedente de Norte América. Se desarrolla en los alrededores del bosque de lomas, en las quebradas de Taro Seco, Ratonera, Avalos, Pueblo y Parra, desde los 400 hasta los 900 m. Ocupa ambientes parcialmente soleados con alta presencia de neblinas en la estación húmeda, crece sobre suelos rocosos y arcillosos con poca retención de humedad. Florece durante la estación húmeda y puede alcanzar a la estación seca, sus flores son visitadas por aves troquílidas e insectos himenópteros. Sus frutos sirven de alimento para aves y hormigas.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Ávalos. 15°45’41’’ S – 74°22’42.8’’ O, 920 m, 21 de febrero del 2005, M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 169 (HUSA).
2. Subfamilia Cactoideae
2.1. Armatocereus matucanensis Backeb.
Diagnosis:Arborescente, de hasta 4 m de alto. Tallos articulados de 40-60 cm de largo. De 6-7 costillas. Areolas de 9 mm de diámetro. 18 espinas grises, una espina central de hasta 8.8 cm de largo, espinas radiales de hasta 1.5 cm de largo. Flores blancas, de 9 cm de largo y 7 cm de diámetro en la antesis, nocturnas; tubo del perigonio con brácteas, pelos, cerdas y espinas, 16 espinas de color marrón-negro de hasta 1 cm de largo; numerosos estambres; estilo de 5.5 cm de largo, 16 ramas estigmáticas. Fruto globoso, espinoso, verde, de 7.5 cm de diámetro. Semillas negras, rugosas, con brillo.
Ecología y distribución: Endémica de Perú. Se desarrollan en zonas secas a subhúmedas de las comunidades de lomas, entre los 350 hasta los 550 m, sobre la cima de laderas de las quebradas El Castillo, Huayauani y en el cerro Huambo, y desde los 1100 hasta los 1265 m en el cerro Cahuamarca, ocupando ambientes tanto soleados como nubosos con mediana presencia de neblina y sobre suelos lateríticos con poca presencia de guijarros, generalmente franco arcillosos. Florece generalmente durante y al final del periodo invernal pudiendo alcanzar la estación seca, fructifica durante la primavera y parte del verano, sus flores son visitadas por insectos Coleópteros y Lepidópteros (Sphingidae), los frutos en la madurez sirven de alimento para aves, avispas y hormigas.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada El Castillo. 15°45’56.12’’ S – 74°20’45.8’’ O, 347 m, 18 de febrero del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 166 (HUSA).
2.2. Browningia candelaris (Meyen) Britton & Rose
Diagnosis: Arborescente, de hasta 4 m de alto. Tallo central entre 2-2.5 m de alto, las ramas de hasta 2 m de largo, ascendentes. Areolas de hasta 1 cm de diámetro. 20-50 espinas en el tallo central, entre 6-15 cm de largo; las ramas no presentan espinas, generalmente con cerdas. Flor blanca, con aroma agradable, de 9.5-10.4 cm de largo; 7-8.5 cm de diámetro en la antesis; tubo del perigonio algo curvado, de 1.5-1.6 cm de diámetro, cubierto por brácteas de hasta 3.5 cm de largo; androceo con numerosos estambres; hipanto de 1.7 cm de diámetro.
Fruto ovoide, de 5 cm de diámetro, cubierto por brácteas, de color verde amarillento. Semillas negras, rugosas, sin brillo.
Ecología y distribución: Conocida en Perú y Chile. Se le encuentra en zonas muy áridas y secas, a los 1500 m en el paraje llamado Quebrada Seca, fuera de los límites de las lomas y entre los 2400 hasta los 2600 m en el paraje denominado Sunchopampa, en el piedemonte alto andino de las vertientes occidentales. En ambos casos, se le encuentra en laderas y cimas de cerros, en ambientes completamente soleados durante todo el año y recibiendo la influencia de la humedad proveniente del mar y de las pocas precipitaciones que alcanzan a llegar al piedemonte. Así mismo, la floración ocurre hacia el final del invierno. Es una especie ausente en las comunidades de lomas y se presentan como individuos aislados.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada Seca. 15°42’35.76’’ S – 74°15’36.74’’ O, 1185 m, 2 de febrero del 2014, A. Pauca 415 (HSP).
2.3. Corryocactus brachypetalus (Vaupel) Britton & Rose
Diagnosis: Arbustivo, de hasta 1.4 m de alto. Tallos de 8-10 cm de diámetro. De 5-6 costillas. Areolas de hasta 1.1 cm de diámetro. 6-15 espinas, rojizas-marrones, hasta grises; 1 espina central de hasta de 6.8 cm de largo; espinas radiales de hasta 0.34 cm de largo. Flores anaranjadas, diurnas, de 8.8 cm de largo y 4 cm de diámetro en antesis; tubo del perigonio con brácteas, lana, cerdas y espinas; numerosos estambres; estilo de 2.6 cm de largo, 17 a más ramas estigmáticas. Fruto globoso, de 3-5 cm de diámetro, amarillo- verdoso, con muchas espinas. Semillas negras, reniformes, rugosas, sin brillo.
Ecología y distribución: Endémica de Perú. Se desarrolla en las partes más secas de las comunidades de lomas, así como en los alrededores del bosque de tara desde los 50 hasta los 1260 m, ocupando ambientes soleados durante la mayor parte del año y recibiendo la influencia de la brisa marina y las neblinas del periodo invernal, sobre suelos planos arcillo-arenosos con abundante presencia de piedras, guijarros y rocas de tamaño mediano. Se encuentran en mayor densidad en las localidades de Silaca, Vizcachani y Cahuamarca. Florece hacia el final del periodo húmedo invernal de las lomas y los inicios de la estación seca, sus flores son visitadas por himenópteros y troquílidos. Es una especie bastante conspicua y medianamente abundante, sobre todo en Silaca y la parte baja de Vizcachani; sin embargo, sus poblaciones pueden verse amenazadas ya que ocupa lugares que están sometidos a sobrepastoreo por rebaños de cabras, vacunos y equinos.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, A mitad del cerro Cahuamarca. 15°43’45.47’’ S – 74°22’33.28’’ O, 1101 m, 21 de julio del 2014, A. Pauca 404 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Taro Seco. 15°46’30.7’’ S – 74°23’21.5’’ O, 1084 m, 21 de febrero del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 167 (HUSA).
2.4. Corryocactus prostratus F. Ritter
Diagnosis: Arbustivo. Tallo rastreros, decumbentes, de 5-6 cm de diámetro. De 4-6 costillas. Areolas de 7-10 mm de diámetro. De 7-13 espinas; 1-3 espinas centrales de hasta 10 cm de largo; 6-10 espinas radiales de hasta 4 cm de largo. Flores amarillas, diurnas, de 4-6 cm de largo y 4.5 cm de diámetro en la antesis. Frutos globulares, rojizos, cubiertos por espinas, de 3 cm de diámetro. Semillas negruzcas, pequeñas, reniformes, rugosas, sin brillo.
Ecología y distribución: Especie endémica de Perú y Arequipa. Crecen en las zonas áridas del extremo superior de las lomas, sobre las pendientes del cerro Cahuamarca, desde los 1000 hasta los 1100 m. Ocupa ambientes soleados con poca influencia de las neblinas costeras, sobre suelos de pendientes abruptas tapizados con guijarros, piedras y rocas de tamaño regular. Florece durante el periodo húmedo invernal y es de corta duración.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, A mitad del cerro Cahuamarca. 15°43’43.5’’ S – 74°22’37.9’’ O, 1046 m, 23 de octubre del 2014, A. Pauca 510 (HSP).
2.5. Eulychnia ritteri Cullman
Diagnosis: Arborescente, de hasta 3 m de alto. Tallos cilíndricos, de 10-15 cm de diámetro. De 11-13 costillas. Areolas de 8 mm de diámetro. De 9-11 espinas, de hasta4.8 cm de longitud. Flores diurnas, rosadas, de 2-4 cm de largo y 2-4 cm de diámetro en la antesis; tubo del perigonio con brácteas y pelos; estambres numerosos; estilo de 11 mm de largo, 12 ramas estigmáticas. Fruto globoso, amarillo-naranja, de 3 cm de diámetro, cubierto de pelos y escamas. Semillas marrones oscuro, reniformes, rugosas, sin brillo.
Ecología y distribución: Endémica de Perú y Arequipa. Restringida a las quebradas de los alrededores de las comunidades de lomas. Se encuentra desde los 500 hasta los 900 m en la Quebrada Vizcachani, donde se encuentra la mayor población y en los cerros Cusihuaman, Cahuamarca y la Quebrada el Tajo en donde su densidad es muy baja. Ocupa ambientes con escasa influencia de neblinas, sobre suelos lateríticos impregnados de piedras y rocas de tamaño regular. Florece durante la primavera y verano durante un corto periodo, la fructificación se produce durante el verano, sus flores son visitadas por himenópteros y troquílidos, sus frutos sirven de alimento a mamíferos pequeños e insectos.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, A mitad del cerro Cusihuamán. 15°43’45.47’’ S – 74°22’33.28’’ O, 1101 m, 23 de julio del 2014, A. Pauca 405 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Vizcachani. 15°42’51.1’’ S – 74°23’51’’ O, 600 m, 5 de mayo del 2005, M. Laura Q., L. Villegas P., V. Ccasa A., J, Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M.185 (HUSA).
2.6. Haageocereus decumbens (Vaupel) Backeb.
Diagnosis: Arbustivo, rastreros, decumbentes. Tallos de 3.8-4.5 cm de diámetro. De 15-16 costillas. Areolas de 3.5 mm de diámetro. De 37-40 espinas, dos espinas centrales de hasta 3 cm de largo, al inicio pardo-rojizas, más tarde grises; 36-40 espinas radiales de hasta 6 mm de largo. Flores blancas, nocturnas, de 7.8-10.5 cm de largo y 5-8 cm de diámetro en la antesis; tubo del perigonio con escamas y pelos; estambres numerosos; estilo de 5.3 cm de largo, con 13 ramas estigmáticas. Fruto globoso, rosado o rojizo, de hasta 4 cm de diámetro. Semillas negras, lustrosas, rugosas.
Ecología y distribución: Distribuido en Perú y Chile. Se desarrolla en las zonas más secas de los alrededores de las lomas de Atiquipa desde los 50 hasta los 1200 m. Se localiza en lugares como Silaca, Vizcachani, Ayparipa, Cusihuamán, Cahuamarca, alrededores del pueblo de Atiquipa, Santa Rosa, Agua Salada, Ocopa y Quebrada Seca. Ocupa ambientes soleados todo el año pero con influencia de la brisa marina y neblinas esporádicas que provienen de las lomas, especialmente en la parte baja de éstas y sobre suelos cascajosos, arenosos hasta guijarrosos y de poca humedad. Florecen hacia el final del periodo húmedo invernal y comienzos de la estación seca, sus flores son visitadas por esfíngidos y coleópteros. Los frutos son consumidos por aves, zorros y hormigas.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Pampa de Ayparipa. 15°49’32.37’’ S – 74°22’36.41’’ O, 137 m, 22 de julio del 2014, A. Pauca 400 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Ocopa. 15°49’0.61’’ S – 74°25’32.1’’ O, 203 m, 23 de febrero del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 170 (HUSA).
2.7. Haageocereus platinospinus (Werderm. & Backeb.) Backeb.
Diagnosis: Arbustivo. Tallos decumbentes, ascendentes, de 5 a 8 cm de diámetro. De 13 a 15 costillas. Areolas de 5 mm de diámetro. De 14-17 espinas, amarillentas en la base y pardas hacia el ápice; hasta 4 centrales de 7 cm de largo, una de ellas dirigida hacia la base del tallo; 10-13 espinas radiales de hasta 1.5 cm de largo. Flores blancas, nocturnas, de 8 cm de largo y 6 cm de diámetro en la antesis; tubo del perigonio con escamas y pelos; con estambres numerosos. Fruto globoso, rosado o rojizo, de hasta 4 cm de diámetro. Semillas negras, pequeñas, lustrosas.
Ecología y distribución: endémico de Perú. Se encuentra restringida a una pequeña zona en Quebrada Seca desde los 750 hasta los 800 m. Ocupa ambientes áridos y soleados pero con influencia de neblinas esporádicas que provienen del litoral marino, sobre suelos lateríticos pedregosos a rocosos. Florece durante la estación invernal y su floración es de corta duración y dependiente de la humedad proveniente del mar.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Sunchopampa. 15°41’51’’ S – 74°15’17’’ O, 826 m, 11 de noviembre del 2014, A. Pauca 535 (HSP).
2.8. Haageocereus subtilispinus F. Ritter
Diagnosis: Arbustivo, erecto o ascendente, hasta 70 cm de alto, de 3.5-4.5 cm de diámetro. De 13-15 costillas. Areolas de 4 mm de diámetro. 53 espinas aciculares; una espina central de hasta 11 cm de largo, 2-4 de menor tamaño, de 5-6 cm de largo, espinas radiales de hasta 0.8 cm de largo. Flores blancas, nocturnas, de 8.8-9.3 cm de largo y 4.3 cm de diámetro en la antesis; tubo del perigonio con brácteas y pelos; estambres numerosos; estilo de 10 cm de largo, 13 ramas estigmáticas. Fruto globoso, de color rosa o rojo, de 5.5 cm de diámetro. Semillas negras, algo rugosas, brillantes.
Ecología y distribución: especie endémica de Perú y Arequipa. Se desarrollan en las zonas secas de los alrededores de las lomas de Atiquipa desde los 50 hasta los 1100 m en las quebradas de Silaca, Ayparipa, Ocopa, Vizcachani, y en el cerro Cusihuamán. Ocupa ambientes completamente áridos y soleados con escasa influencia de humedad, sobre suelos rocosos. Florece después del periodo húmedo invernal, es de corta duración y dependiente de una alta humedad atmosférica; sus flores son visitadas por esfíngidos, coleópteros y quirópteros, los frutos son consumidos por aves, cánidos (zorros) e insectos.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Pampa de Ayparipa. 15°49’32.37’’ S – 74°22’36.41’’ O, 137 m, 22 de julio del 2014, A. Pauca 398 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Ocopa. 15°49’06.1’’ S – 74°25’32.1’’ O, 178 m, 23 de febrero del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 170 (HUSA).
2.9. Islaya islayensis Backeb.
Diagnosis: Arbustivo. Tallo globular, o a veces cilíndrico, de hasta 30 cm de alto y 20 de diámetro. De 16-20 costillas. Areolas de 0.8 cm de diámetro. Espinas de 0.5-1.4 cm de largo, amarillas, posteriormente grises. Flores amarillas, diurnas, de 2.8-3.3 cm de largo y 2.7-3 cm de diámetro en la antesis; tubo del perigonio con escamas, pelos y cerdas; estambres numerosos; estilo de 8-8.5 mm de largo, 7-11 ramas estigmáticas. Fruto seco, globoso a oblongos, de color rosa, de 3.6-4.7 cm de largo y 1.2-7 cm de diámetro. Semillas negras, reniformes, sin brillo.
Ecología y distribución: En Perú y Chile. Se encuentra en lugares secos, en la parte baja de las lomas y cercanos al litoral costero (Agua Salada, Silaca, Ocopa, Ayparipa, Moca) y Quebrada Vizcachani, desde los 100 hasta los 600 m. Ocupa ambientes soleados, sobre suelos arcillosos, guijarrosos, pedregosos y rocosos con mediana a casi nula humedad. Florece durante el periodo invernal y su floración puede alcanzar hasta la estación seca, sus flores son visitadas por himenópteros.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Pampa de Ayparipa. 15°49’32.37’’ S – 74°22’36.41’’ O, 137 m, 22 de julio del 2005, A. Pauca 399 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Ocopa15°49’06.1’’ S – 74°25’32.1’’ O, 112 m, 23 de febrero del 2005, M. Laura Q., V. Ccasa A., J. Churata S., J. Mamani A. & V. Mamani M. 175 (HUSA).
2.10. Loxanthocereus gracilis Backeb.
Diagnosis: Arbustivo. Tallos cilíndricos, postrados, rastreros, con raíces adventicias, verde-violáceos, de 3.8-4 cm de diámetro. De 9-10 costillas tuberculadas. Areolas afelpadas con lana corta, de 3 mm de diámetro. De 11-14 espinas, 3-4 espinas centrales de hasta 5.8 cm de largo, 7-10 espinas radiales de hasta 1.4 cm de largo, amarillas-marrón, posteriormente grises. Flores de color rojo-naranja; tubo del perigonio con brácteas y pelos blancos; estambres numerosos; gineceo con ovario ínfero; estilo de 7.5-8.5 cm de largo con 6 ramas estigmáticas verdes. Fruto esférico, verde-rojizo, de sabor dulce, de 2.5 cm de diámetro. Semillas reniformes, rugosas, sin brillo.
Ecología y distribución: especie endémica de Perú y Arequipa. Se localizan en zonas rocosas de Silaca, Taro Seco, laderas de los cerros Cusihuamán, Cahuamarca y Ocopa y en la parte baja del pueblo de Atiquipa (quebrada de Julio). Se le encuentra en ambientes áridos y semiáridos de las lomas, desde los 180 hasta los 1000 m, con influencia variable de las neblinas costeras, y hasta lugares completamente soleados, sobre suelos preferentemente rocosos. Florece hacia el final del periodo húmedo invernal, pudiendo alcanzar el periodo seco; sus flores son visitadas por troquílidos e himenópteros, los frutos son consumidos por aves.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Julio. 15°47’55.67’’ S – 74°21’33.8’’ O, 250 m, 10 de agosto del 2013, A. Pauca 373 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Silaca. 15°47’49.5’’ S – 74°24’32.2’’ O, 350 m, 6 de noviembre del 2005, M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 173 (HUSA).
2.11. Loxanthocereus peculiaris Rauh & Backeb.
Diagnosis: Arbustivo. Tallos erectos, de hasta de 45 cm de alto y 5-5.5 cm de diámetro. 15 costillas. Areolas de 3mm de diámetro, con lana y espinas. 17 espinas de coloración amarillo-rojiza, más tarde grises. Hasta 17 espinas; 3 centrales, de hasta 3.2 cm de largo; 14 radiales, de hasta 0.8 cm de largo. Flores rojizas-naranja, de 6.7 cm de largo y 2.4 cm de diámetroen la antesis; tubo del perigonio con brácteas y pelos; estambres numerosos; estilo exerto o inserto, con 9o más ramas estigmáticas. Fruto globoso, rojizo, de 2 cm de diámetro. Semillas pequeñas, rugosas, sin brillo.
Ecología y distribución: especie endémica de Perú. Se encuentra en las zonas más áridas y secas de los alrededores de las lomas de Atiquipa, ocupando ambientes completamente soleados durante todo el año en la Quebrada Vizcachani y en las cimas de los cerros Cusihuamán y Cahuamarcadesde los 700 hasta los 1200 m, sobre suelos lateríticos, arcillo-arenosos hasta rocosos. Florece hacia el final de la estación húmeda invernal, sus flores son visitadas por himenópteros y troquílidos, los frutos sirven de alimento a algunas aves.
Material Examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, a mitad del cerro Cahuamarca. 15°43’45.47’’ S – 74°22’33.28’’ O, 1101 m, 23 de julio del 2014, A. Pauca 403 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Cahuamarca. 15°43’45.1’’ S – 74°22’13.3’’ O, 1265 m, 5 de mayo del 2005, M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 187 (HUSA).
2.12. Neoraimondia arequipensisBackeb.
Diagnosis: Columnar, de hasta 4 m de alto y 40-50 cm de diámetro, de ramificación basal. Las ramas al inicio son curvas, luego ascendentes y paralelas, de color verde-gris, de 21-24 cm de diámetro. De 6 a 8 costillas. Areolas afelpadas con pelos marrones, grandes, con los tiempos cilíndricos. De 22-25 espinas, una de ellas más larga que las demás (hasta 15 cm de largo). Flores nocturnas o diurnas, blancas o rosadas, de 4.8-5.4 cm de largo y 4 cm de ancho en la antesis; tubo del perigonio con muchas brácteas de cuyas axilas nacen espinas y bastantes pelos de color marrón. Frutos de 7 cm de diámetro, de color guinda, con areolas y pequeñas espinas que pierde al madurar. Semillas negras, pequeñas de forma arriñonada, rugosas.
Ecología y distribución: Conocida solo en Perú. Se encuentra en zonas secas de las lomas, cerca al litoral en Ayparipa, quebrada Vizcachani y cima del cerro Cahuamarca desde los 150 hasta los 1200 m. También se encuentra en el piedemonte de las vertientes occidentales de los Andes, formando rodales en la zona de Sunchopampa desde los 2400 hasta los 2550 m. En la zona de lomas ocupa ambientes secos con escasa influencia de las neblinas costeras, sobre suelos esencialmente rocosos y pedregosos, mientras que en las vertientes occidentales se encuentra sobre suelos rocosos, un tanto arenosos, recibiendo las escasas precipitaciones de verano. Florece durante el periodo húmedo invernal y es de corta duración, pueden ser visitados por coleópteros, himenópteros, troquílidos, esfíngidosy quirópteros, los frutos son consumidos por aves y hormigas. En la zona del piedemonte andino florece hacia el final de la primavera e inicios del verano.
Material Examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Pampa de Ayparipa. 15°49’32.37’’ S – 74°22’36.41’’ O, 137 m, 22 de julio del 2014, A. Pauca 401 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Cerro Cahuamarca. 15°43’45.1’’ S – 74°22’13.3’’ O, 1167 m, 5 de mayo del 2005, M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 175 (HUSA).
2.13. Pygmaeocereus bylesianus Andreae & Backeb.
Diagnosis: Arbustivo. Tallos esféricos o cilíndricos de hasta de 7 cm de alto y 2.5 cm de diámetro. Raíz napiforme. De 12-16 costillas. Areolas de 1 mm de ancho. De 25-31 espinas, amarillentas, con los ápices negros, a veces una espina central de hasta 1.7 cm de largo. Flor blanca, nocturna, de hasta 7 cm de largo y 3.5 cm de diámetro; tubo del perigonio con escamas y pelos. Fruto globoso, rojizo, de 1 cm de diámetro. Semillas negras, pequeñas, rugosas, sin brillo.
Ecología y distribución: endémico de Perú y Arequipa. Se encuentran en zonas secas de la comunidad de lomas, en Silaca, Quebrada Vizcachani y en las laderas y cima del cerro Cahuamarca, desde los 180 hasta los 1200 m. Ocupa ambientes áridos secos, completamente soleados y recibiendo alguna influencia de la brisa marina y húmeda proveniente del mar. Crece sobre suelos secos, arenosos y arcillosos con alguna presencia de rocas pequeñas y guijarros. Florece durante la estación húmeda de las lomas, su floración es escasa y de corta duración, sus flores son visitadas por esfíngidos, los frutos son consumidos por ratones. Presenta un área de distribución restringida a las cimas de las quebradas con individuos aislados y grupos pequeños.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Quebrada de Vizcachani. 15°43’44.4’’ S – 74°22’46.68’’ O, 951 m, 23 de julio del 2014, A. Pauca 406 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Silaca15°48’38’’ S – 74°24’00.6’’ O, 189 m, 23 de enero del 2006, M. Laura Q., V. Quipuscoa S., V. Ccasa A., J. Churata S., J. Huallpa Ch., J. Mamani A. & V. Mamani M. 186 (HUSA).
2.14. Oreocereus hempelianus (Gürke) D. R. Hunt
Diagnosis: Erectos o decumbentes, ramificados desde la base. Tallos globosos hasta cilíndricos, de hasta 10 cm de diámetroy 60 cm de alto y largo. 10-20 costillas. De 8-30 espinas, pardas oscuras con los ápices rojizos; 3-10 espinas centrales de hasta 5 cm, a veces curvadas; 8-30 espinas radiales de hasta 3 cm de largo. Flores rojizas o anaranjadas, diurnas, algo zigomorfas, apicales, de 7.5 cm de largo y 3.5 cm de diámetro; tubo del perigonio con escamas y pelos. Fruto seco, rojizo, dehiscente por un poro basal. Semillas negras, pequeñas, rugosas.
Ecología y distribución: distribuido en Perú y Chile. Se encuentra en las planicies del piedemonte de las vertientes occidentales en Atiquipa, desde los 2500 hasta los 2600 m, en Sunchopampa. Ocupa ambientes áridos completamente soleados y dependientes de las escasas precipitaciones que provienen de la zona andina, sobre suelos secos, arenosos, guijarrosos y cascajosos. Florece al final de la primavera, pudiendo alcanzar hasta los inicios del verano. Se presenta como individuos aislados y de población poco densa por lo que se le considera como una especie rara para el distrito de Atiquipa.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Sunchopampa. 15°31’50.35’’ S – 74°12’58.9’’ O, 2585 m, 15 de noviembre del 2014, A. Pauca 520 (HSP).
2.15. Trichocereus chalaensis Rauh & Backeb.
Diagnosis: Columnar, de hasta 3 m de alto. Tallos de 10.5-11.5 cm de diámetro. 6-9 costillas. De 15-24 espinas, a los inicios marrón-rojizos, más tarde grises; 1-3 espinas centrales de hasta 7.5 cm de largo, espinas marginales de hasta 1.5 cm de largo. Flores blancas, nocturnas de 14.2- 15 cm de largo, 14-16 cm de diámetro en la antesis; tubo de perigonio con escamas y lana de color marrón oscuro; estambres numerosos; estilo de 8-9.3 cm de largo, 13-19 ramas estigmáticas. Fruto globoso, verde, de 3-5 cm de diámetro. Semillas negras, reniformes, rugosas.
Ecología y distribución: Endémico de Perú y Chile. Se desarrolla en la comunidad de lomas desde los 400 hasta los 1000 m, asociados al bosque de tara y en quebradas con abundante vegetación. Se localiza en los parajes denominados Infiernillo, Taro Seco, Lloque, loma del Olivo, Aguada del Guanaco, Maguey, Yactapara y Cahuamarca. Esta es la única especie de cactus que soporta ambientes sombreados, húmedos y está asociada permanentemente a los árboles de tara y arbustos como Randia armata y Citharexylum flexuosum. Se ubica sobre suelos húmedos, arcillosos y roquedales. Florece durante el periodo húmedo invernal y su floración se ve favorecida por la alta humedad generada por las neblinas costeras, su fructificación se produce durante la primavera y verano, sus flores son visitadas por coleópteros (escarabajos), dípteros, lepidópteros y quirópteros, el néctar de sus flores también sirve de alimento a una ave (Pheucticus chrysogaster), los frutos son consumidos por aves e insectos.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Taro Seco. 15°47’5.07’’ S – 74°23’27.79’’ O, 928 m, 24 de julio del 2014, A. Pauca 407 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Loma del Olivo. 15°46’30.7’’ S – 74°23’21.5’’ O, 1026 m, 22 de febrero del 2005, M. Laura Q.,V. Quipuscoa S., V. Ccasa A., J. Churata S.,J. Huallpa Ch., J. Mamani A. & V. MamaniM. 176 (HUSA).
2.16. Werberbauerocereus weberbaueri (K. Schum. ex Vaupel) Backeb.
Diagnosis: Arbustivo, de hasta 2.5 m de alto. De 14-21 costillas. Areolas cubiertas por pelos blancos. De 53-71 espinas de color pardo-amarillento; 4-6 principales algo curvadas, 1-2 más largas de hasta 6 cm de largo; espinas radiales entre 0.5-0.8 cm de largo. Flores generalmente nocturnas, crema, de 8.7-9 cm de largo y 3.5 cm de diámetro en antesis; tubo del perigonio con escamas coriáceas, y lana; estambres numerosos; ovario ínfero, estilo de 4.7-4.8 cm de largo, 13 ramas estigmáticas. Fruto globoso, rojizo-naranja, de 3.2-3.5 cm de diámetro. Semillas negras, brillantes, rugosas.
Ecología y distribución: Endémico de Perú y Arequipa. Se localiza en zonas secas de las lomas (Cahuamarca y Vizcachani), quebradas áridas (Quebrada Seca) desde los 600 hasta los 1200 m, y al piedemonte de las vertientes occidentales, desde los 2500 hasta los 2600 m (Sunchopampa). En las lomas de Atiquipa se ubica en ambientes árido secos, completamente soleados y con pobre influencia de la brisa marina y humedad proveniente de las neblinas, sobre suelos arcillosos, y rocosos. Florece durante el periodo invernal, sus flores son visitadas por coleópteros, esfíngidos y quirópteros, los frutos sirven de alimento para aves e insectos, sus tallos son usados por el ave Pseudasthenes cactorum para construir sus nidos. En el piedemonte se ubica en laderas pedregosas a rocosas en pequeñas llanuras de suelos arenosos y cascajosos. Florece durante toda la primavera e inicios del verano.
Material examinado: Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, a mitad del cerro Cahuamarca. 15°43’45.47’’ S – 74°22’33.28’’ O, 1101 m, 23 de julio del 2014, A. Pauca 402 (HSP). Perú. Dpto. Arequipa, Prov. Caravelí, Distrito de Atiquipa, Cerro de Cahuamarca. 15°46’30.7’’ S – 74°23’21.5’’ O, 1026 m, 22 de febrero del 2005, M. Laura Q. & Y. Cano B.183 (HUSA).
CLAVE PARA DETERMINACIÓN DE GÉNEROS Y ESPECIES
Clave para las subfamilias
-
Hojas caducas, areolas con gloquídios, semillas con arilo.............................Opuntioideae
-
Sin hojas, areolas sin gloquídios, semillas sin arilo ........................................Cactoideae
Subfamilia Opuntioideae
Espinas cubiertas con un estuche papiráceo .....................................Cylindropuntia (C. rosea)
1’. Espinas sin estuche papiráceo 2
2. Tallos esféricos u ovoides....................................................................... Cumulopuntia (C.
tumida)
2’. Tallos teretes, cilíndricos o aplanados (Opuntia) 3
3. Plantas con tallos teretes, cilíndricos .......................................................... O. pestifer
3’. Plantas con tallos aplanados 4
4. Espinas largas (sobrepasan los 4 cm de largo)..........................................O. stricta 4’. Espinas cortas (no sobrepasan los 2 cm de largo) ........................O. ficus-indica*
Subfamilia Cactoideae
-
Especies columnares (superan los 1,5 m de alto) 2
-
Plantas con tallos articulados ........................................ Armatocereus (A. matucanensis)
2’. Plantas sin tallos articulados 3
-
Areolas de floración con crecimiento continuo.........Neoraimondia (N. arequipensis)
3’. Areolas de floración sin crecimiento continuo 4
-
Flores nocturnas, blancas o cremas 5
-
Tubo del perigonio y frutos con escamas y pelos 6
-
Areolas de los tallos con 15-24 espinas. Flores actinomorfas,
infundibuliformes ................................................... Trichocereus (T. chalaensis)
6’. Areolas de los Tallos con 53-71 espinas. Flores zigomorfas, tubo del
perigonio en forma de S...........................Weberbauerocereus (W. weberbaueri)
5’. Tubo del perigonio y frutos sin pelos ....................... Browningia (B. candelaris)
4’. Flores diurnas, rosadas ...........................................................Eulychnia (E. ritteri)
1’. Especies arbustivas, no sobrepasan los 1.5 m de alto, postradas, decumbentes, erectos
o globulares 7
-
Tubo del perigonio con escamas, pelos, cerdas y/o espinas. Fruto espinoso o solo
el ápice cubierto por cerdas 8
-
Tallos erectos o postrados, ramificados. Tubo del perigonio y pericarpelo cubiertos con espinas, cerdas y pelos. Fruto cubierto con espinas (Corryocactus) 9
-
Tallos erectos. Flores anaranjadas o rojizas............................ C. brachypetalus
9’. Tallos postrados, rastreros. Flores amarillas......................... C. prostratus
8’. Tallos globulares o cilindros cortos, raro ramificados. Tubo del perigonio cubierto por escamas, pelos y cerdas. Fruto solo con cerdas en el ápice Islaya (I. islayensis)
7’. Tubo del perigonio solo con escamas y pelos. Fruto sin cerdas o espinas10
-
Cactus pequeños, globulares o cilíndricos de hasta 6 cm de altoPygmaeocereus (P. bylesianus)
10’.actus de tallos erectos o decumbentes de hasta 70 cm de alto o largo 1
-
Plantas con tallos decumbentes o ascendentes 12
-
Flores diurnas, rojas-anaranjadas 13
-
Areolas de floración ubicadas en el ápice del tallo. Fruto seco, dehiscente por un poro basal ................. Oreocereus (O. hempelianus)
13’.Areolas de floración laterales al tallo. Fruto carnoso, dehiscencia
lateral ......................... Loxanthocereus gracilis
12’. Flores nocturnas, blancas 13
-
Tallos decumbentes, algunas veces ascendentes. 1-2 espinas centrales, de hasta 3.5 cm de largo.................................................... Haageocereus decumbens
13´. Tallos ascendentes. 1-4 espinas centrales, de hasta 7 cm de largo
Haageocereus platinospinus
11’. Plantas con tallos erectos 14
-
Flores nocturnas, de color blanco ...................... Haageocereus subtilispinus
14’. Flores diurnas, anaranjado a rojo-anaranjado..........Loxanthocereus peculiaris
* Especie cultivada
Discusión
El distrito de Atiquipa presenta una alta diversidad de cactus, representando el 73,68% y 36,36% de total de géneros y especies reportadas para Arequipa (según los datos de Pauca & Quipuscoa, 2017). Los resultados obtenidos muestran que en la zona de lomas de Atiquipa, se encuentra la mayor diversidad de cactáceas, correspondiendo a un total de 16 especies, mientras que en las vertientes occidentales solo se presentan 4 especies. Son exclusivas de las comunidades de lomas 13 especies (C. rosea, O. pestifer, A. matucanensis, C. brachypetalus, C. prostratus, E. ritteri, H. decumbens, H. platinospinus, H. subtilispinus, I. islayensis, L. gracilis, L. peculiaris y T. chalaensis), mientras que en las vertientes occidentales son exclusivas solo dos especies (Browningia candelaris y Oreocereus hempelianus); las lomas y las vertientes occidentales comparten 3 especies (C. tumida, N. arequipensis y W. weberbaueri). También es importante mencionar que de las 20 especies registradas, 15 de ellas son endémicas de Perú y 8 son endémicas del departamento de Arequipa; comparando el dato anterior con lo reportado por Arakaki et al. (2006) y Pauca & Quipuscoa (2017), el área de estudio presenta el 40% del total de especies endémicas del departamento de Arequipa. Según Rundell et al. (1991), la alta diversidad vegetal que se presenta en los ecosistemas de lomas, se debe a que estos se aislaron como consecuencia del surgimiento de la corriente de Humboldt y al levantamiento de los Andes durante el Pleistoceno; este aislamiento trajo como consecuencia la especialización de muchos organismos, lo que se tradujo en endemismos (Jiménez et al., 2012; Galán de Mera et al., 1997). Sin embargo, la vegetación de los Andes es tan antigua como la de los desiertos, por lo que algunas especies debido a procesos geológicos cambiaron de ambiente, se adaptaron y redujeron su distribución, es por ello que muchas de las especies del desierto presentan afinidades con las de la Cordillera Andina (Dillon, 1997). Un análisis de las especies compartidas tanto en lomas como en los Andes, evidencian el origen Andino de la vegetación de los desiertos del Pacífico (Galán de Mera et al., 1997).
Cumulopuntia tumida, es considerada por Hunt et al. (2006), Hoxey (2009) y Hunt (2016), como un sinónimo de C. sphaerica, sin embargo, Anderson (2001) y Ostolaza (2014) la consideran válida. Observaciones en campo de ambas especies, muestran diferencias con relación al número y disposición de las espinas en el pericarpelo y los tallos. C. sphaerica presenta en el hipanto hasta 11 espinas por areola, mientras que C. tumida presenta solo hasta 4 espinas; el tallo de C. sphaerica presenta hasta 22 espinas por areola, en cambio, C. tumida presenta hasta 11 espinas; las espinas en C. sphaerica son curvadas y adpresas al tallo, mientras que en C. tumida son rectas o a veces un poco curvadas; por último, en C. tumida a veces se puede distinguir espinas centrales y radiales.
Ostolaza (2011) menciona la presencia de Cylindropuntia tunicata en lomas de Atiquipa, no obstante, en este trabajo consideramos que se trata de C. rosea, ya que la especie de Cylindropuntia observada tiene un hábito arbustivo erecto, tallo central definido y flores rosado púrpuras, C. tunicata, en cambio, presenta un hábito arbustivo algo cespitoso, tallo central muy corto y flores amarillas.
Armatocereus riomajensis es reportado para las lomas de Atiquipa (Ostolaza, 2014), sin embargo, aquí se considera la presencia de A. matucanensis. A. riomajensis se caracteriza por presentar un hábito un tanto arbustivo pudiendo alcanzar los 2 m de alto, no se presenta un tallo central definido; en cambio, A. matucanensis tiene un hábito arborescente de hasta los 4 m de alto y presenta un tallo central corto.
Corryocactus brachypetalus, tal como menciona Pauca & Quipuscoa (2015) viene siendo objeto de estudio, ya que la población de donde procede la colección tipo (Mollendo) presenta diferencias con las demás poblaciones que se desarrollan en la zona costera de Ica y Arequipa.
Haageocereus decumbens presenta muchos sinónimos debido a la gran variabilidad en sus caracteres, sobre todo en las espinas; en Atiquipa se puede encontrar plantas con 3 formas de espinas (espinas centrales rectas, espinas centrales curvadas y espinas centrales muy engrosadas algo curvadas) y también se puede hallar plantas que presentan las 3 formas de espinas a la vez. H. decumbensse caracteriza por su hábito decumbente, la presencia de 1 a 2 espinas centrales y sus flores actinomorfas, blancas nocturnas.
Para Ostolaza (2014) y Hunt et al. (2006), H. subtilispinus, es un sinónimo de H. decumbens. Ritter (1981) describe a esta especie, de la cual se puede resaltar 2 características notorias: el hábito, el cual es arbustivo-erecto y las espinas centrales, las cuales son numerosas (10-15), muy delgadas, de hasta 2 cm de largo; en este caso, las características mencionadas por Ritter (1981) concuerdan con la especie encontrada en Atiquipa, con la diferencia de que una de las espinas centrales puede alcanzar hasta 11 cm de largo; H. subtilispinus a simple vista se puede diferenciar de H. decumbens.
Loxanthocereus gracilis es considerado un sinónimo de L. sextonianus por Anderson (2001) y Hunt et al. (2006), sin embargo Ostolaza (2014) la considera como especie válida. L. gracilis se diferencia fácilmente de L. sextonianus por la mayor cantidad de espinas radiales, mayor número de escamas en el tubo del perigonio y mayor cantidad de tépalos.
Ritter (1981) describe a Pygmaeocereus familiaris, Ostolaza (2014) y Ostolaza (2011) la considera como válida y menciona su distribución en Atiquipa, no obstante, Hunt et al. (2006) y Hunt (2016) la consideran como un sinónimo de P. bylesianus. En las visitas de campo realizadas a localidades como Atiquipa, Atico Camaná y Cocachacra, se pudo encontrar algunas poblaciones de Pygmaeocereus los cuales presentan características más o menos homogéneas, tanto en el hábito como en la variación de la espinas, por lo que consideramos a P. familiaris como un sinónimo de P. bylesianus, tal como Hunt et al. (2006), Hunt (2016) y Pauca & Quipuscoa (2017).
Cactaceae cumple funciones importantes en los ecosistemas áridos, actuando como nodrizas, brindando alimento y refugio a animales. La mayoría de las especies de cactáceas en Atiquipa se encuentran creciendo en los alrededores de las comunidades de lomas, lugares donde la influencia de las neblinas es escasa; sobre suelos áridos, arenosos, rocosos o guijarrosos, con poca materia orgánica; sobre laderas, fondo de quebradas secas, cima de los cerros o sobre llanos, donde se las encuentra asociadas a rocas con escasa vegetación; en contraste, la comunidad de lomas propiamente dicha, presenta una baja diversidad de cactus, lo que probablemente se debe a la alta concentración de materia orgánica y mayor humedad por la influencia de las neblinas. En este sentido, Teixeira et al. (2004) menciona que la relación entre la diversidad de Cactaceae y la composición orgánica del suelo es inversa, es decir, la diversidad disminuye cuando aumenta la concentración de materia orgánica. Fabre et al. (2006) también encontró resultados similares a los de Teixeira et al. (2004) indicando que Cactaceae prefiere suelos con bajo contenido de materia orgánica. En la localidad de Atiquipa se estaría presentando una situación similar, lo que explica la preferencia de la mayoría de especies de Cactaceae a suelos con escasa o nula cobertura vegetal, localizándose en zonas con escasa influencia de neblinas. Otro rol importante que Cactaceae ofrece a los ecosistemas desérticos, es el mantenimiento de las redes tróficas, los cactus como productores ofrecen alimento a animales, ya sea el néctar de sus flores o la pulpa de sus frutos. Algunos autores como Sahley (2001), Nassaret al. (1997), Fleming et al. (1996), Valiente-Banuet et al. (1996), Petit (1995) y Sahley (1996) han comprobado que las flores son visitadas mayormente por insectos (esfíngidos, himenópteros), aves (troquílidos) y mamíferos (chirópteros), concordando con lo observado en Atiquipa, y se menciona que incluso las formas de las flores están adaptadas a su polinizador (Bustamante & Búrquez, 2005). Las interacciones de las cactáceas con la fauna local suele ser muy estrecha, porque además de ofrecerles alimento, estas plantas aprovechan la fauna para el mantenimiento de su supervivencia y reproducción, ya que los frutos son consumidos por muchas especies de aves (Pseudoasthenes cactorum, Psilopsia gonaurifrons, Geossita cunicularia, Phrygilus alaudinus, Poospiza hispaniolensis, Mimus longicaudatus, Sicalis spp., Pheucticus chrysogaster y Turdus chiguanco), reptiles (Microlophus sp.), mamíferos (Lagidium viscacia, Lycalopex culpaeus y L. griseus), e insectos (Formicidae), los cuales contribuyen con la dispersión de semillas; estas relaciones también son descritas por otros autores como Ostolaza (2014), Casado & Soriano (2010), Ceroni et al. (2007) y Novoa et al. (2003).
La presencia de un organismo en un gradiente altitudinal, no está determinado en sí mismo por ese aspecto, sino más bien por el conjunto de factores que implican a este gradiente (Nogues-Bravo et al., 2008). La capa de neblina procedente del océano abarca desde los 600 a 1000 m (Ferreyra, 1993; Rauh, 1958), incidiendo directamente en la zona de barlovento de los cerros, en consecuencia la presencia de mayor diversidad vegetal (Talavera et al., 2017; Llellish et al., 2015). Aproximadamente a esta misma altitud, encontramos la mayor diversidad de cactáceas, exactamente des de los 600 hasta los 1200 m, pero en la zona de sotavento de los cerros, donde la influencia de las neblinas es menor, pero lo suficiente para mantener la supervivencia de estas plantas. En consecuencia, se puede inferir que la poca disponibilidad de agua en estos ambientes es apto para el desarrollan de estas plantas y podría estar condicionando ciertas características en el suelo, como la escasa materia orgánica. En el caso de las vertientes occidentales, la mayor diversidad se presenta desde los 2400 a 2600 m, aquí la mayoría de cactus son columnares (Browningia candelaris, Weberbauerocereus weberbaueri, Neoraimondia arequipensis), y en el paisaje presentan coberturas dominantes, por lo que se encuentran formando un "bosque de cactus". Weberbauer (1945) menciona que inmediatamente después del Piso Desértico, se sitúa el piso de las Cactáceas Columnares, el cual se caracteriza por la vegetación anual y escasa, este piso se inicia en algunos casos a los 2600 m, lo cual concuerda con lo observado en el área de estudio.
A pesar de que Atiquipa alberga las lomas más biodiversas (Talavera et al., 2017) éstas se encuentran poco estudiadas en muchos aspectos. Autores como Rauh (1958), Backeberg (1958-1962) y Ritter (1981), estudiosos de los cactus peruanos, no mencionan la localidad de Atiquipa y solo citan a Chala, un puerto próximo a Atiquipa. Recientemente, Ostolaza (2011) y Ostolaza (2014) refiere que en Atiquipa se encuentran 4 especies de cactus (P. familiaris, E. ritteri, A. riomajensis y C. tunicata). Varias especies de la comunidad de lomas de Atiquipa y costa de Chala (situada a 11 km de Atiquipa) reportadas por diversos autores (Rauh, 1958, Backeberg, 1958-1962; Ritter, 1981; Anderson, 2001; Ostolaza, 2014), también han sido encontradas en Atiquipa, comoCorryocactus brachypetalus, Cumulopuntia tumida, Haageocereus decumbens, H. platinospinus, Eulychia ritteri, Islaya islayensis, Neoraimondia arequipensis, Weberbauerocereus weberbaueri, Trichocereus chalaensis, Loxanthocereus gracilis y Pygmaeocereus bylesianus.
Otras especies como Armatocereus matucanensis y Loxanthocereus peculiaris que normalmente son encontrados en los departamentos de Lima e Ica (Ostolaza, 2014) extienden su distribución hasta las lomas de Atiquipa. Cylindropuntia rosea, posiblemente fue introducida debido al desplazamiento de ganado y Opuntia stricta se cultivó para aprovechar sus frutos.
La presencia de Weberbauerocereus weberbaueri no se encontraba registrada para las lomas costeras. Rauh (1958) menciona que ésta (pero consideradapor él como W. horridispinus) se distribuye en las "pampas" situadas al lado izquierdo del río Chala a 2600 m; si bien Rauh (1958) menciona a Chala, es probable que en realidad se refiriese al Valle de Cháparra, el cual se encuentra muy próximo a Chala y Atiquipa; en las visitas de campo realizadas al distrito de Atiquipa se pudo constatar la presencia de esta especie tanto en lomas, quebradas y en las vertientes occidentales, observando que en la zona andina se presenta una población mucho más extensa y densa en comparación con las lomas; probablemente la poblaciones localizadas en quebradas costeras y formaciones de lomas provinieron de la zona andina debido a factores climáticos, animales y antropológicos; se puede indicar climática ya que en épocas de fuerte precipitación en la zona de las vertientes occidentales es probable que el agua arrastrara semillas hacia las quebradas costeras donde se establecieron y formaron nuevas poblaciones de individuos; la dispersión por animales también pudo ser posible, ya que una especie de camélido (Lama guanicoe) la cual actualmente es muy rara en la zona (Villegas et al., 2017), realizaba migraciones entre la zona de lomas y las vertientes occidentales, está documentado que uno de los componentes en su dieta son los cactus (Huamán, 2008), por lo que al alimentarse de los frutos en las vertientes occidentales y migrar hacia la zona de costa, pudieron llevar en sus tracto digestivo las semillas y depositarlas en zonas donde estas pudieron desarrollarse; por último el factor antropológico parece también intervenir en la dispersión (Ramos-Font et al., 2015; Fedriani et al., 2015), la presencia de antiguas poblaciones humanas denotan la importancia de lugar como fuente de recursos (Talavera et al., 2017), la movilización de poblaciones humanas utilizando animales de carga entre la zona costera y de los Andes o viceversa, también se menciona (Rostworowski, 1981), por lo que los animales utilizados durante los viajes pudieron alimentarse de frutos en la zona andina y llevar las semillas a la zona costera, lo que podría explicar la presencia de W. weberbaueri y C. tumida dentro del complejo arqueológico de Cahuamarca, ubicado en la cima del cerro de el mismo nombre a los 1273 m.
Cumulopuntia tumida fue originalmente reportada en Chala (Ritter, 1981), sin embargo, en esta investigación se amplía su distribución para el distrito de Atiquipa, en las comunidades de lomas, quebradas áridas y vertientes occidentales; al igualque W. weberbaueri, las poblaciones de C. tumidaencontradas en lomas y quebradas costeras, probablemente tienen su origen en las vertientes occidentales.
Conclusiones
1. La diversidad específica de Cac- taceae en el distrito de Atiquipa y en el Área de Conservación Privada Lomas de Atiquipa se encuentra representada por 20 especies, las cuales se encuentran agrupa- das en 15 géneros y 2 subfamilias (Opun- tioideae y Cactoideae); los endemismos corresponden a 15 y 8 especies endémicas para Perú y Arequipa respectivamente. Las especies indicadas en este trabajo se pueden determinar utilizando la clave ta- xonómica presentada.
2. Cactaceae en el área de estudio, se distribuye en zonas cercanas al litoral costero, en los alrededores de las comuni- dades de lomas, sotavento de los cerros, en quebradas áridas y vertientes occidentales. En cuanto a la distribución altitudinal, se presentan dos rangos de distribución, el primero desde los 100 hasta los 1500 m donde se registra la mayor cantidad de es- pecies (16 especies) y el segundo desde los 2400 hasta los 2600 m (4 especies), el rango comprendido desde los 1500 hasta los 2600 m no se registraron especies.
3. Gran parte de las especies de cac- tus prefieren suelos lateríticos, rocosos, con escasa vegetación y ambientes solea- dos con escasa influencia de neblina y pre- cipitación. La floración para las especies distribuidas en la zona de costa se produ- ce principalmente después de la estación húmeda, mientras que para las especies distribuidas en las vertientes occidentales se presenta durante la estación seca. Los visitantes florales corresponden a aves (troquílidos), mamíferos (quirópteros) einsectos (coleópteros, himenópteros y le- pidópteros). Los frutos generalmente son consumidos por aves, mamíferos e insec- tos, por lo tanto el principal tipo de disper- sión de las semillas es por zoocoría.
Agradecimientos: Al convenio UNSA-TNC, por haber facilitado las labores de investigación y recojo de datos sobre la diversidad florística de las lomas del distrito de Atiquipa. A la Comunidad Campesina de Atiquipa, por la facilitación de los trabajos de campo. A Luis Villegas y César Luque, por su valiosa información y ayuda en cuanto a la ubicación de algunas cactáceas y labores en campo. Al Instituto Científico Michael Owen Dillon (IMOD), por la facilitación de sus instalaciones y a Victor Quipuscoa S. por la revisión y sugerencias para el presente manuscrito.
Literatura citada
Anderson, E. F. 2001. The cactus family. Timbres Press, Inc. Portlant, Oregon. U.S.A. [ Links ]
Arakaki, M.; C. Ostolaza; F. Cáceres & J. Roque. 2006. Cactaceae endémicas del Perú. En León B., J. Roque, C. Ulloa Ulloa, C. Pitman, N.Jorgensen&A. Cano. Libro Rojo de las Plantas Endémicas del Perú. Rev. Per. Biol. 193-219. [ Links ]
Arakaki, M.; C. Pascal Antoine; R. Nyffeler; A. Lendel;U. Eggli; O. Matthew; E. Spriggs; M. Moore & E. Edwars. 2011. Contemporaneus and recent radiations of the world’s major succulent plant lineagesPNAS 108(20):8379-8384.
Backeberg, C. 1958-1962. Die cactaceae. 6 Vols. Jena. Gustav Fisher Verlag. Germany. [ Links ]
Brako, L. & J. Zarucchi. 1993. Catalogue of the flowering plants and gymnosperms of Peru. Monographs in Systematic Botany from the Missouri Botanical Garden 45: 1–1286. [ Links ]
Bustamante, M. & A. Búrquez. 2005. Fenología y biología reproductiva de las cactáceas columnares. Cactáceas y Suculentas Mexicanas 50 (3): 68-68. [ Links ]
Casado, R. & P. Soriano. 2010. Fructificación, frugivoría y dispersión en el cactus globular Melocactus schatzlii en el enclave semiárido de Lagunillas, Mérida, Venezuela. Ecotrópicos 23(1):18-36. [ Links ]
Ceroni, A.; V. Castro; V. Teixeira & I. Redolfi. 2007. Neoraimondia arequipensis subsp. roseiflora (Werdermann & Backeberg) Ostolaza (Cactaceae): eje de las interacciones en ecosistemas áridos. EcologíaAplicada 6(1,2): 155-168. [ Links ]
Dillon, M. O. 1997. Lomas formation - Peru. En: Davis, S. D., V. H. Heywood, O. Herrera-Mcbride, J. Villa-Lobos and D. C. Hamilton, (Eds), Centres of Plant Diversity a Guide and Strategy for Their Conservation. WWF, Information Press Oxford, Uk. [ Links ]
Fabre, A.; T. Gauquelin; F. Villasante; A. Ortega & P. Henri. 2006. Phosphorus content in five representative landscape units of the Lomas de Arequipa (Atacama desert-Peru). Catena 65: 80- 86. [ Links ]
Fedriani, J. M. & A. Suarez Esteban. 2015. Frutos, semillas, y mamíferos frugívoros: diversidad funcional de interacciones poco estudiadas. Ecosistemas 24 (3): 1-4 [ Links ]
Ferreyra, R. 1983. Los tipos de vegetación de la costa peruana. Anales del Jardín Botánico de Madrid 40 (1): 241-256. [ Links ]
Ferreyra, R. 1993. Registros en la vegetación en la costa peruana en relación con el fenómeno el niño. Bull. Inst. Fr. Études Andines 22(1): 259-266. [ Links ]
Fleming, T. H.; M. D. Tuttle & M. A, Horner. 1996. Pollination biology and the relative importance of nocturnal and diurnal pollinators in three species of Sonoran Desert columnar cacti. The Southwestern Naturalist 41:257-269. [ Links ]
Galán de Mera, A.; E. Linares Perea; J. Campos de la Cruz & J. A. Vicente Orellana. 2009. Nuevas observaciones sobre la vegetación del sur del Perú. Del DesiertoPacífico al Altiplano. Acta Botánica Malacitana 34: 107-144. [ Links ]
Galán de Mera, A.; E. Linares; C. Trujillo & F. Villasante. 2010. Termoclina y humedad en el sur del Perú. Bioclimatología y bioindicadores en el departamento de Arequipa. Zonas Áridas 14 (1): 71-82. [ Links ]
Galán de Mera. A., V. Orellana, L. García &A. Probanza.1997. Phytogeographical Sectoring of the Peruvian Coast. Global Ecology and Biogeography Letters 6: 349-367. [ Links ]
Hoxey, P. 2009. A brief review of Cumulopuntia sphaerica. Tephrocactus Study Group. 15 (4): 47-54, 56-58. [ Links ]
Huaman, E. 2008. Composición de la dieta del guanaco (Lama guanicoe) en la Comunidad de Huallhua y Anexos – Ayacucho. Tesis de maestría. Posgrado en Especialidad en Conservación de Recursos Forestales, Universidad Nacional Agraria La Molina. Perú, Lima. [ Links ]
Hunt, D. R. 2016. CITES Cactaceae Checklist. Third Edition. Kew. Royal Botanic Gardens. Somerset. [ Links ]
Hunt, D. R.; Taylor N. & G. Charles. 2006. The New Cactus Lexicon. Remous Ltd.Somerset. [ Links ]
Jiménez, P.; L. Villegas; F. Villasante; C. Talavera & A. Ortega. 2012. Las Lomas de Atiquipa: agua en el desierto. En Hajek, F. y P. Martínez (Ed.), ¿Gratis?: los servicios de la naturaleza y como sostenerlos en el Perú. 159-170. Servicios Ecosistémicos Perú. Lima. [ Links ]
Lleellish, M.; J. Odar & H. Trinidad. 2015. Guía de Flora de las Lomas de Lima. Servicio Nacional Forestal y de Fauna Silvestre. Lima. [ Links ]
McCain, C. & J. Grytnes. 2010. Elevational gradients in species richness. En: John Wiley & Sons, Encyclopedia of life sciences, Ltd, Chichester. [ Links ]
Mostacero, J.; F. Mejía; W. Zelada & C. Medina. 2007. Biogeografía del Perú. Asamblea Nacional de Rectores. Lima. [ Links ]
Nassar, J. M.; N. Ramírez & O. Linares. 1997. Comparative pollination biology of venezuelan columnar cacti and the role of nectar-feeding bats in their sexual reproduction. American Journal of Botany 84:918-927. [ Links ]
Nogués Bravo, D.; M. D. Araújo; T. Romdal & C. Rahbek. 2008. Scale effects and human impact on the elevational species richness gradients. Nature 453: 216-220. [ Links ]
Novoa, S.; V. Castro; A. Ceroni& I. Redolfi. 2003. Relación entre la hormiga Camponotus sp. (Hymenoptera: Formicidae) y una comunidad de cactus (cactaceae) en el valle del río Chillón. Ecología Aplicada 2 (1): 69-73. [ Links ]
Ostolaza, C. 2011. 101 Cactus Del Perú. Ministerio del Ambiente. Lima. [ Links ]
Ostolaza, C. 2014. Todos los Cactus del Perú. Ministerio del Ambiente. Lima. [ Links ]
Pauca, A. & V. Quipuscoa. 2017. Catálogo de las cactáceas del departamento de Arequipa. Arnaldoa 24 (2): 447 – 496. [ Links ]
Pauca, A. & V. Quipuscoa. 2015. Corryocactus dillonii (Cactaceae), una nueva especie de la formación de lomas de Arequipa, Perú. Arnaldoa 22(2): 313-328. [ Links ]
Petit, S. 1995. The pollinators of two species of columnar cacti on Curaçao, Netherlands Antilles. Biotropica 27:538-541. [ Links ]
Ramos Font, M.; J. Gonzales & A. Robles. 2015. Dispersión endozoócora de leguminosas silvestres: desde la recuperación hasta el establecimiento en campo. Ecosistemas 24 (3): 14-21 [ Links ]
Rauh, W. 1957. Beitragzurkenntnis der peranischenkaktenvegetation. sitzungsberichte der heidelberger akademie der wissenschaften. Math. naturw. Berlin. [ Links ]
Ritter, F. 1981. Kakteen in Südamerika 4. SelbstverlagFriederich Ritter. Spangenberg. [ Links ]
Rostworowski, M. 1981. Recursos naturales renovables y pesca, siglos XVI y XVII, Instituto de Estudios Peruanos, Lima. col. Historia Andina 8. [ Links ]
Rundell, P.; M. O. Dillon; B. Palma; S. Mooney; S. Gulmon & J. Erleringer. 1991. The phytogeography and ecology of the coastal Atacama and peruvian deserts. Aliso 13(1): 1-49. [ Links ]
Sahley C. 1996. Bat and huming bird pollination of an autotetraploid columnar cactus, Weberbauerocereus webwerbaueri (Cactaceae). American Journal of Botany 83(10): 1329-1336. [ Links ]
Sahley, C. 2001. Vertebrate pollination, fruit production, and pollen dispersal of Stenocereusthurberi (Cactaceae). The Southwestern Naturalist 46:261- 271. [ Links ]
Sociedad Geográfica de Lima. 1990. Anuario geográfico departamental libro n° 24 perfil antropogeográfico de Arequipa. Sociedad Geográfica de Lima. Lima. [ Links ]
Talavera, D.; A. Pauca; C. Fernández; F. Villasante; L. Villegas & A. Delgado. 2017. Flora de Lomas de Atiquipa. Editorial UNSA. Arequipa. [ Links ]
Teixeira, V.; V. Castro; A. Ceroni & R. Eyzaguirre. 2004. Diversidad y densidad de la comunidad de cactáceas en el valle del río Chillón: Cerro Umarcata y Quebrada Orobel y su relación con los factores edáficos. Ecología Aplicada 3(1,2): 1-8. [ Links ]
Valiente Banuet, A.; M. del C. Arizmendi; A. Rojas Martínez & I. Domínguez Canseco. 1996. Ecological relationships between columnar cacti and nectar-feeding bats in Mexico. Journal of Tropical Ecology 12:103-119. [ Links ]
Villegas, L.; K. Caballero & C. Luque. 2017. Fauna silvestre de las Lomas de Atiquipa. Editorial UNSA. Arequipa. [ Links ]
Wallace, R. S. & S. L. Dickie. 2002. Systematic implications of chloroplast DNA sequence variation in subfam. Opuntioideae (Cactaceae). Succulent Plant Research 6: 9-24. [ Links ]
Weberbauer, A. 1945. El mundo vegetal de los Andes Peruanos. Estac. Exper. Agric. La Molina. Edit. Lume. Lima. [ Links ]
Recibido: 5-VIII-2018
Aceptado: 15-X-2018
Publicado online: 30-XI-2018
Publicado impreso: 31-XII-2018