Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.1 Trujillo ene./abr. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26105
ARTÍCULOS ORIGINALES
Impacto de los cambios climáticos y uso de suelo, en la distribución de las especies de géneros endémicos de Asteraceae de Arequipa
Impact of climate changes and land use in the distribution of species of endemic genera of Asteraceae from Arequipa
Victor Quipuscoa Silvestre1;Michael O. Dillon2; Ítalo Treviño Zevallos3, Margarita Balvin Aguilar3; Adolfo Mejía Rios3; Daniel Ramos Aranibar3; Károl Durand Vera3; Daniel Montesinos Tubée3
1 Departamento de Biología, Universidad Nacional de San Agustín, Arequipa, PERÚ. vquipuscoa@unsa.edu.pe
2 Botany Department, The Field Museum, Chicago, IL 60605-2496, USA. mdillon@fieldmuseum.org
3 Instituto Científico Michael Owen Dillon-IMOD, Arequipa, PERÚ
Resumen
La cordillera de los Andes es uno de los centros de especiación o hotspots del mundo con una gran cantidad de plantas endémicas; sin embargo, el cambio constante del clima y el uso de la tierra están afectando significativamente la diversidad y distribución de las especies. Estos cambios probablemente afectarán la distribución de Chionopappus benthamii S.F. Blake y Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S.E. Freire, dos especies que representan géneros endémicos en el Perú. Para Chionopappus, se recolectaron 48 registros y para Paquirea, ocho registros a través de observaciones directas de campo, consulta de colecciones depositadas en los herbarios HSP, USM, MOL, HUT, HAO, PRG y colecciones digitalizadas disponibles a través de Jstor en MO, NY, K y bases de datos digitales de GBIF. ArcGis versión 10.6.1 se utilizó para crear mapas de distribución geográfica y para calcular las áreas de dichas distribuciones. Se utilizó el programa MaxEnt versión 3.4.1 (algoritmo de máxima entropía) para modelar las áreas de distribución actuales, potenciales, los cambios climáticos y el uso de suelo en escenarios futuros para los años 2040, 2060 y 2080. Las proyecciones climáticas han sido propuestas por el Panel Intergubernamental sobre Cambio Climático (IPCC) y se ajustan a los modelos construidos a través de capas climáticas mundiales (WorldClim) y Cambio Climático, Agricultura y Seguridad Alimentaria (CCAFS-Clima), y al modelo de cambio de uso del suelo derivado del índice de vegetación de diferencia normalizada (NDVI) e imágenes de Landsat generadas con los Módulos para Simulaciones de Cambio de Uso del Suelo (MOLUSCE) del sistema de geoinformación QGIS. Chionopappus se distribuye actualmente en Perú desde el departamento de Cajamarca hasta el departamento de Arequipa; y Paquirea está restringida exclusivamente a las provincias de Castilla y Caylloma en el departamento de Arequipa. Se generaron mapas de área actuales y distribuciones potenciales para cada género, cuya área bajo la curva (AUC) fue mayor en 0.97 y los valores de umbrales de corte de 0.16-0.32. Las variables que más contribuyeron a los modelos de cambio climático fueron las variables bioclimáticas de temperatura máxima y mínima, y para el cambio de uso de la tierra fue el NDVI. Chionopappus benthamii en ambos escenarios aumentaría su distribución en el centro y sur del Perú con un aumento en su área general. Alternativamente, Paquirea lanceolata experimentaría una reducción de su distribución y sus poblaciones, así como podría desaparecer.
Palabras clave: Chionopappus, Paquirea, Asteraceae, géneros endémicos, Arequipa, Perú.
Abstract
The Andean Cordillera is one of the world’s speciation centers or hotspots with a large number of endemic plants; however, constant change in climate and land use are significantly affecting the diversity and distribution of species. These changes will likely affect the distribution of Chionopappus benthamii S.F. Blake and Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S.E. Freire, two species that represent endemic genera in Peru. For Chionopappus, 48 records and for Paquirea, eight records were collected through direct field observations, consultation of collections deposited in the herbaria HSP, USM, MOL, HUT, HAO, PRG, and digitized collections available via Jstor at MO, NY, K and digital databases of GBIF. ArcGis version 10.6.1 was used to create geographic distribution maps and to calculate the areas of those distributions. MaxEnt program version 3.4.1 (maximum entropy algorithm) was used to model the current distribution areas, potential climate changes and future land use in scenarios for the years 2040, 2060, and 2080. The climate projections were proposed by the Intergovernmental Panel on Climate Change (IPCC) and comply with models constructed via global climate layers (WorldClim) and Climate Change, Agriculture and Food Security (CCAFS- Climate), and the land-use change model derived from the normalized difference vegetation index (NDVI) and Landsat images generated with the Modules for Land Use Change Simulations (MOLUSCE) of the QGIS geoinformation system. Chionopappus is currently distributed in Peru from the department of Cajamarca to the department of Arequipa; and Paquirea is restricted exclusively to the provinces of Castilla and Caylloma in the department of Arequipa. Current area maps and potential distributions were generated for each genus, whose area under the curve (AUC) was greater in 0.97 and cut-off thresholds values were 0.16-0.32. The variables that contributed the most to climate change models were the bioclimatic variables of maximum and minimum temperature, and for land-use change were the NDVI. Chionopappus benthamii in both scenarios would increase its distribution in central and southern Peru with an increase in its overall area. Alternatively, Paquirea lanceolata would experience a reduction in its distribution and populations, and potentially it could disappear.
Keywords: Chionopappus, Paquirea, Asteraceae, endemic genera, Arequipa, Peru.
Introducción
A nivel mundial como lo manifiesta Van-Proosdij et al. (2016), están realizándose muchos esfuerzos para conocer y entender la diversidad biológica; sin embargo, el conocimiento de esta diversidad es aun limitada, principalmente para lugares muy diversos como los trópicos, donde se reportan cantidades aproximadas, y éstas posiblemente están muy alejadas de la realidad, menos aún se conoce acerca de la distribución de las especies (Whittaker et al., 2005; Mora et al., 2011; Costello et al., 2013). Según McPherson et al. (2004), los científicos de la conservación y los administradores de recursos, emplean cada vez más la distribución de modelos empíricos para ayudar en la toma de decisiones. Por esa razón, Wisz et al. (2008), manifiestan que existe la ventaja para bajar costos que originan obtener muestreos de distribuciones en el campo, con la capacidad para modelar nichos ecológicos y predicciones de distribuciones geográficas; sin embargo, tales modelos no son igualmente confiables para todas las especies, y el tamaño del rango puede afectar su confiabilidad.
Los modelos de distribución de las especies (SDM), según Van-Proosdij et al. (2016) se elaboran a partir de datos o registros espaciales (latitud-longitud), en combinación con una serie de características ambientales de los taxones, los cuales deben ser debidamente tomados en campo, y cuando se obtienen de otras fuentes, las especies o taxones deben ser correctamente determinados y verificados; así como, deben corresponder a los hábitats mencionados. Estos modelos se utilizan ampliamente para predecir la presencia de los taxones; por tanto, aunque la validación de la distribución prevista y la evaluación de la precisión del modelo es un desafío, el rendimiento depende tanto del tamaño de la muestra como de la prevalencia de la especie, y las características específicas del área de estudio (Van-Proosdij et al., 2016; Wisz et al., 2008).
Más aún, en áreas tan diversas como la cordillera andina considerada centro de especiación a nivel mundial, con un elevado porcentaje de endemismos, y donde cualquier cambio en el uso de la tierra, y cambio climático es preocupante (Myers et al., 2000; Fjeldså & Rahbek 2006). La importancia de los taxones endémicos es ampliamente aceptada, y los esfuerzos para el conocimiento y conservación de éstos, tiene grandes avances; sobretodo, en áreas donde se concentran estos endemismos (Olson & Dinerstein 2002;Beck et al., 2007; Young et al., 2002; Swenson et al., 2012), esta atención se basa, en los estrechos rangos de distribución, con grandes riesgos de extinción frente a las diversas amenazas antrópicas, cambios climático y uso de suelo (Beck et al., 2007).
Entre los principales impactos se encuentran las migraciones altitudinales y latitudinales, debido a los cambios en la precipitación y temperatura, lo que aumentan la susceptibilidad a la extinción principalmente en especies con poblaciones reducidas y formas de dispersión limitados (Feeley et al., 2011; Zimmer et al., 2014; El-Keblawy, 2014). En el Perú, la información sobre endemismos se ha reportado desde Macbride (1936-1970), Brako & Zarucchi (1993), actualizado por Ulloa-Ulloa et al. (2004), y el libro rojo de las especies endémicas (León et al., 2006). Dentro de esta diversidad, la familia con mayor cantidad de géneros endémicos es Asteraceae con 14 géneros y 17 especies, dos de ellos hasta la actualidad (Chionopappus y Paquirea) se encuentran en Arequipa (Beltrán et al., 2006; Dillon & Zapata, 2010; Panero & Freire, 2013).
Obtener datos cuantitativos y análisis detallados y confiables, acerca de cómo afectarían la biota andina es necesario. Aunque, se han establecido áreas naturales protegidas, no son suficientes para conservar la diversidad, más aún, cuando solo ca. 29% de las Vertientes Occidentales están protegidas (SERNANP, 2013). En consecuencia, podrían resultar que para los géneros endémicos, las áreas no protegidas serían más importantes (Barry & Elith 2006; Buisson et al., 2010).
Por tanto, los cambios climático y uso de suelo, afectan los taxones endémicos, ya sea de manera positiva (Chionopappus benthamii) o negativa (Paquirea lanceolata), originando cambios en la distribución de las especies en los ecosistemas andinos, información poco conocida y como lo manifiestan Parmesan & Yohe (2003) es necesario investigar. Por ese motivo, se estiman las distribuciones actuales, potenciales y modelos de distribución futuras para las dos especies en escenarios climáticos y uso de suelo, en los principales enfoques; modelos que delimitarán cartográficamente zonas potencialmente adecuadas de distribución, cuyos resultados de estas proyecciones serán reconocidas y usadas en la planificación; además, servirán para establecer estrategias de conservación o mitigación, así como, para proponer áreas de conservación (Franklin, 2009; Mateo et al., 2011; Underwood et al., 2010).
Material y Métodos
Para el modelado de la distribución actual y potencial de las especies se consideró todos los registros de Perú. Los registros se obtuvieron mediante la consulta directa de muestras depositadas en los herbarios HSP, USM, MOL, HUT, HAO y PRG, y colecciones digitalizadas disponibles en las páginas web de los herbarios MO, NY y K, registros de los tipos a través de Jstor y bases de datos digitales de GBIF, revisión de literatura especializada y datos tomados en campo. Se generó una base de 56 registros para ambas especies; 48 registros para Chionopappus benthamii S. F. Blake y 8 para Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S. E. Freire. Para obtener los mapas de distribución geográfica y cálculos de las superficies se utilizó ArcMap versión 10.6.1 con umbrales de corte de 0.16-0.32. Para modelar las áreas de distribución actual, potencial y cambios climático y uso de suelo en escenarios futuros para los años 2040, 2060 y 2080 en los enfoques de proyección climática A2 (no conservacionista), B1 (conservacionista) propuestos por el IPCC, se utilizó el algoritmo de Máxima Entropía (MaxEnt) versión 3.4.1 (Phillips et al., 2006); las capas de variables bioclimáticas utilizadas provienen del WORLDCLIM (Hijmans et al., 2005) que usa las 19 variables (Busby, 1991), y del CCAFS- CLIMATE, el modelo cambio de uso de suelo, fue derivado del NDVI de imágenes LANDSAT y generado con el MOLUSCE, que es un módulo de simulaciones del sistema de geoinformación QGIS, y se usaron variables antrópicas, de cobertura vegetal y ecosistemas de las cuales se seleccionaron aquellas que contribuían con los modelos (tabla 8). Se analizaron la contribución porcentual de cada variable, el test de Jackknife para AUC (Area Under the Curve) y la Curva Operada por el Receptor (ROC, Receiver Operating Curve).
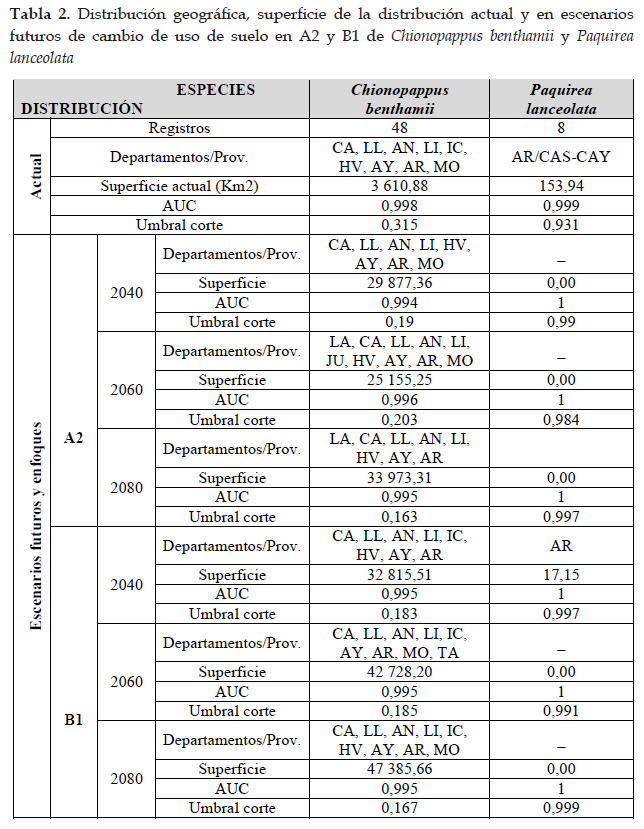
Resultados Distribución actual y potencial de Chionopappus benthamii S. F. Blake
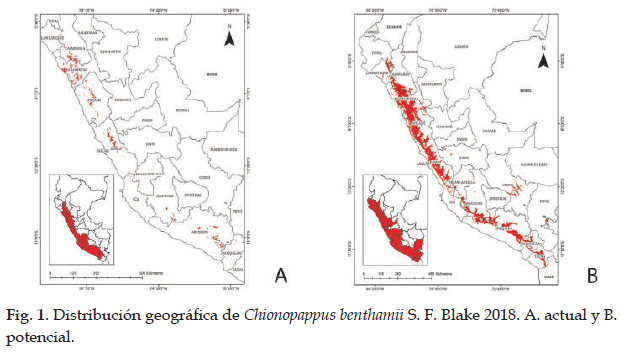
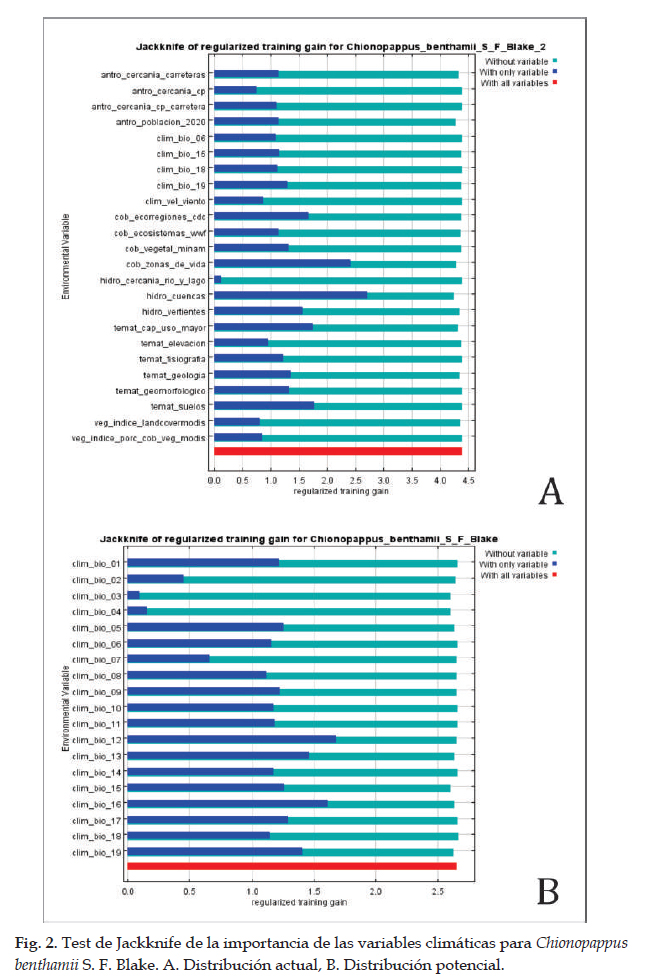
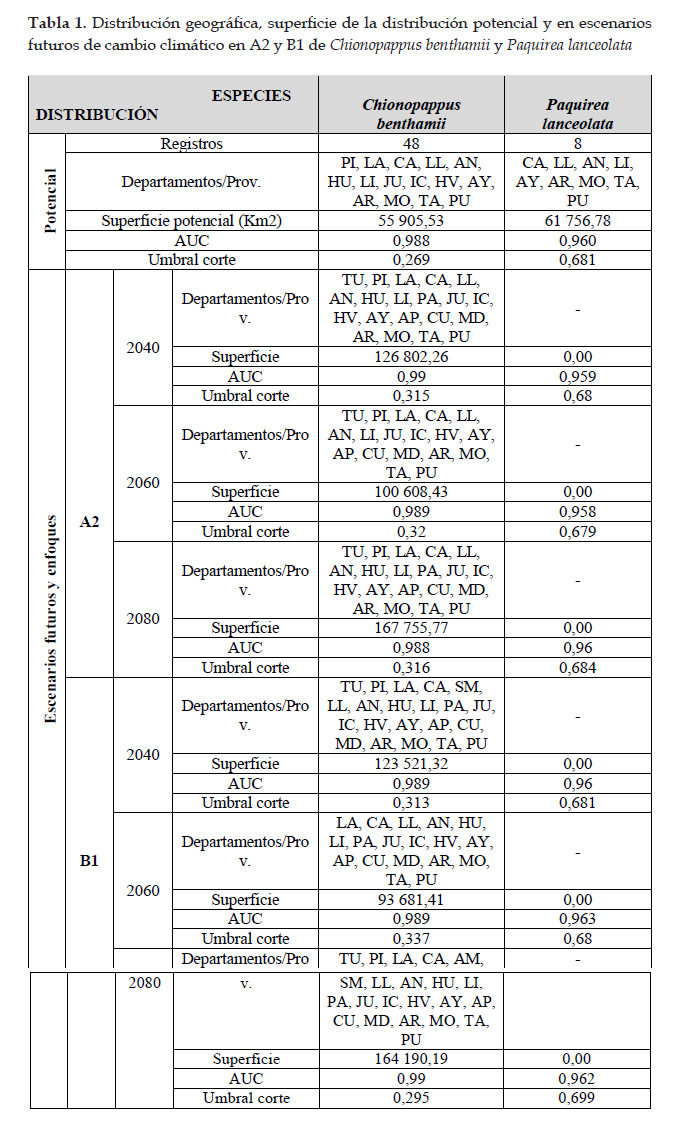
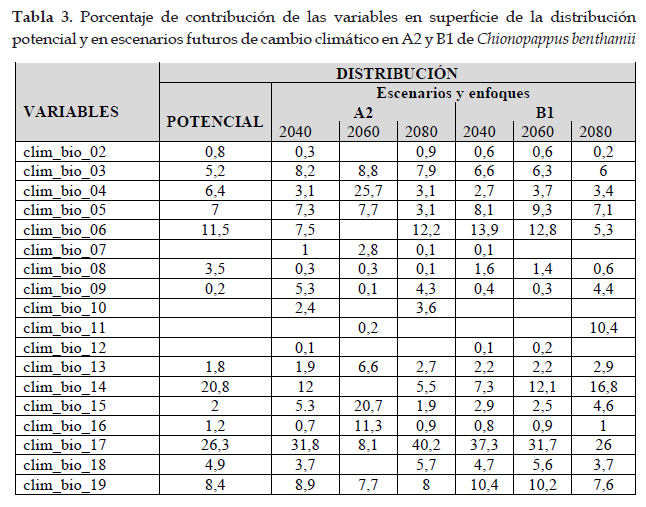
En la Fig. 1 el programa MaxEnt usando 48 registros (tabla 1), predijo una distribución actual adecuada para Chionopappus benthamii; las dos variables que más contribuyeron al modelo fueron: zonas de vida (29,2%) y vertientes (28,3%) (tabla 4); en la prueba de jackknife muestra que las variables con los valores más altos fueron: cuencas y zonas de vida (Fig. 2). Con respecto a la distribución potencial las variables ambientales con mayor ganancia son: precipitación del cuarto más seco (clim_bio_17= 26,3%) y precipitación del mes más seco (clim_bio_14= 20,8%) (tabla 3), y en la prueba de jackknife la variable que más contribuye cuando se usa aisladamente es precipitación anual (clim_bio_12), por lo tanto, parece tener la información más útil en sí misma. En la Fig. 1, la superficie aumenta con áreas más concentradas en la sierra de todos los departamentos con algunas áreas hacia Cusco; aunque es una especie que posee registros y distribución actual en lomas del norte y centro, no existen áreas para esta especie en la formación de lomas del sur de Perú. Así mismo, en el modelo de distribución potencial para Chionopappus benthamii, la superficie se extiende de nueve departamentos según la distribución actual, a 15 departamentos principalmente de la cuenca del Pacífico, y algunas áreas hacia el departamento de Cusco.
Distribución en escenarios futuros para cambios climático y uso de suelo para Chionopappus benthamii S. F. Blake
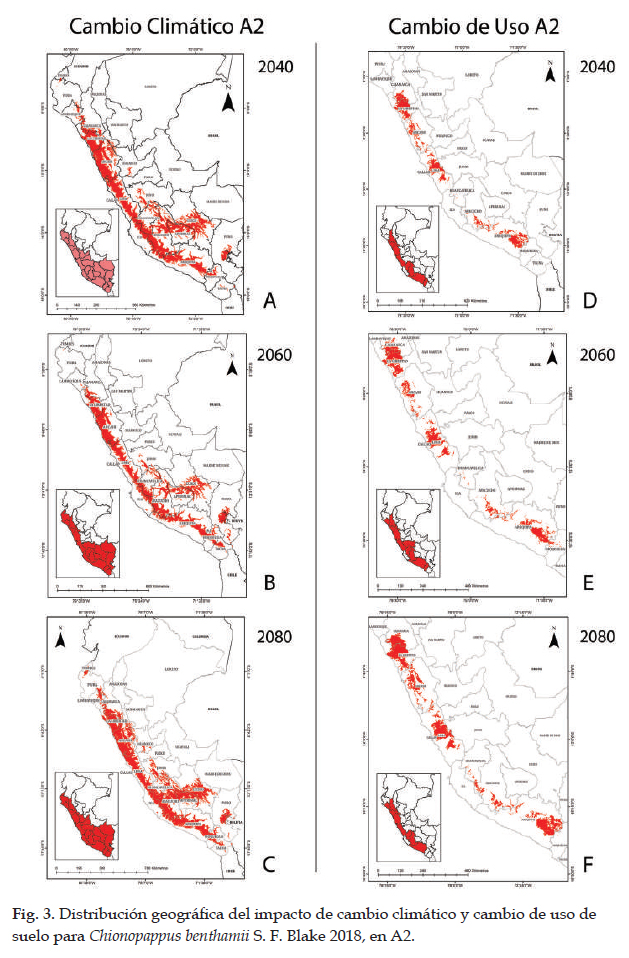
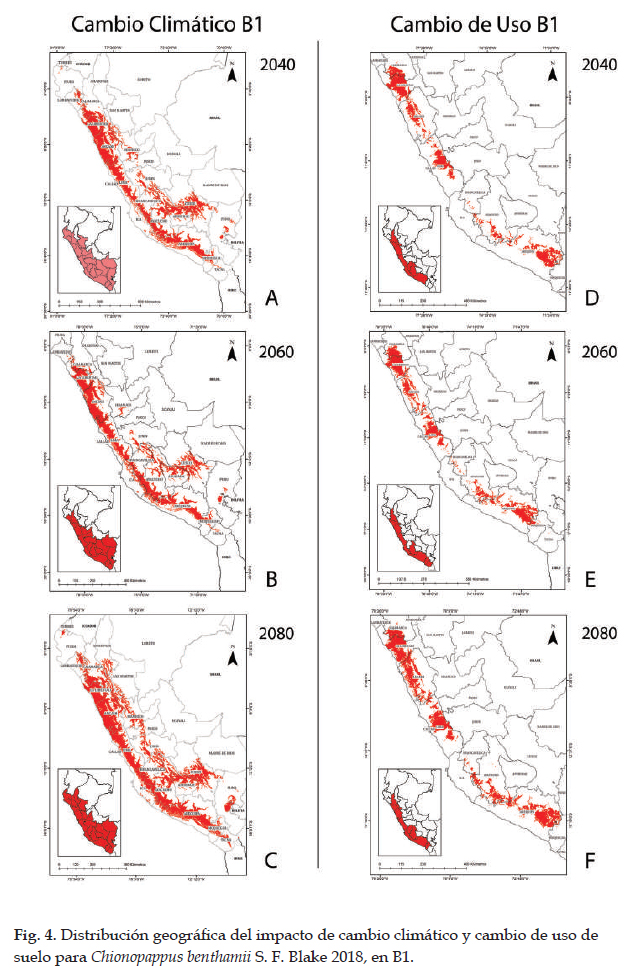
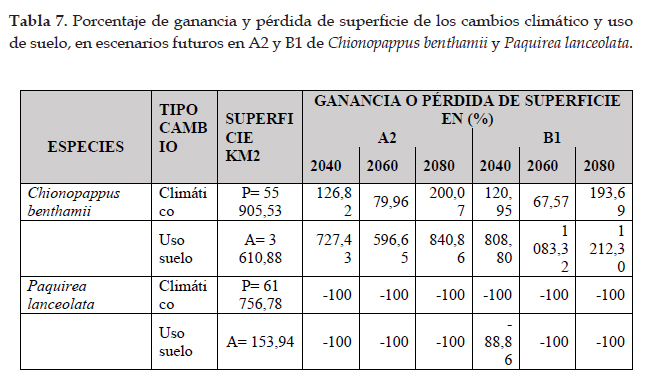
En las Figs. 3 y 4 los modelos para las predicciones futuras de Chinopappus benthamii poseen una alta confiabilidad, porque los valores de AUC están por arriba de 0,99. Así mismo, en la prueba de jackknife, las variables con los valores más altos son las mismas de la distribución potencial, con valores similares y están influenciadas por la precipitación anual y precipitación del cuarto más húmedo. En la Fig. 3, se observan las predicciones futuras de cambio climático y cambio de uso de suelo en A2. Las áreas para cambio climático aumentan en alrededor del 135% en los tres escenarios. Con respecto al cambio de uso de suelo, las poblaciones de Chionopappus benthamii presentan áreas más concentradas en el norte y sur de Perú e incrementaría su extensión en ca. 721% con respecto a su distribución actual (tabla 7). La Fig. 4 muestra las predicciones de cambo climático y cambio de uso de suelo en B1. Con respecto al cambio climático, las áreas aumentan en ca. 127% con respecto a la distribución potencial, con menor incremento en 2060; y con respecto al cambio de uso de suelo, la superficie aumenta en ca. 1000% con respecto a la distribución actual.
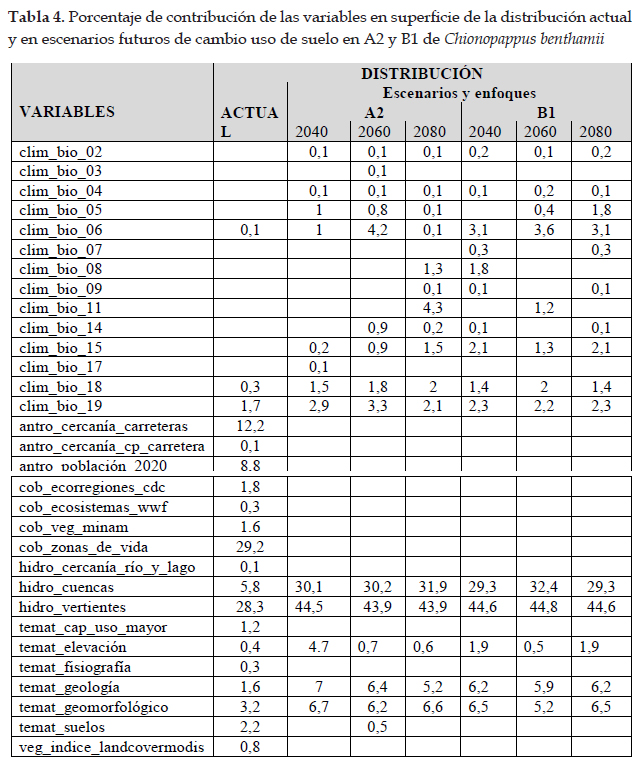
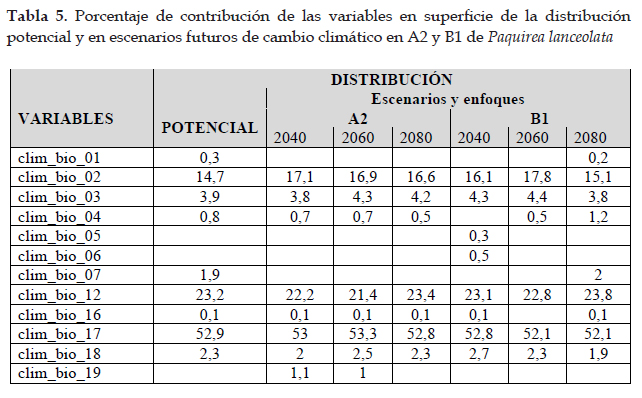
Distribución actual y potencial de Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S. E. Freire
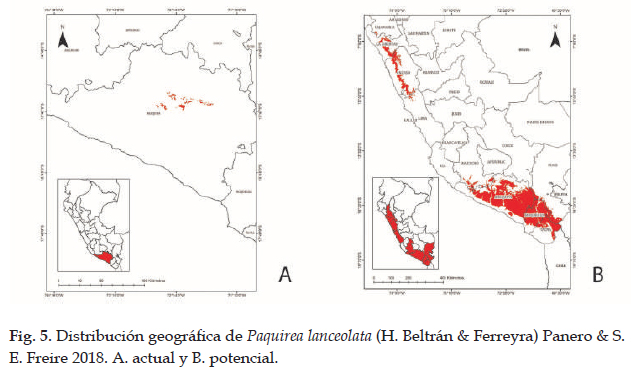
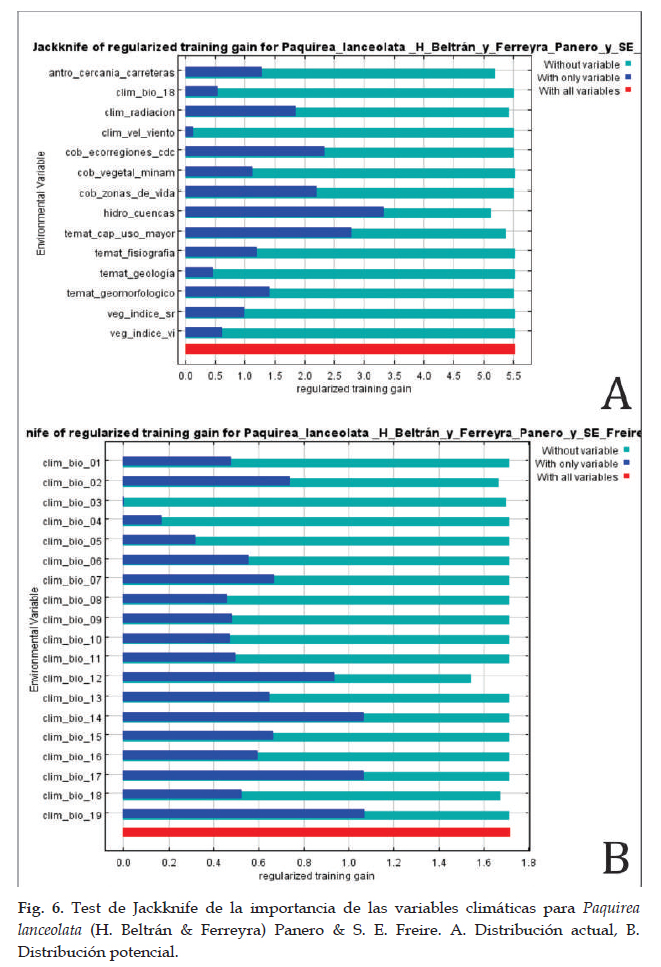
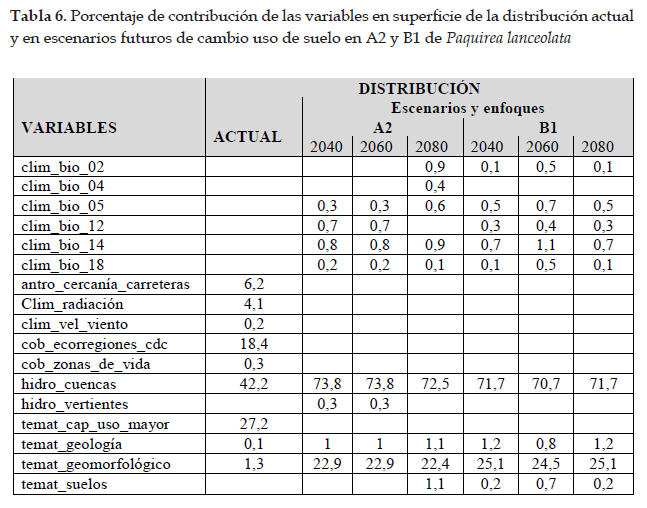
En la Fig. 5 el programa MaxEnt usando ocho registros (tabla 1), predijo una distribución actual adecuada para Paquirea lanceolata; las dos variables que más contribuyeron al modelo fueron: cuencas (42,2%) y capacidad de uso mayor de suelo (27,2%) (tabla 6); en la prueba de jackknife las variables con los valores más altos fueron: cuencas, capacidad de uso mayor de suelo y ecorregiones. Con respecto a la distribución potencial, las variables ambientales con mayor ganancia fueron: precipitación del cuarto más seco (clim_bio_17= 52,9%) y Precipitación anual (clim_bio_12= 23,2%) (tabla 5), y en la prueba de jackknife (Figs. 6) la variable que más aporta cuando se usa aisladamente es precipitación del cuarto más seco (clim_bio_17); por lo tanto, parece tener la información más útil en sí misma. Como se muestra en la Fig. 5, la superficie aumenta y se observan áreas que se extienden a los departamentos del norte y sur hacia la cuenca del Pacífico. Así mismo, según el modelo Paquirea lanceolata, extiende su superficie potencial de un departamento según la distribución actual, a nueve departamentos.
Distribución en escenarios futuros para cambios climático y uso de suelo para Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S. E. Freire
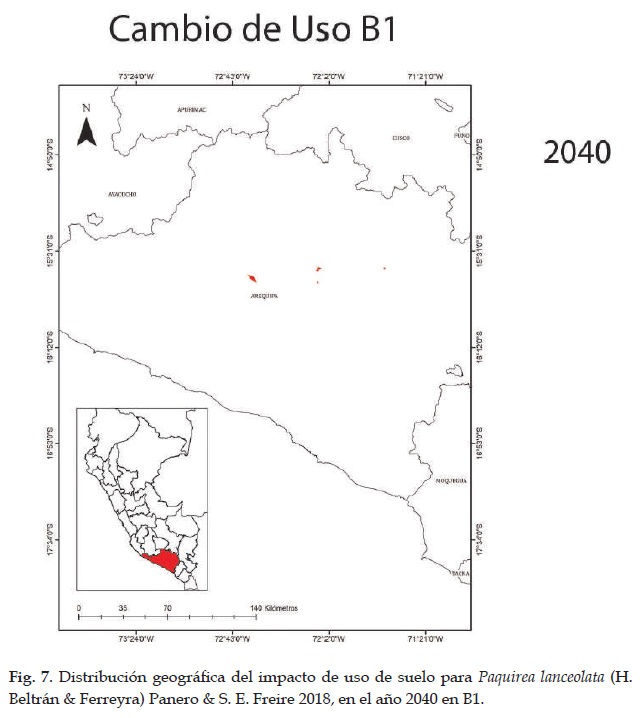
En la Fig. 7 el modelo de distribución futura para Paquirea lanceolata, relacionada a efectos del cambio climático; la especie no contaría con las condiciones óptimas para su desarrollo en A2 y B1 en todos los escenarios; algo similar ocurre con el cambio de uso de suelo, donde solo para el 2040 en B1, existe la posibilidad que la especie encuentre las condiciones apropiadas, pero con disminución en 88,86% de su superficie con respecto a la distribución actual y en los demás escenarios y enfoques la especie no contaría con las condiciones apropiadas para su desarrollo.
Discusión
Para el modelado de la distribución de las especies, se tomaron los datos de presencia, como los puntos de muestreo; donde la región geográfica de interés, es el espacio para definir la distribución y las características son las variables ambientales (Phillips et al., 2006). El modelo de distribución de las especies define también un nicho de las especies, y para aproximarnos a este nicho fundamental (distribución potencial), el modelamiento de las especies se ha realizado con las 19 variables climáticas, principalmente para los modelos de predicción, que se basan actualmente en datos climáticos para la predicción potencial del hábitat, donde generalmente no se toma en cuenta el factor humano, cuya información espacial proviene del worldclim (Fick & Hijmans, 2017), ya que estas, condicionan en mayor o menor grado el tipo de hábitat y estrategias de adaptación de cada especie para un determinado lugar. Así mismo, Hutchinson (1957), definió a nicho efectivo, como el espacio ecológico y geográfico en el que la especie vive; aunque no se conocen las relaciones y/o "enemigos" que condicionan su distribución real, el incorporar otras variables permitirían conocer su distribución actual, y para definir este tipo de distribución, se usaron también, variables que tienen que ver con las acciones de cobertura vegetal, antrópicas y variables ecológicas (García, 2008) (tabla 8). Aunque, lo ideal es considerar variables, que tengan relación directa con la distribución de las especies; sin embargo, como lo mencionan Benito & Peñas (2007) es habitual que se utilicen solo las disponibles; por esa razón, para obtener modelos de distribución más ajustados y parecidos a la realidad se incluyen en el modelado índices de vegetación, porque representan mejor el estado, composición y uso actual del suelo en términos de vegetación (Hirzel & Guisan 2002).
Se ha elegido los escenarios A2 y B1, para conocer la distribución futura de Chinopappus benthamii y Paquirea lanceolata en los años 2040, 2060, 2080 para los cambios climático y uso de suelo. El escenario (A) donde se considera la descripción del mundo tal y como evolucionará de mantener nuestro actual comportamiento, y se caracterizaría por un crecimiento lento y cada vez más desigual entre las distintas regiones del planeta; donde, la autosuficiencia y la conservación de las identidades locales serían rasgos característicos. En el escenario (B) se considera como un mundo más sostenible, tanto a nivel ambiental como económico y social. La conciencia de protección del ambiente e igualdad social está más arraigada, aunque las soluciones a estos aspectos se plantearían de manera regional; el mundo crecería a menor ritmo, pero de forma más sostenible (Pérez et al., 2005; Benavides & León 2007; Cuesta et al., 2012). En ambos casos, los resultados muestran un incremento en superficie de Chionopappus benthamii en todos los escenarios y enfoques; en tanto que, para Paquirea lanceolata desde el año 2040 la superficie decrece en 100%. Para mejorar la coherencia entre los datos de entrada y resultados, se ajustaron los parámetros y las constantes del modelo (Rykiel, 1996; Phillips & Dudik 2008). Así mismo, se eligió MaxEnt porque la reciente comparación entre varias técnicas de predicción de la distribución de especies, muestra que es uno de los métodos más eficaces, con un ajuste particularmente bueno, cuando el conjunto de datos analizados cuenta con un número pequeño de registros de presencia, como es el caso de Paquirea lanceolata, dado que sólo requiere registros de presencia y resulta más eficiente que otros métodos (Pearson et al., 2007).
Chionopappus Benth. es un género descrito por George Bentham (Bentham & Hooker 1873) y consta de una especie Chionopappus benthamii S. F. Blake publicado en 1935 (Blake 1935); posee una amplia distribución en el centro y norte de Perú, con registros en los departamentos de Cajamarca, La Libertad, Ancash y Lima; alcanzando su distribución más austral en el departamento de Arequipa (Brako & Zarucchi 1993; Leiva et al., 2014; Gonzáles, 2016); así mismo, forma parte de las formaciones de lomas del centro y norte de Perú (Leiva et al., 2008; 2014; Dillon et al., 2011), y se distribuye desde 500 m hasta 3500 m de elevación; sin embargo, no está presente en la formación de lomas del sur de Perú. El modelo realizado en MaxEnt (con 24 diferentes variables) (Phillips et al., 2006) predijo una distribución actual adecuado para Chionopappus benthamii (3 610,88 km2), con ganancia de entrenamiento regularizada de 4,405 y 5,532, AUC de 0,998; ganancia de entrenamiento no regularizada de 5,061; lo que indica un buen ajuste del modelo y las variables que más contribuyen son: vertientes y zonas de vida, debido a su distribución en las vertientes occidentales del Perú. Las curvas de respuesta para cada una de las variables y los rangos óptimos de distribución, indican la predicción de las mejores condiciones del hábitat o áreas donde es más probable la especie esté presente (Phillips et al., 2006; Hutchinson, 1957). En la prueba de jackknife para Chionopappus benthamii la variable con mayor ganancia cuando se usa aisladamente es cuencas y de omitirse, es la que disminuye la ganancia.
Para la distribución potencial, el modelo de MaxEnt con las 19 variables climáticas, predijo una distribución potencial adecuada para Chionopappus benthamii con un aumento de área (tabla 7), con altas tasas de éxito (AUC= 0,988), que indican un buen ajuste del modelo; la ganancia de entrenamiento no regularizada es de 3,297. Aunque no hay registros de la especie para los departamentos donde las condiciones de hábitat cumplirían con los requerimientos necesarios, o las mejores condiciones para su desarrollo; el modelo considera áreas en condiciones óptimas para 15 departamentos de costa y sierra, pero no considera a las formaciones de lomas del sur de Perú como un hábitat apropiado para su distribución, áreas que en la actualidad no existen registros (Quipuscoa et al., 2016). Las curvas de respuesta para cada una de las variables y los rangos óptimos de distribución de la especie, indican la predicción de las mejores condiciones del hábitat o áreas donde es más probable su distribución. Los resultados de la prueba de jackknife (Fig. 2), muestra que la variable ambiental con mayor ganancia cuando se usa aisladamente es precipitación anual (clim_ bio_12) y la variable ambiental que más disminuye la ganancia cuando se omite, es estacionalidad de la temperatura (clim_ bio_04); que por lo tanto, parece tener la mayor cantidad de información que no está presente en las otras variables (Fick & Hijmans 2017). La distribución de esta especie herbácea o subarbustiva, estaría relacionada con las precipitaciones para su desarrollo (Blake, 1935).
Las predicciones futuras para Chinopappus benthamii (Figs. 3 y 4), poseen una alta confiabilidad con valores de AUC por arriba de 0,99. Así mismo, en la prueba de jackknife, las variables con los valores más altos, son las mismas de la distribución potencial, y están influenciadas por la precipitación anual y precipitación del cuarto más húmedo. Con respecto a cambio climático el impacto es positivo, las áreas aumentan en alrededor del 55,67% y 53,66% en los enfoques A2 y B1 respectivamente, con respecto a la distribución potencial. El desarrollo de esta especie, al tratarse de una hierba o sufrítice está influenciada por las precipitaciones, cuya parte aérea se seca total o parcialmente cuando no existen lluvias; sin embargo, en épocas húmedas las semillas germinan o los tallos rebrotan con las precipitaciones en la vertientes occidentales o con las neblinas en la formación de lomas del norte y centro de Perú (Bentham & Hooker 1873); además, los modelos futuros indican que las condiciones mejorarían hacia el sur y oriente hacia los departamentos de Puno y Cusco, donde se generarían condiciones apropiadas para su desarrollo (Montesinos-Tubée et al. 2015). Para el cambio de uso de suelo, el impacto también es positivo en todos los escenarios y enfoques; en estas condiciones, las poblaciones de Chionopappus benthamii se mantendrían en el centro y sur de Perú e incrementarían su extensión con respecto a la distribución actual, con traslado hacia elevaciones mayores; como lo manifiestan Markham et al. (1993), Beniston (1994) y Herzog et al. (2012) las especies se trasladan a mayores altitudes cuando existe un incremento de temperatura y por cada 3o C de aumento, daría lugar a un desplazamiento de 600 m hacia arriba. Esta especie se encuentra distribuida en un área natural protegida en el sur de Perú, como es la Reserva Paisajística Sub Cuenca del Cotahuasi; sin embargo, sus hábitats están fragmentándose por la construcción de carreteras, actividad minera, expansión urbana y expansión agrícola.
Paquirea Panero & Freire, es un género descrito por José Panero & Susana Freire (Panero & Freire 2013), consta de una especie Paquirea lanceolata (H. Beltrán & Ferreyra) Panero & S. E. Freire; esta especie fue inicialmente descrita como Gochnatia lanceolata (Beltrán & Ferreyra 2001) quienes manifestaron que estaba distribuida en Perú y Bolivia; posteriormente fue transferida a Chucoa lanceolata (Sancho et al. 2005). Para Panero & Freire (2013) es una especie endémica de Arequipa y crece en el distrito de Andagua de la provincia de Castilla a 3600 y 3700 m de elevación. Con las exploraciones botánicas se confirma que es una especie exclusiva de Arequipa, restringida a las provincias de Caylloma y Castilla. Se trata de un arbusto que crece en matorrales y lugares abiertos desde 2900 hasta los 3700 m de elevación (Panero & Freire 2013). El modelo predijo una distribución actual que según Phillips et al. (2006) es adecuada (153,94 km2), lo que indica un buen ajuste del modelo. Así como, las variables cuencas y capacidad de uso mayor de suelo, son las que más contribuyen al modelo; esta especie crece en el cono y cráter de los volcanes, así como en formaciones arbustivas de Andagua y valle del Colca. Las curvas de respuesta muestran que la especie posee mejores condiciones para su desarrollo en lugares con suelo volcánico, en este caso, el modelo de distribución coincide con los registros de presencia usados, y ocupan un área restringida al departamento de Arequipa (Beltrán & Ferreyra 2001; Beltrán et al., 2006; Panero & Freire 2013). En la prueba de jackknife, las variables con mayor ganancia están relacionadas con cuencas y dependerá del uso adecuado de los ecosistemas de estas áreas.
Para la distribución potencial, el modelo predijo una distribución adecuada de Paquirea lanceolata, con un aumento en área y con altas tasas de éxito (AUC= 0,96) que indican un buen ajuste del modelo. La distribución potencial se extiende a nueve departamentos principalmente hacia la sierra norte, y alcanza su distribución límite en el departamento de Cajamarca a lugares con vegetación arbustiva; hacia el sur su distribución es continua y de mayor extensión; según el modelo; en la sierra del centro, no existen áreas para el desarrollo de la especie, generando una distribución disjunta. En la actualidad, solo existen registros para Arequipa y no en los departamentos que el modelo indica; sin embargo, las condiciones de hábitat abarcan áreas situadas a lo largo de la sierra con características climatológicas similares para el desarrollo de la especie (Panero & Freire 2013). Las curvas de respuesta indican condiciones óptimas para la distribución en climas del piso superior de las vertientes occidentales. Así mismo, en la prueba de jackknife las variables precipitación del cuarto más frío y precipitación del cuarto más seco, son las que contribuyen con mayor ganancia al modelo (Fick & Hijmans 2017). En lo referente a la distribución futura el impacto es negativo para Paquirea lanceolata. En relación a efectos del cambio climático la especie no contaría con las condiciones óptimas para su desarrollo en ambos enfoques y en todos los escenarios, y con respecto al cambio de uso de suelo, solo para el 2040 en B1, existe la posibilidad de contar con una superficie reducida en 88,86% con respecto a la distribución actual.
De estos dos géneros como se ha mencionado, algunas poblaciones de Chionopappus benthamii se encuentran distribuidas en la Reserva Paisajística Sub Cuenca del Cotahuasi y Paquirea lanceolata no tiene protección estatal o privada y la fragmentación de su hábitat principalmente por la construcción de carreteras y actividad minera, la convierten en una especie que urge ser protegida.
Conclusiones
La distribución de las especies son de mucha importancia para realizar conservación y administración de recursos entre otras aplicaciones; Chionopappus benthamii posee una distribución geográfica actual en nueve departamentos con 3 610,88 Km2 de superficie y Paquirea lanceolata está restringida para Arequipa con 153,94 Km2. La superficie de la distribución potencial para Chionopappus benthamii manifiesta un incremento a 55 905,53 Km2 y Paquirea lanceolata en 61 756,78 Km2.
El impacto del cambio climático es positivo o con ganancia de superficie en Chinopappus benthamii con mayor distribución de norte a sur, incluyendo oriente y cuenca del Titicaca, y es negativo o de pérdida mayor al 70% en Paquirea lanceolata con respecto a la distribución potencial, para los años 2040, 2060 y
2080 en los enfoques A2 y B1. El impacto del cambio de uso de suelo es positivo o con ganancia en área para Chinopappus benthamii y es negativo o pérdida mayor al 70%, en Paquirea lanceolata con respecto a
la distribución actual, para los años 2040, 2060 y 2080 en los enfoques A2 y B1.
Agradecimientos
A la Universidad Nacional de San Agustín, a través de sus autoridades por la subvención otorgada en la primera Convocatoria a tesis doctoral, con el contrato N° 02-2016-UNSA y a UNSA INVESTIGA por el apoyo en la gestión de la investigación; así como, por las licencias y permisos otorgados. A los curadores y directores de los Herbarios: HSP (Instituto Científico Michael Owen Dillon-IMOD), CUZ (Universidad Nacional San Antonio Abad de Cusco), USM (Universidad Nacional Mayor de San Marcos), MOL (Universidad Nacional Agraria La Molina), HUT-(Universidad Nacional de Trujillo), HAO (Universidad Privada Antenor Orrego de Trujillo), PRG (Universidad Nacional Pedro Ruiz Gallo de Lambayeque), CPUN (Universidad Nacional de Cajamarca) y F (Field Museum of Chicago); por su amabilidad y permitir la consulta de las colecciones y literatura. A los integrantes del Instituto Científico Michael Owen Dillon – IMOD, institución comprometida con el desarrollo regional y del país.
Contribución de los autores
VQS y MOD: Obtención de datos en campo, en herbarios de Perú, extranjero y literatura especializada, elaboración de mapas, redacción del borrador original y correcciones finales. ITZ, MBA, AMR, DRA y KDV: Elaboración y evaluación de mapas, corrección de los borradores. DMT: Obtención de datos de herbarios nacionales y comentarios en resultados de distribución geográfica de las especies.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Literatura citada
Barry, S. & J. Elith. 2006. Error and uncer tainty in habitat models. Journal of Applied Ecology, 43: 413–423.
Beck, S. G.; P. A. Hernández, P. M. Jørgensen, L. Paniagua, M. E. Timaná & B. E. Young. 2007. Plantas vasculares, en B.E. Young (ed.), Distribución de las especies endémicas en la ver tiente oriental de los Andes en Perú y Bolivia, pp. 18-34. Arlington: Nature Serve. [ Links ]
Beltrán, H. & R. Ferreyra. 2001. Una especie nueva de Asteraceae para Perú y Bolivia: Gochnatia lanceolata. Comp. Newsl, 36:26-30.
Beltrán, H.; A. Granda, B. León, A. Sagástegui, I. Sánchez & M. Zapata. 2006. Asteraceae endémicas de Perú. Rev. peru. biol. número especial 13(2):64s - 164s. En el Libro Rojo de las plantas endémicas del Perú. Ed.: Blanca León et al.
Benavides, H. O. & G. E. León. 2007. Información técnica sobre gases de efecto invernadero y el cambio climático. Instituto de Hidrología, Meteorología y Estudios Ambientales - IDEAM. Bogotá [ Links ].
Beniston, M. (Ed.). 1994. Mountain environments in changing climates. Routledge, London. [ Links ]
Benito de Pando, B. 2009. Ecoinformática Aplicada a conservación: simulación de efectos del cambio global en la distribución de la flora de Andalucía. Tesis Doctoral. Univ. De la Granada. España. [ Links ]
Bentham, G. & J. D. Hooker. 1873. Voluminis Secundi Pars I. Sistens Dicotyledonum Gamopetalarum Ordines VI, Caprifoliáceas-Compositas. Genera Plantarum 2: 410. 1873. [ Links ]
Blake, S. F. 1916. Compositae novae imprimis andinae Weberbauerianae. Bot. Jahrb. Syst., 54(3, Beibl. 119): 47-51. [ Links ]
Brako, L. & J. Zarucchi. 1993. Catalogue of the Flowering Plants and Gymnosperms of Peru. Monogr. Syst. Bot., Missouri Bot. Gard. 45: 1-1286 [ Links ]
Buisson, L.; W. Thuiller; N. Casajus; S. Lek & G. Grenouillet. 2010. Uncer tainty in ensemble forecasting of species distribution. Global Change Biology, 16: 1145–1157. [ Links ]
Busby, J. R. 1991. BIOCLIM- a bioclimate analysis and prediction system. En: Nature conservation: cost effective biological surveys and data analysis. Margules, C.R. & M.P. Austin, Eds. CSIRO, Canberra, ACT, Australia, pp. 64-68. [ Links ]
Costello, M. J.; R. M. May & N. E. Stork. 2013. Can we name Ear th’s species before they go extinct? Science, 339: 413–416.
Cuesta, F.; M. Bustamante; M. T. Becerra, J. Postigo & J. Peralvo (Eds.). 2012. Panorama andino de cambio climático: Vulnerabilidad y adaptación en los Andes Tropicales. CONDESAN, SGCAN, Lima. [ Links ]
Dillon, M. O.; S. Leiva; M. Zapata, P. Lezama & V. Quipuscoa. 2011. Floristic checklist of the Peruvian Lomas Formations. Arnaldoa, 18(1): 7-32. [ Links ]
Dillon, M. O. & M. Zapata. 2010. Angeldiazia weigendii (Asteraceae, Senecioneae), un género y especie nuevo del nor te del Perú. Arnaldoa, 17(1): 19-24. [ Links ]
El-Keblawy, A. 2014. Impact of Climate Change on Biodiversity Loss and Extinction of Endemic plants of Arid Land Mountains. J Biodivers Endanger Species 2: 120. [ Links ]
Feeley, K. J.; M. S. Silman; M. B. Bush; W. Farfan; K. García; Y. Malhi, P. Meir; N. Salinas; M. N. Raurau & S. Saatchi. 2011. Upslope migration of Andean trees. Journal of Biogeography, 38:783-791. [ Links ]
Fick, S. & R. Hijmans. 2017. WorldClim 2: New 1-km spatial resolution climate surfaces for global land areas. International Journal of Climatology. USA. [ Links ]
Fjeldså, J. & C. Rahbek. 2006. Diversification of tanagers, a species rich bird group, from lowlands to montane regions of South America. Integrative and Comparative Biology, 46: 72–81. [ Links ]
Franklin, J. 2009. Mapping species distributions: spatial inference and prediction. Cambridge University Press. [ Links ]
García, M. R. 2008. Modelos predictivos de riqueza de diversidad vegetal. Comparación y optimización de métodos de modelado ecológico. Memoria de Tesis Doctoral. Universidad Complutense de Madrid, Facultad de Ciencias Biológicas. Depar tamento de Biología Vegetal I. Madrid, España. 188 pp. [ Links ]
Gonzáles, P. 2016. Riqueza y distribución de Asteraceae en el depar tamento de Lima (Perú). Arnaldoa, 23 (1): 111 - 134. [ Links ]
Herzog, S. K.; R. Martínez; P. M. Jørgensen & H. Tiessen. 2012. Cambio Climático y Biodiversidad en los Andes Tropicales. Instituto Interamericano para la Investigación del Cambio Global (IAI) Sao José dos Campos y Comité Científico sobre problemas del Medio Ambiente (SCOPE). Paris. [ Links ]
Hijmans, R. J.; S. E. Cameron; J. L. Parra; P. G. Jones & A. Jarvis. 2005. Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, 25: 1965-1978. [ Links ]
Hirzel, A. H. & A. Guisan. 2002. Which is the optimal sampling strategy for habitat suitability modelling. Ecological Modelling, 157(2):331-341. [ Links ]
Hutchinson, G. E. 1957. Concluding remarks. Cold Spring Harbor Symposia of Quantitative Biology, 22, 415-427. [ Links ]
Leiva, S.; M. Zapata; G. Gayoso; L. Chang; M. O. Dillon & V. Quipuscoa. 2014. Diversidad Florística de la Loma Cerro Campana, Provincia Trujillo, Depar tamento La Liber tad-Perú. Arnaldoa, 21(1):187-220. [ Links ]
Leiva, S.; M. Zapata; G. Gayoso; P. Lezama; V. Quipuscoa & M. O. Dillon. 2008. Diversidad Florística de la Loma Mongón, Provincia Casma, Depar tamento Ancash-Perú. Arnaldoa, 15(1): 45-62. [ Links ]
León, B.; J. Roque; C. Ulloa Ulloa; N. Pitman; P. M. JØrgensen & A. Cano. 2006. El Libro Rojo de las Plantas Endémicas del Perú. Rev. Peru. Biol. Vol. 13(2):1-971 [ Links ]
Macbride, J. F. 1946-1970. Flora of Perú.
Markham, A.; N. Dudley & S. Stolton. 1993. Some like it hot: climate change, biodiversity and the survival of species. WWF-International, Gland. [ Links ]
Mateo, R. G.; A. M. Felicísimo & J. Muñoz. 2011. Modelos de distribución de especies: Una revisión sintética. Revista chilena de historia natural, 84: 217–240. [ Links ]
McPherson, J.; W. Jetz & D. J. Rogers. 2004. The effects of species’ range sizes on the accuracy of distribution models: ecological phenomenon or statistical. Journal of Applied Ecology, 41: 811–823.
Montesinos-Tubée, D.; K. Sýkora; V. Quipuscoa & A. Clef. 2015. Species composition and phytosociology of xerophytic plant communities after extreme rainfall in South Peru. Phytocoenologia, 45(3): 203-250. [ Links ]
Mora, C.; D. P. Tittensor; S. Adl; G. B. Simpson & B. Worm. 2011. How many species are there on Ear th and in the ocean? PLoS Biol., 9: e1001127. [ Links ]
Myers, N.; R. A. Mittermeier; C. G. Mittermeier; G. A. B. Da Fonseca & J. Kent. 2000. Biodiversity hotspots for conservation priorities. Nature, 403: 853–858. [ Links ]
Olson, D. M. & E. Dinerstein. 2002. The global 200: priority ecoregions for global conservation. Ann. Missouri bot. Gard., 89: 199–224.
Panero, J. & S. E. Freire. 2013. Paquirea, a new Andean genus for Chucoa lanceolata (Asteraceae, Mutisioideae, Onoserideae). Phytoneuron, 2013-11: 1–5.
Parmesan, C. & G. Yohe. 2003. A globally coherent fingerprint of climate change impacts across natural systems. Nature, 421: 37–42.
Pearson, R. G.; C. J. Raxworthy; M. Nakamura & A. Townsend-Peterson. 2007. Predicting species distributions froms mal lnumbers of occurrencerecords: a test case using cryptic geckos in Madagascar. Journal of Biogeography, 34(1): 102-117. [ Links ]
Pérez, C.; M. Fiebig-Wittmaack & J. Cepeda. 2005. Modelos Climáticos, Escenarios de Emisiones de Gases de Efecto Invernadero y Escenarios Climáticos. SSHRC MCRI-Institutional Adaptation to Climate Change project. Chile. [ Links ]
Phillips, S. J., & M. Dudík. 2008. Modeling of species distributions with MaxEnt: new extensions and a comprehensive evaluation. Ecography, 31(2): 161-175. doi: 10.1111/j.0906-7590.2008.5203.x
Phillips, S. J.; R. P. Anderson & R. E. Schapire. 2006. Maximum entropymodeling of species geographic distributions. Ecological Modelling 190(3-4): 231-259. https://doi.org/10.1016/j.ecolmodel.2005.03.026 [ Links ]
Quipuscoa, V.; C. Tejada; C. Fernández; K. Durand; A. Pauca & M. O. Dillon. 2016. Diversidad de plantas vasculares de las Lomas de Yuta, provincia de Islay, Arequipa Perú, 2016. Arnaldoa, 23 (2): 517 - 546. [ Links ]
Rykiel, E. J. Jr. 1996. Testing ecological models: the meaning of validation. Ecological Modeling, 90(3): 229-244.
Sancho, G.; S. E. Freire; L. Katinas & M. C. Telleria. 2005. Anew combination and a new species of Andean Mutisieae (Asteraceae). Taxon, 54: 85-90. [ Links ]
SERNANP. 2013. Listado Oficial de las Áreas Naturales Protegidas. Available at: http://www.sernanp. gob. pe/sernanp/archivos/biblioteca/mapas/ ListaAnps_18072013.pdf. (accesado 27-Jul-2013, 2013). [ Links ]
Swenson, J. J.; B. E. Young; S. Beck; P. Comer; J. H. Córdova; J. Dyson; D. Embert; F. Encarnación; W. Ferreira; I. Franke; D. Grossman; P. Hernandez; S. K. Herzog; C. Josse; G. Navarro; V. Pacheco; B. A. Stein; M. Timaná; A. Tovar; J. Vargas & C. M. Zambrana-Torrelio. 2012. Plant and animal endemism in the eastern Andean slope: challenges to conservation. Ecology, 12:1-18. [ Links ]
Ulloa-Ulloa, C.; J. Zarucchi & B. León. 2004. Diez años de adiciones a la flora del Perú: 1993—2003. Arnaldoa, Ed. Especial 7—242. [ Links ]
Underwood, J. G.; C. D’agrosa & L. R. Gerber. 2010. Identifying conservation areas on the basis of alternative distribution data sets. Conservation Biology, 24, 162–170.
Van Proosdij, A. S. J.; M. Sosef; J. Wieringa & N. Raes. 2016. Minimum required number of specimen records to develop accurate species distribution models Ecography, 39: 542–552.
Whittaker, R. J.; M. B. Araújo; P. Jepson; R. J. Ladle; J. E. Watson & K. J. Willis. 2005. Conservation biogeography: assessment and prospect. Divers. Distrib., 11: 3–23. [ Links ]
Wisz, M. S.; R. J. Hijmans; J. Li; A. T. Peterson; C. H. Graham; A. Guisan & Nceas Predicting Species Distributions Working Group. 2008. Effects of sample size on the performance of species distribution models. Diversity Distrib., 14: 763–773. [ Links ]
Young, K. & B. León. 1999. Peru´s humid eastern montane forests: An overview of their physical settings, biological diversity, human use and settlement, and conservation needs. DIVA Technical Repor t N°5. Denmark. 97 p. http://diva. dmu.dk/1_viden/2_miljoe-tilstand/3_natur/diva/ repor ts/diva05.pdf [ Links ]
Zimmer, A.; R. I. Meneses; A. Rabatel; A. Soruco & F. Anthelme. 2014. Caracterizar la migración altitudinal de las comunidades vegetales altoandinas frente al calentamiento global mediante cronosecuencias post-glaciales recientes. Ecología en Bolivia, 49(3). [ Links ]
ANEXOS
Recibido: 15-I-2018
Aceptado: 21-II-2019
Publicado online: 10-IV-2019
Publicado impreso: 30-IV-2019