Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Arnaldoa
Print version ISSN 1815-8242On-line version ISSN 2413-3299
Arnaldoa vol.26 no.1 Trujillo Jan./Apr. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26111
ARTÍCULOS ORIGINALES
Inducción in vitro de callo embriogénico a partir del cultivo de anteras en "papa amarilla" Solanum goniocalyx Juz. & Bukasov (Solanaceae)
In vitro induction of embryogenic callus from anther culture in "yellow potato" Solanum goniocalyx Juz. & Bukasov (Solanaceae)
Angel David Hernández Amasifuen & Hermila Belba Díaz Pillasca
Laboratorio de Investigación de la Escuela Profesional de Biología con mención en Biotecnología, Facultad de Ciencias, Universidad Nacional José Faustino Sánchez Carrión, Av. Mercedes Indacochea N° 609, Huacho, PERÚ. adhernandz@hotmail.com.
Resumen
Solanum goniocalyx Juz. & Bukasov (Solanacea), comúnmente llamada "papa amarilla", presenta muchas variedades comerciales como amarilla, Tumbay y peruanita, y tiene una distribución geográfica amplia tan vasta como la papa común. Se propaga vegetativamente a través de tubérculos como semilla, lo cual proporciona ventajas manteniendo características de una determinada variedad, pero también existen desventajas como la transferencia de enfermedades y no poseer, en el mayor de los casos, buenas condiciones genéticas. Estos problemas han hecho necesaria la búsqueda de alternativas de propagación y han permitido la aplicación de nuevos métodos como el cultivo in vitro de tejidos vegetales. Dentro de las técnicas de cultivo in vitro de tejidos vegetales que se han desarrollado en papa, se tiene a los cultivos a partir de meristemos, brotes axilares, embriogénesis somática, etc. Por lo tanto, el objetivo de la presente investigación fue inducir a la formación de callo embriogénico in vitro a partir del cultivo de anteras en "papa amarilla", en el cual se utilizaron cinco tratamientos de medio de cultivo MS, a los cuales se les adicionó citoquininas (zeatina) y auxinas (2,4-D y AIA) en diferentes concentraciones. Se analizó el porcentaje de contaminación, oxidación y de formación de callos embriogénicos. Se determinó que el método de desinfección permite tener 100 % libre de contaminación, además de que las anteras son muy propensas a la oxidación y que el tratamiento D permitió obtener más formación de callos embriogénicos, además de que estos presentaron un mayor tamaño en comparación a los demás tratamientos.
Palabras claves: Solanum goniocalix Juz. & Bukasov, callo embriogénico, in vitro, anteras, Solanaceae.
Abstract
Solanum goniocalyx Juz. & Bukasov (Solanaceae), called "yellow potato", presents many commercial varieties such as amarilla, Tumbay and peruanita; and it has a wide geographic distribution like the common potato. It propagates vegetatively through tubers as seed, which provides advantages maintaining characteristics of a certain variety, but there are also disadvantages like the transfer of diseases and not to have, in most cases, good genetic conditions. These problems have made it necessary to search for propagation alternatives and and have allowed the application of new methods such as in vitro culture of plant tissues. Among the techniques of in vitro culture of tissues that have been developed in potato, we have cultures from meristems, axillary shoots, somatic embryogenesis, etc. Therefore, the objective of this investigation was to induce the formation of embryogenic callus in vitro from anther culture in "yellow potato", in which five treatments of MS culture medium were used, to which were added cytokinins (zeatin) and auxins (2.4-D and AIA) in different concentrations. The percentage of contamination, oxidation and formation of embryogenic calluses was analyzed. It was determined that the disinfection method allows to have 100 % free of contamination, besides that the anthers are very prone to oxidation and that treatment D allowed to obtain more formation of embryogenic calluses, besides that they presented a larger size compared to the other treatments.
Keywords: Solanum goniocalix Juz. & Bukasov, embryogenic callus, in vitro, anthers, Solanaceae.
Introducción
La papa (Solanum spp.) es una plan- ta herbácea que pertenece a la familia de las solanáceas. Se originó y fue domesti- cada por primera vez en las montañas de los Andes de Sudamérica. El cultivo de la papa ocupa el tercer lugar en importancia en el mundo como alimento para consu- mo humano después del arroz y el trigo. El Perú es el país con mayor diversidad en papas, llegando a comercializar 3000 variedades. Dentro de las especies culti- vadas se encuentra Solanum goniocalix Juz. & Bukasov, que es comúnmente llamada "papa amarilla" o "ckello papa" en la zona central del Perú. Presenta una diversidad de variedades comerciales como: Amarilla, Tumbay y Peruanita.; teniendo una distri- bución geográfica amplia tan vasta como Solanum tuberosum (International Potato Center, 2018).
La forma de multiplicación del cultivo de papa es vegetativamente a través de tubérculos como semilla, la cual propor- ciona como ventaja que se mantengan pre- sentes características de una determinada variedad, pero del mismo modo también existen desventajas como la transferencia de enfermedades y no poseer en el mayor de los casos buenas condiciones genéticas. Estos problemas han hecho necesaria la búsqueda de alternativas de propagación y permitido la aplicación de nuevos méto- dos como vienen siendo el cultivo in vitro de tejidos vegetales, las cuales permiten obtener plantas libres de patógenos y clo- nes de gran valor agronómico por presen- tar alta producción (Cárdenas, 1989).
Dentro de las técnicas de cultivo in vitro de tejidos vegetales que se han desarrolla- do en papa se tiene a los cultivos a partir meristemos, brotes axilares desarrollados de puntas meristemáticas, puntas de ápi- ces y también por embriogénesis somática. Aprovechando la totipotencia de las cé- lulas vegetales en Colombia Gómez et al. (1997) indujeron la formación de embrio- nes somáticos a partir de hojas de papa va- riedad "Diacol Capiro" y "Parda Pastusa, de la misma manera en México Sánchez et al. (2005) obtuvieron plántulas completas de papa regenerados de embriones somá- ticos a partir de explantes de mesófilo de hojas. Los estudios condujeron a que la regeneración bajo condiciones in vitro está en relación con el genotipo de los explan- tes, al existir diferencias porcentuales en la formación de callos embriogénicos en las distintas variedades y cultivares de papa.
Los callos embriogénicos son células vegetales en un proceso indiferenciación en constante división celular, dependiendo principalmente genotipo del explante, además de la concentración y combinación de reguladores de crecimiento adicionados al medio de cultivo. Este método es utilizado para diferentes propósitos dentro del mejoramiento vegetal, como la micropropagación y suspensiones celulares para la producción de embriones somáticos (Larson et al., 2006).
Dentro de las técnicas para obtener callo embriogénico se tiene el cultivo de anteras, además de permitir en el proceso de diferenciación obtener plantas haploides y doblehaploides. Teniendo de esta manera antecedentes de investigación por Guha y Maheswari (1964), que obtuvieron embriones a partir del cultivo intacto de anteras de Datura inoxia, y a partir de este estudio se ha dado la formación de plántulas indirectamente mediante callo o directamente por androgénesis, teniendo mayor estudios en las familias Solanaceae y Poaceae. Además los estudios que se han realizado hasta la actualidad sostienen que uno de los mayores problemas que atraviesa esta técnica es la baja frecuencia de plántulas formadas, esto tiene mucha influencia en la etapa de selección de los explantes, donde el mayor desarrollo de callos embriogénicos es cuando las microsporas se encuentran en la etapa de uninucleada o también se han obtenido resultados positivos después de la primera mitosis (Bajaj, 1983).
Por lo tanto, el objetivo de la presente investigación fue inducir a la formación de callo embriogénico in vitro a partir del cul- tivo de anteras en "papa amarilla" Solanum goniocalyx Juz. & Bukasov (Solanaceae).
Materiales y métodos
La investigación se realizó en el laboratorio de investigación perteneciente a la Escuela Profesional de Biología con mención en biotecnología, Facultad de Ciencia, Universidad Nacional José Faustino Sánchez Carrión, en el distrito de Huacho, provincia de Huaura, Perú.
Material vegetal
Las muestras de botones florales de papa amarilla fueron colectadas del invernadero pertenecientes al laboratorio de investigación de la Escuela Profesional de Biología con mención en biotecnología, ubicado en la Universidad Nacional José Faustino Sánchez Carrión, en el distrito de Huacho, provincia de Huaura, Perú; situado a una altitud de 41 msnm, latitud sur 11° 7’ 34"y longitud oeste 77° 36’ 34", con temperatura media anual de 19,2° C.
Identificación de botones florales
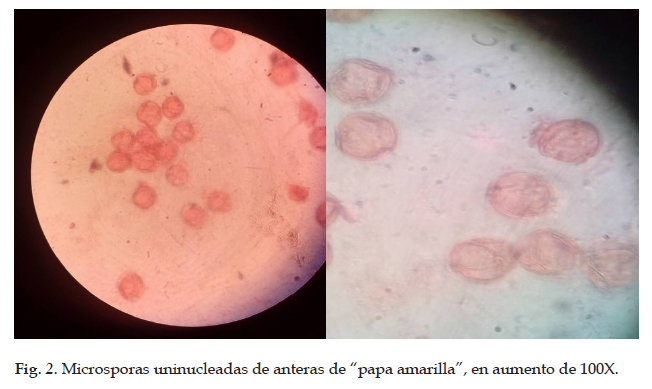
Los botones florales colectados no presentaron daño en el tejido, con un tamaño uniforme entre sí. Se obtuvo un total de 30 botones florales, los cuales fueron clasificados en estadios de acuerdo a su desarrollo de las microsporas de las anteras. Los cuales se determinaron mediante el método de tinción con orceina acética, seleccionando las anteras con microsporas en etapa uninucleada.
Desinfección de botones florales
Los botones florales seleccionados fueron primeramente enjugadas con agua destilada para posteriormente ser llevados a la cámara de flujo laminar, donde se sumergieron en etanol al 70 % durante 3 minutos, luego pasaron a hipoclorito de sodio al 2% durante 15 minutos seguido de 3 lavados en agua destilada estéril.
Cultivo in vitro de anteras
Se sembraron 20 anteras por placa con medio de cultivo, donde se evaluó el efecto de 5 tratamientos con diferentes concentraciones de reguladores de crecimiento, en todos los tratamientos se emplearon al 100% las sales y vitaminas del medio MS (Murashige y Skoog, 1962), adicionado con agar agar y sacarosa (Tabla 1), por último se ajustó el pH a 5,7.
Inducción de embriogénesis
Para inducir la formación de callo embriogénico todos los tratamientos se mantuvieron en oscuridad durante las primeras cinco semanas y luego durante cinco semanas en un fotoperiodo de 16 horas con una intensidad lumínica de 500 Lux. Durante todo el experimento se mantuvo a una temperatura constante de 27° C y humedad relativa del 70 ± 2% (Plant Growth Chamber, LGC – 5201 G, LabTech).
Diseño experimental y análisis estadístico
Se utilizó el diseño experimental completamente al azar y cada tratamiento constó de cinco placas con 8 anteras cada una, utilizando la placa como unidad experimental. La variable evaluada fue el número de anteras que formaron callo embriogénico. Los datos se sometieron a un análisis de varianza (ANOVA). Para los factores que resultaron estadísticamente significativos se realizó una prueba de Tukey (0,05) como separador de medias. Los datos fueron procesados con el software estadístico SPSS (versión 15,0 para Windows).
Resultados
Los botones florales que presentaban el estadio idóneo de desarrollo de las microsporas fueron los que presentaban un tamaño entre 5 y 6,5 mm, con una longitud igual de los sépalos con los pétalos (Fig. 1). Estos presentaron mayor número de células uninucleadas (Fig. 2), los cuales permitirían un mayor porcentaje de inducción de formación callo embriogénico.
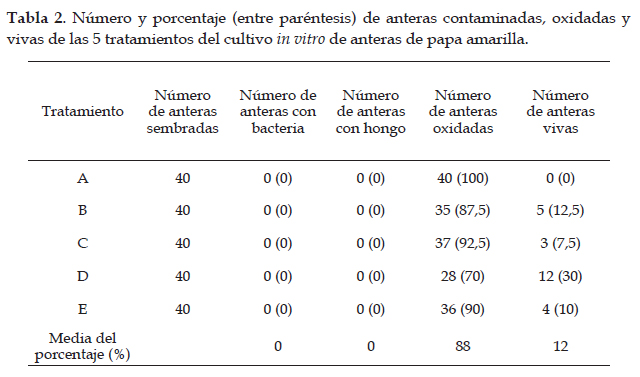
Con respecto a la desinfección de las anteras, la metodología empleada permitió obtener 100% libre de contaminación. Pero se presentó gran porcentaje se oxidación tornándose de color café las anteras y aunque en cuatro de los tratamientos produjeron callo, en tres de ellos este fue muy pequeño y de corta duración (Tabla 2).
Transcurrida las cuatro semanas en oscuridad, se logró apreciar que un gran porcentaje de las anteras se
oxidaron, mientras que las anteras que no presentaron oxidación aumentaron de volumen en relación con la formación de los callos embriogénicos (Fig. 3).
Posteriormente a las cinco semanas con fotoperiodo se pudo apreciar un incremento del tamaño de los callos embriogénicos (Fig. 4), siendo el tratamiento D (zeatina + ácido 2,4-dicloro fenoxiacético) el que presento callos con mayor tamaño en comparación con los demás tratamientos. Pero en el transcurso de ese mismo tiempo la mayoría de estos callos fueron oxidándose, tornándose de color café.
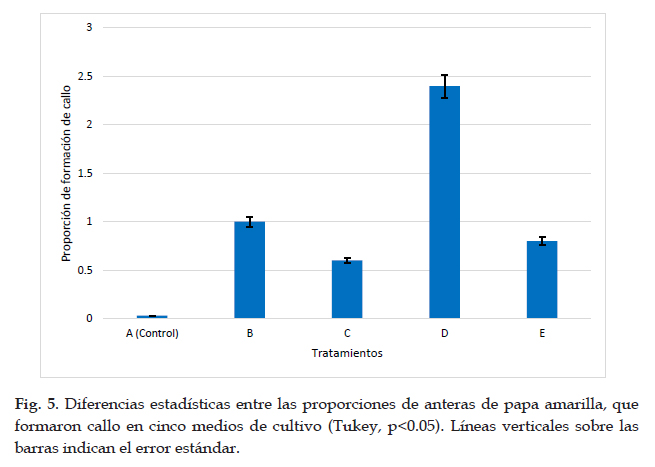
Respecto a la variable formación de callos embriogénicos de acuerdo a la prueba Tukey, se presentaron diferencias significativas entre los cinco tratamientos, de esta manera el tratamiento D (0,5 mg/ L zeatina + 0,5 mg/L ácido 2,4-dicloro fenoxiacético)presento mayor formación de callos embriogénicos en comparación con los demás tratamiento, además el tratamiento A (control) sin reguladores de crecimiento no llego a formar callos embriogénicos, ya que todas las anteras de este tratamiento se oxidaron. (Fig. 5)
Discusión
El promedio de anteras libres de contaminación es similar al obtenido por otros autores, además de presentar oxidación con gran facilidad (Germana 2009, Vélez et al. 2010), en cual se logró apreciar como las anteras durante la primera semana de introducción en el medio de cultivo in vitro perdían su coloración verde hasta tornarse de una coloración parda y finalmente en la siguiente semana de color café, esta variación de coloración tiene relación con la respuesta de la enzima polifenol oxidasa, la cual se activa al daño del tejido de los explantes y de esta manera la enzima oxida a los fenoles, produciendo compuestos tóxicos e insolubles de color marrón denominadas quinonas, además esta reacción puede estar activa en la senescencia y es de fundamental importancia en la respiración celular vegetal (Bidwell, 1979).
Las anteras que no presentaron oxidación se comenzaron a tornar de color blanco a partir de la segunda semana, además de en el transcurso de las semanas fueron aumentando de tamaño hasta tres veces su tamaño inicial. Esto puedo implicar la variabilidad genética que existe entre las anteras además de considerar que las condiciones del medio de cultivo fueron las apropiadas para la inducción en la formación de callos embriogénicos, debido a que la capacidad morfogénica generalmente está latente durante los primeros días o semanas de introducción in vitro pero existen casos que se han reportado por largos periodos la habilidad regenerativa (George et al., 2008). Asimismo, se han reportado estudios en Solanaceas donde han encontrado que existen diferentes respuestas en la formación de embriones de las anteras de una misma flor, en la cual no todas llegaron a formar embrión y se relaciona al grado a la homogeneidad de las anteras en un mismo botón floral (Kim et al., 2004).
El medio de cultivo con diferentes concentraciones de reguladores de crecimiento permite tener diferentes respuestas de parte de las anteras, en este caso la adición de citoquininas y auxinas, los cuales son los compuestos que tienen mayor influencia en el desarrollo y diferenciación celular. Esto debido a que en el cultivo in vitro estos compuestos endógenos presentan cambios drásticos en el ambiente celular, lo que genera efecto de estrés que puede causar una reorganización celular y formar una masa de células no diferenciadas (Fehér et al, 2003).
El mayor número de callos embriogénicos formados se obtuvieron del tratamiento adicionado con 2,4-D y Zeatina a una media concentración, en comparaciones a otros autores que recomienda la adición de una alta combinación de citoquininas y auxinas, o solo la adición de auxinas puede favorecer a la inducción de callos embriogénicos, además de que el aspecto de los callos
embriogénicos está relacionado al tipo de hormona utilizada durante su inducción. En el caso de estos reguladores de crecimiento el que presenta más reportes de inducción de callos es la auxina 2,4-D y en el caso de las citoquininas sugieren el uso de Zeatina, Kinetina, Tiadizuron o 6-bencilaminopurina (BAP) (Shiram et al. 2008, Larson et al. 2006, Meiners et al. 2007).
Estos resultados suponen un avance importante en la utilización de las técnicas biotecnológicas para la mejora genética de papa amarilla, la cual abre expectativas para el potencial uso de los callos embriogénicos de esta especie para producción de protoplastos, híbridos somáticos y sobre todo obtención de plantas haploides y doblehaploides.
Contribución de los autores
A.H.: Recolección de información, datos, redacción, análisis e interpretación de los mismos. H.B.D.P.: Interpretación de los datos, revisión crítica del texto y aprobación de la versión final. Todos los autores han leído el manuscrito final y aprobado la revisión.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Literatura citada
Bajaj, Y. 1983. In vitro production of haploids, pp. 228-287. In: Handbook of Plant Cell Culture. Vol. I. D.A. Evans, W. R. Sharp, P. V. Ammirato y Y. Yamada (eds.). McMillan Pub. Co. New York. USA. [ Links ]
Bidwell, R. 1979. Plant Physiology. McMillan Pub. Co., Inc. New York. USA. pp. 128-129. [ Links ]
Cárdenas, D. 1989. Embriogénesis somática en papa (Solanum tuberosum L.). Tesis de Maestro en Ciencias en Tecnología de Semillas. Universidad Autónoma Agraria Antonio Narro. Saltillo, Coahuila, México. 119 p. [ Links ]
Fehér, A.; T. Pasternak & D. Dudits. 2003. Transition of somatic plant cells to an embryogenic state. Plant Cell Tissue Organ Cult. 74:201-228. [ Links ]
George, F.; M, Hall & G. De Klerk. 2008. Plant propagation by tissue culture. 3rd ed. Vol. 1. Dordrecht: Springer. [ Links ]
Germana, M. 2009. Haploids and doubled haploids in fruit trees. In: Advances in haploid production in higher plants. Alisher, T. et al. (Eds.) Springer. 241-243. [ Links ]
Gómez, G.; O. Jaramillo; S. Jaramillo & R. Hoyos. 1997. Regeneración de plantas de papa (Solanum tuberosum) a par tir de tejido foliar en las variedades Diacol Capiro y Parda Pastusa. Universidad Nacional de Colombia. Medellín, Colombia. 60 p.
Guha, S. & S. Maheshwari. 1964. Producción in vitro de embriones a par tir de anteras de datura. Nature 204:497. [ Links ]
International Potato Center. 2018. Papa: datos y cifras de la papa. Consulta: Enero 2019. Recuperado de: https://cipotato.org/es/potato/potato-facts-and-figures/ [ Links ]
Kim, M.; J. Kim; M. Yoon; D. Choi & K. Lee. 2004. Origin of multicellular pollen and pollen embryos in cultured anthers of pepper (Capsicum annuum). Plant Cell Tissue Organ Cult. 77:63-72. [ Links ]
Larson, C.; C. Gómez; M. Sánchez & D. Ríos. 2006. Inducción de caulogénesis indirecta en Eucalyptus globulus. Bosque 27(3): 250-257. [ Links ]
Meiners, J.; M. Schwab & I. Szankowski. 2007. Efficient in vitro regeneration systems for Vaccinium species. Plant Cell, Tissue and Organ Culture89:169-176. [ Links ]
Murashige, T. & F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiology Plant. 15: 473-497. [ Links ]
Sánchez, M.; J. Rodríguez; G. Zárate; A. López; S. Barrales & G. González. 2005. Embriogénesis somática en papa cvs Atlantic y Fritolay-1867. Revista Chapingo Serie Horticultura 11(2): 219-224. [ Links ]
Shiram, V.; V. Kumar & M. Shitole. 2008. Indirect organogénesis and plant regeneration in Helicteres isora L., an impor tant medicinal plant. In vitro Cellular and Developmental Biology-Plant 44:186. DOI: 10.1007/s11627-008-9108-3. [ Links ]
Vélez, M.; A. Robledo; T. Corona; V. Aguilar; P. Ramírez & J. Suárez. 2010. Obtención de plantas haploides en chile Miahuateco (Capsicum annuum L.). Revista Mexicana de Ciencias Agrícolas 1(2): 189-201. [ Links ]
Recibido: 2-I-2019
Aceptado: 20-II-2019
Publicado online: 10-IV-2019
Publicado impreso: 30-IV-2019