Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.1 Trujillo ene./abr. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26122
ARTÍCULOS ORIGNALES
Efecto antibacteriano de nanopartículas de ZnO sobre Staphylococcus aureus y Salmonella typhi
Antibacterial effect of ZnO nanoparticles on Staphylococcus aureus and Salmonella typhi
Gina Zavaleta Espejo1, José Saldaña Jiménez1, Segundo R. Jáuregui Rosas2, Diego Pacherrez Gallardo2, María Rivera Burgos2, Fanny V. Samanamud Moreno2,Oscar J. Perales Pérez3
1 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo, PERÚ gzavaleta@unitru.edu.pe, jasalji@hotmail.com
2 Facultad de Ciencias Físicas y Matemáticas, Universidad Nacional de Trujillo, PERÚ sjauregui@unitru.edu.pe, elspiceboy_16@hotmail.com, mariahs00s@gmail.com fsamanamud@yahoo.com
3 Universidad de Puer to Rico, Recinto Universitario de Mayaguez, Mayagüez, PUERTO RICO
Resumen
El efecto antibacteriano de nanopartículas de ZnO, obtenidas por el método sol-gel modificado, sobre Staphylococcus aureus ATCC 25923 y Salmonella typhi fue evaluado empleando el método Kirby-Bauer modificado con hoyos de 7 mm de diámetro realizados con sacabocados estériles en lugar de usar discos. Se desarrolló un diseño experimental en bloques completamente al azar con cuatro tratamientos y un control negativo (PEG 6000) con cinco repeticiones. Las concentraciones de nanopartículas de ZnO (0.4, 0.8, 1.2, 1.6, 2.0 mg/ml) fueron preparadas en soluciones acuosas de PEG 6000 a la concentración de 100 mg/ml. Los resultados obtenidos muestran una relación entre el incremento en la concentración de las nanopartículas y el efecto antibacteriano, notándose el mayor halo de inhibición del crecimiento (14.78 mm) para S. aureus a la concentración de 2.0 mg/ ml, a diferencia de S. typhi que presentó un menor diámetro de inhibición (11.01 mm) a la misma concentración. Lo cual probablemente se debería a que las nanopartículas generan radicales libres (ROS), que al interactuar con la pared celular bacteriana ocasionan una extrusión del contenido intracelular debido al daño oxidativo de proteínas y lípidos, originando un efecto antibacteriano. Debido a esto se presume que en un futuro podrían convertirse en una alternativa para combatir enfermedades bacterianas.
Palabras claves: antibacteriano, crecimiento, Kirby-Bauer, nanopartículas, ZnO.
Abstract
The antibacterial effect of ZnO nanoparticles, obtained by the modified sol-gel method, on Staphylococcus aureus ATCC 25923 and Salmonella typhi was evaluated, using the modified KirbyBauer method with 7 mm diameter holes made with sterile punches instead of discs. A completely randomized block experimental design was developed with four treatments and a negative control (PEG 6000) with five repetitions. The concentrations of ZnO nanoparticles (0.4, 0.8, 1.2, 1.6, 2.0 mg/ ml) were prepared in aqueous solutions of PEG 6000 at the concentration of 100 mg/ml. The results obtained show a relationship between the increase in the concentration of the nanoparticles and the antibacterial effect, noticing the highest growth inhibition halo (14.78 mm) of S. aureus at the concentration of 2.0 mg/ml, unlike S. typhi, which had a smaller diameter of inhibition (11.01 mm) at the same concentration. This is probably because the nanoparticles generate free radicals (ROS), which when interacting with the bacterial cell wall cause an extrusion of the intracellular content due to the oxidative damage of proteins and lipids, generating in this way an antibacterial effect. Due to this, it is presumed that in the future they could become an alternative to fight bacterial diseases.
Keywords: antibacterial, growth, Kirby-Bauer, nanoparticles, ZnO.
Introducción
En las Américas, como en el resto del mundo, la resistencia a los antimicrobianos es una amenaza grave y cada vez mayor para la salud pública. Las cepas de agentes infecciosos farmacorresistentes son catastróficos en la lucha contra la tuberculosis, la malaria, la diarrea y la neumonía; enfermedades que en conjunto causan la muerte de más de 10 millones de personas cada año en el mundo (Organización Panamericana de Salud, 1999).
Staphylococcus aureus, anaerobio facultativo, capaz de crecer en un medio con una elevada concentración de sal (cloruro sódico 10%) y a temperaturas desde 18 a 40 °C, las colonias son doradas debido a los pigmentos carotenoides que se forman durante su crecimiento (Murray et al., 2006), se localizan en el aire, suelo y seres vivos, estando presentes en la mucosa y en la piel de los humanos, aves y de otros mamíferos; agente etiológico de diversas patologías incluyendo infecciones en la piel y tejidos blandos del sistema nervioso central y del tracto urinario. Pero quizás su relevancia radica en que es el causante de las enfermedades nosocomiales o intrahospitalarias las cuales son inevitables e incontrolables en la mayoría de hospitales y clínicas a nivel mundial (Gil, 2000).
Salmonella typhi es un bacilo anaerobio facultativo gram negativo, no produce esporas, produce ácido a partir de glucosa, maltosa y sorbitol, sin la producción de gas; pero no fermenta la lactosa, sacarosa, la ramnosa y otros azúcares (Uribe & Suárez, 2006). La salmonelosis es una infección bacteriana que generalmente afecta el tracto intestinal y ocasionalmente el torrente sanguíneo; constituye una de las causas más comunes de gastroenteritis (Pérez et al., 2002). S. typhi es un patógeno que causa principalmente inflamación intestinal y diarrea, sobrevive y se sobrevive dentro de los macrófagos; es la causante de la fiebre tifoidea que es una causa importante de la morbilidad y mortalidad en muchas partes del mundo, se estima que las salmonelas tifoideas causan más de 600 000 muertes por año, la fiebre tifoidea es más común en comunidades urbanas densamente pobladas donde el agua potable está contaminada con heces humanas (Winn et al., 2008).
El óxido de zinc (ZnO), se caracteriza por la capacidad fotocatalítica contra especies químicas y biológicas, es un material semiconductor de la familia II-VI, ya que el Zn y O pertenecen a los grupos II y VI respectivamente, con una amplia banda de energía de 3.3 eV y una elevada energía de exciton (60 meV) a temperatura ambiente (Sirelkhatim et al., 2015).
Los mecanismos exactos de la toxicidad de las nanopartículas contra diversas bacterias no se han definido completamente. Sin embargo, varios estudios han reportado que las nanopartículas son capaces de unirse a las membranas, ya que la carga positiva de éstas facilita su unión a la superficie de las bacterias cargada negativamente e interactúan con los lípidos de membrana rompiendo la integridad de la membrana. También podría ser por la toxicidad de iones metálicos libres que surge de la disolución de los metales en la superficie de las nanopartículas y el estrés oxidativo a través de la generación de especies reactivas de oxigeno (ROS) (Salem et al., 2015; Dizaj et al., 2014).
La investigación del comportamiento de la materia a escala nanométrica abre una prometedora perspectiva de nuevos conocimientos y aplicaciones; ya que actualmente observamos el aumento de los brotes e infecciones de cepas patógenas y su mayor resistencia a los diferentes tipos de antibióticos habituales, que se ha convertido en un problema de salud pública, por ello, es necesario la búsqueda de nuevas alternativas de tratamiento, lo que ha despertado el interés en el uso de agentes antimicrobianos como las nanopartículas de ZnO contra bacterias Gram-positivas y Gram-negativas siendo una gran alternativa y convirtiéndose en una extensa área de investigación, dado que tiene un amplio espectro de acción y un bajo nivel de resistencia, son más estables y fáciles de preparar; debido a su tamaño las hace muy atractivas ya que poseen una mayor razón de área–volumen.
El objetivo de la presente investigación fue demostrar el efecto antibacteriano de diferentes concentraciones de nanopartículas de ZnO sobre Staphylococcus aureus ATCC 25923 y Salmonella typhi.
Material y métodos
Material biológico
Cultivos de Staphylococcus aureus ATCC 25923 y Salmonella typhi fueron proporcionados por el Laboratorio Referencial Regional de Trujillo.
Material químico
Las nanopartículas de ZnO fueron sintetizadas por el método sol-gel modificado a partir de soluciones etanólicas (Jáuregui-Rosas et al., 2011) y su caracterización estructural para determinar su tamaño promedio de cristalito (7 nm) fue realizada mediante difracción de rayos X, por el Grupo Multidisciplinario de Investigación en Nanociencia y Nanotecnología de la UNT.
Preparación del inóculo y del caldo
Mueller Hinton con la bacteria
El inóculo se preparó a partir de un cultivo joven en agar nutritivo, después de
24 horas a 37°C. Luego se suspendió las bacterias en solución salina estéril (0,9 %) y se ajustó hasta alcanzar el equivalente al tubo 0,5 de McFarland (1x108 UFC/mL), esto se corroboró realizando la medición de absorbancia con el espectrofotómetro Specord S600 (Analytikjena) a una longitud de onda de 540 nm.
Preparación de las diluciones de nanopartículas de ZnO
Las nanopartículas de Óxido de Zinc (polvo) fueron pesadas en una balanza analítica Mettler Toledo, las diferentes concentraciones de nanopartículas de ZnO (0.8, 1.2, 1.6, 2.0 mg/ml) fueron preparadas con PEG-6000 como disolvente a la concentración de 100 mg/ml, estas se sometieron a la acción de un ultrasonicador Branson 2510 por 30 minutos; para una mejor dispersión. Se preparó la concentración madre a 5 mg/mL. Luego se prepararon cuatro concentraciones.
Determinación del efecto bacteriano
Se empleó el método recomendado por el Sub Comité de Ensayos de Susceptibilidad del NCCLS (National Committee for Clinical Laboratory Standards), basado en el procedimiento descrito originalmente por Kirby-Bauer. Para el caso de la investigación el método usado Kirby Bauer modificado en lugar de usar discos se trabajó con hoyos realizados con sacabocados estériles de acero de 7 mm de diámetro. Para este método se preparó agar Mueller Hinton el cual se sirvió a cada placa de Petri 20 mL de agar dejando que se solidifique, posteriormente se colocaron en la estufa por 15 minutos para eliminar la humedad de la superficie, luego con la ayuda de un hisopo estéril se realizó la siembra de cada una de las cepas (S. aureus y S. typhi) en toda la superficie del agar de las placa en forma homogénea. A cada placa se le hizo cinco hoyos de 7 mm de diámetro, en cada uno de los hoyos se colocó 50 uL de las nanopartículas de ZnO las concentraciones de 0,8 mg/ml; 1,2 mg/ ml, 1,6 mg/ml y 2,0 mg/ml; se trabajó con un control negativo (Polietilenglicol 6000), finalmente las placas fueron incubadas a
37ºC durante 24 horas, transcurrido este tiempo fueron medidos los diámetros (mm) de los halos de inhibición formados. Para la determinación del efecto bactericida se realizó cinco repeticiones para cada una de las cepas bacterianas.
Diseño experimental
El ensayo se realizó bajo un diseño experimental en bloques (bacterias) completamente al azar, con 4 tratamientos (concentraciones) y control negativo (PEG
6000) y 5 repeticiones.
Evaluación de los tratamientos:
El efecto de las diferentes concentraciones de las nanopartículas de ZnO fue determinado por el diámetro de los halos de inhibición del crecimiento del microorganismo utilizando un vernier, en cada halo de inhibición se tomó tres medidas del diámetro en milímetros con lo cual se obtuvo un promedio para las diferentes concentraciones y cada una de las bacterias.
Análisis estadístico:
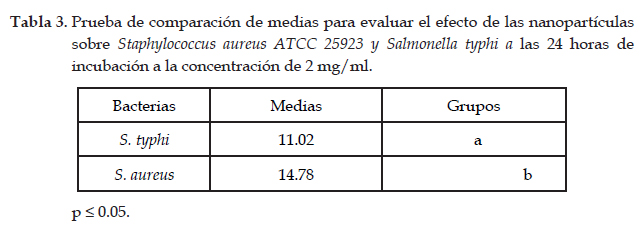
Con los datos obtenidos en la presente investigación se calcularon los estimadores estadísticos de media, así mismo se aplicó el análisis de varianza para determinar diferencias significativas entre los tratamientos según los bloques y la prueba de comparación múltiple de Tukey (p≤ 0.05), utilizando el programa estadístico Infostat (versión libre). Las letras (a-c) representan los 3 grupos estadísticamente homogéneos según el test de comparación múltiple de medias (Tukey). Los promedios relacionados con la misma letra no presentan diferencias significativas entre ellos para un valor de p ≤ 0.05.
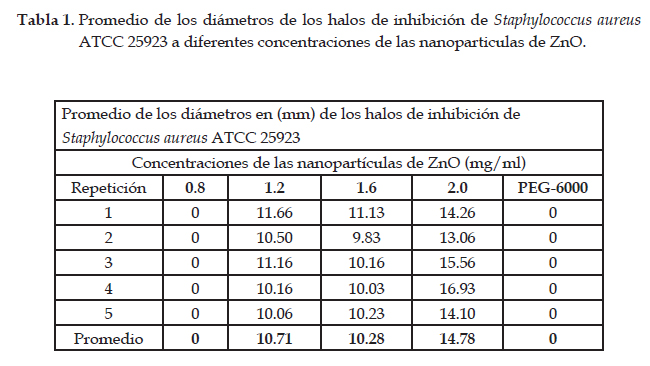
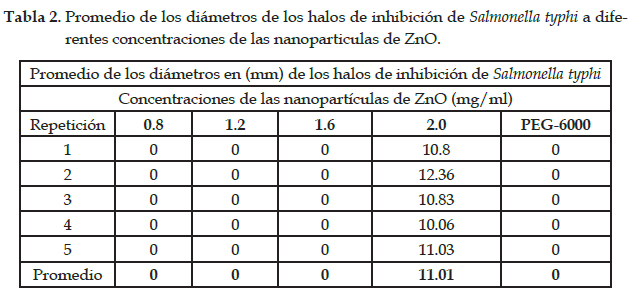
Resultados
Discusión
Las nanopartículas de ZnO han demostrado capacidad antibacteriana sobre Staphylococcus aureus ATCC 25923 a diferentes concentraciones (Tabla 1), excepto para la mínima concentración (0,8mg/ml). Sin embargo, para Salmonella typhi solo fue efectivo a la mayor concentración (2 mg/ml) (Tabla 2), lo que convierte al ZnO nanoestructurado en una gran alternativa para combatir bacterias Gram positivas y Gram negativas, mostrando un efecto bactericida. Se atribuye su actividad antibacteriana a su pequeño tamaño y amplia superficie de contacto; muchos estudios han indicado su alta toxicidad (Wahab et al., 2010), con mínimos efectos sobre células humanas a bajas concentraciones (Kairyte et al., 2013).
Los resultados muestran que para la bacteria S. aureus ATCC 25923 se obtuvo el mayor halo de inhibición de crecimiento (14,78 mm) a la concentración de 2,00 mg/ ml con respecto a las otras concentraciones (Tabla 1). Las diferencias del efecto de las diferentes concentraciones de las nanopartículas de ZnO sobre el crecimiento de S. aureus fueron confirmadas por el análisis de varianza evidenciando la existencia de diferencias significativas entre los tratamientos, estableciéndose la conformación de tres grupos estadísticamente homogéneos en función a su efecto (Tabla 1). Ramírez (2013), al evaluar las propiedades antimicrobianas de nanopartículas de ZnO demostró que tienen inhibición al crecimiento bacteriano con un halo de 16 mm, resultados muy similares a los obtenidos en el presente trabajo; sin embargo, los resultados reportados por Francisco et al. (2017), no encontraron efecto de las nanopartículas de ZnO para S. aureus, estos resultados difieren por el tamaño, la técnica de obtención de las nanopartículas de ZnO lo cual modifica sus características físicas y químicas (Abinaya et al., 2016).
Con respecto a S. typhi, como se observa en la Tabla 2, solo se obtuvo un halo de inhibición de crecimiento (11.01 mm) a la concentración de 2,00 mg/ml, no existiendo efecto frente a las otras concentraciones. Este efecto depende en gran medida de la cepa bacteriana, además a las diferencias estructurales y de composición, las bacterias Gram-negativas tienen una membrana externa de plasma con una capa de lipopolisacáridos sobre la misma. Esta capa es más gruesa que la capa de peptidoglucano presente en las bacterias Gram-positivas; estas dos estructuras de una célula bacteriana Gramnegativa, se oponen a la peroxidación lipídica en presencia de producidas por las nanopartículas de ZnO (Jain et al., 2013; Premanathan et al., 2011).
Los mecanismos de la acción antibacteriana de las nanopartículas de ZnO no están aún bien dilucidados, pero se proponen tres principales mecanismos de acción: generación de ROS; liberación de iones Zn2+ y acumulación en la membrana celular. La producción de ROS ha sido revelada por varios estudios (Dizaj et al., 2014; Leung et al., 2013), se reportó que la producción de ROS se debe principalmente a la autoxidación de NADH deshidrogenasa II en el sistema respiratorio (Messner & Imlay, 1999). Estos ROS ocasionan una fuga del contenido intracelular debido al daño oxidativo a las proteínas y lípidos, también se ha determinado que dicho estrés oxidativo posee un débil potencial mutagénico, que ocasiona inhibición de las enzimas respiratorias (Wahab et al., 2013; Matsumura et al., 2003). Asimismo, los superóxidos y los radicales hidroxilos no pueden penetrar en la membrana debido a sus cargas negativas. Por lo tanto, se encuentran en la superficie externa de las bacterias, a diferencia de las moléculas de H2O2 que son capaces de pasar a través de la pared celular bacteriana, ocasionando< lesiones, destrucción y finalmente la muerte celular. También la liberación de iones de zinc, tiene un efecto significativo en la inhibición del transporte activo, así como en el metabolismo de los aminoácidos y la disrupción del sistema enzimático (Song et al., 2010).
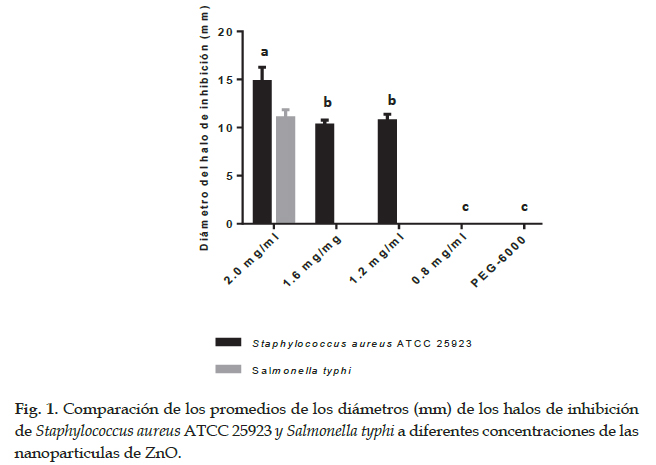
Al comparar las dos bacterias (Tabla 3 y Fig. 1) usadas en la investigación podemos observar que la bacteria S. aureus con respecto a S. typhi es la más sensible a las nanopartículas de ZnO puesto que presenta los mayores diámetros de halos de inhibición, evidenciando que las dos bacterias son susceptibles a la concentración de 2.00 mg/ml de nanopartículas de ZnO. Estos resultados evidencian que S. typhi es la que presenta mayor capacidad de bloquear la acción de estas nanopartículas y esto puede estar influenciado por la propia estructura de su pared celular, membrana celular (Premanathan et al., 2011).
Estos resultados de las nanopartículas de ZnO sobre las bacterias Gram positivas y Gram negativas abren un campo promisorio para sustituir a los antibióticos que causan resistencia a las bacterias, en ese sentido se debe continuar con las investigaciones para dilucidar los mecanismos de acción y la estandarización de las nanopartículas, así como evaluar su potencial actividad sobre otras bacterias patógenas incluyendo las hospitalarias.
Conclusiones
Las nanopartículas de ZnO demostraron tener un efecto antibacteriano sobre Staphylococcus aureus ATCC 25923 y Salmonella typhi, presentando inhibición del crecimiento para S. typhi solo a la concentración de 2.00 mg/ml, recalcando que S. aureus ATCC 25923 fue la que presento el mayor efecto antibacteriano, considerando a futuro a las nanoparticulas de ZnO como potenciales antibacterianos contra bacterias resistentes.
Agradecimientos
A la Universidad Nacional de Trujillo por el financiamiento con recursos del Canon Minero (RR 222-2012/UNT y R.C.U.
0885-2014/UNT)
Contribución de los autores
G. Z., S. J. y O. P.: Concepción, diseño, recolección de datos, revisión crítica del artículo y aprobación de la versión final. J. S.: Análisis e interpretación de los resultados obtenidos. D.P., M. R. y F. S.: Producción y caracterización de nanopartículas. Todos los autores han leído el manuscrito final y aprobado la revisión.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Literatura citada
Abinaya, C.; M. Marikkannan; M. Manikandan; P. Mayandi; V. Suresh; C. Sahanmugaiah; C. Ekstrum & J. Pearce. 2016. Structural and optical characterization and efficacy of hydrothermal synthesized Cu and Ag doped zinc oxide nanoplate bactericides. Materials Chemistry and Physics 184, 172-182. DOI: 10.1016/j.matchemphys.2016.09.039 [ Links ]
Dizaj, S. M.; F. Lotfipour; M. Barzegar-Jalali; M. Zarrintan & K. Adibkia. 2014. Antimicrobial activity of the metals and metal oxide nanopar ticles. Materials Science and Engineering 44: 278–284. DOI:10.1016/j.msec.2014.08.031. [ Links ]
Francisco-Escudero, J.; M. Villanueva-Ibañez; C. Lucho-Constantino; C. Coronel-Olivares; M. Hernández-Pérez & M. Flores-Gonzáles. 2017. Biosíntesis de con Nanopar tículas de ZnO Extracto Acuoso de Mucílago de Opuntia Amychlaea. Simposio Iberoamericano Multidisciplinario de Ciencias e Ingeniería Año 5 N°5:19-21. [ Links ]
Gil, M. 2000. Staphylococcus aureus: Microbiologia y aspectos moleculares de la resistencia a meticilina. Rev. Chil. Infect 17(2):145-152. [ Links ]
Jain, A.; R. Bhargava & P. Poddar. 2013. Probing interaction of Gram-positive and Gramnegative bacterial cells with ZnO nanorods, Material Science and Engineering: C 33 (3): 1247-1253. [ Links ]
Jáuregui-Rosas, S.; O.J. Perales-Pérez; L. A. Noriega & L. A. Castillo. 2011. Structural, Optical and Magnetic proper ties of Co-doped ZnO Nanopowders. MRS Proceedings, 1292, Mrsf10-1292-k08-09. Doi:10.1557/opl.2011.19 [ Links ]
Kairyte, K.; A. Kadys & Z. Luksiene. 2013. Antibacterial and antifungal activity of photoactived ZnO nanopar ticles in suspension. Journal of Photochemistry and Photobiology B: Biology 128: 78–84. DOI:10.1016/j.jphotobiol.2013.07.017. [ Links ]
Leung, Y.; F. Liu; A. Ng; M. Gao; C. Chan; A. Djurisic; F. Leung & W. Chan. 2013. Antibacterial activity of ZnO nanopar ticles under ambient illumination-The effect on nanopar ticle proper ties. Thin Solid Films 542: 430-435. [ Links ]
Matsumura Y.; K. Yoshikata; S. Kunisaki & T. Tsuchido. 2003. Mode of bactericidal action of silver zeolite and its comparison with that of silver nitrate. Applied Environmental Microbiology 69(7): 4278– 4281. [ Links ]
Messner K. & J. Imlay. 1999. The identification of primary sites of superoxide and hydrogen peroxide formation in the aerobic respiratory chain and sulfite reductase complex of Escherichia coli. J. Biol. Chem 274(15), 10119–10128. [ Links ]
Murray, P.; K. Rosenthal & M. Pfaller. 2006. Microbiología Médica. España. Editorial Elsevier S. A. [ Links ]
Organización Panamericana de Salud. 1999. Prevención y control de la resistencia a los antimicrobianos en las Américas. Plan estratégico de vigilancia de la resistencia de los antibióticos. Asunción: OPS/HCP/HCT/139/99. [ Links ]
Perez-Ciordia, I.; M. Ferrero; E. Sánchez; M. Aba- días; F. Martínez-Navarro & DHerrera. 2002. Salmonella enteritis in Huesca. 1996-1999. Enfermedades Infecciosas Microbiología Clínica 20(1): 16-21. [ Links ]
Premanathan, M.; K. Karthikeyan; K. Jeyasubramanian & G. Manivannan. 2011. Selective toxicity of ZnO nanopar ticles toward Gram-positive bacteria and cancer cells by apoptosis through lipid peroxidation. Nanomedicine 7 (2):184 -192. [ Links ]
Ramírez, B. 2013. Estudio del efecto antimicrobiano y citotóxico de nanopar ticulas de ZnO con y sin tratamiento superficial en nanocompuestos para uso médico. Tesis de Maestría. Centro de Investigación en Química Aplicada. México. [ Links ]
Salem, W.; D. Leitner; F. Zingl; G. Schratter; R. Prassl; W. Goessler; J. Reidl & S. Schild. 2015. Antibacterial activity of silver and zinc nanopar ticles against Vibrio cholera and enterotoxic Escherichia coli. International Journal of Medical Microbiology 305 (1): 85–95. [ Links ]
Sirelkhatim, A.; S. Mahmud; A. Seeni; N. Mohamad; L. Chuo; S. Mohd; H. Hasan & D. Mohamad. 2015. Review on Zinc Oxide Nanopar ticles: Antibacterial Activity and Toxicity MechanismNano-Micro Lett, 2015; 7(3):219–242. [ Links ]
Song, W.; J. Zhang; J. Guo; J. Zhang; F. Ding; L. Li & Z. Sun. 2010. Role of the dissolved zinc ion and reactive oxygen species in cytotoxicity of ZnO nanopar ticles. Toxicology Letters 199(3), 389–397. [ Links ]
Uribe, C. & M. Suárez. 2006. Salmonelosis no tifoidea y su transmisión a través de alimentos de origen aviar. Colombia Médica 37(2): 151-158. [ Links ]
Wahab, R.; A. Mishra; S. Yun; Y. Kim & H. Shin. 2010. Antibacterial activity of ZnO nanopar ticles prepared via non-hydrolytic solution route. Appl. Microbiol. Biotechnol, 87(5): 1917–1925. [ Links ]
Wahab, R.; N. Kaushik; N. Kaushik; E. Choi; A. Umar; S. Dwivedi; J. Musarrat & A. Al-Khedhairy. 2013. ZnO nanopar ticles induces cell death inmalignant human T98G gliomas, KBand non-malignant HEK cells. J. Biomed. Nanotechnol, 9(7), 1181–1189. [ Links ]
Winn, W.; S. Allen; J. Janda; E. Koneman; G. Procop; P. Schrecenberger & G. Wood. 2008. Koneman Diagnóstico microbiológico. Texto y Atlas en color. Buenos Aires-Argentina. Editorial Médica Panamericana. [ Links ]
Recibido: 10-I-2019
Aceptado: 25-II-2019
Publicado online: 10-IV-2019
Publicado impreso:30-IV-2019