Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.2 Trujillo mayo/ago. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26209
ARTÍCULOS ORIGINALES
Comunidades criofílicas de los glaciares del nevado de Allincapac, Andes del sur de Perú, departamento de Puno: variabilidad fenotípica de la cianobacteria Nostoc commune (Nostocales, Nostocaceae)
Cryophilic communities of the Allincapac mountain glaciers, southern Peruvian Andes, Puno Department: Phenotypic variability of the cyanobacterium Nostoc commune (Nostocales, Nostocaceae)
Haydee Montoya T.1, José A. Fiestas I.2, Rómulo Cruz S.2, Ruth Quispe P.3, Sofia Rodríguez V.3
1 Facultad de Ciencias Biológicas, UNMSM, Lima, PERÚ. haydmon@yahoo.com
2 Universidad Nacional de Ingeniería, Centro de Tecnologías de Información y Comunicaciones (CTIC). Av. Túpac Amaru 210, Rímac, Lima, PERÚ. joseafiestasi@gmail.com / romulocruzs007@gmail.com
3 Museo de Historia Natural, Departamento de Simbiosis Vegetal, UNMSM, Lima, PERÚ. ruthappy7@gmail.com / sofia.rodriguez@unmsm.edu.pe
Resumen
Los ecosistemas terrestres del territorio peruano tienen una extensión aproximada del 71 % de los glaciares tropicales del mundo. La criósfera en los alrededores del nevado Allincapac, cordillera de Carabaya, departamento de Puno, en los Andes del sur del Perú fue evaluada entre los 4500 y 4700 m de altitud. Colecciones estándar de los biofilms o costras complejas se realizaron mediante raspados de acantilados y laderas de montañas calcáreas en las estaciones de verano (febrero 2018) e invierno (agosto 2017). Los registros de las termogradientes estuvieron entre 0 y 10 °C y el pH entre 6,0 y 6,5. Este ecosistema extremófilo, amenazado por el calentamiento global, posee hábitats colo- nizados por comunidades litofílicas, casmolíticas y subaerofíticas. La colonización cianobacterial y de microalgas criófilicas fue dominante con talos coloniales de Nostoc commune que demostraron su potencial adaptación a periodos de congelamiento y desecación, así como descongelamiento e hidratación. La plasticidad fenótípica de N. commune se evidenció por sus morfotipos (estadios hormogonial, crecimiento seriado y aseriado, estructura del mucílago, desarrollo de heterocistos y acinetos) durante los estadios del ciclo de vida. Las estrategias morfofisiológicas de N. commune para la protección del congelamiento, desecación y radiación ultravioleta (mucílago colonial complejo), su capacidad diazotrófica aunada a las estrategias ecológicas de sobrevivencia y propagación (acine- tos) en zonas altoandinas permitió considerarla como especie ideal para experimentos extraterres- tres de las misiones espaciales.
Palabras clave: criósfera, biofilms, morfotipos, litofílica, casmolítica, subaerofítica.
Abstract
Peruvian terrestrial ecosystems encompass an extension about 71 % of the world’s tropical glaciers. The cryosphere in the surroundings of Allincapac mountain glacier, Carabaya Cordillera, southern Peruvian Andes was evaluated between 4500 and 4700 m of altitude. Standard collections of cyanobacteria and microalgae were done by scraping the biofilms or crusts from cliffs or slopes of calcareous mountains. They were carried out in summer season (February 2018) and winter (August 2017). The thermogradients were between 0 and 10 °C and pH between 6.0 and 6.5. This extreme ecosystem, threatened by the climate change, has habitats colonized by litophilic, chasmolithic and subaerophytic communities. Colonization of cryophilic cyanobacteria and microalgae with dominance of colonial thalli of Nostoc commune showed their adaptation to freeze and desiccation, as well as deglaciation and hydration periods. Phenotypic variability in N. commune was recognized by its morphotypes (hormogonial stage, seriate and aseriate growth, sheath structure, heterocysts and akinetes development) during the stages of the life cycle. In addition, its phenotypic plasticity is favored by morphophysiological strategies against freeze and thaw, desiccation, ultraviolet radiation (complex mucilage), by its diazotrophic ability, and ecological strategies for propagation and survival (akinetes) in the highlands. Therefore, this cryophilic species can be considered as candidate for extraterrestrial experiments during space missions.
Keywords: cryosphere, biofilms, morphotypes, lithophilic, chasmolithic, subaerophytic.
Introducción
En el territorio sudamericano, el Perú tiene aproximadamente el 71% de los glaciares tropicales del mundo que constituyen los ecosistemas más inhóspitos de la biosfera como desiertos polares y fríos que albergan organismos extremófilos. La criosfera corresponde a regiones donde las temperaturas permanecen por debajo de 0°C durante la mayor parte del año (Nadeau & Castenholz, 2000; Bradley et al., 2006; Quesada & Vincent, 2012). Las cianobacterias constituyen un grupo de procariontes oxigénicos de distribución amplia en hábitats extremos. En el ártico parte de cianobacterias estuvieron dominadas por las Oscillatoriales como Leptolyngbya y Phormidium y en el antártico por Phormidium autumnale (Nadeau & Castenholz 2000; Strunecký et al., 2012). Casamata et al. (2005) realizaron la caracterización morfológica y molecular de cepas Oscillatoriales polares y concluyeron que los análisis moleculares fueron congruentes con su morfología y ultraestructura.
La presencia del grupo de las Nostocales en ambientes extremófilos, con el género Nostoc es fuente importante de nitrógeno en regiones polares, habitats glaciares y el permafrost (Vishnivetskaya, 2009). Este género cianobacterial también ha sido reportado en América, como en los desiertos cálidos de Norte América (Johansen, 1993), en los desiertos costeros del Pacífico Oriental de América del sur como Lachay y Pachacamac ,Lima (Aguilar, 1985; Montoya et al., 1998) y algunos humedales andinos (Aldave, 1985). Investigaciones en los ecosistemas de los Andes del sur de nuestro país así como sobre los productores primarios y otros microorganismos en ambientes extremos de altas montañas (5500 m de altitud) han sido realizados por Schmidt et al. (2009, 2017).
Los crioecosistemas extremos se presentan en algunas zonas alto andinas del Perú con hábitats cubiertos por glaciares, hielo o nieve la mayor parte del año, aunque algunos lugares pueden estar libres. Las predicciones sobre el calentamiento global en los países andinos es alarmante con consecuencias en el retroceso rápido de los glaciares de las montañas. El objetivo de la presente investigación es reportar la presencia de comunidades epilíticas, casmolíticas y subaerofíticas cianobacteriales y algales en los alrededores del Nevado Allincapac recientemente deglaciados con énfasis en la plasticidad fenotípica (morfotipos) de los estadíos del ciclo de vida de Nostoc commune relacionándolos con sus estrategias de colonización para ser considerada (cepa del Allincapac) en el futuro con posibilidad de adaptación a condiciones extremas del espacio.
Material y métodos
Área de estudio y estrategias de muestreo
En los Andes tropicales del territorio peruano, el nevado de Allincapac pertenece a la Cordillera Carabaya, distrito de Macusani, Provincia de Carabaya, departamento de Puno y al igual que otros glaciares del territorio andino experimentan cambios por el calentamiento global. En la base del nevado Allincapac existe una plataforma desde donde se inició el ascenso por las laderas parcialmente descongeladas en verano del 2018 (febrero). Este ecosistema perteneciente a la criosfera andina exhibe una variedad de hábitats y microhábitats sobre el sustrato rocoso calcáreo de los acantilados y laderas escarpadas, con grietas, fisuras e irregularidades por donde filtra el agua de manantial o fluye el agua del deshielo. El retroceso glacial y la pérdida de la superficie glacial o masas de hielo ha impactado en la fisionomía montañosa con exposición de las superficies rocosas y las comunidades que forman biofilms, costras o matas complejas cianobacteriales y algales que fueron obtenidas directamente por el raspado superficial. Simultáneamente se registraron la temperatura y el pH. Las muestras fueron colectadas en agosto 2017 (época de sequía, con nevada en estación de invierno) y en febrero 2018 (época de lluvia, granizo o nevada, estación de verano). Las costras cianobacteriales y algales desecadas temporalmente en verano fueron colectadas alejadas de las zonas húmedas o de goteo. También se obtuvieron talos cianobacteriales rehidratados que habían quedado sumergidos en depresiones o fisuras rocosas. La integridad de las colonias fue reconocida en la mayoría de muestreos así como los talos coloniales desintegrados por la desecación, éstos fueron seleccionados para las mediciones morfométricas, obtención de microfotografías y evaluados con bibliografía especializada (Mollenhauer, 1988; Mollenhauer et al., 1999; Komárek, 2013; Komárek et al., 2014).
Resultados
Área de estudio, comunidades cianobacteriales y microalgales
Los biofilms, costras o matas complejas fueron dominantes en las laderas o acantilados de las montañas expuestas a radiación ultravioleta intensa en los alrededores del nevado Allincapac que forma parte de la Cordillera Carabaya, con altitudes que oscilan entre los 4500 y 4700 msnm. Las costras dominadas por comunidades de cianobacterias y en menor proporción por microalgas estreptofitas y diatomeas estuvieron adaptadas al frio extremo por el congelamiento y a la desecación por la escasa disponibilidad de agua líquida en invierno del 2017 (agosto). En la base del nevado del Allincapac, la temperatura del aire osciló entre 0 y 2°C a las 8.30 am mientras que a medio día la temperatura del aire estuvo entre 0 y 5°C en invierno. En verano del 2018 (febrero) la temperatura del aire entre las 8 y 14 pm estuvo entre 0 a 10°C. El pH osciló entre 6.0 y 6.5.
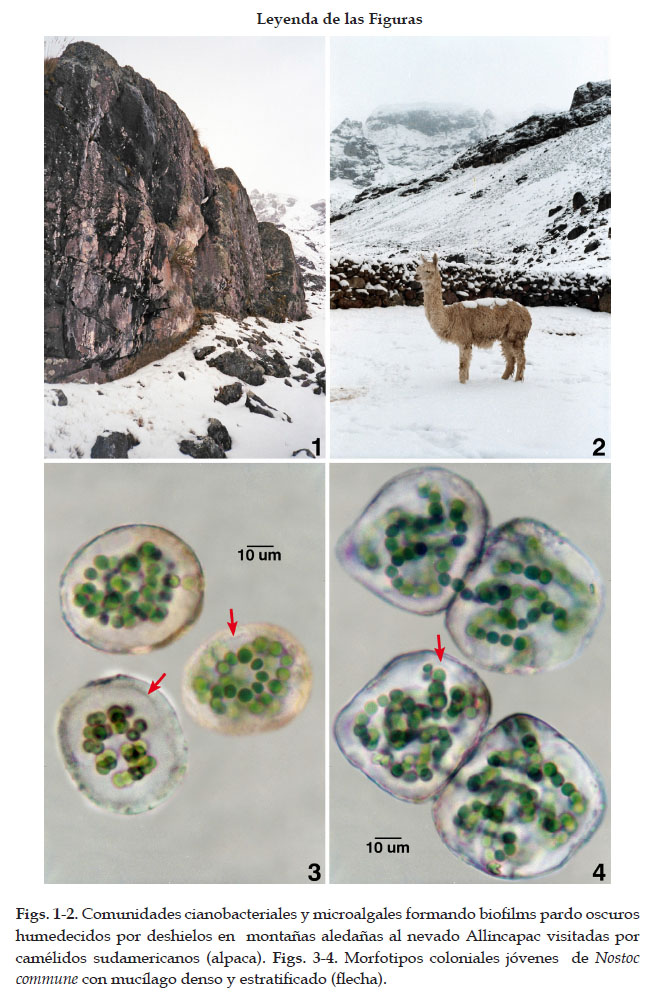
La deglaciación de los Andes del Sur con el deshielo notorio de las montañas aledañas de mayor altitud (>5000 m) contribuyó a incrementar el flujo hídrico que humedece las comunidades principalmente en verano. En la zona de estudio aún existen zonas glaciares perennes. Sin embargo, debido al calentamiento global, la mayoría de los deshielos del nevado y laderas descongeladas (verano) con goteos de agua continuo y temporal humedecieron las costras o biofilms y facilitaron su colonización. Las comunidades desarrolladas fueron las casmolíticas, epilíticas y subaerofíticas de coloración pardo a pardo rojiza o pardo oscura debido a la pigmentación (scitonemina) que exhiben la mayoría de las especies en sus estuches coloniales e individuales. Las comunidades cianobacteriales y algales sobre las rocas cubiertas de nieve parcial o totalmente, absorben la radiación solar principalmente en verano e incrementan su temperatura lo suficiente para derretir la nieve y el hielo circundante. Las comunidades formaron biofilms estratificados con talos macroscópicos que incluyen en su mayoría penachos mucilaginosos y colonias redondeadas, lobuladas e irregulares, parduzcas o verde parduzcas, parte de las cuales son desintegradas en las laderas de las montañas y se desprenden por el flujo de agua de los nevados que discurren y se inoculan en humedales altoandinos próximos como turberas, bofedales, pozas o riachuelos de origen glacial donde llegan los camélidos sudamericanos como las "alpacas" (Figs.1-2).
Los efectos de la erosión eólica por vientos irregulares del área glaciar de estudio, principalmente en las tardes invernales, también están relacionados con la dispersión de las especies criofílicas, posterior inoculación y colonización de hábitats próximos. La colonización cianobacterial en áreas aledañas al nevado Allincapac (menor y mayor altitud), se reconoció en las superficies rocosas calcáreas irregulares, verticales u horizontales, con fisuras o grietas en los bordes de las montañas quedando expuestas a fluctuaciones térmicas diurnas. Las costras o colonias extensivas mucilaginosas de la cianobacteria Nostoc commune (L.) Vauch. estuvieron asociadas con otras microalgas criófilas. Los talos varian en forma y tamaño como las colonias esféricas, gelatinosas e irregulares, de 48 um hasta macroscópicas de 3,5 cm de diámetro que dominaron la comunidad cianobacterial. Las colonias adultas e irregulares de N. commune se presentaron algo aplanadas entre las irregularidades de la superficie rocosa (granulada y con depresiones) donde se acumula periódicamente el agua de deshielo o lluvia y están asociadas con otras cianobacterias como Leptolyngbya, Chroococcus, Scytonema, Phormidium, las estreptofitas como Mesotaenium y Klebshormidium y diatomeas. Los talos de N. commune fueron expuestos a ciclos repetidos de secado y rehidratación y de esta manera fue posible reconocer el estado fisiológico de desecación por la extensiva capa de nieve cubriendo parte de las colonias en su mayoría aplanadas y rugosas y el estado de hidratación con colonias lobuladas y turgentes de los individuos de N. commune. Sin embargo, este proceso fue interrumpido por eventos cortos de deshielo y descongelamiento efímeros de la nieve a medio día y donde la colonización cianobacterial y algal nativa fue conspicuamente visible como bandas irregulares, pardo oscuras o verde parduzcas en la superficie calcárea. También, fue evidente los consorcios de bacterias asociadas principalmente a los restos orgánicos y entre las matas cianobacteriales y algales acumuladas entre las irregularidades del sustrato rocoso constituyendo estados sucesionales de la colonización mixta compuestas de agregados o capas cohesivas parduzcas, pardo anaranjados ó pardo verdosas.
La plasticidad fenotípica de N. commune se evidenció en sus diferentes morfotipos que desarrolló durante los estadios del ciclo de vida con formas de crecimiento (seriado, aseriado, hormogonial), estructuras de dispersión y reposo (acinetos) y células especializadas (heterocistos) en gradientes de altitud (4500 - 4700 m) como sigue:
Morfotipos coloniales con estadios seriados y heterocistados de N. commune
Los talos cianobacteriales complejos, de un nivel altitudinal de 4700 m, exhibieron morfotipos diversos de N. commune con colonias jóvenes verdosas, ovoides u esféricas, lobuladas ó cuadrangulares por la presión de colonias vecinas y de la superficie rocosa del hábitat, alcanzando de 48 a 64,2 um de diámetro. Estas microcolonias con estuche colonial, grueso, estratificado e incoloro, estuvieron latentes y en laderas sombreados, hasta que fueron reactivadas por hidratación o imbibición, en contraste con las colonias pequeñas y parduzcas de laderas expuestas y con mucílago colonial definido, denso e incoloro con aspecto de película superficial firme o laxa en su mayoría pigmentados tenuemente (scitonemina). Células esféricas u ovoides, de 4,2 a 5,3 um de diámetro, inicialmente organizadas en hormogonios seguidos por filamentos seriados contorneados conforme las colonias incrementan en tamaño (Figs. 3-4). Las divisiones celulares del filamento son continuas y los filamentos incrementan en tamaño, superpuestos por ocupar un mayor espacio tridimensional reducido debido al incremento en su longitud. Posteriormente, se produce la formación colonial de estructura ovoide u esférica con agregados de filamentos contorneados y seriados.
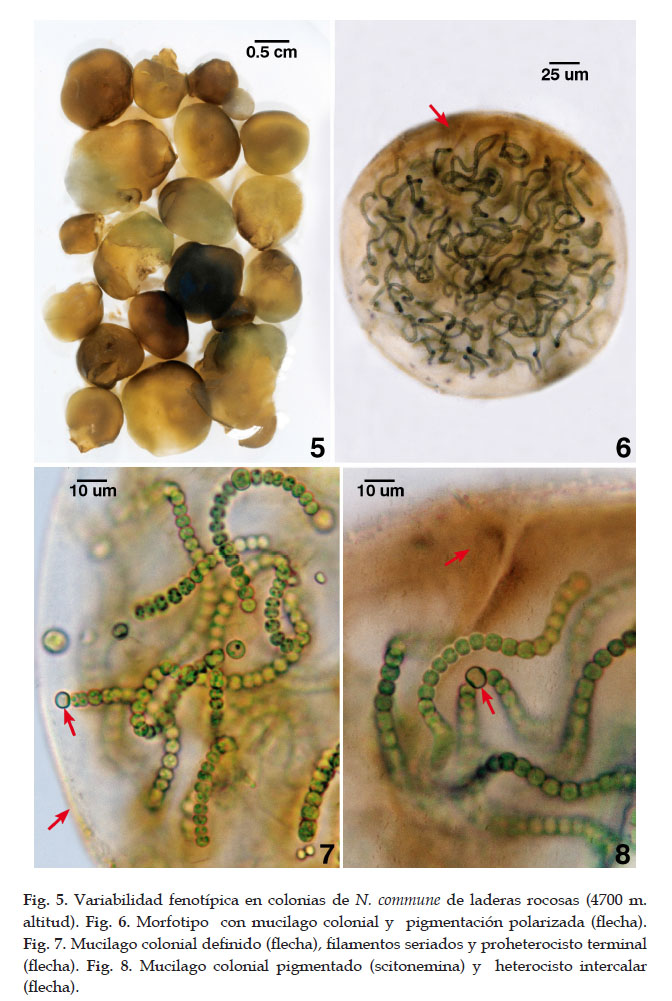
Las colonias adultas macroscópicas parduzcas a pardo verdosas, pardo naranja o pardo oscuros ó azul verdes en las laderas, alcanzaron de 2 a 3,5 cm de diámetro (Fig. 5). Colonias esféricas, lobuladas e irregulares por acción del flujo hídrico temporal del hábitat en la superficie rocosa. Las colonias hidratadas con filamentos distribuidos dentro de una matriz de polisacáridos coloreadas con el pigmento scitonemina. Las tonalidades del estuche colonial que exhiben la scitonemina varían según la posición de la colonia a la radiación siendo más oscuras las expuestas directamente y mas pálidas las que están protegidas (depresiones de rocas) o sombreadas siendo algunas fácilmente desintegradas. Las colonias azul verdes o parduzcas con mucílago colonial que incluye numerosos filamentos largos, ondulados, azul verdes pero con estuche marrón de distribución polarizada (orientación hacia la radiación). Otras colonias con denso estuche colonial incoloro. El mucilago externo colonial alcanzó entre 26,7 a 34,2 (64,2) um de espesor. Los filamentos con estuche definido alcanzaron entre 22,5 y 32 um de espesor.
El estuche individual (mucílago amorfo) difícilmente reconocido por presentarse fluido e incoloro proporcionando el aspecto de filamentos individuales desnudos en oposición a los que son definidos (encapsulados). De esta manera, el mucílago colonial con cierto grado de hidratación, le proporciona protección contra la desecación (invierno). Sin embargo, durante la remoción del agua con el consiguiente proceso de desecación (sequía) se contrae el mucílago colonial y los filamentos llegan a estar en contacto. Las colonias hidratadas de consistencia gelatinosa estuvieron adheridas a las superficies rocosas formando talos epíliticos con biofilms mucilaginosos y complejos. También, en las colonias hidratadas fue posible reconocer estuche individual del filamento con la matriz extracelular colonial (coloide). De esta forma, con los deshielos del área de estudio relacionados con el ciclo de rehidratación (humedad) restaura la distribución original de los filamentos dentro de la colonia hidratada favoreciendo con su crecimiento y sobrevivencia en zonas altoandinas del Allincapac.
Filamentos ondulados o contorneados con células vegetativas esféricas u ovoides, azul verdes, de protoplasto granulado algo parduzcas, sin estuche individual notorio solo el colonial donde están embebidos, las células vegetativas, de 4,2 a 6,4 um de diámetro por 2,7 a 6,4 um de longitud. Una de las células terminales de los hormogonios o en filamentos cortos o ambas células terminales de hormogonios o de filamentos largos seriados son transformados en células especializadas o preheterocistos inicialmente seguido por los heterocistos primarios y luego los heterocistos maduros. Heterocistos frecuentes, ovoides u esféricos o subesféricos, con distribución intercalares o terminales, de (5,3) 6,4 – 8,6 um de diámetro por 4,8 a 6,4 um de longitud. Los heterocistos terminales desarrollaron por diferenciación de las células terminales del hormogonio o filamento (Figs. 6-8).
Morfotipos coloniales con estadios seriado, aseriado, formación de colonias hijas y germinación de acinetos
El crecimiento seriado y aseriado de N. commune resulta en diferentes fenotipos. La liberación secuencial del mucílago se produce primero en las células vegetativas de los filamentos seriados que desarrollan productos extracelulares simbolizados como (EPC) y en forma secuencial corresponde a un estuche individual alrededor de las células que es simbolizado como (EPC1), posteriormente en un nivel posterior se produce un estuche extracelular (EPC2) y luego un estuche colonial (EPC3). Durante el desarrollo de los heterocistos y acinetos, éstos quedan embebidos dentro del estuche extracelular y colonial constituyéndose así el volumen de las colonias gelatinosas. En los talos adultos, el estuche colonial experimenta cambios que conducen al rompimiento de las masas coloniales aseriadas y subsecuente liberación y crecimiento de hormogonios (fase o estadío seriado). En la fase aseriada también se reconoció la polaridad física del mucílago colonial con la producción localizada de la scitonemina en respuesta a la orientación hacia la radiación solar del talo colonial.
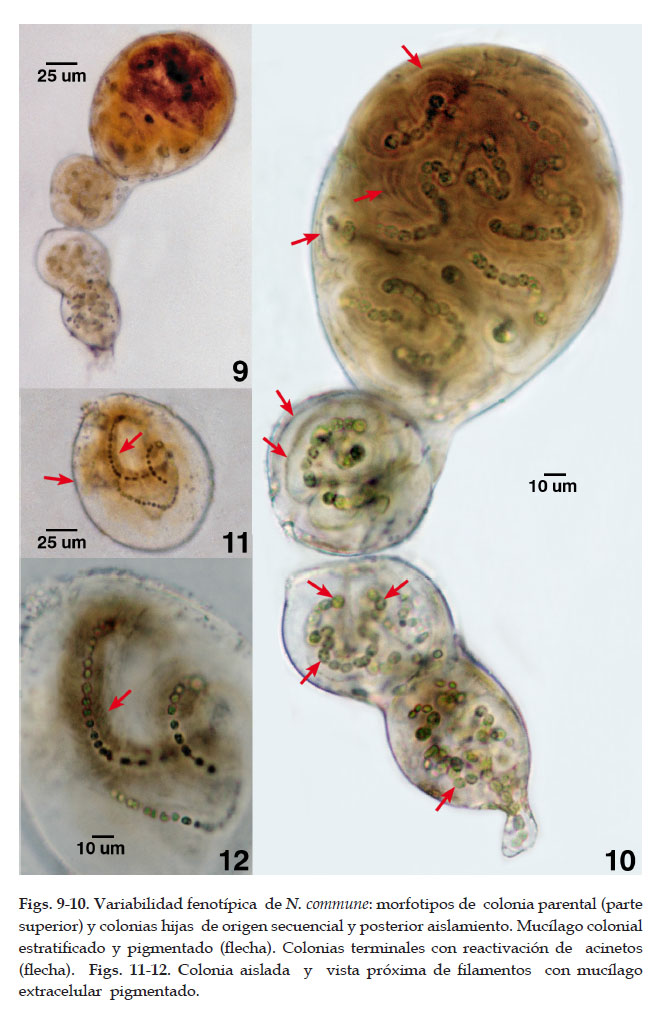
Durante el desarrollo, los talos coloniales microscópicos ovoides y elongados se evidenció el crecimiento diazotrófico y, la reproducción por fragmentación colonial con ruptura de la colonia parental originando proliferaciónes o yemas y posterior desarrollo de colonias hijas microscópicas, ovoides o esféricas, en hilera o sucesión (40 um de longitud) que se desprenden formando colonias jóvenes con estadios seriados y aseriados. La colonia adulta expuesta y reactivada, pardo oscura ovoide alcanzó de 13 a 13,9 um de diámetro por 16,5 a 17,6 um de longitud. Filamentos parduzcos, densos, ondulados con estuche individual estratificado, hasta 7,5 um de espesor. Células esféricas, con fisión binaria, de (3,2) 4,2 – 6,4 um de diámetro. Las células vegetativas reducidas por desecación se vuelven turgentes y se activan con las nevadas o lluvias. También algunas células vegetativas evidenciaron reducción de tamaño, éste fenotipo fue notorio cuando desarrollaron un estuche denso y pardo oscuro en los filamentos internos de las colonias. Acinetos esféricos, ovoides y en cadena, de 5,4 a 7,5 um de diámetro por 7,0 a 9,0 um de longitud. Los acinetos como células especializadas de resistencia y sobrevivencia pudieron dispersarse, se reactivaron y luego germinaron.
El diámetro promedio de la colonia hija fue de 7,4 um reconociéndose en las ultimas colonias hijas de la hilera la activación de los acinetos en verano (febrero) además de la proyección del mucílago estructural y posterior diseminación de las nuevas colonias por la caída de agua y por consiguiente la colonización del sustrato rocoso andino. En las colonias jóvenes aisladas con denso estuche colonial estratificado incoloro o pardo claro también se evidenció la proliferación de hormogonios y filamentos vegetativos (Figs. 9-12).
Morfotipos coloniales adultos irregulares
Nostoc commune produce significantes cantidades de productos o matriz extracelulares (EPS) en su mayoría polisacáridos, de esta manera, se formaron agregados coloniales gelatinosos principalmente cuando estuvieron hidratados. El mucílago estuvo distribuido laxamente y alrededor de las células, siendo liberados al medio circundante en el cual las células estuvieron creciendo, siendo embebidas en mucílago denso. En la etapa del ciclo de vida de N. commune cuando se observó los inicios de la desecación natural, el mucílago del filamento (fase seriada) fue visible y no ó expansivo. Los polisacáridos extracelulares asociados a los filamentos y colonias constituyeron los estuches, cápsulas o vainas filamentosas o coloniales respectivamente.
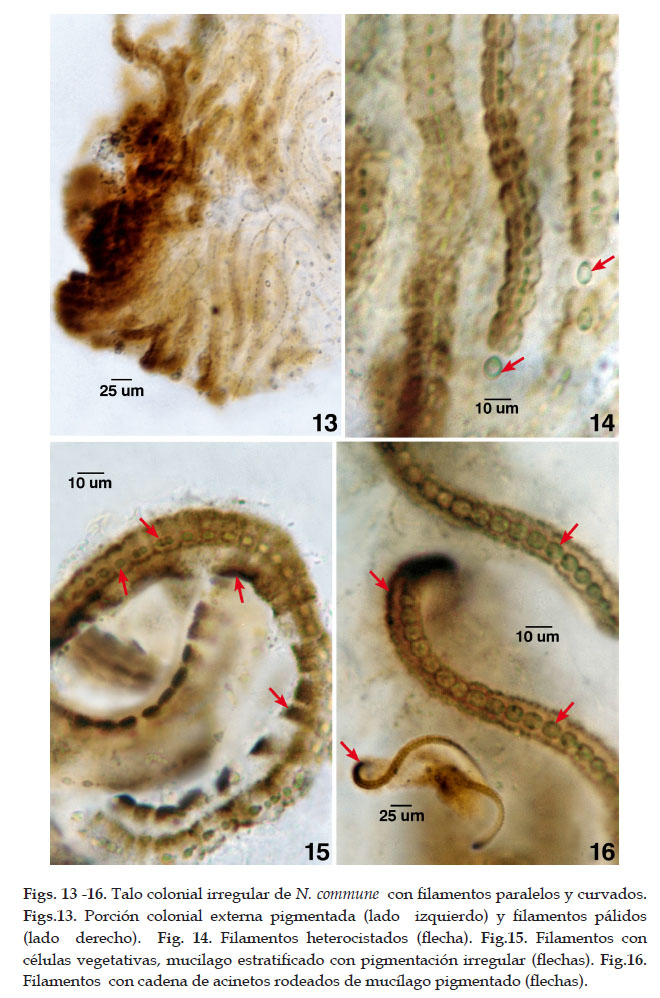
Los talos coloniales pequeños, redondeados y verde parduzcos y cuando son adultos se vuelven irregulares por desintegración colonial quedando la porción externa expuesta, de color pardo oscuro y con filamentos en su mayoría dispuestos en forma paralela y curvados. Los talos de ésta especie tienen una cubierta externa firme y algo coriácea que se quiebra por presión externa (bloque de hielo o nieve) con la consiguiente formación de hormogonios y posterior desintegración parcial o completa del talo. N. commune produce gran cantidad de polisacáridos extracelulares que se evidenció con el crecimiento de las células vegetativas intercalares de los filamentos seguida por fisión celular y con la formación de estuches gelatinosos individual, extracelular, y colonial (EPS3). La producción y distribución de la scitonemina en el mucilago produjo una tonalidad pardo naranja o pardo oscuro notoria en las partes externas coloniales (Figs.13-16).
La superficie colonial exhibió densos filamentos agrupados mientras que en la parte interna colonial los filamentos estuvieron dispersos. Las células del interior de la colonia en su mayoría cocoides incrementan su tamaño, alcanzando varias veces (hasta 4) la longitud de las células vegetativas de los filamentos. Estas células llegaron a diferenciarse en heterocistos que alcanzan el tamaño o son mayores que las células vegetativas. Algunas veces por la posición en que desarrollan favorecen la fragmentación de los filamentos. La complejidad colonial de N. commune basada en la distribución celular de los filamentos contorneados y regulares fue modificada por la remoción gradual del agua colonial (desecación) y de contracción de la matriz extracelular con pérdida de forma y estructura colonial. Esta contracción o colapso colonial favoreció el contacto celular en cierto nivel. Luego de la rehidratación la estructura espacial y distribución celular colonial fue restablecida.
A mayor intensidad de coloración del estuche colonial estratificado, las células del interior de la colonia fueron pálidas expuestas a escasa intensidad luminosa y condiciones sombreadas. Algunas porciones del talo colonial parduzco desintegrado e irregular con hormogonios (fase hormogonial del ciclo de vida). También, se presentaron filamentos estratificados o aislados, elongados, curvados y superpuestos con aspecto contorneados curvados. Los hormogonios se dispersaron y formaron colonias nuevas al segregar en forma gradual el mucílago o estuche individual seguido por el extracelular y colonial. La fragmentación de filamentos favoreció la formación de nuevas colonias a partir de las células aisladas. De esta forma, las colonias hijas dentro del talo colonial incrementan en tamaño y se aislan para originar colonias independientes con la desintegración del talo parental colonial.
Los filamentos curvados que rodean o están circundantes a las células vegetativas desarrollaron estuche individual incoloro ó pardo oscuro. La mayoría de filamentos presentaron estuche estratificado, con 2 capas, la interna ó EPS1 y la externa o EPS2 coloreadas de color parduzco que corresponden al estuche individual con un espesor de 4,3 a 6,4 um y estuche externo al anterior con un espesor de 10,7 a 14 – 16 um de diámetro respectivamente. Ambos estuches rodeados adicionalmente de un mucilago colonial (EPS3) incoloro o parduzco de 16 a 26,7 um que confluye con los estuches de los filamentos embebidos en el mucílago colonial. La pigmentación del mucílago con la scitonemina fue homogénea o distribuida en parches a lo largo de los filamentos y con mayor intensidad los orientados a la mayor radiación. Células esféricas u ovoides de (2,6) 4,8 a 3,2 (5,8) um de diámetro por (2,2) 3,7 a 4,2 (6,9) um de longitud. Heterocistos ovoides, de 5,3 a 6,4 um de diámetro por 7,4 – 8,5 um de longitud y no evidencia mucílago pigmentado. Acinetos ovoides en cadena, de formación apoheterocítica por su desarrollo intermedio entre dos heterocistos distantes, alcanzando de 6,4 a 8,0 um de diámetro por 7,5 a 9,6 um de longitud, con sustancias de reserva conspícuas y detectadas en verano.
Morfotipos coloniales de N. commune colonizando laderas de menor gradiente de altitudinal
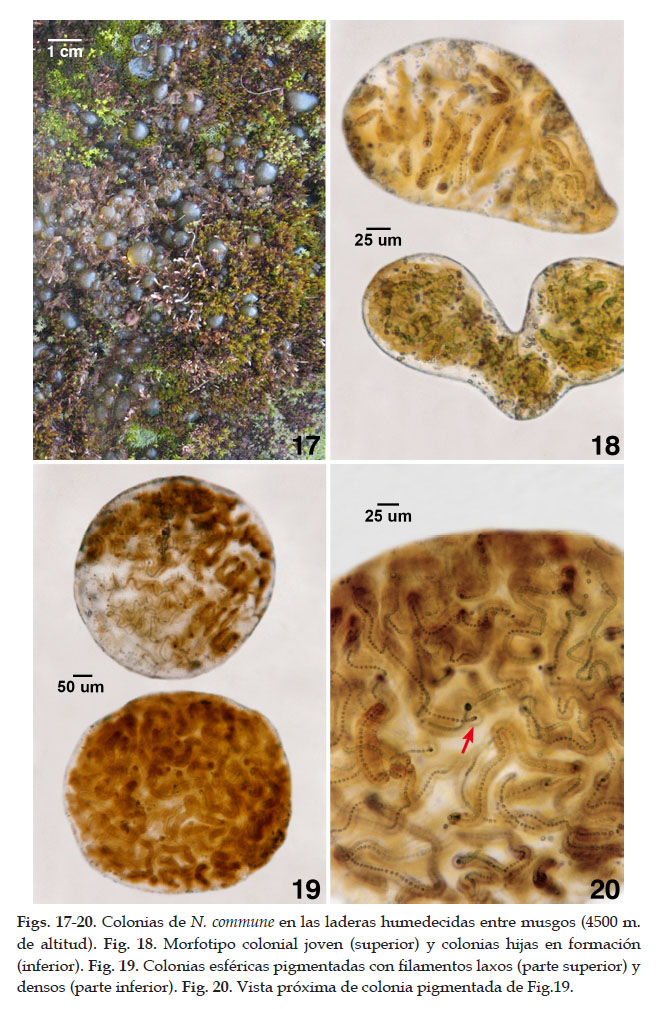
Los morfotipos de N. commune de las laderas de menor altitud entre los 4500 y 4600 m exhibieron colonias macroscópicas hidratadas, verde parduzcas, de formas esféricas, lobuladas, alargadas, irregulares colectadas en verano (Fig.17). Algunas colonias ovoides lobuladas presentaron una constricción mediana con la consiguiente formación de nuevas colonias hijas. Los talos coloniales en diferentes estados de división, dependiendo de la madurez de la colonia también estuvieron rodeados de un mucílago extracelular coloidal constituyendo un agregado multicelular. También se presentaron colonias similares a racimos o yemas secuenciales en hileras. En laderas las colonias pequeñas pardas se desarrollaron por la germinación de acinetos.
Los hormogonios como segmentos de los filamentos, constituyen estadios mótiles que se deslizaron inicialmente sobre el sustrato rocoso que es facilitado por el deshielo de la nieve circundante. También, los estadios hormogoniales que no son liberados y permanecen en el talo colonial, crecieron vigorosa y organizada produciendo estados celulares como primordios o proliferaciones celulares similares a yemas constituyendo en sus formas avanzadas morfotipos aseriados (Fig.18). Las células vegetativas de colonias jóvenes alargadas con estuche individual y colonial y formaron filamentos curvados con células esféricas de 2,1 a 3,2 um de diámetro. Algunas células estuvieron encapsuladas. Las células aisladas también se presentaron con estuche individual. La mayoría de filamentos encapsulados y desintegrados con proliferación de células aisladas o en pares. Filamentos con estuche individual pardos, alcanzaron de 6,4 a 8,6 um de diámetro. Heterocistos terminales (extremos de colonias jóvenes) alcanzaron de 6,4 a 7 um de diámetro por 5,3 a 5,7 um de longitud (Figs. 17-20).
Discusión y conclusiones
Las cianobacterias constituyen un grupo de productores primarios adaptados a una variedad de hábitats siendo dominantes en los criosistemas. Las cianobacterias de las regiones del ártico y el antártico son consideradas criotolerantes por su habilidad de sobrevivir largos periodos de dormancia en la criosfera, donde el agua líquida es limitante la mayor parte del año y existen periodos rápidos de congelamiento y descongelamiento de la nieve y hielo (Marshall, 2014). La diversidad cianobacterial y algal en la criosfera es baja, con algunas morfoespecies y ecotipos cianobacteriales de distribución cosmopolita aunque existe evidencia de taxa endémicos (Wynn-Williams, 2000; Jungblut et al., 2010; Strunecký et al., 2012).
En la presente investigación, el contraste térmico diurno y anual en la zona de estudio del Allincapac se estableció con fluctuaciones extremas durante el medio día donde las temperaturas descienden conforme el sol es cubierto por las nubes y el régimen de temperaturas frías nocturnas (bajo 0°C). Las implicaciones del descongelamiento abrupto de la criosfera andina por los cambios hidroclimáticos se apreció por la erosión de las rocas y suelos descongelados de las laderas y acantilados de las montañas que se reconocieron inestables y quebradizos durante el muestreo. Los suelos tropicales de alta elevación han incrementando su superficie a nivel global debido a la deglaciación rápida de los casquetes polares y glaciares como en los Andes altoandinos. Los suelos de altas elevaciones han sido poco estudiados por las condiciones rigurosas y secas por encima de los 5000 m de elevación (Bradley et al., 2006; Schmidt et al., 2009).
Las comunidades cianobacteriales y algales formaron biofilms complejos, dinámicos por el ensamblaje de litobiontes fototróficos poiquilohídricos y sus morfoespecies en la criósfera sur andina. Las fluctuaciones hídricas favorecieron el incremento en la complejidad dinámica de la matriz extracelular de los biofilms o matas cianobacteriales y microalgales que está relacionada con su sobrevivencia al ser protegidas de la detención del metabolismo en periodos extremos. La periodicidad en la disponibilidad del agua líquida principalmente como goteo o, escurrimientodeaguas deglaciares uescaso flujo de manantiales nivales favoreció el desarrollo de las matas con talos coloniales mucilaginosos, como los filamentos de N. commune y otras cianobacterias coloniales cocoides y filamentosas como Chroococcus, Leptolyngbya, Phormidium y Scytonema, estreptofitas y diatomeas. Así mismo, los biofilms pardo oscuros experimentaron fluctuaciones drásticas de temperaturas en pocas horas por el riguroso clima frio congelante. Sin embargo, la radiación absorvida por las matas especialmente en verano favoreció el descongelamiento diurno temporal. Las morfoespecies cianobacteriales sobre o dentro del hielo fueron resistentes para poder sobrevivir.
Las condiciones de estrés hídrico en la criósfera puede inhibir o disminuir los procesos de producción primaria y fijación de nitrógeno (Kvíderová et al., 2011). Los eventos de desecación repetidas incrementa su tolerancia (estrés osmótico e hídrico) después de la resistencia a cambios de temperatura, la rehidratación colonial permite la recuperación metabólica por su plasticidad fisiológica como se observó en la cepa de N. commune del Allincapac. Las fluctuaciones térmicas en la zona de estudio y al igual que los desiertos polares, regiones alpinas y montañas altoandinas del mundo (glaciares) la diversidad de especies es baja aunque en las cianobacterias se ha subestimado su alto grado de diversidad críptica (Gorbushina, 2007; Vincent, 2007).
La ecología, estado de desarrollo con características biosistemáticas y conservación de siete especies de Nostoc han sido reportados por Mollenhauer (1988), Mollenhauer et al. (1999). Entre las especies citadas N. commune, N. microscopicum, N. parmeloides y N. pruniforme forman talos esféricos en sus estados juveniles que pueden permanecer así cuando maduran o cambiar a formas irregulares huecas o aplanados y laminares. La especie de N. commune del Allincapac exhibe éstas características y cierto grado de diversidad criptica en la criosfera andina. La colonización cianobacterial no constituye una adaptación a condiciones óptimas como las temperaturas bajas sino una tolerancia a éstas condiciones según Quesada &Vincent (2012) y Nadeau & Castenholz (2000). Las cianobacterias también tienen que enfrentar los efectos del congelamiento por las bajas temperaturas, la formación del hielo (destrucción de integridad celular con alteración de membranas) y estrés osmótico (exclusión de solutos en la formación del hielo). Entre las estrategias para reducir los daños señalados, el primer mecanismo de protección es proporcionado por los ex polisacáridos así como, la presencia de crio protectores (Potts, 2000; Vincent, 2007). Tamaru et al. (2005) demostraron el rol de los polisacáridos extracelulares en la desecación y tolerancia al congelamiento en N. commune. Las especies resistentes a desecación generalmente desarrollan un mucílago grueso como estuches o capsulas o forman acinetos como se evidenció en N. commune del Allincapac.
Varias especies de Nostoc sintetizan compuestos protectores como la scitonemina que colorea la cubierta mucilaginosa de tonalidades parduzcas (Garcia - Pichel & Castenholz 1991; Dodds et al.,1995). N. commune continua creciendo en condiciones de luz tenue bajo hielo (en invierno) protegida por la scitonemina. La polaridad y producción localizada del pigmento scitonemina alrededor de los filamentos se ha descrito para el N. commune del Allincapac.
La plasticidad fenotípica ha sido definida como un mecanismo para la producción de múltiples fenotipos de un solo genotipo dependiendo de las condiciones ambientales. La diversidad funcional así como la variedad de formas fenotípicas (vegetativas, reproductivas, de propagación y resistencia) y crípticas de los talos de N. commune del Allincapac favoreció su distribución geográfica en los glaciares la zona altoandina del sur de Perú (Puno). De esta manera, sus repuestas plásticas fisiológicas y fenotípicas facilitaron la colonización de N. commune disminuyendo las presiones de selección (ecoevolutivas) impuestas por el cambio climático para otros autótrofos. Los procesos en acción como, los cambios en los patrones hidroclimáticos continuarán en el futuro y, fortaleceran las ventajas fisiológicas de los diversos morfotipos o ecotipos de la especie dominante N. commune en la presente investigación.
Los suelos glaciales altoandinos son considerados entre los más extremos de la biosfera y análogos para las regiones polares extraterrestres (Wynn-Williams, 2000; Vincent & Howard-Williams, 2000; Schmidt et al., 2009). La disponibilidad de oportunidades ecológicas y habilidad de la especie N. commune así como, sus patrones fenotípicos (morfotipos) para la colonización exitosa en la criosfera del Allincapac permite considerar esta especie como candidata para viajes espaciales de regiones extraterrestres.
Agradecimiento
La presente investigación forma parte del proyecto FONDECYT N°117-2017-DE "Estudio experimental e in situ del efecto de la superficie lunar sobre las biopelículas de cianobacterias extremófilas del Perú en un simulador de condiciones lunares y en el experimento KillaLab del HHK-1 de la misión Team Indus 2018" por lo cual agradecemos el apoyo del CONCYTEC.
Contribución de los autores
H. M.; J. F.; R. C.; R. Q. & S. R.: han contribuido en forma similar en los diferentes aspectos de la investigación (selección del área de investigación, colecciones, evaluación del material de estudio o biofilms, datos morfométricos, descripciónes, macro y microfotografías, revisión bibliográfica, logística) hasta elaboración final del artículo científico.
Conflictos de intereses
Los autores declaran no tener conflicto de intereses
Literatura citada
Aguilar, P. 1985. Fauna de las lomas costeras del Perú. Bol.de Lima. 7(41):17-28. [ Links ]
Aldave, A. 1985. Algas Andino Peruanas como recurso hidrológico alimentario. Bol.de Lima. 37(7):66-73 [ Links ]
Bradley R.; M. Vuille; H. Diaz & W. Vergara. 2006. Threats to water supplies in the Tropical Andes. Science 312:1755-1756. [ Links ]
Casamatta, D.; J. Johansen; M. Vis; S. Broadwater. 2005. Molecular and morphological characterization of ten polar and near- polar strains within the Oscillatoriales (Cyanobacteria). J. Phycol. 41:421- 438. [ Links ]
Dodds, W.; D. Gudder & D. Mollenhauer. 1995. The ecology of Nostoc. J. Phycol. 31:2-18. [ Links ]
García- Pichel, F. & R. Castenholz. 1991. Characterization and biological implication of scytonemin, a cyanobacterial sheath pigment. J. Phycol. 27:395-409. [ Links ]
Gorbushina, A. 2007. Life on the rocks. Environ. Microbiol. 9: 1613-1631. [ Links ]
Johansen, J. 1993. Cryptogamic crusts of semiarid and arid lands of North America. J. Phycol. 29: 140- 147. [ Links ]
Jungblut, A. D.; C. Lovejoy & W. Vincent. 2010. Global distribution of cyanobacterial ecotypes in the cold biosphere. ISME J. 4:191-202. [ Links ]
Kvíderová, J.; J. Elster & M. Simek. 2011. In situ response of Nostoc commune s.l. colonies to desiccation in Central Svalbard, Norwegian High Artic. Fottea 11(1): 87-97. [ Links ]
Komárek, J. 2013. Cyanoprokaryota. Heterocytous genera. In SüBwasserflora von Mitteleuropa Freshwater Flora of Central Europe. B. Büdel et al. eds. 3.Teil/Part 3. Band/Vol 19/3. Springer-Verlag Berlin Heidelberg. 1130p. [ Links ]
Komárek, J.; J. Kastovsky; J. Mares & J. Johansen. 2014. Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia 86: 295-335. [ Links ]
Marshall, S. 2014. Glacier retreat crosses a line. Science.345: 872-873. [ Links ]
Montoya, H.; J. Gómez; D. Medina & G. Vera. 1998. Cultivo de cianobacterias de costras algal- liquénicas de las lomas de Pachacamac, Lima. Biotempo.Vol.3:7-16. Lima. [ Links ]
Mollenhauer, D. 1988. Nostoc species in the field. Algological Studies 50-53:315-326. [ Links ]
Mollenhauer, D.; R. Bengtsson & E. Lindstrom. 1999. Macroscopic cyanobacteria of the genus Nostoc: a neglected and endangered constituent of European inland aquatic biodiversity. Eur. J. Phycol. 34: 349- 360. [ Links ]
Nadeau, T. & R. Castenholz. 2000. Characterization of psychrophilic oscillatorians (Cyanobacteria) from Antartic meltwater ponds. J. Phycol. 36: 914-923. [ Links ]
Potts, M. 2000. Nostoc. In The ecology of Cyanobacteria. Their diversity in time and space.
B. A. Whitton & M. Potts (eds.). Kluwer Academic Publ. The Netherlands. 465 - 504p.
Quesada, A. & W. Vincent. 2012. Cyanobacteria in the Cryosphere: snow, ice and extreme cold. In Ecology of Cyanobacteria II: their diversity in space and time. B.A. Whitton (ed.). Springer Science. 387- 399. [ Links ]
Schmidt, S. K.; D. Nemergut; A. Miller; K. Freeman; A. King & A. Seimon. 2009. Microbial activity and diversity during extreme freeze-thaw cycles in periglacial soils, 5400 m elevation, Cordillera Vilcanota, Perú. Extremophiles 13: 807-816. [ Links ]
Schmidt, S. K.; J. Darcy; P. Sommers; E.Gunawan; J. Knelman & K. Yager. 2017. Freeze-thaw revival of rotifers and algae in a desiccated, high-elevation (5500 meters) microbial mat, high Andes, Perú. Extremophiles. Doi: 10.1007/s00792-017-0926-2. [ Links ]
Strunecký, O; J. Elster & J. Komárek. 2012. Molecular clock evidence for survival of Antarctic cyanobacteria (Oscillatoriales, Phormidium autumnale) from Paleozoic times. FEMS Microbiol. Ecol. 82: 482- 490. [ Links ]
Tamaru, Y.; Y. Takani; T. Yoshida & T. Sakamoto. 2005. Crucial role of extracellular polysaccharides in desiccation and freezing tolerance in the terrestrial cyanobacterium Nostoc commune. Applied and Env. Microbiol. 71: 7327-7333. [ Links ]
Vincent, W. 2007. Cold tolerance in cyanobacteria and life in the cryosphere. In Algae and Cyanobacteria in extreme environments. J.Seckbach (ed.). Springer, Heidelberg. 289 -304p. [ Links ]
Vincent, W. & C. Howard-Williams. 2000. Life on snowball Earth. Science 287: 24-21. [ Links ]
Vishnivetskaya, T. A. 2009. Viable cyanobacteria and green algae from permafrost darkness. In Permafrost soils. R. Margesin (ed.). Vol.16. Soil Biology. Springer, Heidelberg. 73 - 84 p. [ Links ]
Wynn-Williams, D. D. 2000. Cyanobacteria in deserts – life at the limit? In The ecology of Cyanobacteria. Their diversity in time and space. B.A. Whitton & M. Potts (eds.). Kluwer Academic Publ. The Netherlands. 341-366p. [ Links ]
Recibido: 1-IV-2019
Aceptado: 115-V-2019
Publicado online: 15-VIII-2019
Publicado impreso: 31-VIII-2019