Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.2 Trujillo mayo/ago. 2019
http://dx.doi.org/10.22497/arnaldoa.261.26210
ARTÍCULOS ORIGINALES
Características estructurales del cistocarpo de Gelidium serrulatum J. Agardh (Gelidiales, Rhodophyta)
Structural characteristics of the cystocarp of Gelidium serrulatum J. Agardh (Gelidiales, Rhodophyta)
Rómulo E. Loayza Aguilar1
1 Escuela de Biología en Acuicultura, Universidad Nacional del Santa. Chimbote, PERÚ. rloayza@uns.edu.pe
Resumen
Gelidium serrulatum es una Rhodophyta endémica de la costa este del mar Caribe que, por la calidad del agar, podría ser manejada, de allí su importancia. El conocimiento taxonómico de esta especie se basa en aspectos externos, pero su morfología externa cambia en el laboratorio; por ello, se propuso estudiar en las características del cistocarpo, que es una de las estructuras más estables de las agarofitas. Se colectaron organismos en punta Guarapo del Caribe venezolano, realizándose cortes histológicos y criofractura para microscopía electrónica de barrido. El cistocarpo es bicon- vexo, biostiolar y bilocular, con compartimientos simétricos. Su región cortical tiene una sola capa de células y la subcortical 5-6 filas, que proyectan filamentos corticales perpendiculares al carpos- porofito. Son estructuras provistas de una cutícula y los ostiolos se presentan taponados. Presenta carpogonios intercalares en la región subcortical, fructificando varios en un mismo cistocarpo, y los carposporangios son individuales.
Palabras clave: cistocarpo, carpogonio, Gelidium serrulatum, Gelidiales.
Abstract
Gelidium serrulatum is a Rhodophyta endemic to the east coast of the Caribbean Sea which, due to the quality of the agar, could be managed, hence its importance. The taxonomic knowledge of this species is based on external aspects, but its external morphology changes in the laboratory; there- fore, it was proposed to study the characteristics of the cystocarp, which is one of the most stable structures of the agarophytes. Organisms were collected in Punta Guarapo of the Venezuelan Carib- bean, with histological sections and cryofracture for scanning electron microscopy. The cystocarp is biconvex and bilocular, with symmetrical compartments. Its cortical region has a single layer of cells and the subcortical 5-6 rows, which project cortical filaments perpendicular to the carposporophyte. They are structures equipped with a cuticle and the ostioles are plugged. It presents intercalary carpogones in the subcortical region, fruiting several in the same cystocarp, and the carposporangia are individual.
Keywords: cystocarp, carpogonium, Gelidium serrulatum, Gelidiales.
Introducción
No obstante que el género Gelidium fue establecido en el año 1813 por Lamouroux (Santelices & Montalva, 1983; Santelices, 1988), sin embargo, la taxonomía de las Gelidiaceae, e incluso del Orden Gelidiales, sigue siendo clarificada (Santelices & Mon- talva, 1983; Santelices, 1991; Norris, 1992; Craig & Freshwater, 1997). Este género es tipificado como uno de los más polimór- ficos de las Florideophyceae (Akatsuka, 1986) y nomenclatural y taxonómicamente el más confuso de las algas rojas (Dixon & Irvine, 1961; 1966 in Kapraun, 1980; Bold & Wynne, 1985).
En general, las especies de Gelidium son consideradas muy importantes para la in- dustria de los coloides, por ser producto- ras de agar de alta calidad (Duddington, 1966; Chapman,1970; Etcheverry, 1986; Rodríguez & Espinosa, 1987; Santelices, 1988; Desikachary et al., 1990a; Souza & Oliveira, 1990; Salinas, 1991; Jensen, 1993; Iha, 2014); sin embargo, Craigie & Leigh (1978), Etcheverry (1958, 1986) y Santelices & Stewart (1985), advierten que es de suma importancia precisar taxonómicamente las especies de algas en explotación, por ser la base para realizar una eficiente adminis- tración y utilización del recurso, además de tener la seguridad y garantía de estar utilizando correctamente la especie.
Gelidium serrulatum es una agarofita descrita para Venezuela en 1847 por J. C. Agardh (Ganesan, 1978), considerada endémica del Mar Caribe (Aponte, 1985; Ganesan, 1989), y en base a estudios preliminares de carácter bioecológico (González, 1977; Lemus & Aponte, 1987) y de su agar (Aponte, 1987; Lemus et al., 1991; Loayza, 1994), representa una valiosa alternativa para la industria de este ficocoloide en este país (Loayza & Lemus, 1994). Este contex- to ha despertado interés por estudiar a G. serrulatum, principalmente desde otros enfoques no florísticos, para impulsar su aprovechamiento económico en beneficio del país (Gómez, 2017).
Los estudios taxonómicos realizados en G. serrulatum por Taylor (1960), Gessner & Hammer (1967), Hammer & Gessner (1967), Ríos de (1972), Richardson (1975), Ganesan (1983), Aponte (1985) y Rodríguez (1991), están referidos básicamente a las características morfológicas exter- nas, sin embargo, estás pueden cambiar, dependiendo de las condiciones del ambiente, como ha podido ser observado en estudio de cultivos de la especie bajo condiciones de laboratorio, y en la morfología apical de Gelidium sclerophyllum (Ro- driguez & Santelices, 1993 in Rodriguez & Rivas, 1995), debido probablemente a su gran plasticidad fenotípica (Iha, 2014). Es posible por tanto, que este comportamiento pueda presentarse en condiciones naturales, lo que podría conducir a confundirla con otra especie.
En tanto, las especie de los géneros Gelidium y Pterocladia son los más cercanos morfológicamente, se han realizado intentos para establecer patrones estructurales para diferenciar las especie, como la arquitectura de la célula apical (Dawson, 1966; Dawes, 1986; Rodríguez & Santelices, 1987,1988; Santelices, 1988; Rodríguez & Rivas-Lechuga, 1993), la presencia y posición relativa de las rizinas internas y forma de las células medulares (Joly, 1965; Dawson, 1966; Abbott & Dawson, 1978; Dawes, 1986; Okamura et al., 1934 in Santelices, 1991), el patrón de dimensión y ramifica- ción de los ejes, la presencia de soros (Santelices & Stewart, 1985), la forma y orientación de las células corticales (Akatsuka, 1986), y la estructura del cistocarpo (Dixon & Irvine, 1977; Zhang & Enzhan, 1988; Fredriksen & Rueness, 1990; Santelices, 1988, 1991; Ponce-Márquez et al., 2009). De todos ellos, a criterio de Fan (1961), Okamu- ra (1934 in Santelices, 1976), Rodríguez & Santelices (1988) y Santelices (1988, 1991), sólo la estructura del cistocarpo es reconocida como característica notablemente constante en la segregación de las especies de éstos géneros.
Teniendo en cuenta estos antecedentes, se propuso en el presente trabajo estudiar la estructura del cistocarpo de G. serrulatum, como contribución a su ubicación taxonómica exacta, aun cuando su morfología externa pueda variar, aportando así información básica para su futuro manejo.
Material y métodos
Los cistocarpos de Gelidium serrulatum proceden de un lote de talos colectados del sustrato rocoso de la zona intermareal, entre marzo de 1992 y enero de 1994, en Punta Guarapo, ubicada en el Mar Caribe al oriente de Venezuela (Fig. 1), y conservados en formaldehído al 4% en agua de mar en el Laboratorio de Biología Marina del Instituto Oceanográfico de Venezuela de la Universidad de Oriente.
Se seleccionaron los talos femeninos más representativos, y se procedió a separar y limpiar las pínulas conteniendo cistocarpos, a cuyas estructuras se les practico cortes histológicos adoptando la técnica descrita por Aponte (1985, 1987), Lemus & Ganesan (1977), Rodríguez (1991) y Velás- quez (1981). Para ello, un grupo de pínulas fueron incluidas en anilina azul al 1% por 24 horas, las que luego de lavarlas con agua destilada, se las acidificó con HCl al 1%, y se procedió a realizar cortes de un grosor promedio de 25 μm utilizando un micrótomo de congelación Letiz Wetzler. Las observaciones microscópicas fueron fotografiadas con una cámara fotográfica Pentax-Z-10 incorporada un microscopio y película AGFA blanco y negro de 100 ASA. Otro grupo de pínulas, utilizando la técni- ca convencional de criofractura reportada por Tanaka & Naguro (1981), fueron preparadas para su análisis ultraestructural mediante microscopía electrónica de barrido. La post-fijación se realizó en una solución de tetróxido de Osmio (OsO4) al 5%, la deshidratación en una batería creciente de etanol, el secado en un secador de punto crítico y el recubrimiento de las muestras fracturadas con Platino-Paladio en un evaporador de metales. Las observaciones se hicieron en un microscopio electrónico de barrido Hitachi B-800, y las microgra- fías tomadas en película Agfa de 120 mm, blanco y negro de 100 ASA.
Resultados
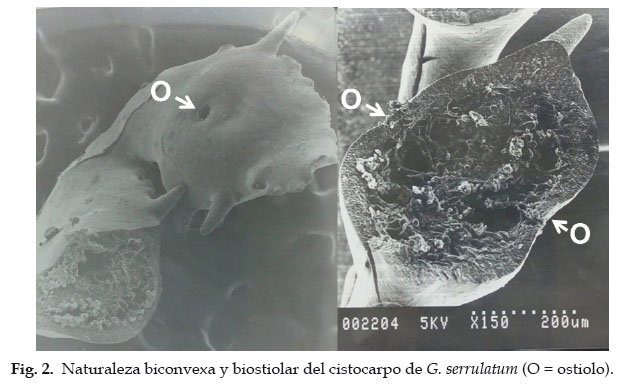
La apariencia externa del cistocarpo de G. serrulatum es de carácter biconvexo y biostiolar, ubicándose el ostiolo en una depresión central en cada una de las caras de la pínula reproductiva (Fig. 2). Se apre- cia también que las pínulas reproductivas pueden contener más de dos cistocarpos en serie lineal. En la micrografía de la par- te derecha de la misma figura se observa que los espacios loculares de los cistocarpos están ocupados por una sustancia mu- cilaginosa.
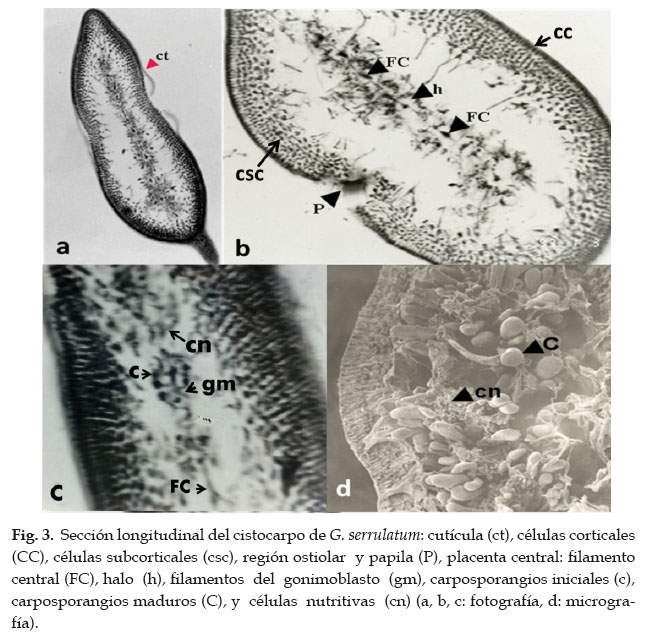
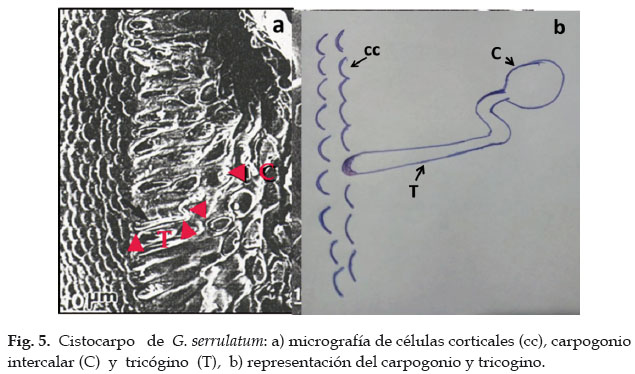
Los cistocarpos están protegidos por una cutícula que los recubre completamente (Fig. 3a), las células corticales (cc), vistas desde la superficie con micrografía electrónica, son pequeñas, ovaladas y dispuestas en forma irregular (Fig. 5a), e internamente, vistas con microscopio simple, son de forma ahusada y dispuestas en una sola capa (Fig. 3b). Se presenta una capa de células subcorticales (csc) constituida por 5-6 filas de células de forma poligonal y más pequeñas que las corticales (Fig. 3b).
Las regiones ostiolares se encuentran taponadas por una papila (P), que se rom- pe en su momento para la liberación de las carposporas. El carposporofito se observa como placenta central, que divide en dos compartimentos simétricos al cistocarpo (Fig. 3b). La placenta central vista en microscopio de luz visible, presenta engrosamientos a cortas distancias, provistos de halos (h) y unidos por un filamento central (FC) (Fig. 3b). Los elementos que conforman la placenta central son las células del filamento central (Fig. 3c), el carpogonio fertilizado (c) generando filamentos gonimoblásticos (gm), que se fusionan con las células nutritivas (cn), pequeñas y dispuestas en hilera, para dar origen a los carposporangios (C). Los carposporangios son uniloculares, de forma clavada u ova- da, hacia uno y otro lado de los lóbulos (Fig. 3d).
Es típico encontrar células muy alargadas, denominadas filamentos corticales (fc) que parten de la fusión de dos células de la última fila de subcorticales, desarrollándose perpendicularmente a la placenta central, y que llegan a fusionarse con células especiales del carposporofito (cec) (Fig. 4).
En la zona subcortical del cistocarpo se presentan muchos carpogonios de tipo intercalar, los que se fusionan con las células de soporte, proyectando sus largos tricóginos hacia la superficie externa (Fig. 5a).
La parte del talo, inmediatamente basal del cistocarpo, presenta las rizinas internas concentradas en la región medular.
Discusión
Las características externas del cistocarpo de G. serrulatum, su aspecto bicon- vexo, la presencia de un ostiolo en cada una de sus caras, así como el carácter interno bilocular, son señalados como ele- mentos estructurales propios del género Gelidium por Newton (1931), Taylor (1945), Fan (1961), Dawson (1966), Dixon & Irvine (1977), Santelices & Stewart (1985), Hommersand & Fredericq (1988), Desikachary et al. (1990b), Fredriksen & Rueness (1990), Santelices (1988, 1991) y Ponce-Márquez et al. (2009). Esta característica permite diferenciarla de otras especies muy cercanas morfológicamente, como de Pterocladiella caerulescens, que posee un cistocarpo solitario y unilocular (Rodríguez et al., 2016).
Santelices (1991) señala que el septum central o filamento central, es una estructu- ra propia de los cistocarpos de género Gelidium, por lo que, dadas las evidencias para el caso de G. serrulatum, esta estructura podría ser derivada de las células corticales, para cumplir una función básicamente de soporte para el desarrollo del carposporofito, en tanto éstas células no se fusionan con las propias del carposporofito, como se aprecia en las Figs. 3c, d. Estos células nutritivas organizadas en un núcleo en torno al filamento central, también se encuentran en Pterocladiella caerulescens (Rodríguez et al., 2016), pero son mucho menos evidentes que el G. serrulatum (Fig. 3).
En cuanto a la cutícula que rodea el cistocarpo de G. serrulatum (Figs. 3a), Hommersand & Fredericq (1990) señalan que esta estructura está presente en algunas algas rojas, en donde cumpliría la función de membrana permeable diferenciada, permitiendo el paso de moléculas pequeñas, pero reteniendo las moléculas gran- des producidas por fotosíntesis, sustancias que estarían orientadas a la formación y mantenimiento del carposporofito.
Según Hommersand & Fredericq (1990), los cistocarpos de la mayoría de las algas rojas están divididos en tres compartimientos: a) el tejido fotosintético externo, b) el tejido gametofítico interno modificado, no fotosintético, y c) el carposporofito. El primero consta de tejido cortical no modificado del sistema vegetativo, más algún tejido fotosintético secundario (con cloroplastos funcionales) generado antes o después de la fertilización, que se desa- rrolla perpendicular al carposporofito, los que son denominados filamentos cortica- les por Desikachary et al. (1990a) y Santelices (1991). Estos filamentos también apreciados en G. serrulatum (Fig. 4) y Gelidium maggsiae (Rico & Guiry, 1997), y de acuerdo con Hommersand & Fredericq (1988), estarían cumpliendo una función estricta- mente nutricional, tomando en cuenta que estas estructuras serían una manifestación morfológica de la interacción entre el ga- metofito y carposporofito (Hommersand & Fredericq, 1990), considerados hospedante y parásito, respectivamente.
Según Morris (1967), Dawes (1986) y Desikachary et al. (1990b), el filamento car- pogonial en las Gelidiales y en particular en Gelidium (Dawson, 1966; Desikachary et al., 1990a), es una célula única localizada entre las células corticales y constituidas por un carpogonio sésil con un largo tricógino, siendo fácil de distinguir debido a que se tiñe fuertemente. Por otro lado, Santelices (1988) señala que en este grupo de algas pueden formarse carpogonios sésiles e intercalares, y según Fritsch (1977), la rama carpogonial está formada por tres células. Hommersand & Fredericq (1988) afirman que en G. pteridifolium siem- pre se evidencian carpogonios intercala- res, y que los carpogonios sésiles parecen ser no funcionales, en la medida que no encontraron evidencias de fusión con las células de soporte.
Con referencia a lo anterior, en G. serrulatum, y dada la presencia de carpogonios intercalares (Fig. 5), la condición más importante que induce a la formación de gonimoblastos en esta especie, sería la fusión del carpogonio con las células de soporte.
En relación al tricógino es poco lo que se conoce, por esa razón Pueschel (1990) señala que sobre esta estructura se requiere más estudios referidos a su formación, fijación y penetración del espermio, su migración y la tabicación luego de la fertilización. Al respecto, Broadwater & Scott (1982 in Pueschel, 1990) de manera general sostienen que se trata de una estructura cubierta con material poco consolidado, importante en la receptividad del espermio. De este modo, la característica del tricógino, de ser largo, como se observa en G. serrulatum (Fig. 5), podría considerarse como una característica de la especie.
Luego de la fertilización, los carpogonios se fusionan con las células de soporte y migran hasta la placenta central en donde, coincidiendo con lo señalado por Dawson (1966), Dawes (1986), Hommersand & Fredericq (1988) y Desikachary et al. (1990a), se hacen irregulares y multicelulares. Fan (1961) refiere que paralelamente al desarrollo del carpogonio se forman pequeñas células nutritivas en cadenas (como se aprecian en la Fig. 3d de G. serrulatum), las que de acuerdo a Hommersand & Fredericq (1988) son generadas de la parte interior de los filamentos de tercer orden, denominado centro de procesamiento de nutrientes por Hommersand & Fredericq (1990). El reporte de Santelicies (1991) refuerza lo observado en G. serrulatum en cuanto a la fusión de las células nutritivas con los fila- mentos gonimoblásticos iniciales para dar lugar a los carposporangios, que se desarrollan en ambas direcciones de la placenta central.
La manera de producirse los carpos- porangios en las Gelidiaceae varían: Fan (1961) y Kylin (1956 in Fredriksen & Rueness, 1990) observaron en general, que en Pterocladia éstos se desarrollan en cadenas cortas, y en Gelidium como individuales; sin embargo, Santelices (1991) señala que en G. galapagensis las carpósporas se generan como únicas y directamente de los gonimoblastos iniciales, en tanto que G. pteridifolium las esporas son producidas en racimos, y en G. amansii en racimos en el extremo de un proceso alargado. Dados estos antecedentes, la disposición de los carposporangios maduros en G. serrulatum (Fig. 3d) podría ser una característica útil en la segregación genérica y específica.
La naturaleza biconvexa observada en los cistocarpos de G. serrulatum, tomando en consideración lo señalado por Santelices (1988, 1991) para otras especies de ese género, serian debido a la producción de carpósporas y al alargamiento de los filamentos corticales, que originan un enma- rañado en la matriz locular. Como se pue- de apreciar en la micrografia electrónica (Fig. 2), el mucílago que ocupa espacios lo- culares en los cistocarpos de G. serrulatum, también estaría contribuyendo con la for- ma biconvexa de éste. Por otro lado, y aun- que no ha sido posible encontrar información que contribuya a explicar la función que cumple dicho mucílago, es posible que juegue papel importante en minimizar la desecación del carposporofito, y además en el almacenamiento de sustancias nu- tritivas producidas por el tejido gametofitito o las incorporadas desde el ambiente, y que estarían orientadas al desarrollo y mantenimiento de la estructura parásita.
Sería importante analizar la composición química del mucílago antes señalado, ya que podría tratarse de agar, y por ello explicar las diferencias en el rendimiento de este ficocoloide entre fases reproductivas, encontradas en otras especies del género.
En G. pteridifolium, Hommersand & Fredericq (1988) no encontraron rizinas internas en la región fértil, característica que es compartida con las observaciones hechas en G. serrulatum en el presente estudio, sin embargo, en esta última especie, y a diferencia de lo apreciado en el resto del tejido vegetativo, la porción inmediata del tallo que sostiene al cistocarpo, presenta rizinas internas concentradas hacia la zona medular, carácter que debería ser profundizado en estudio a objeto de determinar su valor como criterio taxonómico. Las rizinas en Gelidium coarctatum se presentan copiosas concentradas en la médula externa y la corteza interna del talo, o razonablemente importantes en Gelidium floridanum, G. mi- crodontivum (Iha et al., 2016).
Conclusiones
El cistocarpo de Gelidium serrulatum es biconvexo, biostiolar y bilocular, con compartimientos simétricos, con matriz mucilaginosa. Su región cortical tiene una sola capa de células, y la subcortical con 5-6 filas, que proyectan filamentos corticales perpendiculares al carposporofito. Son estructuras provistas de una cutícula y los ostiolos se presentan taponados. Poseen carpogonios intercalares en la región subcortical, fructificando varios en un mismo cistocarpo, y provistos de un largo tricogino, y los carposporangios son producidos individualmente.
Agradecimientos
El autor expresa sus agradecimientos al Doctor Andrés Lemus y Doctor D. Arrieche, ambos pertenecientes a la Universidad de Oriente (Núcleo Sucre), de Venezuela, por su valiosa contribución con el desarrollo del trabajo.
Contribución de los autores
R. E. L.A.: Concepción del trabajo, obtención de muestras en campo, preparación de las muestras, toma de fotografías y micrografias, redacción del borrador original y correcciones finales.
Conflictos de intereses
El autor declara no tener conflictos de intereses.
Citación: Loayza, R. 2019. Características estructurales del cistocarpo de Gelidium serrulatum J. Agardh (Gelidiales, Rhodophyta). Arnaldoa 26 (2): 675-688 http://doi.org/10.22497/arnaldoa.262.26210
Literatura citada
Abbott, I. & E. Dawson. 1978. How to know the sea- weeds. Ws. C. Brows Comp. Publ., Iowa, 141 p. [ Links ]
Akatsuka, I. 1986. Japanese Gelidiales (Rhodophyta), especially Gelidium. Oceanogr. Mar. Biol. Ann. Rev. 14: 171-263. [ Links ]
Aponte, M. 1985. Evaluación taxonómica de las algas marinas de la costa norte de la Isla Margarita, Ve- nezuela. Tesis M Sc., Inst. Oceanog. Venez., Univ. Oriente. Cumaná, Venezuela. 394 p. [ Links ]
Aponte, M. 1987. Localización de algunos bancos de agarofitas de los estados Sucre y Nueva Esparta, reconocimiento de las especies y características de los agares obtenidos de las mismas. Inst. Oceanog. Venez. Univ. Oriente – CONICYT. Cumaná, Venezu- ela, 73 p. [ Links ]
Bold, H. & M. Wyne. 1985. Introduction to the algae: structure and reproduction. Prentice-Hall, Inc., En- glewood Cliffs, New Jersey. 720 p. [ Links ]
Chapman, V. 1970. Seaweeds and their uses. 2da edic. Methuen and Co. Ltd. London. 304 p. [ Links ]
Craig, J. & D. Freshwater. 1997. Molecular systemat- ics of the Gelidiales: inferences from separate and combined analyses of plastid rbcL and nuclear SSU gene sequences, European Journal of Phycology, 32:4, 343-352. https://doi.org/10.1080/09670269710001737279 [ Links ]
Craigie, J. & C. Leigh. 1978. Carrageenans and agars. In Handbook of phycological Nethds physiological and Biochemical Methods, Hellebust, A.; Craigie, J. (eds.), pp.109-131. Cambridge Univ. Press. [ Links ]
Dawes, C. 1986. Botánica Marina. Ed. Limusa, S, A., México. 637p. [ Links ]
Dawson, E. 1966. Marine Botany: an introduction. Holt, Reinehart and Winston, Inc. USA. 371 p. [ Links ]
Desikachary, T.; V. Krishnamurthy & S. M. Balakrishnan. 1990a. Rhodophyta: II-Taxonomy Part, Part II A: Palmariales to Gelidiales, pp. 191-212. Madras Science Foundation. Madras. 289p. [ Links ]
Desikachary, T.; V. Krishnamurthy & S. M. Balakrish- nan. 1990b. Rhodophyta. Part. 1: General Part. Madras Science Foundation. Madras. 289 p. [ Links ]
Dixon. P. & E. Irvine. 1977. Seaweeds of the British Isles. Vol. 1. Rhodopyta. Part 1. Introduction, Ne- maloniales, Gigartinales. Britain Museum (Nat. Hist.). London. 252 p. [ Links ]
Duddington, C. 1966. Seaweeds and other algae. Faber and Faber Ltd. London. 207 p. [ Links ]
Etcheverry, H. 1958. Algas marinas chilenas pro- ductoras de ficocoloides. Rev. Biol. Mar. 7 (1 y 2): 153-174. [ Links ]
Etcheverry, H. 1986. Algas marinas bentónicas de Chile. Ofic. Reg. Cs. Téc. UNESCO. Montevideo, 379 p. [ Links ]
Fan, K. 1961. Morphological studies of the Gelidiales. In University of California Pub., Botany. Papenfus, C.; Foster, A.; Proskauer, J. (eds.). 32 (5): 315-368. [ Links ]
Fredriksen, S. & J. Rueness. 1990. Culture studies on Pterocladia mealnoidea (Schousboe ex Bornet) comb. Nov. (Gelidiales, Rhodophyta). Phycologia 29(2):182-190. [ Links ]
Fritsch, F. 1977. The structure and reproduction of the algae. vol. II: Foreword, Phaeophyceae, Rhodophy- ceae, Myxophyceae. Cambridge Univ. Press. 939 p. [ Links ]
Ganesan, E. 1978. Reseña histórica, catálogo y dis- tribución de las microalgas bentónicas y faneró- gamas marinas citadas para Venezuela. Trabajo Ascenso, Univ, Oriente. Cumana, Venezuela. 226 p. [ Links ]
Ganesan, E. 1983. Evaluación de la flora macroben- tónica (microalgas y fanerógamas marinas) de la Cuenca Tuy-Cariaco, Venezuela. Bol. Inst. Oceano- gráfico Universidad Oriente 22 (1 y 2): 145-175. [ Links ]
Ganesan, E. 1989. A catalog of benthic marine algae and seagrasses of Venezuela. Fondo Edit. CONICYT. Caracas, Venezuela, 237 p. [ Links ]
Gessner, F. & L. Hammer. 1967. Die litorale algen- vegetation an den Kustes von Ost-Venezuela. Inst. Revne ges. Hydrobiol. 52 (5): 657-692. [ Links ]
Gómez, S. 2017. Reseña histórica, catálogo actua- lizado y estatus actual de los estudios florísticos sobre macroalgas bénticas marinas de Venezuela. Trabajo de Ascenso presentado ente la Ilustre Univ. Central de Venezuela, para optar a la categoría de Profesor Titular en el escalafón universitario. Caracas, Venezuela. 154 p. [ Links ]
Gonzáles, A. 1977. Estudio-ecológico de una región del litoral central (punta de Tarma)-Venezuela, Sep. Act. Bot. Venezuelica 12 (1, 2, 3 y 4): 207-240. [ Links ]
Hammer, L. & F. Gessner. 1967. La taxonomía de la vegetación marina en la costa de Venezuela. Bol. Inst. Oceanog.. Univ. Oriente 6 (2): 186-265. [ Links ]
Hommersand, D. & S. Fredericq. 1988. An investiga- tion of cystocarp development in Gelidium pterid- ifolium with a revised description of the Geldiales (Rhodophyta). Phycol. 27 (2): 254-272. [ Links ]
Hommersand. M. & S. Fredericq. 1990. Sexual re- production and cystocarp development. In Biology of the red algae, Cole, K.; Sheath, R. (eds.), pp. 305-344. Cambridge Univ. Press. [ Links ]
Iha, C.; K. O’Shaughnessy; S. Guimarães; M. Olivei- ra & D. Wilson. 2016. Taxonomic reappraisal of Gelidium coarctatum (Gelidiales, Rhodophyta) and Gelidium lineare sp. nov. from the tropical western Atlantic. Phycologia 55 (5): 555-563.
Jensen, A. 1993. Present and future needs for algae and algal products. Phycologia 260/261:15-23. [ Links ]
Joly, A. 1965. Flora marinha do litoral norte do Estado de Sao Paulo e regioes circunvizinhas. Bol. Fac. Fil. Cs. Letr.Univ. Sao Paulo, 294. Botanica 21:1-393. [ Links ]
Kapraun, D. 1980. An illustred guide to the benthic ma- rine algae of coastal North Carolina. I. Rhodophyta. Univ. of North Carolina Press. 206 p. [ Links ]
Lemus, A. & E. Ganesan. 1977. Morphological and cul- ture studies two species of Predaea G. De Toni (Rhodophyta, Gymmophlaeceae) from the Caribbe- an Sea. Bol. Inst. Oceanogr. Univ. Oriente 16 (1 y 2): 63-77. [ Links ]
Lemus, A. & M. Aponte. 1987. Estudios de biomasa y regeneración de algunos bancos naturales de aga- rofitas en el oriente de Venezuela. Bol. Inst. Ocea- nog. Univ. Oriente 26 (1 y 2): 37-44. [ Links ]
Lemus, A.; K. Bird; D.Kapraun & F. Kdehn. 1991. Agard yield, quality and standing crop biomass of Gelidium serrulatum, Gelidium floridanum and Pterocladia capillacea in Venezuela. Food Hydrocol. 5 (5): 469-479. [ Links ]
Loayza, R. 1994. Aspectos fenológicos, fases de desa- rrollo in vitro y características reologicas del agar de Gelidium serrulatum (Gelidiales, Rhodophyta). Tesis de Maestría, Univ. Oriente. Cumana, Vene- zuela. [ Links ]
Loayza, R. & A. Lemus. 1994. Fases de desarrollo in vitro del alga agarofita Gelidium serrulatum J. Agar- dh (Gelidiales, Rhodophyta). Bol. Inst. Oceanogr. Venezuela, Univ. Oriente 33 (1 y 2): 49-58. [ Links ]
Morris, I. 1967. An introduction to the algae. Hutchin- son & Co. London. 189 p. [ Links ]
Newton, L. 1931. A handbook of the British seaweeds. The Trustees of the British Museum. London. 478 p. [ Links ]
Norris, R. 1992. A proposed phylogenetic scheme for the Gelidiales. In Abbott, I. (ed.), Taxonomy of eco- nomic seaweeds: with reference to some Pacific and western Atlantic species, vol. III. Californis Sea Grant College Program, Univ. of California. La Jolla, Calif. 151-171. [ Links ]
Ponce-Márquez, E.; D. Rodríguez; N. López; L. Alba & Ma. Aguilar. 2009. Estudio citogenético de pobla- ciones mexicanas de Gelidium sclerophyllum (Geli- diales, Rhodophyta). Hidrobiológica, 19 (2): 85-93. [ Links ]
Pueschel, C. 1990. Cell structure. In Biology of the red algae, K. Cole & R. Sheath (eds.), pp. 7-41, Cam- bridge Univ. Press. [ Links ]
Rico, J. & M. Guiry. 1997. Life history and reproduction of Gelidium maggsiae sp. nov. (Rhodophyta, Geli- diales) from Ireland. Eur. J. Phycol. 32: 267–277. [ Links ]
Rodríguez, N. 1991. Estudios taxonómicos en agaro- fitas de Venezuela. I. Notas sobre el género Geli- dium Lamouroux (Rhodophyta, Gelidiales). Ernstia 1(1):5-20. [ Links ]
Rodríguez, H. & J. Espinosa. 1987. Variación de fases reproductivas de Gelidium robustum Gard. Holl: y Abbott en 7 mantos algales de la Península de Baja California, México. Invest. Mar. CICIMAR 3 (2): 79-86. [ Links ]
Rodriguez, D. & B. Santelices. 1987. Patterns of api- cal structure in the genera Gelidium and Ptero- cladia (Gelidiaceae, Rhodophyta). Hydrobiologia 151/152:199-203. [ Links ]
Rodriguez, D. & B. Santelices. 1988. Separation of Gelidium and Pterocladia on vegetative characters. In Taxonomic of economic seaweeds: with refer- ence to some Pacific and Caribbean species. Vol. 2, I. Abbott (ed.), pp.115-125. A Publication of the California Sea Grant Program, La Jolla, California. [ Links ]
Rodríguez, D. & G. Rivas-Lechuga. 1993. Arquitectura apical y estructura medular de Gelidium sclerophy- llum Taylor. Ficología: II Congreso Latinoamericano, la Reunión Iberoamericana, I Congreso Mexicano, 17-23 oct., 1993, México. [ Links ]
Rodriguez, D. & G. Rivas. 1995. Gelidium sclerophy- llum (Gelidiales: Gelidaceae): Evaluación de carac- teres para la segregación genérica. Rev. Biol. Trop. 44 (3)/45 (1): 305-310. [ Links ]
Rodríguez, J.; A. Guilarte; A. Velásquez-Boadas; E. Martínez-Véliz; E. Hernández & A. Marcano. 2016. Pterocladiella caerulescens (Kützin) San- telices & Hommersand (Rhodophyta), una nueva adición para la flora ficológica del estado Nueva Esparta (Venezuela). Saber, Universidad de Oriente, Venezuela. (28):4: 713-719. [ Links ]
Salinas, J. 1991. El proceso de refinación de Gelidium sesquipedle (Clem.) Born. et Thur. (Gelidiales, Rhodophyta). Bol. Inst. Esp. Oceanog. 7 (2): 3-58. [ Links ]
Santelices, B. 1976. Taxonomic and nomenclatural notes on some Gelidiales (Rhodophyta). Phycolo- gia 15 (2): 165-173. [ Links ]
Santelices, B. & S. Montalva. 1983. Taxonomic studies on Gelidiales (Rhodophyta) from central Chile. Phycologia 22 (2): 185-186. [ Links ]
Santelices, B. & J. Stewart. 1985. Pacific of Gelidium Lamouroux and other Gelidiales (Rhodophyta), with keys and descriptions to the common or eco- nomically important species. In Abbott, I.; Norris, J. (eds.), Taxonomy of economic seaweeds with references to some Pacific and Caribbean species. pp. 17-31. Univ. of California. [ Links ]
Santelices. B. 1988. Synopsis of biological date the seaweed genera Gelidium and Pterocladia (Rhodo- phyta). FAO Fish. Synop. 145:55. [ Links ]
Santelices, B. 1991. Variations in cystocarp structure in Pterocladia (Gelidiales: Rhoodophyta). Pacific Sc. 45 (1): 1-11. [ Links ]
Souza, F. & E. De Oliveira. 1990. Growth, in Vitro of the agar production seaweed Pterocladia capilla- cea (Rhodophyta, Gelidiaceae) under differences of ligth, temperature and nutrients. Rvta. Brasil Bot. 13:55-59. [ Links ]
Tanaka, K. & T. Naguro. 1960. Hihg resolution scan- ning electron microscopy of cell organells by a new specimen preparation method. Biomed. Res. 2(suppl.): 63-70. [ Links ]
Taylor, W.R. 1945. Pacific marine of the Allan Hancock Pacific Expedition to the Galapagos Islands. Allan Hancock Pacific Expeditions 12: 1-528 pp. [ Links ]
Velásquez, C. 1981. Estudios sobre bioecologia, eco- logía y composición química de la agarofita Pte- rocladia capillacea (Gmelin) Bornet & Thuret del oriente de Venezuela. Trabajo Grado Lic. Biol. Univ. Oriente. Cumaná, Venezuela. 100 p. [ Links ]
Recibido: 10-IV-2019;
Aceptado: 18-V-2019;
Publicado online: 15-VIII-19;
Publicado impreso: 31-VIII-2019