Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.2 Trujillo mayo/ago. 2019
http://dx.doi.org/10.22497/arnaldoa.262.26216
ARTÍCULOS ORIGINALES
Estudio comparativo del porcentaje de carbono entre especies de flora vascular de los Pantanos de Villa (Lima-Perú)
Comparative study of the percentage of carbon among species of vascular flora of the Pantanos de Villa (Lima-Peru)
Telassim Aldave & Héctor Aponte
Facultad de Ciencias Veterinarias y Biológicas, Carrera de Biología Marina, Universidad Científica del Sur. Lima, PERÚ. Autor para correspondencia: telassimaldave@gmail.com
Resumen
A pesar de que frecuentemente se utiliza 50% como medida del porcentaje de carbono (%C) en las plantas, este valor varía entre las diferentes formas de vida de las especies vegetales e incluso entre los órganos de una misma especie. Ajustar estos porcentajes es sumamente importante ya que el cambio en unidades puede llevar a variaciones considerables en el cálculo de los stocks de carbono. Se tuvo como objetivo comparar los %C entre 15 especies de flora vascular. El área de estudio fue el Refugio de Vida Silvestre Pantanos de Villa (Lima, Perú). Se colectaron muestras completas (tallo, raíz y hojas, según aplique) por especie y se analizaron siguiendo el método de Walkley y Black. Se comparó el %C separando las plantas en tres grupos: a) suculentas, b) acuáticas flotantes y c) hierbas anfibias. Se hallaron diferencias (p < 0.05) entre los %C de los grupos de plantas suculentas (33,77% ± 7,05), acuáticas flotantes (39,25% ± 11,76) y hierbas anfibias (48,97% ± 9,32). Se evidenció la variabilidad entre los %C de las especies de flora vascular más abundantes de los Pantanos de Villa; encontrando que las plantas suculentas y acuáticas flotantes presentan menores valores que las hierbas anfibias.
Palabras clave: carbono, flora, humedales, plantas acuáticas.
Abstract
Although 50% is frequently used as a measure of the percentage of carbon (%C) in plants, this value varies between the different life forms of plant species and even between the organs of the same species. Adjusting these percentages is extremely important since the change in units can lead to considerable variations in the calculation of carbon stocks. The objective was to analyze the %C among 15 species of vascular flora, verifying the variability. The study area was the Pantanos de Villa Wildlife Refuge (Lima, Peru). Complete samples (stem, root and leaves, as applicable) were collected per species and analyzed following the Walkley and Black method. The %C was compared by separating the plants into three groups: a) succulents, b) free floating aquatic plants and c) amphibian plants. Differences (p < 0.05) were found among the %C of the groups of succulent (33.77% ± 7.05), free floating aquatic plants (39.25% ± 11.76) and amphibian plants (48.97% ± 9.32). The variability among %C of the most abundant vascular flora species of the Pantanos de Villa was evidenced; finding that succulent and free floating aquatic plants have lower values than amphibian plants.
Keywords: carbon, flora, wetlands, aquatic plants.
Introducción
Actualmente, el cambio climático está causando serias repercusiones en la vida de las personas; algunos de estos impactos se han podido apreciar con temperaturas cada vez más extremas, inundaciones más frecuentes, problemas de salud en ciertas regiones del planeta e inclusive un potencial deterioro en la seguridad alimentaria de los pueblos (Chivian & Bernstein, 2008). Por estas razones, proteger los stocks de carbono del planeta y cuantificarlos apropiadamente es una necesidad. Evaluar el porcentaje de carbono (%C) en las especies vegetales es parte de esta cuantificación. El valor del 50% es ampliamente utilizado como contenido de carbono en la biomasa vegetal (De Vries et al., 2006; Keith et al. 2009; Lewis et al. 2009; Saatchi et al. 2011; Zhu et al., 2015, Zhu et al., 2017) sin embargo, se ha reportado cómo este porcentaje puede ser mayor o menor dependiendo de la especie y su forma de vida (Ma et al., 2018). Estos ajustes son sumamente importantes ya que el cambio en unidades de este porcentaje puede llevar a variaciones considerables en el cálculo de los stocks (por ejemplo, un cambio de 1% conllevaría a una variación de 7 petagramos de carbono (PgC) en la estimación total del carbono mundial, que es casi equivalente a la mitad del carbono total de la vegetación de los Estados Unidos; Martin et al., 2013). Conocer la cantidad de carbono almacenado en las especies de flora permite reducir esta incertidumbre en las estimaciones (Jones & O’hara, 2012; Pelluso-Rodrigues et al., 2014; Wu et al., 2017).
En Perú, algunos estudios consideran esta variación en el %C para el cálculo de los stocks (por ejemplo, Concha et al., 2007; Lapeyre et al., 2004), mientras que otros no (Málaga et al., 2014; Timoteo et al., 2016; Zavala et al., 2018). Para los humedales costeros, la situación es similar, con trabajos que consideran (por ejemplo Hidalgo et al., 2011; Palomino-Contreras & Cabrera-Carranza, 2007; Pérez-Pinedo et al., 2015) o no (Hidalgo et al., 2011) esta variación .
Con la finalidad de aportar con los valores del contenido de carbono de las especies vegetales representativas de la costa central del Perú, el presente trabajo tuvo como objetivo evaluar el %C en las especies de flora vascular más abundantes de los Pantanos de Villa, un sitio Ramsar de Lima Metropolitana, que posee especies representativas de los humedales costeros de la región.
Materiales y métodos
Área de estudio
El estudio se realizó en el Refugio de Vida Silvestre los Pantanos de Villa (RVSPV), el cual es un sitio Ramsar ubicado en el distrito de Chorrillos (Lima-Perú) en las coordenadas 12°12’S, 076°59’O. El RVSLPV es un humedal costero que abarca un área de 263,27 ha que está compuesta principalmente por totorales, gramadales, juncales y carrizales (Aponte & Cano, 2013).
Especies estudiadas
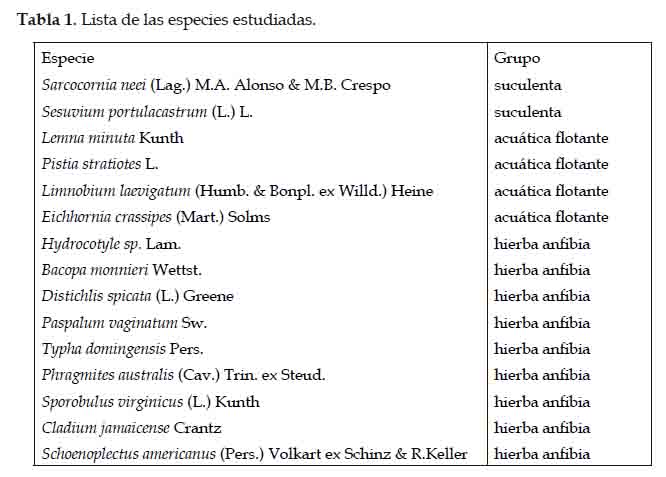
Se seleccionaron las especies de mayor abundancia, determinadas como especies que dominan las formaciones vegetales de los Pantanos de Villa y otros humedales de la región (Aponte & Cano, 2013; Aponte et al., 2018) siendo un total de 15 especies que incluyen plantas suculentas (2), acuáticas flotantes (4) y hierbas anfibias (9) (Tabla 1).
Colecta de muestras
La colecta de muestras se realizó en la estación de invierno (julio-noviembre) del 2018 contando con la autorización R. J. 001-2018-SERNANP-JEF salvo para L. laevigatum y las especies T. domingensis, P. australis, C. jamaicense y S. americanus las cuales han venido siendo analizadas en estudios sobre modelamiento del carbono (Aponte, 2017) e incendios (Vargas, datos no publicados 2015) que nos han permitido conocer sus valores de %C. Se colectaron 3 muestras de 300 g por especie para realizar los análisis del %C. Las muestras estuvieron compuestas por todos los órganos de cada especie vegetal (tallo, raíz, rizoma y hojas, según aplique).
Procesamiento de las muestras
Las muestras fueron llevadas al Laboratorio de Oceanografía de la Universidad Científica del Sur, donde se secaron en una estufa a 75 ºC por un periodo de 24 a 48 horas (hasta conseguir un peso constante).
El %C se obtuvo siguiendo el método de Walkley & Black (1934), proceso que se llevó a cabo en el Laboratorio de Análisis de Suelos, Plantas, Agua y Fertilizantes (LASPAF) de la Universidad Nacional Agraria La Molina.
Análisis estadístico
Se comparó el %C separando las plantas en tres grupos: a) hierbas suculentas, b) acuáticas flotantes y c) hierbas anfibias. Se verificó la normalidad utilizando la prueba de Shapiro Wilk. Al no presentar todos los grupos una distribución normal (p<0.05 en algunos casos) los datos se analizaron con la prueba no paramétrica de Kruskall Wallis y se compararon posteriormente con la prueba de Mann-Whitney. Los resultados se expresaron en promedio ± coeficiente de variación. Todo el análisis estadístico se realizó con el software PAST 3.22 (Hammer et al., 2001).
Resultados
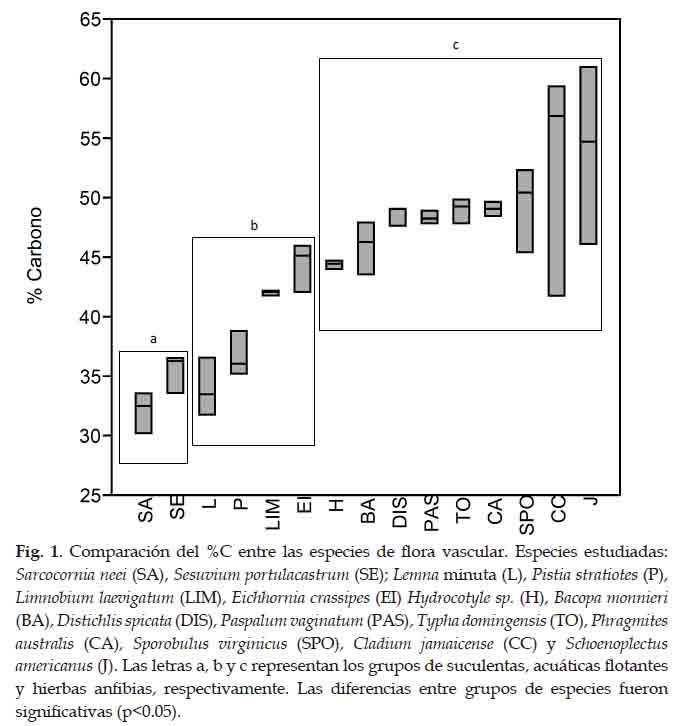
Se hallaron diferencias significativas del %C entre los grupos de plantas suculentas, acuáticas flotantes y hierbas anfibias (p<0.05). Los %C de las plantas suculentas, acuáticas flotantes y hierbas anfibias fueron de 33,77% ± 7,05; 39,25% ± 11,76 y 48,97% ± 9,32, respectivamente. Los %C más alto y más bajo fueron encontrados en las especies S. neei y S. americanus (las cuales tuvieron 32,08% ± 5,32 y 53,93% ± 13,85, respectivamente) (Fig. 1).
Discusión
Los resultados obtenidos en el presente trabajo muestran la variabilidad del %C en las especies estudiadas, encontrando diferencias entre los grupos comparados. Una de las explicaciones de esta variabilidad está ligada al hecho de que algunas especies requieren inversiones mayores de carbono a nivel celular para sintetizar fibras (puntualmente lignina), fenómeno que se ha evidenciado en una gran cantidad de especies de diferentes formas de vida (Ma et al., 2018) y en particular en especies arbóreas (Lamlom & Savidge, 2003). La lignina, que es necesaria para la formación de estructuras de soporte, tarda más tiempo en ser sintetizada en comparación a los demás componentes químicos de las fibras vegetales; por esta razón, plantas más maduras tienen más fibras (Buxton & Redfearn, 1997) y, en consecuencia, más lignina (y más %C en su biomasa). Asimismo, las especies de baja tasa de crecimiento relativo (por tomar más tiempo en crecer y con ello tener más tiempo para producir fibras), incrementan los niveles de lignina y en consecuencia tienen un mayor %C (Armstrong et al., 1950; Johnson et al., 2007; Wu et al., 2017) con alguna excepción (por ejemplo, para E. crassipes, se reporta la disminución de la producción de fibras con bajas tasas de crecimiento; verano, Tucker & Debusk, 1981). Esto explicaría el por qué especies de rápido crecimiento (como las acuáticas flotantes evaluadas en el presente estudio, Aponte & Pacherres, 2013; Mkandawire & Dudel, 2007; Reddy & Debusk, 1984)2013; Mkandawire & Dudel, 2007; Reddy & Debusk, 1984 presentan menos %C que las de crecimiento lento (como especies caducifolias y perennifolias, Antúnez et al., 2001; Ruiz-Robleto & Villar, 2005); también explicaría el por qué las plantas de los humedales costeros, como el evaluado, tienen en promedio un %C menor al 50% (más del 90% de las especies de los humedales de la costa central del Perú son hierbas; muchas tienen comportamiento invasivo y rápido crecimiento, Aponte & Cano, 2013). Los resultados obtenidos muestran la necesidad de medir el %C cada vez que quiera trabajarse con comunidades vegetales específicas, lo cual concuerda con estudios previos (Jones & O’hara, 2012; Pelluso-Rodrigues et al., 2015; Wu et al., 2017).
Existen diversos estudios que detallan las variaciones del %C entre los órganos de la planta (Alriksson & Eriksson, 1998; Bert & Danjon, 2006; Yao et al., 2015), las formas de vida (Tolunay, 2009; Fang et al., 2010), la ubicación geográfica, el clima, las condiciones del suelo (Pettersen, 1984) e incluso a través de los individuos (Elias & Potvin, 2003; Uri et al., 2012; Martin et al., 2013). Nuestros resultados contribuyen al conocimiento de esta variación, en plantas de las que anteriormente no se conocían los %C. Esto permitirá mejorar las estimaciones del almacenamiento de carbono en los humedales de la zona costera del Perú y facilita los datos para quienes trabajen en la medición de stocks en estos ecosistemas (y con ello posibilitar una valoración ecosistémica eficiente).
Agradecimientos
El presente estudio se desarrolló en el marco del proyecto "Estimación y valoración del stock de carbono del Refugio de Vida Silvestre Pantanos de Villa (Lima-Perú)" el cual fue financiado por la Dirección General de Investigación, Desarrollo e Innovación de la Universidad Científica del Sur a quienes quedamos muy agradecidos. Agradecemos también al Servicio Nacional de Áreas Naturales Protegidas por el Estado (SERNANP) y a la Autoridad Municipal de los Pantanos de Villa (PROHVILLA) por los permisos brindados. El presente estudio formó parte del trabajo de investigación de T.A. para la obtención de su grado de bachiller.
Contribución de los autores: T. A.: Planificación, análisis y ejecución del proyecto; así como, redacción del manuscrito. H. A.: Planificación y análisis del proyecto; así como, redacción del manuscrito.
Conflictos de intereses: Los autores declaran no tener conflictos de intereses.
Literatura citada
Alriksson, A. & H. M. Eriksson. 1998. Variations in mineral nutrient and C distribution in the soil and vegetation compartments of five temperate tree species in NE Sweden. Forest Ecology and Management 108: 261–273. https://doi.org/10.1016/S0378-1127(98)00230-8
Antúnez, I.; E. C. Retamosa & R. Villar. 2001. Relative growth rate in phylogenetically related deciduous and evergreen woody species. Oecologia 128:172-180. http://doi.org/10.1007/s004420100645
Aponte, H. 2017. Productividad de Limnobium laevigatum (Hydrocharitaceae) bajo condiciones de laboratorio. Polibotánica 44: 157-166. http://doi.org/10.18387/polibotanica.44.12. [ Links ]
Aponte, H.; D. Ramírez & G. Lértora. 2018. Los Pantanos de Villa: Un Oasis de Vida en Lima Metropolitana. Fondo Editorial de la Universidad Científica del Sur, Lima.
Aponte, H. & A. Cano. 2013. Estudio florístico comparativo de seis humedales de la costa de Lima (Perú): actualización y nuevos retos para su conservación. Revista Latinoamericana de Conservación 3: 13.
Aponte, H. & C. O. Pacherres. 2013. Growth and propagation of Limnobium laevigatum (Hydrocharitaceae) under different nutrient concentrations. The Biologist 11: 10.
Armstrong, D. G.; H. Cook & B. Thomas. 1950. The lignin and cellulose contents of certain grassland species at different stages of growth. The Journal of Agricultural Science 40: 93. http://doi.org/10.1017/s002185960004555x
Bert, D. & F. Danjon. 2006. Carbon concentration variations in the roots, stem and crown of mature Pinus pinaster (Ait.). Forest Ecology and Management 222: 279–295. http://doi.org/10.1016/j.foreco.2005.10.030
Buxton, D. R. & D. D. Redfearn. 1997. Plant Limitations to Fiber Digestion and Utilization. The Journal of Nutrition 127: 814S-818S. http://doi.org/10.1093/jn/127.5.814S
Chivian, E. & A. Bernstein. 2008. Sustaining Life. Oxfors University Press, New York.
Concha, J. Y.; J. C. Alegre & V. Pocomucha. 2007. Determinación de las reservas de carbono en la biomasa aérea de sistemas agroforestales de Theobroma cacao L. en el departamento de San Martín, Perú. Ecología Aplicada 6: 75–82. http://www.scielo.org.pe/pdf/ecol/v6n1-2/a09v6n1-2.pdf
De Vries, W.; G. J. Reinds; P. Gundersen & H. Sterba. 2006. The impact of nitrogen deposition on carbon sequestration in European forests and forest soils. Global Change Biology 12: 1151–1173. https://doi.org/10.1111/j.1365-2486.2006.01151.x
Elias, M. & C. Potvin. 2003. Assessing inter- and intra- specific variation in trunk carbon concentration for 32 neotropical tree species. Canadian Journal of Forest Research 33: 1039–1045. http://doi.org/10.1139/x03-018
Fang, S.; H. Li; Q. Sun & L. Chen. 2010. Biomass production and carbon stocks in poplar-crop intercropping systems: a case study in northwestern Jiangsu, China. Agroforestry Systems 79: 213–222. http://doi.org/10.1007/s10457-010-9307-x
Hammer, O.; D.A.T. Harper D.A.T. & P. D Ryan. 2001. PAST: Paleontological Statistics Software package for education and data analysis. Palaeontologia Electronica 4: 9.
Hidalgo-C, P.; P. Espinoza-T & E. Tuya-C. 2011 Cuantificación de las reservas de carbono del humedal de Yanayacu-Cátac, Ancash-Perú, 2011. Rev. Aporte Santiaguino 5: 33 -40. http://doi.org/10.32911/as.2012.v5.n2.551
Johnson, J. M. F.; N. W. Barbour & S. L. Weyers. 2007. Chemical Composition of Crop Biomass Impacts Its Decomposition. Soil Science Society of America Journal 71: 155. http://doi.org/10.2136/sssaj2005.0419
Jones, D. A. & K. L. O’hara. 2012. Carbon density in managed coast redwood stands: implications for forest carbon estimation. Forestry 85: 99–110. https://doi.org/10.1093/forestry/cpr063
Keith, H.; B. G. Mackey & D. B. Lindenmayer. 2009. Reevaluation of forest biomass carbon stocks and lessons from the world’s most carbon-dense forests. Proceedings of the National Academy of Sciences 106: 11635–11640. https://doi.org/10.1073/pnas.0901970106
Lamlom, S. H. & R. A. Savidge. 2003. A reassessment of carbon content in wood: variation within and between 41 North American species. Biomass and Bioenergy 25: 381–388. http://doi.org/10.1016/S0961-9534(03)00033-3.
Lapeyre, T., Alegre J. & L. Arévalo. 2004. Determinación de las reservas de carbono de la biomasa aérea, en diferentes sistemas de uso de la tierra en San Martín, Perú. Ecología Aplicada 3: 35–44. http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-22162004000100006
Lewis, S. L.; G. Lopez-Gonzalez; B. Sonké; K. Affum- Baffoe; T. R. Baker; L. O. Ojo; O. L. Phillips; J. M. Reitsma; L. White; J. A. Comiskey; K. M. N. Djuikouo; C. E. Ewango; T. R. Feldpausch; A. C. Hamilton; M. Gloor; T. Hart; A. Hladik; J. Lloyd; J. C. Lovett; J. R. Makana; Y. Malhi; F. M. Mbago; H. J. Ndangalasi; J. Peacock; K. S. Peh; D. Sheil; T. Sunderland; M. D. Swaine; J. Taplin; D. Taylor; S. C. Thomas; R. Votere & H. Wöll. 2009. Increasing carbon storage in intact African tropical forests. Nature 457: 1003–1006. http://doi.org/10.1038/nature07771
Ma, S.; F. He; D. Tian; D. Zou; Z. Yan; Y. Yang; T. Zhou; K. Huang; H. Shen & J. Fang. 2018. Variations and determinants of carbon content in plants: a global synthesis. Biogeosciences 15: 693–702. https://doi.org/10.5194/bg-15-693-2018
Málaga, N.; R. Giudice; C. Vargas & E. Rojas. 2014. Estimación de los contenidos de carbono de la biomasa aérea en los bosques de Perú. Ministerio del Ambiente, Perú. http://www.bosques.gob.pe/archivo/7220e0_libro_carbono.pdf
Martin, A. R.; S. C. Thomas & Y. Zhao. 2013. Size- dependent changes in wood chemical traits: a comparison of neotropical saplings and large trees. AoB PLANTS 5: plt039. http://doi.org/10.1093/aobpla/plt039
Mkandawire, M. & E. G. Dudel. 2007. Are Lemna spp. Effective Phytoremediation Agents? Bioremediation. Biodiversity and Bioavailability 1: 56–71. http://www.globalsciencebooks.info/Online/GSBOnline/images/0706/BBB_1(1)/BBB_1(1)56-71o.pdf
Palomino-Contreras, D. & C. Cabrera-Carranza. 2007. Estimación del servicio ambiental de captura del CO en la flora de los humedales de Puerto Viejo. Revista del Instituto de Investigaciones FIGMMG 10: 49–59.
Pelluso-Rodrigues, D.; C. Hamacher; G. C. Duque-Estrada & M. L. Gomes-Soares. 2014. Variability of carbon content in mangrove species: Effect of species, compartments and tidal frequency. Aquatic Botany 120: 346–351. http://dx.doi.org/10.1016/j.aquabot.2014.10.004
Pérez-Pinedo, H.; E. Luccini; L. Herrera; M. Parodi; M. Matar; L. Barrea; M. Mechni & E. Masramón. 2015. Cuantificación de la captura de CO por la flora nativa de totora en un humedal costero en Perú. Energeia 13: 9. http://bibliotecadigital.uca.edu.ar/repositorio/revistas/cuantificacion-captura-co2-flora-nativa.pdf
Pettersen, R. C. 1984. The Chemical Composition of Wood. The Chemistry of Solid Wood 57–126. http://doi.org/10.1021/ba-1984-0207.ch002. [ Links ]
Reddy, K. R. & W. F. Debusk. 1984. Growth characteristics of aquatic macrophytes cultured in nutrient-enriched water: I. Water hyacinth, water lettuce, and pennywort. Economic Botany 38: 229–239. http://doi.org/10.1007/BF02858838.
Ruiz-Robleto, J. & R. Villar. 2005. Relative growth rate and biomass allocation in ten woody species with different leaf longevity using phylogenetic independent contrasts PICs. Plant Biology 7: 484-494. https://doi.org/10.1055/s-2005-865905.
Saatchi, S. S.; N. L. Harris; S. Brown; M. Lefsky; E. T. A. Mitchard; W. Salas; B. R. Zutta; W. Buermann; S. L. Lewis; S. Hagen; S. Petrova; L. White; M. Silman & A. Morel. 2011. Benchmark map of forest carbon stocks in tropical regions across three continents. Proceedings of the National Academy of Sciences 108: 9899–9904. http://doi.org/10.1073/pnas.1019576108
Timoteo, K.; J. Remuzgo; L. Valdivia; F. Sales-Dávila; D. García-Soria & C. Abanto-Rodriguez. 2016. Estimación del carbono almacenado en tres sistemas agroforestales durante el primer año de instalación en el departamento de Huánuco. Folia Amazónica 25: 45–54. https://doi.org/10.24841/fa.v25i1.382
Tolunay, D. 2009. Carbon concentrations of tree components, forest floor and understorey in young Pinus sylvestris stands in north-western Turkey. Scandinavian Journal of Forest Research 24: 394–402. https://doi.org/10.1080/02827580903164471. [ Links ]
Tucker, C. S. & T. A. Debusk. 1981. Seasonal growth of Eichhornia crassipes (Mart.) solms: Relationship to protein, fiber, and available carbohydrate content. Aquatic Botany 11: 137–141. https://doi.org/10.1016/0304-3770(81)90055-3
Uri, V.; M. Varik; J. Aosaar; A. Kanal; M. Kukumägi & K. Lõhmus. 2012. Biomass production and carbon sequestration in a fertile silver birch (Betula pendula Roth) forest chronosequence. Forest Ecology and Management 267: 117–126. http://doi.org/10.1016/j.foreco.2011.11.033
Walkley, A. & I. A. Black. 1934. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method. Soil Science 37: 29–38. http://dx.doi.org/10.1097/00010694-193401000-00003
Wu, H.; W. Xiang; X. Fang; P. Lei; S. Ouyang & X. Deng. 2017. Tree functional types simplify forest carbon stock estimates induced by carbon concentration variations among species in a subtropical area. Scientific Reports 7: 4992. http://doi.org/10.1038/s41598-017-05306-z. [ Links ]
Yao, F.; Y. Chen; Z. Yan; P. Li; W. Han & J. Fang. 2015. Biogeographic Patterns of Structural Traits and C:N:P Stoichiometry of Tree Twigs in China’s Forests. PLoS ONE 10: e0116391. https://doi.org/10.1371/journal.pone.0116391
Zavala, W.; E. Merino & P. Peláez. 2018. Influencia de tres sistemas agroforestales del cultivo de cacao en la captura y almacenamiento de carbono. Scientia Agropecuaria 9: 493–501. http://dx.doi.org/10.17268/sci.agropecu.2018.04.04
Zhu, J.; H. Hu; S. Tao; X. Chi; P. Li; L. Jiang; C. Ji; J. Zhu; Z. Tang; Y. Pan; R. A. Birdsey; X. He & J. Fang. 2017. Carbon stocks and changes of dead organic matter in China’s forests. Nature Communications 8: 151. http://doi.org/10.1038/s41467-017-00207-1
Zhu, J.; X. Hu; H. Yao; G. Liu; C. Ji & J. Fang. 2015. A significant carbon sink in temperate forests in Beijing: based on 20-year field measurements in three stands. Science China Life Sciences 58: 1135–1141. http://doi.org/10.1007/s11427-015-4935-z
Recibido: 11-IV-2019
Aceptado: 17-V-2019
Publicado online: 15-VIII-2019
Publicado impreso: 31-VIII-2019.