Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.3 Trujillo set./dic. 2019
http://dx.doi.org/10.22497/arnaldoa.263.26305
ARTÍCULOS ORIGINALES
Efecto del estrés salino en el crecimiento y contenido relativo del agua en las variedades IR-43 y amazonas de Oryza sativa "arroz" (Poaceae)
Effect of salinity stress in growth and relative water content in Oryza sativa "rice", var. IR-43 and amazonas (Poaceae)
Nixer Deinerk Rodríguez Ledesma1, Cinthya Noelia Torres Sevillano1, Mercedes Elizabeth Chaman Medina1, José Ernesto Manuel Hidalgo Rodríguez2
1 Laboratorio de Fisiología Vegetal Universidad Nacional de Trujillo, PERÚ. deinerk_1490@hotmail.com, cntorres@gmail.com , elizchm@yahoo.com
2 Escuela de Medicina Humana, Universidad Privada Antenor Orrego, PERÚ. jemhidalgor@gmail.com
Resumen
Oryza sativa L. "arroz" (Poaceae) es uno de los cereales más importantes a nivel mundial. Sin embargo, su cultivo puede ser drásticamente afectado por el estrés salino. El objetivo de este trabajo fue determinar efecto del estrés salino sobre la Tasa Absoluta de Crecimiento (TCA) y el Contenido Relativo de Agua (CRA) de las variedades IR-43 y amazonas de "arroz". Para lo cual, plántulas homogéneas fueron sometidas en solución hidropónica La Molina® y dispuestas en un diseño factorial. Las plántulas de 16 días fueron sometidas a soluciones NaCl de 0, 100, 150 y 200 mM para determinar la CRA y TCA a los 8 días de tratamiento. El estrés salino afectó de forma significativa las variables evaluadas. IR-43 fue la variedad más afectada al mostrar 12,46 y 19,04 mm/día de TCA de vástago y raíz respectivamente, bajo NaCl 200 mM; mostrando 73,35% de CRA al ser estresada con 100 mM. La variedad amazonas mostró mayor tolerancia a estrés salino, con TCA de 21,25 mm/día en vástago y 22,54 mm/día en raíz, bajo 200 mM de NaCl, mostrando CRA de 78,47% al ser tratada con NaCl 100 mM. La disminución en el crecimiento podría deberse a cambios en el estado hídrico celular y a disturbios en la toma y translocación de nutrientes causados por el estrés osmótico. Las diferencias en la respuesta al estrés salino de ambas variedades de arroz, muestran ventajas en el reajuste osmótico y regulación restablecer y mantener la homeostasis celular de la var. amazonas sobre IR-43.
Palabras clave: estrés salino, "arroz", crecimiento, CRA, TCA.
Abstract
Oryza sativa L. "rice" (Paceae) is one the most important crops worldwide. However, it is drastically affected by salinity. Therefore, the objective of this research was to determine the effect of salinity over the absolute growth rate (AGR) and the relative water content (RWC) of rice varieties IR-43 and amazonas. "Rice" seedlings were grown in hydroponic conditions with nutritive solution La Molina® and arranged in a factorial design. 16-day plantlets were treated with NaCl solutions 0, 100, 150 and 200 mM to determine AGR and RWC at 8-day-treatment. Salinity stress affected both variables. IR-43 was more affected when treated with 200mM NaCl, showing AGR of 12.46 and 19.04 mm/day in shoots and roots respectively; when treared with 100 mM, RWC was 73.35%. The Amazonas variety had more tolerance to salinity, with AGRs of 21.25 and 22.54 mm/day in shoots and roots treated with 200mM NaCl, respectively; and RWC was 78.47% at 100mM. The reduction in growth could be caused by changes in cell water state caused by salinity and changes in nutrient and water uptake. The differences in stress response to salinity in both rice varieties showed advantages in osmotic adjustment and regulation to maintain cell homeostasis of Amazonas over IR-43 rice varieties.
Keywords: salinity stress, "rice", growth, RWC, AGR.
Introducción
El "arroz" Oryza sativa (Poaceae) es uno de los cultivos más importante en el mundo, se produce en 113 países y es el alimento básico de más de la mitad de la población mundial proporcionando el 27% de la energía alimentaria y el 20% de las proteínas (FAO, 2018; Juliano, 1991; Lasse, 1991). En el 2005, la superficie mundial cultivada de "arroz" fue de 156 millones de hectáreas, con una producción de 628 millones de toneladas. Para el mismo año, China fue el responsable de 28,9% de la producción lo cual lo ubica en el primer lugar, seguido por India e Indonesia con 20,8% y 8,6% respectivamente (FAO, 1997). En América Latina y el Caribe, se cultivaron en el mismo año 6,7 millones de hectáreas, con una producción total de 26,4 millones de toneladas, siendo los principales países productores: Brasil con 49,7% de la producción, seguido por Colombia (9,8%), Perú (9,3%), Argentina (3,9%) y Venezuela (3,6%) (FAO et al., 2018).
Todos los organismos vivos están expuestos a diferentes tipos de estreses, los cuales pueden ser originados por la actividad del hombre o causas naturales como la contaminación del aire, sequía, temperatura, intensidad luminosa y limitaciones nutricionales (Chang & Loresto, 1986; Chinnusamy & Zhu, 2003). Debido a que las plantas poseen limitados mecanismos para evitar el estrés, estas han desarrollado flexibles vías para adaptarse a los cambios medioambientales (Zhu, 2001).
La salinidad de los suelos precede al origen de la civilización humana y continúa siendo en la actualidad el mayor estrés abiótico que perjudica la productividad y calidad de las cosechas (Ingram & Yambao, 1988). Aproximadamente el 20% del área cultivada a nivel mundial y cerca de la mitad de las tierras irrigadas son afectadas por este factor (Hasegawa et al., 2000). El estrés salino es uno de los factores que mayores daños ocasiona en el crecimiento, desarrollo y rendimiento de los cultivos (Lascano et al., 2001). Especialmente, en arroz, este factor es la limitante principal de su productividad (Jamil et al., 2007).
Los suelos salinos se caracterizan por presentar niveles tóxicos de cloruro de sodio y sulfato de sodio. Los valores de conductividad eléctrica en extractos saturados de suelo salino oscilan alrededor de 4.0 dS/m (≈ 40 mM NaCl; Marschner, 2012).
Las cantidades excesivas de sal en el suelo afectan de manera adversa el crecimiento y desarrollo de las plantas. Procesos biológicos como la germinación de la semilla y su vigor, crecimiento vegetativo, floración y desarrollo del fruto son afectados por las altas concentraciones de sales (Ren et al., 2005).
La salinidad puede causar dos clases de estrés en los tejidos de las plantas: osmótico e iónico. El estrés osmótico se presenta cuando el aumento de sales en la solución del suelo ocasiona disminución de los potenciales hídrico y osmótico del suelo, lo cual se refleja en el estado hídrico de la planta o contenido relativo de agua (CRA); es decir, la planta tiende a perder agua, por lo que la planta debe mantener un potencial hídrico más negativo que el sustrato para asegurar la absorción de agua (Alfonso, 1998; Bartels & Ramanjulu, 2005). El estrés iónico está asociado con altas relaciones Na+/K+ y Na+/Ca+2 y la acumulación de Na+ y Cl- en los tejidos, lo cual es dañino para el metabolismo general de las células (Chaman, 2007). Puede inhibir el crecimiento de las plántulas debido a la toxicidad iónica para una variedad de procesos metabólicos, incluyendo enzimas que participan en la fotosíntesis, deficiencia en la nutrición mineral (Buchanan et al., 2000).
Como resultado del estrés salino, las plantas pueden responder con un amplio rango de respuestas fisiológicas a nivel molecular, celular y de organismo. Estas incluyen, por ejemplo, cambios en el desarrollo y la morfología de las plantas (inhibición del crecimiento apical, incremento en el crecimiento de las raíces y cambios en el ciclo de vida), ajuste en el transporte iónico (concentración, expulsión y secuestro de iones) y cambios metabólicos (metabolismo del carbono y la síntesis de solutos compatibles; Hasegawa et al., 2000). Así también, para mantener el estado hídrico, las acuaporinas, proteínas canales de membrana (PIP) juegan un papel dinámico clave en el control del movimiento del agua en las células de la raíz y las proteínas TIP a nivel del tonoplasto, son las responsables del control del agua transcelular, para restablecer y mantener la homeostasis celular de los cambios en el potencial osmótico celular ocasionado por las sales (Azevedo et al., 2004; Bartels & Ramanjulu, 2005). Además, está bien establecido la inducción de una señal (ABA) en la raíz la cual alcanza las hojas gracias a la transpiración para inducir el cierre de estomas, reduciéndose así la pérdida de agua. (Wilkinson & Davies, 2002). Actualmente, se desconoce la respuesta fisiológica de las variedades IR-43 y Amazonas al estrés por salinidad, por lo cual, el objetivo del presente trabajo fue determinar el efecto del estrés salino en la tasa de crecimiento absoluto y el contenido relativo del agua en las variedades IR-43 y amazonas de Oryza sativa "arroz" (Poaceae) sometidas a 8 días de estrés salino con NaCl en condiciones de invernadero.
Materiales y Métodos
Diseño experimental:
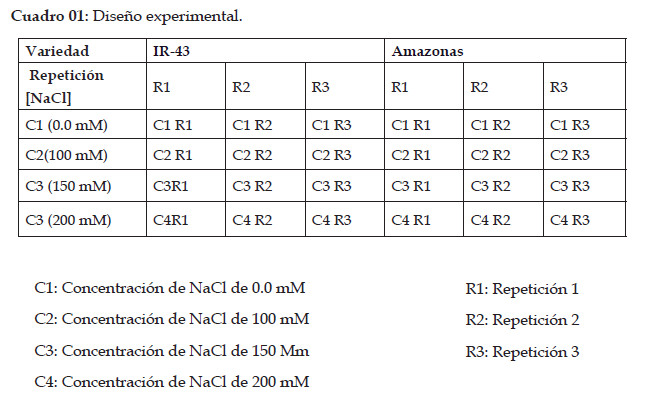
Se utilizó un diseño completamente al azar, con un arreglo factorial de 2x4 (2 variedades de arroz x 4 concentraciones de NaCl: 0 mM; 100 mM; 150 Mm y 200 mM de NaCl). En cada tratamiento se utilizaron 30 plántulas para cada unidad experimental, además se realizaron 3 repeticiones para cada tratamiento (Cuadro 1).
Selección y preparación del material biológico:
Para cada variedad de Oryza sativa "arroz" se seleccionaron 270 semillas, teniendo en cuenta la uniformidad de estas en cuanto a su tamaño, color y peso. Luego se procedió a realizar una desinfección de las semillas sumergiéndolas en una solución de hipoclorito de sodio al 2% durante 10 minutos, seguidamente fueron lavadas con agua de caño y agua destilada.
Acondicionamiento del material biológico:
Una vez desinfectadas las semillas se procedió a distribuir 90 semillas por cada tratamiento de las cuales 30 semillas se colocaron en cada unidad experimental que estaba representada por cada taper de tecnopor, el cual fue acondicionado con una esponja y sobre esta una malla delgada de 0,2 cm de abertura, al taper junto con la esponja se perforo unos agujeros de 1 cm de diámetro y dentro de estos se colocó las 30 semillas de arroz previamente germinadas, una por cada agujero distribuidas equidistantemente unas de otras. Como medio nutritivo se utilizó la solución nutritiva La Molina, con la cual se rego 2 veces por semana a todos los tratamientos utilizando el mismo volumen, a partir del décimo día de germinadas las semillas.
Generación del estrés salino:
A los 16 días de haber instalado los tratamientos se procedió a generar un estrés salino agregando cloruro de sodio (NaCl) reactivo en las concentraciones de acuerdo al tratamiento: T1: 0 mM NaCl; T2: 100 mM NaCl; T3: 150 mM NaCl, y T4 200 mM de NaCl y se regó 2 veces durante los 8 días de tratamiento.
Recolección de datos:
Los parámetros morfométricos a analizar fueron medidos después de 8 días de haber realizado la inducción del estrés salino, es decir a los 24 días desde el inicio de la germinación de las semillas. Los parámetros evaluados fueron:
- Longitud de tallo: Se determinó la longitud del tallo utilizando una cinta métrica de 1 m con graduación en milímetros y se midió directamente el tallo o vástago.
- Longitud de raíz: Se determinó la longitud de la raíz utilizando una cinta métrica de 1 m con graduación en milímetros y se midió directamente la raíz.
- Determinación de la Tasa de Crecimiento Absoluto (TCA)
Tanto para la longitud del tallo como para la longitud de raíz, se tomó una medida inicial antes de aplicar el tratamiento y una medida una vez finalizado el tratamiento con las cuales se determinó la tasa de crecimiento absoluto para el vástago y para la raíz. Utilizando la siguiente fórmula:
TAC = (Xf-Xi)/t
Donde:
Xf = valor de la variable al final del tratamiento
Xi= valor de la variable al inicio del tratamiento
t= tiempo de permanencia de las plántulas en los tratamientos
- Determinación del contenido relativo del agua (CRA)
Para la determinación del CRA se utilizó la 2º hoja de cada plántula, estas fueron separadas de las plántulas después de 8 días de tratamiento con NaCl. Se registró el peso fresco (PF) de cada hoja tan pronto sea retirada de la planta, luego se registró el peso túrgido (PT) para lo cual las hojas fueron sumergidas en agua destilada por 24 horas. Seguidamente se procedió al secado de cada una de ellas en una estufa hasta que se obtuvo un peso constante (PS). El contenido relativo del agua se determinó de acuerdo a Kramer (1974), mediante la fórmula:
CRA=100x(PF-PS)/(PT-PS)
Análisis estadístico:
Los valores obtenidos serán analizados estadísticamente mediante un análisis de varianza (ANOVA) y se realizara una comparación de medias según la prueba de significación de Duncan, usando el paquete SPSS ver. 15.
Resultados
Tasa de Crecimiento Absoluto (TCA)
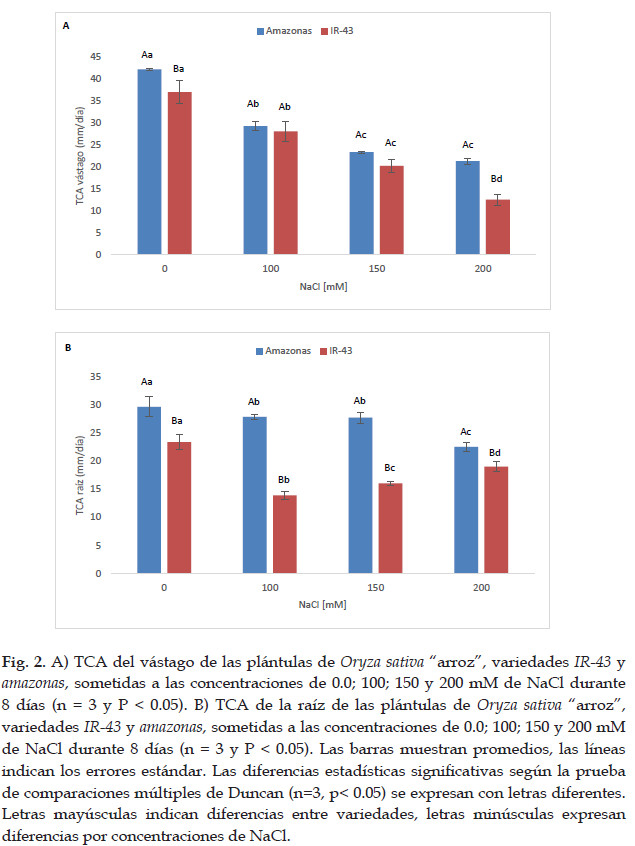
Las plántulas de Oryza sativa arroz variedad IR-43 y amazonas expuestas a diferentes concentraciones de NaCl durante 8 días, mostraron diferencias significativas (p< 0.05) en la tasa de crecimiento absoluto (TCA) tanto del vástago como de la raíz observándose una disminución en las dos variedades al aumentar la concentración de NaCl (Fig. 1 y 2). En la concentración de 100 y 150 mM de NaCl no se presentaron diferencias significativas para la TCA del vástago en las dos variedades. De la misma manera en la variedad Amazonas para la concentración de 150 y 200 mM de NaCl no se presentaron diferencias significativas para la TCA del vástago. Para la TCA de la raíz en la variedad Amazonas, no se presentaron diferencias significativas para las concentraciones de 100 y 150 mM de NaCl.
Contenido Relativo de Agua
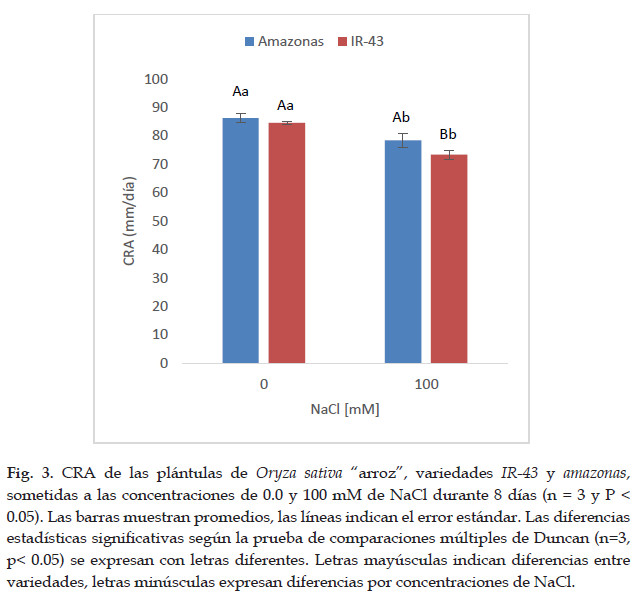
Las plántulas de Oryza sativa. variedad IR-43 y amazonas expuestas a diferentes concentraciones de NaCl, mostraron cambios en el contenido relativo de agua (CRA). Se observó disminución en el CRA en las dos variedades al aumentar la concentración de NaCl (Fig. 3). Las dos variedades analizadas no mostraron diferencias significativas (p < 0.05) en el CRA para el tratamiento control (0,0 mM de NaCl) a los 8 días del tratamiento, siendo sus valores de 86,22 % y 84,60 % para la variedad amazonas e IR-43 respectivamente. Sin embargo, a la concentración de 100 mM de NaCl hay diferencias significativas (p < 0.05) en el CRA para la variedad amazonas e IR-43 siendo sus valores de 78,47 % y 73,35 % respectivamente.
Discusión
En el presente trabajo se evaluó el efecto de estrés salino ocasionado por NaCl a diferentes concentraciones sobre el crecimiento de las plántulas de Oryza sativa "arroz" medido en su TCA y CRA. Se observó que, al incrementarse la intensidad del estrés, se encontró una reducción significativa de las TAC del vástago y de la raíz de las dos variedades (Fig. 2), debido al desbalance de iones específicos y el efecto toxico ocasionado por la excesiva acumulación de iones que depende de la variedad (Namuco, 1993). Así mismo, se observó una disminución del CRA, probablemente ocasionado por el estrés osmótico que produce el NaCl (Yang et al., 2004).
La salinidad puede inhibir el crecimiento de las plántulas debido a varios factores, incluyendo la toxicidad iónica para una variedad de procesos metabólicos, incluyendo enzimas que participan en la fotosíntesis, deficiencia en la nutrición mineral y cambios en las relaciones hídricas, siendo esto último un efecto similar al producido por la sequía (Sairam & Tyagi, 2004). El grado en el que cada uno de estos factores puede afectar el crecimiento depende del genotipo de la planta y de las condiciones ambientales.
Los principales iones salinos, Na+ y Cl-, pueden suprimir la absorción neta de nutrimentos debido a las interacciones competitivas iónicas (Kerkeb et al., 2001) o afectar la integridad de la membrana, altos niveles de Na+ a menudo indican deficiencias de K+ (Rus et al., 2001). La salinidad puede causar dos clases de estrés en los tejidos de las plantas: osmótico e iónico, siendo el primero similar al causado por la sequía, mientras que el último es a menudo asociado con altas relaciones Na+/K+ y Na+/Ca+2 y la acumulación de Na+ y Cl- en los tejidos, lo cual es dañino para el metabolismo general de las células (Gonzales & Cárdenas, 2001; Maser et al., 2002).
Bajo estrés salino, el mantenimiento de K+ citosólico y la homeostasis de la concentración intracelular de iones es aún más crucial. Sin embargo, las plantas en respuesta a la presencia de grandes concentraciones de sodio tienden a acumularlo y lo depositan en un gradiente a lo largo de su eje de crecimiento, con la mayor concentración depositada en las partes jóvenes de las hojas, donde es secuestrado dentro de la gran vacuola central de las células denominada célula vejiga (Gonzalez & García, 1997).
El aumento de sales en la solución del suelo ocasiona disminución de los potenciales hídrico y osmótico del suelo, lo cual se refleja en el estado hídrico de la planta (Lerch, 1974); es decir, la planta tiende a perder agua, por lo que la planta debe mantener un potencial hídrico más negativo que el sustrato para asegurar la absorción de agua (Buchanan et al., 2000). También ante esta situación, está bien establecido la inducción de una señal (ABA) en la raíz la cual alcanza las hojas gracias a la transpiración para inducir el cierre de estomas (Wilkinson & Davies, 2002), reduciéndose así la pérdida de agua.
El estado hídrico de una planta puede establecerse mediante la estimación del contenido relativo de agua (CRA). En el presente trabajo, se observó disminución del CRA en variedades IR-43 y amazonas cuando las plántulas crecieron en medios con diferentes concentraciones de NaCl. A diferencia de otras variedades, los diferentes valores del CRA observados a la concentración de 100 mM en las dos variedades de arroz analizados podrían estar relacionados con los mecanismos de respuesta de cada cultivar a este factor (Tavitas, 1987). Como el estado hídrico de la planta se ve afectado por la exposición a concentraciones elevadas de sales, deben ocurrir cambios en el flujo de agua de tal manera que las células y los tejidos se adapten a esta situación.
La absorción de agua se lleva a cabo gracias al mayor potencial osmótico de la raíz con respecto al suelo y que ocurre en cuanto las células dejan de estar turgentes (Rojas, 2003). En un sustrato con niveles elevados de NaCl, el ajuste osmótico exitoso en los vegetales, implica la toma de iones (Na+, Cl-) del suelo independientemente de la toxicidad que estos iones puedan causar, con el fin de reducir el potencial osmótico a un nivel inferior al del medio, para lograr la entrada de agua (Allen et al., 1995; Yang et al., 2004); pero una vez que han podido tomar el agua necesaria, se almacenan estos iones en la vacuola, para evitar los efectos tóxicos (Shi & Zhu, 2002).
Así también, para mantener el estado hídrico, las acuaporinas, proteínas canales de membrana (PIP) juegan un papel dinámico clave en el control del movimiento del agua (Vera-Estrella, 2004) en las células de la raíz y las proteínas TIP a nivel del tonoplasto, son las responsables del control del agua transcelular, para restablecer y mantener la homeostasis celular de los cambios en el potencial osmótico celular ocasionado por las sales (Bartels & Ramanjulu, 2005; Tsunoda, 1997). El reajuste osmótico y la regulación de estas proteínas podrían estar dando cuenta del estado hídrico de las dos variedades de "arroz" estudiadas (Tsunoda, 1997). Cuando las plántulas de Oryza sativa "arroz" crecieron en la concentración de 100mM NaCl, sugiere que la variedad amazonas responde mejor al déficit de agua ocasionado por la salinidad, siendo la Variedad IR-43 la más susceptible a los efectos del NaCl.
Conclusiones
Las TCAs de vástago y raíz disminuyen conforme se incrementan las concentraciones de NaCl en las variedades de arroz IR-43 y Amazonas sometidas a 8 días de estrés por NaCl, mostrando 12,46 y 21,25 mm/día, respectivamente.
El CRA disminuye al incrementarse las concentraciones de NaCl en las variedades de "arroz" IR-43 y amazonas sometidas a 8 días de estrés por NaCl (73,35% y 78,47%, respectivamente).
La variedad amazonas de Oryza sativa "arroz" respondió mejor que la variedad IR-43 al estrés salino por NaCl a los 8 días de tratamiento al mostrar mayores valores de TCA y CRA.
Agradecimientos
Expresamos nuestro reconocimiento a las autoridades de la Universidad Privada Antenor Orrego de Trujillo y Universidad Nacional de Trujillo, Perú, por su constante apoyo y facilidades para la realización de las expediciones botánicas.
Contribución de los autores
N. R.: Redacción del texto, ejecución del experimento, mediciones de CRA y TCA. C. T.: Mediciones de CRA y TCA, redacción del texto. J. H.: Redacción y corrección del texto, análisis estadístico y elaboración de gráficos. M. C.: Diseño y supervisión del experimento, corrección del informe final. Todos los autores revisaron y aprobaron el manuscrito final.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Citación: Rodríguez, N.; C. Torres; M. Chaman & J. Hidalgo. 2019. Efecto del estrés salino en el crecimiento y contenido relativo del agua en las variedades IR-43 y amazonas de Oryza sativa "arroz" (Poaceae). Arnaldoa 26 (3): 931-942 2019. http://doi.org/10.22497/arnaldoa.263.26305
Literatura citada
Alfonso, R. V. 1998. Determinación de los parámetros genéticos-fisiológicos indicadores del estrés hídrico para su empleo en el mejoramiento genético del arroz (Oryza sativa L.) y la estabilidad varietal. [Tesis de grado]; INCA, Cuba. 86 pp. [ Links ]
Allen, G. J; R. G. Wyn-Jones & R. A. Leigh. 1995. Sodium transport measured in plasma membrane vesicles isolated from wheat genotypes with different K+/Na+ discrimination traits. Plant Cell Environ. 18(1): 105-115. [ Links ]
Azevedo, A. D.; J. Tarquinio; J. Eneas-Filho; C. Feitosa; J. Vieira; P. H. Alves & E. Gomes-Filho. 2004. Effects of salt stress on plant growth, stomatal response and solute accumulation of different maize genotypes. Brazilian Journal of Plant Physiology. 16(1): 31-38. [ Links ]
Bartels, D. & S. Ramanjulu. 2005. Drought and salt tolerance in plants. Plant Science 24(1): 23-58. [ Links ]
Buchanan, B. B.; W. Gruissem & R. L. Jones. 2000. Biochemistry & Molecular Biology of plants. American Society of Plant Physiologists. Rockville, Maryland, USA. 1367 pp. [ Links ]
Chaman, M. 2007. Variaciones en el contenido relativo de agua y la concentración de prolina en Capsicum annuum L. inducido por NaCl. Arnaldoa 14(2): 251- 258 pp. [ Links ]
Chang, T. T. & G. C. Loresto. 1986. Varietal Improvement for drought resistance in upland rice. IRRI. Los Baños. Philippines. 145 pp.
Chinnusamy, V. & J. K. Zhu. 2003. Plant salt tolerance. Topics in Current Genetics 4(1): 241–270. [ Links ]
FAO. 2018. Food Outlook biannual report on global food markets. FAO. 169 pp. [ Links ]
FAO (Food and Agriculture Organization of the United Nations). 1997. FAOSTAT statistical database. [Rome]. FAO. Disponible en: http://faostat.fao.org/site/567/default.aspx [ Links ]
FAO, OPS, WFP & UNICEF. 2018. Panorama de la seguridad alimentaria y nutricional en América Latina y el Caribe 2018. Santiago. 132 pp. [ Links ]
Gonzales, M. & M. Cárdenas. 2001. Evaluación de la tolerancia a la salinidad en el estado juvenil de tres nuevas líneas de arroz (Oryza sativa L.) utilizando marcadores morfoagronómicos. Cultivos Tropicales, La Habana, Cuba, 22(2): 43-45. [ Links ]
Gonzalez M. C. & A. Garcia. 1997. Detección de posibles marcadores morfológicos para la selección temprana de genotipos de arroz tolerantes a la salinidad. Rev. Cultivos tropicales 18 (3): 87-90. [ Links ]
Hasegawa, P. M.; R. Bressan; J. Zhu & H. Bohnert. 2000. Plant celular and molecular responses to high salinity. Annual Review of Plant Physiology and Plant Molecular Biology 51(1): 463-499. [ Links ]
Ingram K. T. & E. B. Yambao. 1988. Rice sensitivity to water deficit at different growth stages. Agris Newsletter 13(5): 16-28. [ Links ]
Jamil, M; K. Lee; K. Jung; D. Lee; M. Han & E. Rha. 2007. Salt stress inhibits germination and early seedling growth in cabbage (Brassica oleracea capitata L.). Pakistan Journal of Biological Sciences 10(6): 910-914. [ Links ]
Juliano, Bienvenido. 1991. Rice in Human Nutrition. Cereals International. 31-34. [ Links ]
Kerkeb, L.; J. Donaire & M. Rodríguez Rosales. 2001. Plasma membrane H+-ATPase activity is involved in adaptation of tomato calli to NaCl. Physiologia Plantarum 111(1): 483-490. [ Links ]
Kramer, P. 1974. Relaciones hídricas de suelos y plantas. Edutex S.A. Mexico. 538 pp. [ Links ]
Lascano, H.; G. Antonicelli; C. Luna; M. Melchiore; L. Gomez; R. Racca; V. Trippi & L. Casano. 2001. Antioxidant system response of different wheat cultivars under drought field and in vitro studies. Australian Journal of Plant Physiology 28(11): 1095-1102. [ Links ]
Lasso, R. 1991. Contribución de un programa de Mejoramiento Genético de Arroz para el agricultor de subsistencia. VIII Conferencia Internacional de Arroz para América Latina y el Caribe. Villa Hermosa. Tabasco. México. 40-54 pp. [ Links ]
Lerch, G. 1974. Desarrollo y rendimiento del arroz variedad IR-8 en Cuba. IX Relación entre área foliar, producción de materia seca y rendimiento agrícola. Agricultura 7(2): 15-38. [ Links ]
Marschner, H. 2012. Mineral nutrition of higher plants. Academic Press. 3rd edition. London. 672 pp. [ Links ]
Maser, P.; M. Gierth & J. Schroeder. 2002. Molecular mechanisms of pottassium and sodium transport in plants. Plant and Soil 247(1): 43-54. [ Links ]
Namuco, O.; K. Ingram & L. Fuentes. 1993. Root Characteristics of Rice Genotypes with different drought responses. International Rice Research Notes 18(1): 38-1993. [ Links ]
Ren, Z.; J. Gao; L. Li; X. Cai; W. Huang; D. Chao; M. Zhu; Z. Wang; S. Luan & H. Lin. 2005. A rice quantitative trait locus for salt tolerance encodes a sodium transporter. Nature Genetic. 37 (1): 1141-1146. [ Links ]
Rojas, G. M. 2003. La resistencia a la sequía. Ciencia UANL 3(1): 326-331. [ Links ]
Rus, A.; S. Yokoi; A. Sharkhuu; M. Reddy; B. Lee; T. Matsumoto & P. Hasegawa. 2001. AtHKT1 is a salt tolerance determinant that controls Na+ entry into plant roots. Proceedings of the National Academy of Sciences of the United States of America. 98(24): 14150-14155. [ Links ]
Sairam, R. K. & A. Tyagi. 2004. Physiology and Molecular Biology of Salinity Stress Tolerance in Plants. Current Science. 86(1): 407-421. [ Links ]
Shi, H. & J. Zhu. 2002. Regulation of expression of the vacuolar Na+/H+ antiporter gene AtNHX1 by salt stress and abscisic acid. Plant Molecular Biology 50(1): 543-550. [ Links ]
Tavitas, F. L. 1987. Necesidades hídricas de la planta de arroz. Trabajo presentado en el curso sobre Producción de Arroz en el Trópico Húmedo de México. INIFAT-CIAT Campuche Camp. México. 30 pp. [ Links ]
Thanh, N.; H. Zheng; N. Dong; L. Trinh; M. Ali & H. Nguyen. 1999. Genetic variation in root morphology and microsatellite DNA loci in upland rice (Oryza sativa L.) from Vietnam. Euphytica 105(1): 43-51. [ Links ]
Tsunoda, S. 1997. Dry matter productivity and yielding ability. In Science of plant. Volume three Genetics. Edited by Tanake Matsuo et al. Food and Agriculture Policy Research Center Tokyo. 1008 pp.
Vera-Estrella, R.; B. Barkla; H. Bohnert & O. Pantoja. 2004. Novel regulation of aquaporins during osmotic stress. Plant physiology. 135(4): 2318–2329. [ Links ]
Wilkinson, S. & W. Davies. 2002. ABA-based chemical signaling: the co-ordination of responses to stress in plants. Plant, Cell and Environment 25(1): 195-210. [ Links ]
Yang, Y.; J. Guo; F. Zhang; L. Zhao & L. Zhang. 2004. NaCl induced changes of the H+-ATPase in root plasma membrane of two wheat cultivars. Plant Science 166(1): 913-918. [ Links ]
Zhu, J. K. 2001. Plant salt tolerance. Trends in Plant [ Links ]
Recibido: 10-IV-2019;
aceptado: 25-V-2019;
publicado online: 31-VII-2019;
publicado impreso: 30-VIII-2019