Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Arnaldoa
Print version ISSN 1815-8242On-line version ISSN 2413-3299
Arnaldoa vol.26 no.3 Trujillo Sept./Dec 2019
http://dx.doi.org/10.22497/arnaldoa.263.26309
ARTÍCULOS ORIGINALES
Coinoculación de Rhizophagus irregularis y Rhizobium sp. en Phaseolus vulgaris L. var. canario (Fabaceae) "frijol canario"
Coinoculation of Rhizophagus irregularis and Rhizobium sp. in Phaseolus vulgaris L. var. canary (Fabaceae) "canary bean"
José Ernesto Manuel Hidalgo Rodríguez1 ORCID: 0000-0002-6595-0037, Cynthia Catheryne Ramos Otiniano1 ORCID: 0000-0003-1739-634X, Pedro Bernardo Lezama Asencio2 ORCID: 0000-0002-8594-0346, Pablo Chuna Mogollón2 ORCID: 0000-0003-4395-2784, Mercedes Elizabeth Chaman Medina3 ORCID: 0000-0001-8621-375X
1 Escuela de Medicina Humana, Universidad Privada Antenor Orrego, Trujillo, PERÚ
jemhidalgor@gmail.com, cynthiaramosotiniano@gmail.com
2 Departamento de Ciencias, Universidad Privada Antenor Orrego, Trujillo, PERÚ
plezamaa@gmail.com, pchuna05@gmail.com
3 Laboratorio de Fisiología Vegetal, Universidad Nacional de Trujillo, Trujillo, PERÚ
Resumen
Phaseolus vulgaris L. (Fabaceae), es uno de los cultivos más importantes al ser una de las principales fuentes de proteína. El objetivo del trabajo fue evaluar el efecto de la coinoculación de Rhizophagus irregularis y Rhizobium sp. sobre el crecimiento de P. vulgaris. Se inocularon plantas de frijol con ambos microorganismos y se cultivaron en condiciones hidropónicas. Se evaluó el número de hojas y nudos, diámetro de tallo, longitud de tallo, índice de área foliar, peso fresco y seco, proteínas foliares totales y componentes de rendimiento. Rhizobium sp. mejoró el crecimiento vegetativo (diámetro de tallo, peso seco de la parte aérea, área foliar y contenido de proteínas), así como el rendimiento (número y peso de semillas). La micorrización no promovió el incremento de número de hojas y nudos, longitud de tallo, peso fresco y seco, ni cantidad de proteínas foliares. Sin embargo, se observaron diferencias respecto a parámetros de rendimiento (número de semillas por planta y peso de semillas). Se concluye que la inoculación conjunta de Rhizophagus irregularis y Rhizobium sp., promueve el aumento de los parámetros de crecimiento y desarrollo, así como los componentes de rendimiento en Phaseolus vulgaris var. canario "frijol canario", cultivado en condiciones de invernadero.
Palabras clave: frijol, micorrizas, Rhizophagus irregularis, Rhizobium sp.
Abstract
Phaseolus vulgaris L. (Fabaceae) is one of the most important crops and one of the main protein sources. The objective of this research was to evaluate the effect of the inoculation of Rhizophagus irregularis and Rhizobium sp. on the growth and production of P. vulgaris. Plantlets were inoculated with both microorganisms and we measured the number of leaves, knots, stem diameter, shoot length, leaf area, fresh and dry weight, total protein content and yield components. Rhizobium sp. promoted plant growth, increasing the shoot diameter, dry weight, leaf area, total protein content and yield. Mycorrhizal fungi did not affect the number of knots, leaves, shoot length, protein content or fresh and dry weight. However, differences were observed in the yield components number and weight of seeds. Coinoculation with both microorganisms promoted an increase in the growth parameters (number of leaves, leaf area, fresh and dry weight, shoot length and stem diameter) and at the same time caused an increase in yield components (seed number and seed weight). It is concluded that the inoculation of both Rhizophagus irregularis and Rhizobium sp., promotes the growth, development and yield in Phaseolus vulgaris var. Canario "canary bean" under greenhouse conditions.
Keywords: canary bean, mycorrhizal fungi, Rhizophagus irregularis, Rhizobium sp.
Introducción
El "frijol" común Phaseolus vulgaris L. (Fabaceae), es una especie originaria de América, considerada como uno de los cultivos más importantes siendo una de las principales fuentes de proteína vegetal para los seres humanos (Shamseldin et al., 2005). Este cultivo cuenta con más de 30 millones de hectáreas cosechadas, y más de 26 millones de toneladas (tn) de semillas producidas a nivel mundial (FAOSTAT, 2016). En Perú, según el Ministerio de Agricultura (MINAGRI, 2017), entre el 2010 y el 2016, el "frijol" de grano seco se ha cultivado en 78476.29 has, con una producción total de 89431.2 tn y un rendimiento de 1139.59 Kg/ha en promedio. El "frijol" es la especie más importante dentro del grupo las leguminosas de grano, de manera que aproximadamente el 60% de la producción es consumida en la costa central, donde hay preferencia por el grano de color amarillo de la variedad "canario" (Espinoza, 2009).
El "frijol" es capaz de establecer asociación simbiótica con un grupo de bacterias Gram negativas del orden Rhizobiales (Larcher, 1995) capaces de fijar el nitrógeno (N) atmosférico y convertirlo en amoníaco (NH3) (García de Salomone & Döbereiner, 1992). Estos microorganismos fijan N atmosférico en simbiosis, favoreciendo con ello el enriquecimiento del suelo. Entre las especies capaces de nodular al frijol se encuentran Rhizobium leguminosarum bv. phaseoli, R. tropici, R. etli, R. gallicum y R. giardini (Rouhrazi et al., 2016), que a través de mecanismos complejos e interacciones con las raíces de las plantas estimulan incluso mayor producción de proteínas (Küçük, 2011) e incrementan el crecimiento de las plantas (Camelo, 2011).
El crecimiento también puede ser estimulado por hongos micorrícicos. Estos hongos se asocian con las raíces de diversas plantas en una relación simbiótica mutualista conocida como micorriza (Chung, 2005), siendo las más importantes las micorrizas arbusculares. El hongo Rhizophagus irregularis (antes Glomus intraradices, Tisserant et al., 2013) establece con las raíces de las plantas una de las simbiosis más abundantes e importantes en la biósfera al incrementar la eficacia en la absorción de agua y nutrientes (Izco, 2004), confiriendo a las plantas micorrizadas la capacidad de crecer en suelos ácidos y pobres en nutrientes (Mosse, 1963), además de incrementar su tolerancia a algunas enfermedades (Chung, 2005) y ataques de nemátodos (Fundora, 2008). Muchos hongos micorrizico-arbusculares (HMA), incluso disminuyen los daños causados por estrés hídrico y salinidad (Ferrera, 1993).
El estudio y utilización de la simbiosis entre plantas y microorganismos como R. irregularis y Rhizobium sp. cumple una función clave en la agricultura moderna al reducir la aplicación de insumos químicos como fertilizantes y pesticidas, e incrementar la absorción de nutrientes y por consiguiente el rendimiento de cultivos como el "frijol". Por esta razón, el presente trabajo tuvo como objetivo evaluar el efecto de la coinoculación de Rhizophagus irregularis y Rhizobium sp. en el crecimiento y rendimiento de Phaseolus vulgaris var. canario (Fabaceae) "frijol canario".
Materiales y métodos
Material biológico
Se utilizaron semillas de P. vulgaris (L) var. canario "frijol canario", obtenidas del Programa de Investigación y Proyección Social de Leguminosas de la Universidad Nacional Agraria La Molina. El inóculo de R. irregularis se obtuvo del producto comercial AEGIS Endo Gránulo, donado por la Empresa Agrotecnologías Naturales ATENS. Las cepas de Rhizobium spp. fueron adquiridas del Laboratorio de Ecología Microbiana y Biotecnología "Marino Tabusso" de la Universidad Nacional Agraria La Molina.
Germinación
Las semillas de "frijol" fueron germinadas usando papel toalla como sustrato dentro de placas Petri. Se colocaron 10 semillas con papel absorbente en cada placa y se mantuvo la humedad al 100% usando agua destilada hasta la germinación. Las plántulas germinadas fueron trasplantadas a macetas con sustrato estéril Premix 8. El sustrato fue esterilizado en la estufa a 200° C durante 3 horas para eliminar los agentes patógenos. La inoculación se realizó durante el trasplante.
Siembra, trasplante e inoculación de las plántulas
Tras la germinación, y al comprobar la presencia de raíces, se inoculó un grupo de plántulas con Rhizobium sp. mientras estaban en las placas. Para ello se preparó una solución en CELM con una población de 100 bacterias/ml, usando como base las cepas de Rhizobium sp. y se agregaron 5 ml de esta solución a las placas.
La inoculación con R. irregularis se realizó cuando se trasplantaron las plántulas a las macetas con sustrato. Para ello, se llenaron las macetas con sustrato y se hicieron hoyuelos en el sustrato, dentro de los cuales se agregaron 5 gramos del inóculo de micorrizas (500 esporas) de manera que el hongo permanezca en contacto con las raíces. Seguidamente, se procedió a colocar las plántulas dentro de los hoyuelos y se regó con agua destilada.
Tratamientos
Se seleccionaron 20 plántulas de tamaño homogéneo, las cuales fueron aleatoriamente distribuidas en 4 grupos cuando se realizaron las inoculaciones. Se asignó un tratamiento a cada grupo, de manera que cada tratamiento contará con 5 repeticiones. Los tratamientos se describen en el Cuadro 1.
Las plantas fueron cultivadas en condiciones de invernadero en el Invernadero de la Cátedra de Fisiología Vegetal de la Universidad Nacional de Trujillo. Las plantas fueron regadas con solución nutritiva La Molina (solución A de macronutrientes a ¼ de concentración). El riego se dio a capacidad de campo, dos o tres veces por semana, y se mantuvo hasta la etapa de madurez fisiológica de las plantas.
Evaluación
Luego de 120 días de tratamiento, se evaluó en cada planta el número de nudos y hojas, diámetro y longitud de tallo, índice de área foliar, peso seco y fresco de parte aérea, número y peso total de vainas, número total de semillas, número de semillas por vaina, peso total y peso de 100 semillas, determinación proteínas en tejido foliar y semillas.
- Número de hojas y nudos: Para evaluar el número de hojas y nudos, se realizó el conteo directo.
- Diámetro de tallo: El diámetro se midió en la parte media del tallo, utilizando un Vernier.
- Longitud de tallo: La longitud del tallo se determinó considerando la distancia entre el cuello y la yema apical de la planta.
- Índice de área foliar: Para encontrar el índice de área foliar se realizó un escaneo de las dos hojas contiguas de la parte media del tallo. Estas se colocaron entre láminas transparentes de PVC para luego ser escaneadas, recortando y pesando las siluetas de las hojas. Se estimó el área foliar de las siluetas tomando como referencia el peso de 1 dm2 de papel utilizado.
- Peso fresco y seco: El peso fresco se determinó en tallo, separado a la altura del cuello y ambos fueron inmediatamente pesados en la balanza analítica. Para obtener el peso seco, la parte aérea fue secada en estufa a 105° C, hasta obtener un peso constante.
- Rendimiento: Se evaluó el rendimiento de P. vulgaris, teniendo en cuenta el número de vainas, peso fresco de vainas, número de semillas/vaina, peso total de semillas y peso de 100 semillas.
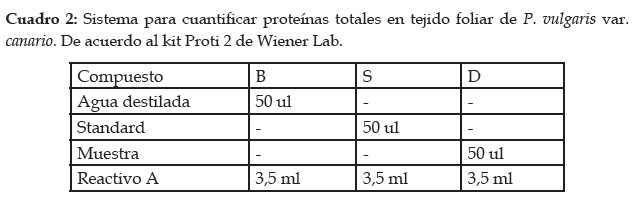
- Proteínas foliares totales: La cantidad de proteínas fue medida en la segunda hoja a partir del cotiledón. Se utilizó el kit Proti 2 de Wiener Lab, basado en la reacción de los enlaces peptídicos de las proteínas con el ión cúprico, en medio alcalino, para dar un complejo color violeta con máximo de absorción a 540 nm, cuya intensidad es proporcional a la concentración de proteínas totales en la muestra. Para ello, se homogenizó el tejido foliar en mortero utilizando para la extracción buffer fosfato pH 7.2. Luego, se centrifugó a 3500 rpm, tras lo cual se filtró el sobrenadante. El filtrado fue utilizado como muestra en la preparación del sistema. El sistema empleado para la determinación de las proteínas totales se describe en el Cuadro 2.
- Nodulación y micorrización: Se tomó en cuenta la presencia de nódulos para determinar la presencia de Rhizobium sp. La micorrización fue evaluada mediante la observación microscópica tras realizar la técnica de clareo y tinción de Phillips & Hayman (1970) modificada con azul de lactofenol.
Análisis de datos
Los resultados fueron ordenados en tablas y gráficos y se analizaron estadísticamente con el software estadístico SAS 9.1.3 Service Pack 4. Se determinó si existen diferencias significativas entre tratamientos mediante el análisis de varianza y las diferencias fueron luego estimadas mediante la prueba de comparación múltiple de Duncan.
Resultados
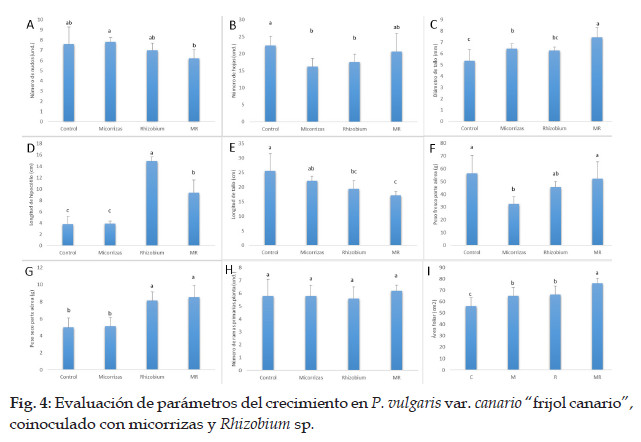
Los parámetros relacionados con el crecimiento vegetativo del "frijol" son mostrados en la Fig. 4. Al analizar el número de nudos (Fig. 4A), se encontró que el tratamiento con micorrizas presentó mayor número de nudos (7.8 und.) que las plantas del tratamiento micorrizas + Rhizobium sp. (6.2 und.). En tanto que las plantas del grupo control, las del tratamiento de micorrizas y las de Rhizobium sp. no mostraron diferencias significativas entre sí, ni con los dos tratamientos previamente mencionados.
Con respecto al número de hojas (fig. 4B), se observó que los tratamientos con micorrizas y Rhizobium sp. disminuyeron significativamente, mostrando menor número que las plantas del tratamiento control (16.2, 17.6 y 22.4 unidades, respectivamente). En cambio, las plantas del grupo micorrizas + Rhizobium sp., mostraron un número de hojas intermedio, sin diferencias con respecto a los grupos previamente mencionados.
Al analizar el diámetro de tallo (Fig. 4C), se observó que las plantas del grupo micorrizas + Rhizobium sp. presentaron un valor significativamente más elevado (7,43 mm) al ser comparadas con los demás tratamientos. Los grupos micorrizas (6,42 mm) y Rhizobium sp. (6,25 mm) no mostraron diferencias en su diámetro de tallo, en tanto que el tratamiento control indujo los valores de diámetro de tallo menores (5,35 mm).
Al comparar la longitud de tallo (Fig. 4D), se observó que las plantas del grupo control presentaron una longitud de tallo (25,6 cm) similar estadísticamente a las plantas tratadas con micorrizas (22,2 cm), pero a su vez mayor a los tratamientos con Rhizobium (19,5 cm) y con micorrizas + Rhizobium sp. (17,2 cm), las cuales a su vez presentaron la menor longitud de tallo.
Al evaluar la longitud de hipocótilo (Fig. 4E), se encontró que la longitud mayor fue obtenida en el grupo Rhizobium sp. (14,9 mm), en tanto que las plantas del grupo micorrizas + Rhizobium sp. mostraron un valor de 9,34 mm, que fue significativamente más elevado que las plantas de los grupos micorrizas (3,88 mm) y control (3,82 mm), las cuales a su vez no mostraron diferencias significativas entre sí.
La evaluación de la biomasa fresca de la parte aérea (Fig. 4F) demostró que las plantas del tratamiento control y del grupo tratado con micorrizas + Rhizobium alcanzan mayor peso fresco (56,4 g y 45,7 g, respectivamente). Estos tratamientos no presentan diferencias significativas con el tratamiento con Rhizobium sp. (45,7 g), pero su peso fresco fue mayor que el de las plantas tratadas con Micorrizas (32,4 g).
En relación al peso seco (Fig. 4G), se observó que las plantas de los grupos micorrizas + Rhizobium y Rhizobium presentaron valores mayores (8,52 g y 8,13 g, respectivamente) que los encontrados en los tratamientos control y micorrizas (4,99 g y 5,12 g, respectivamente).
Al evaluar el número de ramas primarias por planta (Fig. 4H), se observó que todos los tratamientos indujeron un número de ramas primarias similares. Las plantas tratadas con micorrizas + Rhizobium mayor número (6,2 unidades en promedio), seguidas por las plantas tratadas con micorrizas y del grupo control, ambas con 5,8 ramas primarias en promedio. El menor número de ramas primarias fue encontrado en el tratamiento con Rhizobium. Sin embargo, no se encontraron diferencias estadísticas significativas entre los cuatro tratamientos.
El área foliar de las plantas tratadas con micorrizas + Rhizobium sp., fue mayor estadísticamente (76.2 cm2) con respecto a los demás tratamientos. En tanto, los grupos tratados con Rhizobium sp. y micorrizas mostraron mayor similitud entre sí (66,2 cm2 y 65,2 cm2, respectivamente) y a su vez significativamente mayores que las plantas del grupo control (55,9 cm2), que presentaron los menores valores (Fig. 4I).
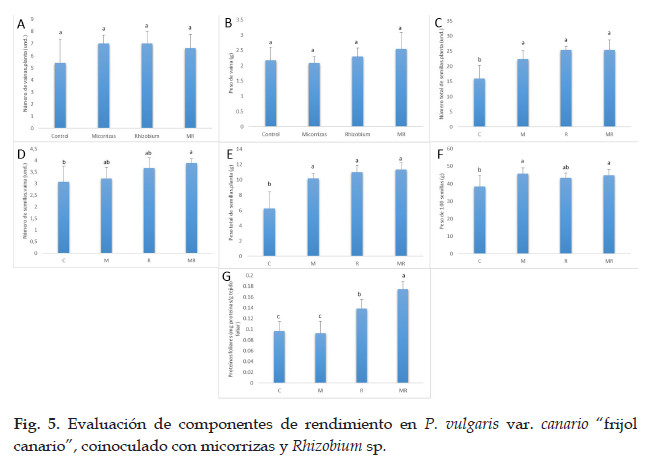
Los resultados referentes a los componentes del rendimiento del frijol son mostrados en la Fig. 5. Con respecto al número de vainas por planta (Fig. 5A), se obtuvo un número de vainas mayor en las plantas sometidas a los tratamientos con micorrizas y Rhizobium, con 7 vainas. Las plantas tratadas con micorrizas + Rhizobium sp. mostraron un valor menor de vainas (6,6), mientras que las plantas control mostraron 5,4 vainas en promedio. Sin embargo, no se observaron diferencias estadísticamente significativas entre tratamientos.
Al evaluar el peso de vainas (Fig. 5B), se encontró que las plantas del tratamiento micorrizas + Rhizobium sp. tuvieron mayor peso de vaina (2,55 g), seguidas del tratamiento con Rhizobium (2,3 g) y del grupo control (2,18 g). En tanto, las plantas del tratamiento con micorrizas mostraron los menores valores (2,09 g). Vale mencionar que no se encontraron diferencias significativas entre los tratamientos mencionados.
El número total de semillas por planta (Fig. 5C) mostró valores estadísticamente inferiores para las plantas control (16 und.), al ser comparada con los grupos de plantas tratados con micorrizas (22,4 und.), Rhizobium sp. (25,4 und.) y micorrizas + Rhizobium sp. (25,4 und.).
Al evaluar el número de semillas por vaina (Fig. 5D), se encontró que las plantas del grupo control presentaron un valor estadísticamente inferior (3,08 und.) a las plantas de los tratamientos con micorrizas (3,22 und.) y Rhizobium sp. (3,68 und.). Sin embargo, se encontraron diferencias significativas al compararlas con las plantas tratadas con micorrizas + Rhizobium sp. (3,88 und.). A su vez, el tratamiento con micorrizas y Rhizobium sp. no indujo diferencias significativas con respecto a las plantas del grupo de micorrizas y Rhizobium sp.
Cuando se determinó el peso total de semillas por planta (Fig. 5E), se encontró que las plantas tratadas con micorrizas + Rhizobium sp. (11,3 g), Rhizobium sp. (11 g) y micorrizas (10,2 g) no mostraron diferencias estadísticamente significativas. Sin embargo, dichas plantas mostraron valores significativamente superiores a las plantas del grupo control (6,28 g).
El peso de 100 semillas (Fig. 5F) en las plantas de los grupos micorrizas (45,7 g.) fue similar estadísticamente al valor del grupo micorrizas + Rhizobium sp. (45 g) y Rhizobium sp. (43,4 g). A su vez, los grupos micorrizas + Rhizobium sp. y Rhizobium sp. mostraron valores significativamente superiores a las plantas del grupo control (38.5 g), cuyo peso de 100 semillas no mostró diferencias con respecto a las plantas tratadas con Rhizobium sp.
El nivel de proteínas foliares mostró diferencias significativas entre los diferentes tratamientos (Fig. 5G). Los valores más elevados estadísticamente, fueron obtenidos por el grupo micorrizas + Rhizobium sp., seguidos de las plantas del grupo Rhizobium sp. Por su parte, los menores valores se observaron en las plantas de los grupos micorrizas y control, los cuales, a su vez, no mostraron diferencias significativas entre sí.
Discusión
Es ampliamente conocido el efecto benéfico que la inoculación con hongos micorrícicos y rhizobacterias tiene en diferentes cultivos. En dichas interacciones, las bacterias favorecen una mayor disponibilidad de N, al tiempo que los hongos se convierten en la vía de ingreso de mayores cantidades de P y algunos micronutrientes. Por ello, se consideran como una gran alternativa para lograr una agricultura sostenible, sobre todo en la familia Fabaceae (Campillo et al., 2003), con la que se ha demostrado su capacidad de estimular el desarrollo de las plantas de manera directa e indirecta a través de una serie de mecanismos complejos e interacciones con las raíces de las plantas (Camelo, 2011). Dichos efectos benéficos varían, desde un mejor desarrollo en la etapa vegetativa, hasta la promoción de mejores rendimientos y frutos de mayor calidad, tal como se pudo observar en este trabajo, en el cual todos los parámetros de crecimiento fueron promovidos gracias a la coinoculación de las plantas con micorrizas y Rhizobium sp.
Los resultados obtenidos al tratar las plantas de "frijol" (P. vulgaris var. canario) con Rhizobium sp., demuestran el efecto benéfico promovido por esta bacteria. El "frijol" es una leguminosa perteneciente a la familia Fabaceae, la cual cuenta con especies de importancia económica, caracterizadas por la ocurrencia natural de simbiosis con bacterias fijadoras de N. Este es un elemento indispensable para la nutrición vegetal, y a pesar de su abundancia en la atmósfera, se halla en cantidades deficientes en los suelos tropicales y subtropicales, siendo rápidamente eliminado por procesos de nitrificación, desnitrificación, lixiviación (Larcher, 1995) y volatización de amonio (Soule & Piper, 1994). En los agroecosistemas, alrededor del 80% del amonio proviene del N atmosférico, por ello, el proceso de fijación biológica de N adquiere mayor importancia cuando las cantidades de N son limitadas, condición presente en sustratos estériles como la turba utilizada en este trabajo.
La fijación de N es un proceso complejo, genéticamente controlado entre los organismos involucrados e influenciado por el medio ambiente (Olmedo et al., 1992). Este proceso biológico es catalizado por la nitrogenasa, que reduce el N2 a NH4+, la cual está sujeta a regulación por el estatus de N, las mismas que están correlacionadas de manera negativa, así como la razón C:N en la raíz, tallo y los nódulos, las que muestran una correlación positiva; aunque la eficiencia de este proceso está sujeta a los genotipos bacterianos y vegetales (Bacanamwo & Harper, 1996). Este proceso determina una mayor biodisponibilidad de N, propiciando una síntesis de proteínas más elevada a nivel foliar y de diferentes tejidos en plantas infectadas (Küçük, 2011), lo cual podría explicar la mayor concentración de proteínas encontrada en las plantas inoculadas con Rhizobium sp. Cabe mencionar que existen diversos factores ambientales, principalmente referentes a la composición del suelo e interacción con otros microorganismos como hongos micorrícicos, los cuales serían capaces de propiciar una nodulación y fijación de N más efectiva (Singleton, 1986).
Los resultados de este trabajo demuestran que la inoculación con micorrizas no promovió el incremento de parámetros de crecimiento, como número de nudos, hojas, longitud de tallo, o peso fresco y seco, con relación a las plantas control. Así mismo, no se observaron diferencias con respecto a la cantidad de proteínas foliares evaluadas en las plantas tratadas con micorrizas, con respecto a las del grupo control. Sin embargo, se observaron diferencias respecto a algunos parámetros de rendimiento, como el número total de semillas por planta y el peso total de semillas. Esto podría ser explicado por el efecto limitado que estos hongos tendrían en los parámetros de crecimiento, al no estar directamente relacionados con una mayor disponibilidad de N en la parte aérea de las plantas (Karandashov & Bucher, 2005). A su vez, el incremento observado en los parámetros de rendimiento, concuerda con estudios en diversas especies vegetales, que detallan los beneficios del empleo de los hongos formadores de micorrizas arbusculares, en relación al mayor rendimiento que estos promueven. Sin embargo, es necesario mencionar que estos resultados contrastan con trabajos realizados por Fundora et al. (2009) y Roveda et al. (2007) quienes encontraron mayor crecimiento en plantas de Ipomoea batatas y Zea mays L., respectivamente.
Entre los diversos trabajos realizados para evaluar el aumento en rendimiento promovido por micorrizas, se tienen el de Llonín & Medina (2002), quienes evaluaron la acción de la inoculación con Glomus clarum y G. fasciculatum en plantas de Solanum esculentum, cultivadas con diferentes relaciones de nutrientes NPK, encontrando que la inoculación incrementó significativamente el contenido de nutrientes (3,33% N, 0,46% P, 2,42% K) y el rendimiento del cultivo (26 t.ha-1) en plantas fertilizadas con NPK. Roveda et al. (2007), evaluaron el efecto de Glomus spp. sobre el crecimiento, nutrición mineral (N, P, K, Ca, Mg, S) y concentración de azúcares en Zea mays L. cultivado bajo diferentes niveles de P, encontrando que la micorrización favoreció la capacidad de adaptación al estrés en las plantas que crecieron a niveles muy bajos de P (1 mgxkg-1). Destaca también, el trabajo realizado por Fundora et al. (2009), quienes evaluaron los rendimientos de Ipomoea batatas tras la aplicación de un fitoestimulante y un biofertilizante, en asociación con Glomus hoi-like INCAM-4, observando que la aplicación del fitoestimulante FitoMas-E, combinado con el hongo micorrícico y sólo el 50% de la fertilización NPK incrementan el desarrollo y los rendimientos de este cultivo en condiciones de producción. En general, debido a la poca especificidad de hospedero que muestran estos hongos, se pueden asociar con la mayoría de los cultivos agrícolas, por lo que presentan una gran importancia biológica y económica (Simon et al., 1993).
Respecto a los parámetros de rendimiento, se observó una carencia de efecto de las micorrizas sobre los parámetros de rendimiento. Esta carencia podría deberse a la dinámica de absorción y la naturaleza de la interacción planta-simbionte. Se ha demostrado que existen diversos mecanismos de absorción de los elementos por las micorrizas. Por ejemplo, el fósforo (P) una vez absorbido por los HMA, es transportado a las plantas en forma de gránulos de polifosfato a través de mecanismos de ciclosis (Karandashov & Bucher, 2005). El N ingresa al hongo a través de aminoácidos como la arginina, que son transportados a la planta sin carbón (Govindarajulu et al., 2005); y los elementos menos móviles son introducidos al micelio mediante corrientes citoplasmáticas, dado que las micorrizas se extienden a mayor distancia que las raíces absorbentes (Blanco & Salas, 1997).
Al analizar los resultados obtenidos en "frijol" inoculado con ambos microorganismos, se observa que este tratamiento promovió los parámetros de crecimiento propiciando una mejora en los componentes de rendimiento. Ello se corresponde con la literatura, que demuestra que existen estudios que han demostrado el efecto sinérgico de la infección de bacterias fijadoras de N, como Rhizobium sp., y su inoculación con hongos formadores de micorrizas en estos cultivos. Por ejemplo, Stancheva et al. (2006) evaluaron el efecto de la coinoculación de Rhizobium sp. y Glomus sp. en el crecimiento, nodulación y la actividad fijadora de nitrógeno en Pisum sativum cv. avola cultivado a bajas concentraciones (60mg P2O5 kg.suelo-1) de P, encontrando un incremento significativo en biomasa, tasa de fijación de N, y contenido de P en plantas tratadas con G. mosseae. Geneva et al. (2006) corroboraron dichos resultados al estudiar la respuesta de P. sativum a la coinoculación con Glomus spp. y R. legominosarum, encontrando además incremento significativo en la tasa fotosintética, porcentaje de micorrización y nodulación en las plantas tratadas con G. mosseae. Bhattarai et al. (2011) trabajaron con plantas de P. vulgaris, a las que fertilizaron con NPK e inocularon con micorrizas y Rhizobium sp., encontrando que ambos microrganismos mejoraron el crecimiento de las plantas, siendo la bacteria el organismo que indujo un mayor incremento de biomasa, número de vainas, longitud de raíz, longitud de tallo y peso seco de la semilla. Más adelante, Tajini et al. (2012a, 2012b) evaluaron el efecto del empleo de Rhizobium tropici y R. irregularis en plantas de P. vulgaris cultivadas con dos niveles de P, mostrando las plantas inoculadas con ambos microorganismos a la vez, una alta eficiencia en el uso de P, mayor crecimiento, y N total, especialmente en los tratamientos con niveles deficientes de P. Además, se ha encontrado que los mecanismos de absorción y transporte de fosfato promovidos por las micorrizas no son afectados por la presencia de concentraciones crecientes de nitratos; sin embargo, estos compuestos actúan como reguladores positivos del transporte de amonio, tanto en la simbiosis rhizobiana, como en la micorrícica (Nanjareddy et al., 2014; Lowry & Lopez, 1946).
Conclusiones
La inoculación conjunta de Rhizophagus irregularis y Rhizobium sp., promovió el crecimiento y desarrollo de Phaseolus vulgaris var. canario (Fabaceae) "frijol canario".
Rhizobium sp. indujo mejor crecimiento, así como mayor rendimiento que R. irregularis, en P. vulgaris var. canario "frijol canario".
Rhizophagus irregularis promovió mejoras en el rendimiento en las plantas de P. vulgaris var. canario "frijol canario", sin embargo, no se observaron efectos significativos en los componentes del rendimiento.
Agradecimientos
Este trabajo fue financiado por el Fondo de Apoyo a la Investigación de la Universidad Privada Antenor Orrego (R.R. 2992-2015-R-UPAO)
Contribución de los autores
J. H., P. L., P. C.: Concepción, diseño del trabajo de investigación; J. H., C. R., M. C. Recolección de datos o información, análisis e interpretación de los resultados obtenidos; J. H., P. L., M. C.:Preparación, redacción del artículo y revisión crítica: Todos los autores han leído el manuscrito final y aprobado la revisión.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de interés tanto de tipo financiero, como no financiero.
Citación: Hidalgo, J: C. Ramos; P. Lezama; P. Chuna & M. Chaman. 2019. Coinoculación de Rhizophagus irregularis y Rhizobium sp. en Phaseolus vulgaris L. var. canario (Fabaceae) "frijol canario". Arnaldoa 26 (3): 991-1006 2019. http://doi.org/10.22497/arnaldoa.263.26309
Literatura citada
Bacanamwo, M. & J. Harper. 1996. Regulation of nitrogenase activity in Bradyrhizobium japonicum/soybean symbiosis. Nitrogen status as determined by shoot C:N ratio. Phisiologia Plantarum. 98(2): 529-538. [ Links ]
Bhattarai, N.; B. Baral; G. Shrestha & K. Yami. 2011. Effect of mycorrhiza and rhizobium on Phaseolus vulgaris L. Scientific World 9(9): 66-69. [ Links ]
Blanco, F. & E. Salas. 1997. Micorrizas en la agricultura: Contexto mundial e investigación realizada en Costa Rica. Agronomía Costarricense. San José. 21 (1): 55-67. [ Links ]
Camelo, M.; S. Vera & R. Bonilla. 2011. Mecanismos de acción de las rizobacterias promotoras del crecimiento vegetal. Revista Corpoica - Ciencia y Tecnología Agropecuaria. 12(2): 159-166. [ Links ]
Campillo, R.; S. Urquiaga; I. Pino & A. Montenegro. 2003. Estimación de la Fijación Biológica de Nitrógeno en leguminosas forrajeras mediante la metodología del 15N. Agric. Téc. INIA, Chile. 63 (2): 169-179. [ Links ]
Chung, P. 2005. Hongos micorrícicos comestibles. Opción productiva aplicada a las plantaciones forestales. Publicado por INFOR – FONDEF de la Red agroforestal Nacional, Santiago de Chile. 1º Ed: 63 pp. [ Links ]
Espinoza, E. 2009. Evaluación de 16 genotipos seleccionados en dos densidades de siembra de frijol canario cv. Centenario (Phaseolus vulgaris L.) por su calidad y rendimiento en condiciones de costa central" Tesis para optar el grado de: Magister Scientiae en la Especialidad de Producción Agrícola de la Escuela de Post Grado de la Universidad Nacional Agraria La Molina. Perú: 179 pp. [ Links ]
FAO. 2016. FAOSTAT database collections. Food and Agriculture Organization of the United Nations. Rome. Access date: 2019-08-08. URL: http://faostat.fao.org. [ Links ]
Ferrera, R. 1993. Manual de Agromicrobiología. Ed. Trillas. 1° Ed. México: 144 p. [ Links ]
Fundora L.; J. Gonzáles; L. Ruiz & J. Cabrera. 2009. Incrementos en los rendimientos del cultivo de boniato por la utilización combinada del fitoestimulante Fitomas-E y el biofertilizante Ecomic® en condiciones de producción. Cultrop. La Habana. 30 (3): 14-17. [ Links ]
Fundora, L.; A. Mena; Y. Rodríguez; J. González; P. Rodríguez & D. González. 2008. Estabilidad de la eficiencia de la cepa Glomus mosseae en la respuesta del tomate a condiciones de estrés hídrico fuera de su periodo óptimo. Cultivos tropicales, La Habana. 29 (4): 47-53. [ Links ]
García, E. & J. Döbereiner. 1992. Estudio de la asociación Azospirillum – maíz (Zea mays) en dos campañas sucesivas de experimentos de campo. Fac. Agronomia UBA. Rio de Janeiro. Brazil. XVI RELAR. Argentina: 96 pp. [ Links ]
Geneva, M.; G. Zehirov; E. Djonova; N. Kaloyanova; G. Georgiev & I. Stancheva. 2006. The effect of inoculation of pea plants with mycorrhizal fungi and Rhizobium on nitrogen and phosphorus assimilation. Plant Soil Environment. 52 (10): 435-440. [ Links ]
Govindarajulu, M.; P. Pfeffer; H. Jin; J. Abubaker; D. Douds; J. Allen; et al. 2005. Nitrogen transfer in the arbuscular mycorrhizal simbiosis. Nature. 435 (7043): 819-823. [ Links ]
Izco, J.; E. Barreno; M. Brugués; M. Costa; J. Devesa; F. Fernández; et al. 2004. Botánica. McGraw Hill – Interamericana. Madrid: 906 p. [ Links ]
Karandashov V. & M. Bucher. 2005. Symbiotic phosphate transport in arbuscular mycorrhizas. Trends in Plant Science. 10 (1): 22-29. [ Links ]
Küçük, Ç. 2011. Inoculation with Rhizobium spp. in kidney bean (Phaseolus vulgaris L.) varieties. Žemdirbystė Agriculture. 98 (1): p. 49–56. [ Links ]
Larcher, W. 1995. Phisiological Plant Ecology. 3rd. Ed. Edit. Springer. Germany: 168-199. [ Links ]
Llonín D. & N. Medina. 2002. Nutrición mineral con N, P y K en la simbiosis hongos micorrizogenos-tomate (Licopersicum esculentum Mill.) en Ferralsols. Cultivos Tropicales, Bogotá. 23 (4): 83-88. [ Links ]
Lowry, O. & J. Lopez. 1946. The determination of inorganic phosphate in the presence of labile phosphate esters. J. Biol. Chem. 162 (1): 421-426. [ Links ]
MINAGRI. 2017. Consulta a la base de datos de la DGESEP (Cultivos). Fecha de acceso: 08-12-2017. URL: http://frenteweb.minagri.gob.pe/sisca/?mod=consulta_cult [ Links ]
Mosse, B. 1963. Vesicular-arbuscular mycorrhiza: an extreme form of fungal adaptation. Symbiotic Associations. Symp. Soc. gen. Microbiol. 13 (1): 146-170. [ Links ]
Nanjareddy, K.; L. Blanco; M. Arthikala; X. Affantrange; F. Sánchez & M. Lara. 2014. Nitrate regulates rhizobial and mycorrhizal symbiosis in common bean (Phaseolus vulgaris L.). J Integr Plant Biol 56: 281–298. [ Links ]
Olmedo, C; A. Thuar; G. Tissera & S. Sánchez. 1992. Dpto. de Biología Agrícola, Córdoba. Argentina. XVI RELAR: 25 pp. [ Links ]
Rouhrazi, K.; G. Khodakaramian & E. Velázquez. 2016. Phylogenetic diversity of rhizobial species and symbiovars nodulating Phaseolus vulgaris in Iran. FEMS Microbiol Lett. 363 (5): 1-8. [ Links ]
Roveda, G. & C. Polo. 2007. Mecanismos de adaptación de maíz asociado a Glomus spp. en suelos con bajo fósforo disponible. Agronómica. Bogotá. 25 (2): 349-356. [ Links ]
Shamseldin, A.; A. Yousef; P. Vinuesa; H. Thierfelder & D. Werner. 2005. Rhizobium etli and Rhizobium gallicum nodulate Phaseolus vulgaris in Egyptian Soils and Display Cultivar-Dependent Symbiotic Efficiency. Symbiosis. 38 (1): 145-161. [ Links ]
Simon, L.; J. Bousquet; R. Levesque & M. Lalonde. 1993. Origin and diversification of endomycorrhizal fungi and coincidente with vascular land plants. Nat. Res. 3 (63): 67-69. [ Links ]
Singleton, P. 1986. Efecto de la salinidad sobre el crecimiento y sobrevivencia de Rhizobium. Res. XIII RELAR. UNMSM. Lima: 197 pp. [ Links ]
Soule, J. & J. Piper. 1994. Farming in Nature’s Image. Island Press. 1st Ed. USA: 90-117 pp.
Stancheva, M.; G. Geneva; G. Zehirov, G. Tsvetkova, M. Hristozkova & G. Georgiev. 2006. Effects of combined inoculation of pea plants with arbuscular mycorrhizal fungi and rhizobium on nodule formation and nitrogen fixing activity. Gen. Appl. Plant Physiology. Special Issue: 61-66. [ Links ]
Tajini, F.; M. Trabelsi & J. Drevon. 2012. Arbuscular mycorrhizas by contact with mycorrhized Stylosanthes guianensis enhance P use efficiency for N2 fixation in the common bean (Phaseolus vulgaris L.). African Journal of Microbiology Research. 6(6): 1297-1305. [ Links ]
Tajini, F. & J. Drevon. 2012. Effect of arbuscular mycorrhizas on P use efficiency for growth and N2 fixation in common bean (Phaseolus vulgaris L.). Scientific Research and Essays. 7(16): 1681-1689. [ Links ]
Tisserant, E.; M. Malbreil; A. Kuo; A. Kohler; A. Symeonidid; R. Balestrini; et al. 2013. Genome of an arbuscular mycorrhizal fungus provides insight into the oldest plant symbiosis. PNAS. 110 (50): 20117-20122. [ Links ]
Recibido: 10-IV-2019;
aceptado: 25-V-2019;
publicado online: 31-VII-2019;
publicado impreso: 30-VIII-2019