Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.3 Trujillo set./dic. 2019
http://dx.doi.org/10.22497/arnaldoa.263.26314
ARTÍCULOS ORIGINALES
Efecto de los flavonoides extraídos de Equisetum bogotense (Equisetaceae) sobre los niveles de TNF-α en la inflamación inducida experimentalmente en Mus musculus BALB/c
Effect of flavonoids extracted from Equisetum bogotense (Equisetaceae) on the levels of TNF-α in experimentally induced inflammation in Mus musculus BALB / c
Claudio Quiñones Cerna1,a, Natali Lucas Segura1, Erick Benites Plasencia1, Favio Calixto Pisconte1, Waldo Payano López1, Manuela Luján Velásquez1
1 Laboratorio de Inmunología, Escuela de Microbiología y Parasitología, Universidad Nacional de Trujillo, Av. Juan Pablo II, Trujillo 13011, PERÚ
Resumen
Equisetum arvense (Equisetaceae) es una planta que posee efectos antiinflamatorios debido a sus compuestos fitoquímicos como los flavonoides, los cuales actúan a nivel de citocinas proinflamatorias, principalmente el TNF-α. Sin embargo, se conocen otras especies de Equisetum en el Perú, de las cuales no se ha demostrado dichos efectos. Una de estas especies es Equisetum bogotense, de la cual se extrajeron los flavonoides y fueron inoculados en Mus musculus BALB/c. Estos flavonoides actuaron sobre los niveles de TNF-α producidos en la inflamación inducida experimentalmente en Mus musculus BALB/c mediante la inoculación de carragenanos. Para la cuantificación de los niveles de TNF-α se realizó la prueba de ELISA, obteniéndose que los flavonoides redujeron ligeramente los niveles de TNF-α, sin embargo, no hubo diferencia significativa entre las concentraciones utilizadas.
Palabras clave: Equisetum bogotense, TNF, inflamación, Mus musculus, elisa, flavonoides.
Abstract
Equisetum arvense (Equisetaceae) is a plant that has anti-inflammatory effects due to its phytochemical compounds such as flavonoids, which act at the level of proinflammatory cytokines, mainly TNF-α. However, other species of Equisetum are known in Peru, of which these effects have not been demonstrated. One of these species is Equisetum bogotense, from which the flavonoids were extracted and inoculated in Mus musculus BALB / c. These flavonoids acted on the levels of TNF-α produced in the inflammation experimentally induced in Mus musculus BALB / c by the inoculation of carrageenans. For the quantification of TNF-α levels the ELISA test was performed, obtaining that the flavonoids reduced the levels of TNF-α, however there was no significant difference between the concentrations used.
Keywords: Equisetum bogotense, TNF, inflammation, Mus musculus, elisa, flavonoids.
Introducción
Las plantas han sido utilizadas desde la antigüedad en la asistencia medicinal y sanitaria, por lo cual se han llevado a cabo estudios a nivel mundial para verificar su eficacia, dando lugar a la producción de medicamentos a base de plantas. Dentro de las especies de plantas utilizadas para este fin, se encuentran las pertenecientes a la familia Equisetaceae (Smith-Hall, Larsen, & Pouliot, 2012; Sofowora et al., 2013). Las especies de esta familia se caracterizan por contener diversos compuestos fitoquímicos, y más del 10% de sustancias inorgánicas (dos tercios de los cuales son sales de ácido silícico y potasio). Además, contiene esteroles, ácido ascórbico, ácidos fenólicos, ácidos polienicos, ácidos dicarboxílicos (ácidos equisetólicos) y flavonoides (Carneiro et al., 2014; D’Agostino et al., 1985; MimicaDukic et al., 2008).
Así por ejemplo, la especie Equisetum arvense contiene altas cantidades de polifenoles, como los flavonoides (Corti et al., 2004; L.D., M.A., J., & D.L., 2012), lo cual ha despertado el interés por sus actividades antiasmáticas, antiinflamatorias (Mazzon et al., 2008; Rämer et al., 2011), antioxidante, hepatoprotectora; además presenta propiedades moduladores sobre la función de las células inmunocompetentes inflamatorias (Hassimotto et al., 2013).
En el Perú, se reconocen tres especies que son Equisetum bogotense, E. giganteum y la escasamente reportada E. myriochaetum. Equisetum bogotense se encuentra ampliamente distribuido en el Perú, ocupando ambientes húmedos y alterados desde el nivel del mar hasta los 4200 m de altitud. Sin embargo, hasta la fecha, no hay estudios sobre el efecto de esta planta en el proceso inflamatorio (Bhattacharyya et al., 2013).
La inflamación se define como un proceso dinámico en el que participan diversas citoquinas proinflamatorias tales como la interleucina (IL) -1β, el factor de crecimiento endotelial vascular (VEGF) y el factor de necrosis tumoral TNF-α, el cual es producido fundamentalmente por los macrófagos y monocitos activados, y desempeña una función importante en la inflamación, lo cual se ha demostrado en varios estudios llevados a cabo utilizando líneas celulares, modelos animales y seres humanos (Pereda et al., 2006; Shen & Pervaiz, 2006; Warren & Ward, 1988).
El extracto hidroalcohólico de Equisetum bogotense tiene por finalidad disminuir los niveles de TNF-α que serán inducidos por carragenanos; para la evaluación de los niveles de TNF-α, ya sea en plasma o en suero sanguíneo, frecuentemente se realiza el ensayo por inmunoabsorción ligado a enzimas (ELISA), para lo cual se utiliza un Kit específico para la especie de experimentación, que en este caso es Mus musculus BALB/c. De acuerdo con los antecedentes mencionados, el estudio realizado proporciona una alternativa natural y efectiva en el tratamiento de la inflamación, sin producir efectos secundarios como algunos de los medicamentos utilizados actualmente (Kiasalari, Khalili, Roghani, Heidari, & Azizi, 2013). Por esta razón, se evaluó el efecto de las concentraciones de 0.2, 0.4 y 0.8 µg/mL de flavonoides extraídos de las hojas y tallo de Equisetum bogotense sobre los niveles de TNF-α en la inflamación inducida experimentalmente por carragenanos en Mus musculus BALB/c.
Materiales y métodos
Se recolectó plantas de 8 a 10 meses de edad de Equisetum bogotense en el Fundo "Las Tallas" del distrito San Benito, provincia Contumazá, departamento Cajamarca, Perú. Su identificación taxonómica se realizó en el herbarium Truxillensis (HUT) de la Universidad Nacional de Trujillo. Se colocaron las plantas seleccionadas sobre papel kraft en un lugar fresco y seco, y se llevó a la estufa a 40º C por un periodo de 48 horas. Las plantas secas fueron tamizadas, con la finalidad de separar las partículas uniformes. Se almacenaron en frascos ámbar en un lugar libre de humedad y sin exposición directa a la luz.
Obtención del extracto hidroalcohólico de Equisetum bogotense
Se pesó 1000 g entre tallos y hojas de E. bogotense, siendo éstas posteriormente humectadas con alcohol de 70°, hasta cubrir la muestra. Se colocó el material vegetal en el equipo de percolación con alcohol de 70° dejándose macerar por un periodo de 48h. Pasado el periodo de maceración se percoló a velocidad constante de 1020 gotas /min el equivalente al 75% del extracto fluido Total (750mL), guardándose en frasco ámbar. Se percoló hasta que el ensayo de tricloruro férrico realizado a una alícuota del extracto de negativo (Fig.). El volumen obtenido se concentró en un rotaevaporador a una cantidad equivalente al 25% (250 mL) del extracto fluido total, lo cual se reúne con la primera fracción, obteniendo así una cantidad total de 1000 mL del extracto (Pereira et al., 2014; Winter, 1965).
Extracción y purificación de flavonoides
Se midió 100 mL del extracto madre en un balón de 250 mL y se llevó a sistema de reflujo durante dos horas con 100 mL de ácido sulfúrico al 10%. Se concentró el extracto hidrolizado a la mitad del volumen utilizando un rotaevaporador a 80ºC. Se llevó a refrigeración el concentrado a una temperatura de 2-8 ºC, durante 1 hora. Se filtró al vacío el extracto refrigerado utilizando papel filtro WATMAN # 1 previamente tarado y se lavó el residuo con 3 volúmenes sucesivos de 100 mL de agua destilada helada. Se llevó el papel filtro con los cristales de flavonoides totales, a la estufa a 40ºC durante 2 horas. Los cristales se pulverizaron y se realizó la preparación de las soluciones de flavonoides en Solución salina fisiológica, a las concentraciones de 0.2, 0.4 y 0.8 µg/ mL. Las soluciones obtenidas se guardaron en frascos ámbar.
Distribución e inducción de la inflamación en los animales de experimentación Mus musculus BALB/c
Se obtuvieron 16 ejemplares de Mus musculus BALB/c procedentes del Bioterio de la Universidad Cayetano Heredia, de 28 g de peso y 2 meses de edad. Éstos fueron distribuidos en 1 grupo control y 3 grupos experimentales, cada uno con 4 ejemplares.
Se inyectó vía intraperitoneal, 1 mL de solución de carragenanos al 2%, en cada uno de los ejemplares de Mus musculus BALB/c (Beall et al., 1992).
Inoculación de la solución de flavonoides extraídos de Equisetum bogotense en Mus musculus BALB/c
Después de 3 días de la inoculación de carragenanos, se inoculó vía intraperitoneal: 1 mL de Solución Salina al 0,85% de NaCl en el grupo de control; y 1mL de la solución de flavonoides de Equisetum bogotense a concentraciones de 0.2, 0.4 y 0.8 µg/mL, respectivamente para cada grupo experimental. Después de 3 días, se obtuvo una muestra de sangre periférica de cada ejemplar, se centrifugó a 5000 rpm por 10 minutos y se conservó a 4°C.
Determinación de la producción de TNF -α
Para la evaluación de los niveles de TNF-α se utilizó el suero obtenido de cada ejemplar de Mus musculus BALB/c y se realizó la prueba de ELISA, siguiendo el protocolo indicado en el inserto del Kit de Elisa Mouse Tumor TNF-α (Sigma-Aldrich, RAB0477), con una sensibilidad menor a 60 pg / mL y se procedió las lecturas a 450 nm en un lector de Elisa (Charo et al., 1994; Luster & Rothenberg, 1997; Rollins et al., 2006; Williams et al., 2017)including bone remodeling and injury. These cells appear at early stages of bone formation and repair and persist throughout the later stages. In experiments described here, unstimulated normal human osteoblastic cells did not produce detectable levels of monocyte chemotactic activity. However, interleukin-1 (IL-1.
Análisis estadístico
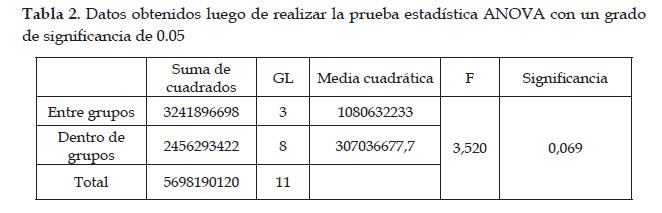
Los datos obtenidos de la experimentación se analizaron con el programa estadístico SPSS, mediante el análisis de varianza ANOVA, para saber el efecto de las diferentes concentraciones de flavonoides y, para determinar si hay diferencias estadísticas (p<0.05) entre los grupo de control y experimentales ( Leiva et al., 2019).
Resultados
Según los resultados obtenidos al analizar los datos experimentales con la prueba estadística ANOVA (Tabla 2), estos mostraron que no hay relación directa entre el aumento de la concentración de flavonoides extraídos de Equisetum bogotense y la disminución de los niveles de TNFα en la inflamación.
Discusión
Se utilizaron carragenanos como estímulo de la inflamación, debido a que se ha demostrado que éstos inducen una respuesta inflamatoria y pueden activar las respuestas inmunes que son medias por las células B (Bcl10) y los receptores Toll (TLR4) (Borthakur et al., 2006; Gründemann et al., 2014). En los animales experimentales se ha demostrado que inducen una inflamación colónica, con la producción de infiltrados inflamatorios, ulceraciones y evidencias clínicas de colitis (Bhattacharyya et al., 2008; Joanne, 2001)
Los carragenanos inducen la activación de la respuesta inmune innata en las células epiteliales del colon, para lo cual interactúan con sus receptores de tipo Toll (TLR4); de esta manera activan el factor nuclear NF-kB, el cual induce la activación de los genes responsables de la producción de interleucinas proinflamatorias, principalmente la IL-8 y el TNFα (Bhattacharyya et al., 2011). Los flavonoides presentes en Equisetum bogotense, inhiben la proliferación de linfocitos así como la polifuncionalidad de los mismos, que se relaciona directamente con los cambios en la producción de TNF-α, además inactivan el factor nuclear NF-kB, por lo que los niveles de TNFα en un proceso inflamatorio disminuyen (Bhattacharyya et al., 2010).
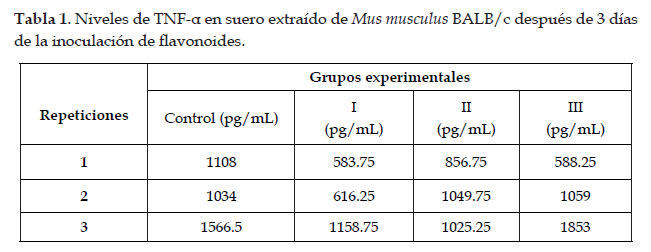
Según los resultados obtenidos, se observó que, en promedio, el efecto de los flavonoides a las concentraciones de 0,2 ug/mL; 0,4 ug/mL y 0,8 ug/mL ocasionaron una ligera disminución en los niveles de TNFα producido como respuesta a la inflamación inducida por carragenanos en Mus musculus BALB/c (Tabla 1), sin embargo, no se evidencia una diferencia significativa (p > 0.05) entre el aumento de dichas concentraciones y la disminución de TNF-α. Estos resultados difieren a los reportados en el artículo publicado por Gründemann et al. (2014), en el cual detalla que los flavonoides presentes en el extracto obtenido de la especie Equisetum arvense presentó un efecto antiinflamatorio, disminuyendo significativamente los niveles de TNFα (Bhattacharyya et al., 2010).
Consideraciones éticas
En este estudio, el manejo de los ratones Mus musculus BALC/c para la experimentación en el laboratorio, se aplicaron durante el proyecto las normas y los procedimientos éticos según el Guía de manejo y cuidado de animales de Laboratorio propuesto por el Instituto Nacional de Salud (Fuentes et al., 2008)
Agradecimientos
Nuestra gratitud al Laboratorio ESCALABS por permitirnos desarrollar una parte de la fase experimental durante el desarrollo de la prueba de elisa del proyecto de investigación. Al doctor Segundo Eloy Lopez Medina por la asesoría en la recolección de la planta Equisetum bogotense y su extracción de flavonoides.
Contribución de los autores
C. Q.: Elaboración del artículo, realización de la fase experimental, análisis de datos, elaboración del informe final; N. L.: Realización de la fase experimental, análisis de datos, elaboración del informe final; E. B.: Realización de la fase experimental; W. P.: Realización de la fase experimental; F. P.: Realización de la fase experimental, análisis de datos; M. L.: Preparación del artículo, revisión crítica. Todos los autores leyeron y aprobaron el manuscrito final.
Conflicto de los autores
Los autores declaran no tener conflicto de intereses.
Citación: Quiñones, C.; N. Lucas; E. Benites; F. Calixto; W. Payano & M. Luján. 2019. Efecto de los flavonoides extraídos de Equisetum bogotense (Equisetaceae) sobre los niveles de TNF-α en la inflamación inducida experimentalmente en Mus musculus BALB/c. Arnaldoa 26 (3): 1075-1082 2019. http://doi.org/10.22497/arnaldoa.263.26314
Literatura citada
Beall, C.; S. Mahajan & E. Kolattukudys. 1992. Conversion of Monocyte Chemoattractant Protein1 into. The Journal of Biological Chemistry, 267(5): 3455–3459. [ Links ]
Bhattacharyya, S.; L. Xue; S. Devkota; E. Chang & T. Morris. 2013. Carrageenan-Induced Colonic Inflammation Is Reduced in Bcl10 Null Mice and Increased in IL-10-Deficient Mice. Mediators of Inflammation, 2013. 13 pp. [ Links ]
Bhattacharyya, S.; A. Borthakur; A. N. Anbazhagan; S. Katyal; P. K. Dudeja & J. K. Tobacman. 2011. Specific effects of BCL10 Serine mutations on phosphorylations in canonical and noncanonical pathways of NF-κB activation following carrageenan. American Journal of Physiology. Gastrointestinal and Liver Physiology, 301(3): G475-86. [ Links ]
Bhattacharyya, S.; R. Gill; L. C. Mei; F. Zhang; R. J. Linhardt; P. K. Dudeja, & J. K. Tobacman. 2008. Toll-like receptor 4 mediates induction of the Bcl10-NFκBinterleukin-8 inflammatory pathway by carrageenan in human intestinal epithelial cells. Journal of Biological Chemistry, 283(16): 10550– 10558. [ Links ]
Bhattacharyya, S.; H. Liu; Z. Zhang; M. Jam; P. K. Dudeja; G. Michel; R. J. Linhardt; J. K. Tobacman. 2010. Carrageenan-induced innate immune response is modified by enzymes that hydrolyze distinct galactosidic bonds. Journal of Nutritional Biochemistry, 21(10): 906–913. [ Links ]
Borthakur, A.; S. Bhattacharyya; P. K. Dudeja & J. K. Tobacman. 2006. Carrageenan induces interleukin-8 production through distinct Bcl10 pathway in normal human colonic epithelial cells. American Journal of Physiology-Gastrointestinal and Liver Physiology, 292(3): G829–G838. [ Links ]
Carneiro, D. M.; R. C. Freire; T. C. D. D. Honório; I. Zoghaib; F. F. D. S. E. S. Cardoso; L. M. F. Tresvenzol; J. Realino de Paula; A. L. L. Sousa; P. C. B. V. Jardim; L. C. Da. Cunha. 2014. Randomized, double-blind clinical trial to assess the acute diuretic effect of equisetum arvense (field horsetail) in healthy volunteers. Evidence-Based Complementary and Alternative Medicine. [ Links ]
Charo, I. F.; S. J. Myers; A. Herman; C. Franci; A. J. Connolly & S. R. Coughlin. 1994. Molecular cloning and functional expression of two monocyte chemoattractant protein 1 receptors reveals alternative splicing of the carboxyl-terminal tails. Proceedings of the National Academy of Sciences of the United States of America, 91(7): 2752–2756. [ Links ]
Corti, A.; P. Ghezzi; P. Villa; & P. Ghezzi. 2004. Animal Models of Endotoxic Shock. Tumor Necrosis Factor, 98(1): 199–206. [ Links ]
D’Agostino, M.; A. Dini; C. Pizza; F. Senatore & R. Aquino. 1985. Sterols from Equisetum arvense. Bollettino Della Società Italiana Di Biologia Sperimentale, 60: 2241–2245.
Fuentes, F.; R. Mendoza; A. Rosales & A. Cisneros 2008. Guia de manejo y cuidado de animales de laboratorio: Raton. Instituto nacional de salud. [ Links ]
Gründemann, C.; K. Lengen; B. Sauer; M. GarciaKäufer; M. Zehl & R. Huber. 2014. Equisetum arvense (common horsetail) modulates the function of inflammatory immunocompetent cells. BMC Complementary and Alternative Medicine, 14(1): 4–13. [ Links ]
Hassimotto, N. M. A.; V. Moreira; N. G. Nascimento ; P. C. M. C. Souto; C. Teixeira & F. M. Lajolo. 2013. Inhibition of Carrageenan-Induced Acute Inflammation in Mice by Oral Administration of Anthocyanin Mixture from Wild Mulberry and Cyanidin-3-Glucoside. BioMed Research International, 2013: 1–10. [ Links ]
Joanne, K. T. 2001. Review of harmful gastrointestinal effects of carrageenan in animal experiments. Environmental Health Perspectives, 109(10): 983– 994. [ Links ]
Kiasalari, Z.; M. Khalili; M. Roghani; H. Heidari & Y. Azizi. 2013. Antiepileptic and Antioxidant Effect of Hydroalcoholic Extract of Ferula Assa Foetida Gum on Pentylentetrazoleinduced Kindling in Male Mice. Basic and Clinical Neuroscience, 4(4): 299–306. [ Links ]
Leiva, S. M.; V. V. Moya & D. E. Mejía. 2019. Efecto ansiolítico in vivo del extracto etanólico de Passiflora salpoense S. Leiva & Tantalean (Passifloraceae) en "ratones albinos" Balb/c. Arnaldoa, 26(1): 391– 408. [ Links ]
Luster, A. D. & M. E. Rothenberg. 1997. Role of the monocyte chemoattractant protein and eotaxin subfamily of chemokines in allergic inflammation. Journal of Leukocyte Biology, 62(5): 620–633. [ Links ]
Mazzon, E.; E. Esposito; R. Di Paola; C. Muià; C. Crisafulli; T. Genovese; R. Caminiti; R. Meli; P. Bramanti & S. Cuzzocrea. 2008. Effect of tumour necrosis factor-α receptor 1 genetic deletion on carrageenan-induced acute inflammation: A comparison with etanercept. Clinical and Experimental Immunology, 153(1): 136–149. [ Links ]
Mimica-Dukic, N.; N. Simin; J. Cvejic; E. Jovin; D. Orcic & B. Bozin. 2008. Phenolic compounds in field horsetail (Equisetum arvense L.) as natural antioxidants. Molecules, 13(7): 1455–1464. [ Links ]
Pereda, J.; L. Sabater; L. Aparisi; J. Escobar; J. Sandoval; J. Viña; G. Lopez-Rodas & J. Sastre. 2006. Interaction Between Cytokines and Oxidative Stress in Acute Pancreatitis. Current Medicinal Chemistry, 13(23): 2775–2787. [ Links ]
Pereira-Filho, A. A.; C. R. C. FranÇa; D. da S. Oliveira; R. J. de A. Mendes; J. de R. S. Gonçalves & I. G. Rosa. 2014. Avaliação do potencial moluscicida de extratos hidroalcoólicos do caule, folhas e frutos de Jatropha gossypiifolia Linnaeus, 1753 em Biomphalaria glabrata (Say, 1818). Revista Do Instituto de Medicina Tropical de Sao Paulo, 56(6): 505–510. [ Links ]
Rämer, P. C.; O. Chijioke; S. Meixlsperger; C. S. Leung & C. Münz. 2011. Mice with human immune system components as in vivo models for infections with human pathogens. Immunology and Cell Biology, 89(3): 408–416. [ Links ]
Rollins, B. J.; E. D. Morrison & C. D. Stiles. 2006. Cloning and expression of JE, a gene inducible by platelet-derived growth factor and whose product has cytokine-like properties. Proceedings of the National Academy of Sciences, 85(11): 3738– 3742. [ Links ]
Shen, H.M. & S. Pervaiz. 2006. TNF receptor superfamily-induced cell death: redox-dependent execution. The FASEB Journal, 20(10): 1589–1598. [ Links ]
Shultz, L. D.; M. A. Brehm; J.V. Garcia-Martinez & D. L. Greiner. 2012. Humanized mice for immune system investigation: Progress, promise and challenges. Nature Reviews Immunology, 12(11): 786–798. [ Links ]
Smith-Hall, C.; H. O. Larsen & M. Pouliot. 2012. People, plants and health: A conceptual framework for assessing changes in medicinal plant consumption. Journal of Ethnobiology and Ethnomedicine, 8: 1–11. [ Links ]
Sofowora, A.; E. Ogunbodede & A. Onayade. 2013. The role and place of medicinal plants in the strategies for disease prevention. African Journal of Traditional, Complementary, and Alternative Medicines : AJTCAM / African Networks on Ethnomedicines, 10(5): 210–229. [ Links ]
Warren, S. & J. K. Ward. 1988. Tumor necrosis factor: a plurifunctional mediator of acute inflammation. Modern Pathology, 1: 242–247. [ Links ]
Williams, S. R.; Y. Jiang; D. Cochran; G. Dorsam & D. T. Graves. 2017. Regulated expression of monocyte chemoattractant protein-1 in normal human osteoblastic cells. American Journal of Physiology-Cell Physiology, 263(1): C194–C199. [ Links ]
Winter, F. L. 1965. Reaction Thresholds To Pressure In Edematous Hindpaws Of Rats And Responses To Analgesic Drugs. Journal of Pharmacology and Experimental Therapeutics, 150: 165–171. [ Links ]
Recibido: 15-VII-2019
Aceptado: 26-VIII-2019
Publicado online: 31-IX-2019
Publicado impreso: 30-XII-2019