Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.26 no.3 Trujillo set./dic. 2019
http://dx.doi.org/10.22497/arnaldoa.263.26318
ARTÍCULOS ORIGINALES
Evaluación de digestibilidad proteica in vivo e in vitro utilizando Saccharomyces cerevisiae (Saccharomycetaceae) como organismo modelo
Evaluation in vivo and in vitro protein digestibility using Saccharomyces cerevisiae (Saccharomycetaceae) as a model organism
Víctor Javier Vásquez Villalobos1,a ORCID: 0000-0002-9625-8385, Carmen Rosa Rojas Padilla1,b ORCID: 0000-0001-8359-0082, Manuela Natividad Luján Velásquez2 ORCID: 0000-0002-4765-7961, Milagros A. Cholán Rodríguez3 ORCID: 0000-0001-7086-6545, Leylan A. Mercedes Chávez 3 ORCID: 0000-0002-9558-4445, Julia Desiré Vásquez Angulo4 ORCID: 0000-0002-9951-6327
1 Departamento de Ciencias Agroindustriales, Universidad Nacional de Trujillo. Av. Juan Pablo II s/n., Trujillo, PERÚ
2 Departamento de Microbiología y Parasitología, Universidad Nacional de Trujillo. Av. Juan Pablo II s/n., Trujillo, PERÚ mlujan@unitru.edu.pe
3 Laboratorio de Biomoléculas, Departamento de Ciencias Agroindustriales, Universidad Nacional de Trujillo. Av. Juan Pablo II s/n., Trujillo, PERÚ
4 Departamento Académico de Ciencia y Tecnología de Alimentos, Universidad Nacional de la Amazonía Peruana. Sargento Lores 385, Iquitos, PERÚ juliavasquez721@gmail.com
Resumen
Se evaluó la digestibilidad proteica aparente (DA) de harina y soluciones de harina de "garbanzo" (GD) Cicer arietinum L. in vivo empleando "ratones albinos" de laboratorio (Mus musculus BALB/C) e in vitro empleando Saccharomyces cerevisiae (Saccharomycetaceae) como organismo modelo, utilizando el medio YPD (extracto de levadura, peptona, dextrosa) a pH 5.8 como control. Los medios GD fueron preparados con y sin enzima ajustada a valores de pH de 5.8, 5.5, 4.6, 3.8, 2.8, 2.3 Y 2.0. El organismo modelo fue sembrado en placas Petri con medios YDP y GD, incubado a 30ºC por 24 h. Se utilizó ratones en 5 grupos de trabajo con 2 especímenes por grupo, alimentados con dietas a base de avena comercial, harina de maíz y 4, 8, 12% de harina de "garbanzo". Se suministró una ración de 20 g/d durante 15 días, al final se recogieron las heces y se determinó el contenido de nitrógeno y proteína por el método de Kjeldahl. La DA in vitro obtenida con el organismo modelo a partir de GD a pH 5.8 con adición de enzima, mostró un valor de 66.5±11. 9%. La DA obtenida in vivo con "ratones albinos" utilizando harina de "garbanzo" entre 4 a 12%, mostraron valores entre 80,0 y 83,5% con p<0.05. Se observó la viabilidad de utilizar evaluación de DA utilizando S. cerevisiae, la cual debe ser ampliada con investigaciones adicionales, debido a que constituye una alternativa de bajo costo, que ayudaría a superar limitaciones y objeciones éticas por el uso de animales.
Palabras clave: digestibilidad aparente, digestibilidad verdadera, organismos modelo, "garbanzo" Cicer arietinum L.
Abstract
The apparent protein digestibility (AD) of flour and solutions of chickpea flour (GD) (Cicer arietinum L.) in vivo was evaluated using albino laboratory mice (Mus musculus BALB / C) and in vitro using Saccharomyces cerevisiae (Saccharomycetaceae) as the model organism, using the YPD medium (yeast extract, peptone, dextrose) at pH 5.8 as control. The GD media were prepared with and without enzyme adjusted to 5.8, 5.5, 4.6, 3.8, 2.8, 2.3 and 2.0 pH values. The model organism was seeded in Petri dishes with YDP and GD media, incubated at 30ºC for 24 h. Mice were used in 5 working groups with 2 specimens per group, fed diets based on commercial oats, corn flour and 4, 8, 12% chickpea flour. A 20 g/d ration was given for 15 days, at the end the feces were collected and the nitrogen and protein content was determined by the Kjeldahl method. The in vitro AD obtained with the model organism from GD at pH 5.8 with the addition of enzyme, showed a 66.5±11.9 % value. The AD obtained in vivo with "albino mice" using chickpea flour between 4 to 12%, showed values between 80,0 and 83,5% with p <0.05. We observed the feasibility of using DA evaluation using S. cerevisiae, which should be expanded with additional research, because it is a low cost alternative that would help overcome limitations and ethical objections for the use of animals.
Keywords: apparent digestibility, true digestibility, model organisms, chickpea Cicer arietinum L.
Introducción
La alimentación humana es un aspecto de interés y responsabilidad, frente a un entorno de mayor necesidad, disponibilidad, así como de calidad de alimentos. Siendo de suma importancia, la forma de determinar la cantidad y calidad de proteínas para satisfacer las necesidades nutricionales humanas, con el objeto de mantener la salud y bienestar de la población (FAO & FINUT, 2017). La calidad de proteína en la dieta se mide utilizando una variedad de métodos, muchos de los cuales están relacionados con respuestas de animales (a menudo "ratas") después de su alimentación con proteína. Estos métodos tienen la ventaja de reflejar el suministro de aminoácidos y la digestibilidad de la proteína, que son dos factores importantes en la evaluación proteica. Para proteína dietética se considera importante considerar la demanda de aminoácidos y su digestibilidad potencial (Boye et al., 2012). Durante muchos años, han sido empleados Test de crecimiento utilizando ratas (PER: Protein Efficiency Ratio, NPR: Net Protein Ratio o NPU: Net Protein Utilization), estas pruebas sufren la desventaja que las "ratas" pueden presentar necesidades diferentes de aminoácidos que los seres humanos. En este sentido, el análisis de balance de nitrógeno en "ratas", tales como evaluación de digestibilidad, puede proporcionar resultados que son más directamente relevantes a los seres humanos (Schaafsma, 2012).
En 1989, consultores expertos sobre evaluación de la calidad de la proteína de la FAO/WHO recomendaron el uso del método de Digestibilidad de la Proteína Corregida por la Puntuación de Aminoácidos (Protein Digestibility Corrected Amino Acid Score PDCAAS), que considera tanto el contenido del aminoácido indispensable en el test de proteína y su digestibilidad (Schaafsma, 2012; Boye et al., 2012; Leser, 2013). La digestibilidad ileal es más apropiada para la cuantificación de la digestión, debido a que la digestibilidad verdadera de nitrógeno fecal, no toma en cuenta los aminoácidos esenciales que se pierden en el colon, a través de la actividad de la flora intestinal (Schaafsma, 2012). Sin embargo, ensayos de "ratas" para digestibilidad verdadera se han utilizado, en parte debido a su practicidad en comparación con el uso de cerdos con fistura ileal. Por otro lado, experimentos in vivo tienen altos costos y mayor tiempo para el desarrollo experimental (aproximadamente 10 días como mínimo), así como objeciones éticas por el uso de animales. Por esta razón, el empleo de métodos alternativos in vitro deben ser considerados y desarrollados para mejorar las correlaciones con los ensayos in vivo (Tavano et al., 2016).
Expertos de la FAO/WHO han recomendado revisar las ventajas y desventajas de métodos alternativos para evaluar la calidad de las proteínas e investigaciones adicionales de acuerdo con las necesidades emergentes y los nuevos progresos científicos. Así como, han encontrado similitudes en la capacidad de humanos y "ratas" para digerir alimentos, sugiriendo que el método de balance nitrogenado, en "ratas" es el método práctico más aconsejable para predecir la digestibilidad de la proteína en humanos (FAO & FINUT, 2017).
En este sentido los organismos modelo podrían constituir una posible alternativa para simular o entender procesos propios de los seres humanos. Según Karathia et al. (2011) el uso de organismos modelo para la investigación es un rasgo distintivo de la actividad científica. Los cuales se utilizan debido a que: a) pueden ayudar a superar las limitaciones éticas y experimentales, b) proporcionan un marco que permiten desarrollar y optimizar métodos analíticos para facilitar y estandarizar los análisis y, c) pueden representar una clase más grande de los seres vivos para cualquier proceso o fenómeno biológico de interés de la comunidad. La elección de un organismo modelo es a menudo guiada más por las dos primeras consideraciones, que por la última de ellas. Sin embargo, la selección de un organismo modelo basado en la experiencia técnica acumulada y en la disponibilidad de técnicas experimentales, no garantiza resultados representativos en otros organismos. En realidad, existe una brecha en el establecimiento de forma sistemática de cuan cercanos o diferentes son los organismos con respecto a un determinado proceso, por lo que se debe dilucidar antes de elegir uno de ellos. Tal elección debe tener en cuenta que los procesos de interés para la comparación, deben ser claramente identificados. Debiéndose establecer una medida cualitativa o cuantitativa para estimar la similitud entre los diferentes organismos con respecto a los procesos. Asimismo que los procesos de interés sean suficientemente bien caracterizados en los organismos alternativos, para que la medida pueda utilizarse para la comparación. Si se realiza rigurosamente, el uso del modelo, estaría caracterizado previamente como una herramienta extrapolable. De hecho, esta caracterización es el propósito de usar un organismo modelo. Por lo tanto, métodos que predicen racionalmente cómo similar, diferentes organismos, podrían ser necesarios con respecto a lo biológico en procesos de interés (Karathia et al., 2011).
En este sentido un organismo de interés es la levadura Saccharomyces cerevisiae (S. cerevisiae) (Saccharomycetaceae), la cual es uno de los organismos modelo eucariota más utilizado. Se ha empleado para estudiar el envejecimiento, regulación de la expresión génica, señales de transducción, ciclo celular, metabolismo, apoptosis, enfermedades neurodegenerativas y muchos otros procesos biológicos. Según Karathia et al. (2011) existen hasta el 30% de genes implicados en enfermedades humanas que pueden tener ortólogos (secuencias homólogas) en el proteoma de la levadura. La humanización sistemática de los genes de levadura, ha revelado funciones conservadas y modularidad genética. Según Kachroo et al. (2015) aproximadamente el 47% de los genes esenciales de la levadura pueden ser reemplazados por sus genes ortólogos humanos. Según estas características ventajosas Tucker & Fields (2001), han utilizado la levadura como una herramienta experimental para muchos estudios biológicos. El análisis de dos híbridos en levadura, han sido utilizados para su identificación a través de la interacción de biomoléculas funcionales mediante la interacción proteína-proteína. La levadura también se ha utilizado para el cribado de inhibidores químicos de proteínas humanas. Se han desarrollado varios métodos de cribado de alto rendimiento, tales como el cribado de estrógeno de levadura (Tucker & Fields, 2001).
Utilizando un modelo metabólico simple de S. cerevisiae, se ha encontrado una relación entre la tasa de absorción de amonio y la tasa de crecimiento de la biomasa teórica constante. Reportándose que el contenido de nitrógeno (relacionado con la producción de biomasa) no fue afectada claramente por la relación de C/N para las condiciones experimentales, donde al parecer no existe limitación de N. Sin embargo un valor bajo para la tasa de crecimiento mostró un alto contenido de N en la biomasa. En muy bajas concentraciones de N el contenido de proteína permaneció en el nivel más bajo y el rendimiento fue afectado (Rodríguez et al., 2004).
Meng et al. (2017) estudiaron la actividad antioxidante de fitoquímicos dietéticos utilizando S. cerevisiae como modelo. Reportaron las características antioxidantes de los componentes dietéticos en la levadura, utilizando "yerba mate", "té verde", propóleos, "arándanos", "achicoria roja", resveratrol, catequina, quercitina entre otros. Habiendo encontrado ciertas ventajas como: tiempo de generación corto y facilidad para el cultivo, así como observaron que la división y el crecimiento pueden ser controlados con eficacia, y que el sistema de desintoxicación ROS (Reactive Oxygen Species) se conserva altamente en la levadura. Concluyéndose que las investigaciones en la levadura son económicas y tienen un gran potencial para aplicaciones industriales. Entre las limitaciones se tiene: que el metabolismo y la absorción pueden ser diferentes en el cuerpo humano, asimismo que los niveles y concentraciones eficaces pueden ser diferentes. La levadura es un organismo unicelular y el humano es un organismo multicelular, y que la dieta fotoquímica no puede dirigirse con precisión a los tejidos o células en el cuerpo humano.
Dolezalova&Rumlova(2014)realizaron una prueba biológica de toxicidad de agua, basada en el seguimiento de los cambios de la conductividad específica de la suspensión de S. cerevisiae, como resultado de la inhibición de actividad de fermentación de levadura en condiciones tóxicas.
Los medios de cultivo son factores ambientales importantes en el crecimiento microbiano y afectan fuertemente varios procesos metabólicos celulares. En este sentido Kim & Kim (2017) utilizando metabolómica, investigaron el efecto de medios simples (caldo de nitrógeno a base de levadura) y complejo (caldo YP: extracto de levadura y peptona) en los perfiles metabólicos intracelulares de S. cerevisiae. Los medios tuvieron 2% de glucosa como única fuente de carbono. Cultivadas en estos medios, los análisis fueron realizados por cromatografía de gases/ espectrometría de masas con tiempo de vuelo. De los metabolitos intracelulares, 120 fueron identificados en la levadura, los niveles de aminoácidos, esenciales para la síntesis de proteína y el crecimiento celular, fueron significativamente mayores en los organismos que se desarrollaron en el cultivo con medio complejo, comparados con los que se desarrollaron en medio simple. En contraste, los niveles de azúcares, alcoholes de azúcar y los ácidos grasos, fueron significativamente superiores en los organismos cultivados en medios simples, comparados con los cultivados en medio complejo. En este sentido, los perfiles de metabolitos intracelulares demostraron ser dependientes del tipo de medios de cultivo. Estos resultados sugieren que las células preparan su metabolismo de supervivencia en medio simple, considerando que están activamente comprometidos para un rápido crecimiento en medio complejo.
Oprea et al. (2014) investigaron la acción quimioprotectiva de extractos de "arándano" contra la toxicidad de cadmio usando una cepa de S. cerevisiae extremadamente sensible al cadmio. Utilizaron cuatro variedades de "arándanos", encontrando que los extractos con elevado contenido de antocianidinas totales, exhiben un efecto protector significativo contra la toxicidad del cadmio y H2O2. Tanto los extractos de los "arándanos", como el flavonoide cianidina pura, exhibieron efectos protectores contra el cadmio en forma de dosis dependiente, sin interferir significativamente con la acumulación de cadmio en las células de levadura.
Haraldsson et al. (2005) estudiaron la hidrólisis del fitato extracelular (mio- inositol hexakisfosfato, InsP6) con cepas de levadura de alta fitasa y su supervivencia en condiciones digestivas simuladas, utilizando levadura en medio de cultivo dextrosa peptona y "trigo" como alimento modelo. La digestión in vitro fue modificada para mejor correlación con el gradiente del pH gástrico, simulando el consumo del alimento in vivo. S. cerevisiae ha demostrado ser notablemente ácido tolerante, resistir valores de pH tan bajos como 1.0 hasta por 4 h. También ha demostrado sobrevivir a las enzimas gástricas, sales biliares y cambios en el pH producidos en una simulación de digestión humana (Scevola et al., 2003). La levadura de alta fitasa produjo una fuerte reducción de fitato (mio-inositol hexakisfosfato InsP6) de 60% en la fase gástrica temprana, comparada con la no degradación por cepas de tipo salvaje. El nivel de degradación durante la digestión del InsP6, fue influenciado por el tipo de cepa, densidad celular y concentración de InsP6. A pesar de la alta solubilidad del InsP6, se observó alta resistencia a la proteólisis por pepsina, elevada supervivencia celular y la degradación en las últimas fases intestinales gástricas y tempranas, fue insignificante. La dependencia del pH para expresión de la fitasa, parece ser un factor importante y limitante. Los resultados demuestran el potencial del uso de la levadura como un portador de fitasa en el tracto gastrointestinal.
En este sentido, los organismos modelo podrían constituir una posible alternativa para simular o entender procesos propios de los seres humanos, debido a que pueden ayudar a superar las limitaciones éticas y experimentales, proporcionando un marco que permita desarrollar y optimizar métodos analíticos. Permitiendo estandarizar los análisis aplicables a cualquier proceso o fenómeno biológico de interés de la comunidad. En el presente proyecto de investigación, se planteó utilizar S. cerevisiae como organismo modelo de digestibilidad proteica in vitro de harina de "garbanzo", en comparación con el método tradicional in vivo de determinación de digestibilidad proteica, que utiliza "ratas" o "ratones" de laboratorio. En este contexto, en la presente investigación se tuvo como objetivos evaluar la analogía de la digestibilidad proteica de harina y soluciones de harina de "garbanzo" Cicer arietinum L. in vivo empleando "ratones albinos" de laboratorio (Mus musculus BALB/C) e in vitro empleando Saccharomyces cerevisiae (Saccharomycetaceae) como organismo modelo.
Materiales y métodos
Materiales
"Garbanzo" Cicer arietinum, cepa de Saccharomyces cerevisiae (Laboratorio de biomoléculas, Facultad de Ciencias Agropecuarias, UNT), agar Sabouraud para manutención de cepa. Cloranfenicol en cápsula, conteniendo: 7 mg de clorhidrato de metoclopramida, 30 mg de dimeticona, 25 mg de ácido dehidrocólico. Enzima en cápsula, conteniendo: clorhidrato de metoclopramida 7 mg, dimeticona 30 mg, ácido dehidrocólico 25 mg, enzimas digestivas de origen fungal: pancreatina 4-NF proteasa 40 mg; celulasa 30 UI; pepsina 100 UI; lipasa 100 UI; amilasa 5600 UI; excipientes c.s.p.
Colorantes: Violeta de genciana, safranina, azul de metileno con los reactivos: Lugol, alcohol acetona.
"Ratones albinos" (Mus musculus BALB/C), machos destetados, con peso 20±2.0 g alimentados con una dieta estándar de laboratorio para un período de aclimatación de 2 días, colocándose un "ratón" por jaula.
Medio de cultivo control pH 5.8 (YPD): 1% extracto de levadura, 2% de peptona, 2% dextrosa, 1.5% de agar y 0.16 % de cloranfenicol.
Medio de cultivo con harina de garbanzo (GD): solución obtenida a partir de 3% de harina de "garbanzo" (fuente de proteína), 2% dextrosa, 1,5% de agar, 0,16 % de cloranfenicol y 0,0024 % de enzima agregada después de la esterilización del medio, asimismo se utilizó otro medio sin enzima. Los medios de cultivo fueron ajustados a valores de pH 5.8, 5.5, 4.6, 3.8, 2.8, 2.3 y 2.0, los cuales fueron previamente filtrados al vacío y centrifugados a 600 rpm por 15 min, con el objeto de obtener un medio que facilite posterior a la incubación el recuento de colonias. También, se agregó 1 mL de azul de metileno a algunas diluciones de siembra para diferenciar las colonias durante el recuento en placa.
Material de vidrio: Probetas 2 L, pipetas 10 mL, placas petri, balones 500 mL, matraces de 2 L, tubos de ensayo de 15 mL, mecheros.
Equipos
Autoclave vertical Fravill 905070, incubadora de laboratorio controlada por Arduino (ILCA) (Herrera-German et al., 2018), balanza analítica digital Precision 200/0.0001 g, centrífuga Hettich EBA20-6000 rpm, microscopio óptico Motic BA310, pH-metro HACH sesión 1, espectrofotómetro Unico 4802 UV/VIS, agitador orbital BioMarker BS-E24-1004, 50-250 rpm, capacidad de carga 2 kg, jaulas metabólicas individuales de 45x35x25 cm. de alto.
Metodología
Obtención de la harina de "garbanzo" Cicer arietinum L.: Semillas de "garbanzo" se remojaron 24 h en agua destilada a 4 ºC, fueron descascarados, secadas en una estufa a 60°C por 6 h para luego ser pulverizadas y tamizadas con malla mesh- 60. Finalmente se almacenaron en bolsas herméticas a temperatura ambiente para ser utilizadas posteriormente.
Siembra del organismo modelo (S. cerevisiae): Se empleó cepas de levadura S. cerevisiae mantenidas en agar Sabouraud de las cuales se procedió a tomar una muestra con asa de platino disolviéndose en una suspensión de NaCl 0.9%, las que fueron preparadas a una concentración correspondiente a DO de 610 nm, en un volumen a 50 mL. De la que se tomó un 1 mL y se colocó en 9 mL de agua estéril, agitándose para uniformizarla, realizándose seguidamente diluciones de 10-4 y 10-5, de la que se procedió a sembrar 0.1 mL en la superficie de placas petri con medios nutritivos YDP y GD, incubándose a 30ºC por 24 h, para obtener y evaluar posteriormente las Unidades Formadoras de Colonia (UFC) en los diversos tratamientos.
Determinación del nitrógeno: Se empleó el método de Kjeldahl (AOAC, 1990). La proteína cruda se calculó empleando el factor Nx6.25.
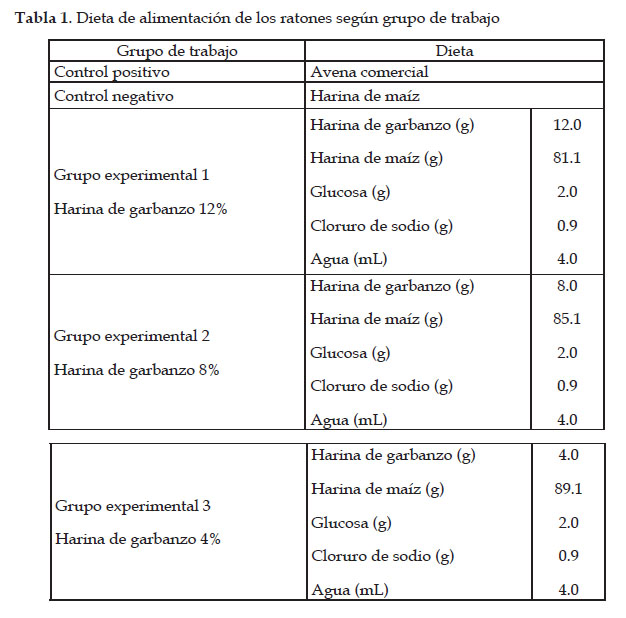
Digestibilidad proteica de "garbanzo" in vivo con "ratones" de laboratorio: Después de período de aclimatación de dos días, los "ratones" fueron divididos aleatoriamente en 5 grupos de trabajo de 2 especímenes cada grupo de acuerdo a lo indicado seguidamente y según dietas mostradas en la Tabla 1.
Grupo control positivo: Alimentados con una dieta a base de "avena" comercial.
Grupo control negativo: Alimentados con una dieta libre de proteína a base de harina de "maíz".
Grupo experimental 1: Alimentados con una dieta a base de harina de "garbanzo" 12%.
Grupo experimental 2: Alimentados con una dieta a base de harina de "garbanzo" 8%.
Grupo experimental 3: Alimentados con una dieta a base de harina de "garbanzo" 4%.
Los especímenes fueron alojados en jaulas individuales, en una habitación mantenida a 24±1 °C y 50-60% de humedad relativa, con un ciclo de 12 h luz/oscuridad (Tavano et al., 2008). La alimentación se realizó de acuerdo a dietas modificadas para el crecimiento de los "ratones" de acuerdo (dieta AIN-9) (Reeves et al., 1993), excepto el contenido de proteína. El agua fue proporcionada ad libitum. Los "ratones" fueron alimentados con una ración de 20 g por día durante 15 días. En los días 13 al 15 se recogieron las heces de cada uno de los "ratones" para determinar el porcentaje de nitrógeno y proteínas en las heces según el método de Kjeldahl (A.O.A.C., 1990).
Para evaluar la digestibilidad proteica de la harina de "garbanzo" se determinó la Digestibilidad Verdadera (DV) y Digestibilidad Aparente (DA). La DV se calculó empleando la siguiente fórmula:
El consumo de N se halló multiplicando el contenido de N (%) por el consumo de alimento (g). El N fecal multiplicando el contenido de nitrógeno (%) por la cantidad (g) de heces. El N fecal metabólico se estimó determinando la cantidad de nitrógeno fecal excretado cuando el animal está consumiendo una dieta libre de proteína (Silva et al., 2003). La Digestibilidad Aparente (DA) se calculó considerando la DV sin el N metabólico (Malca et al., 2006).
Resultados
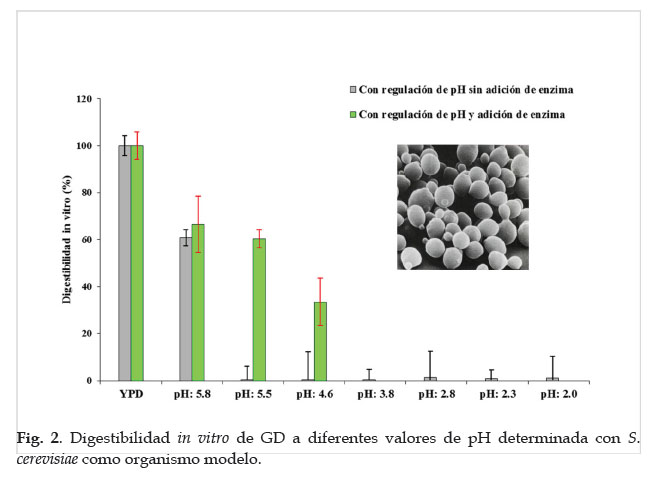
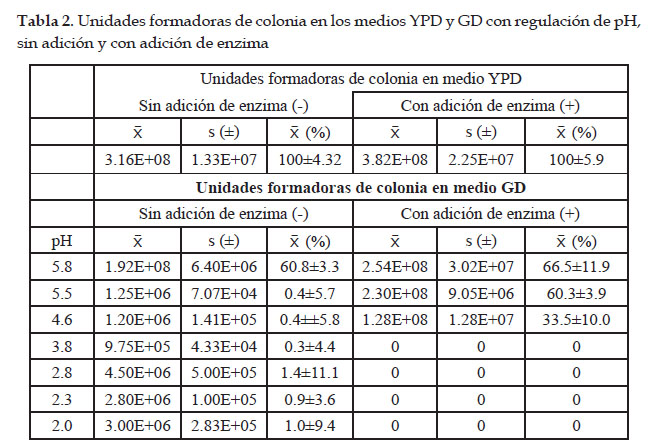
En la Fig. 1 se observa el crecimiento en placas Petri de colonias de S. cerevisiae en medio control (YPD) y medios con solución de harina de "garbanzo" (GD) a diferentes valores de pH sin y con adición de enzima. En la Tabla 1 los valores de las UFC en ambos medios. En donde las UFC sin adición de enzima (-) para YPD fue de 3.16E+08, en GD a diferentes valores de pH fue: a pH 5.8 de 1.92E+08, a pH 5.5 de 1.25E+06, a pH 4.6 de 1.20E+06, a pH 3.8 de 9.75E+05, a pH 2.8 de 4.50E+06, a pH 2.3 de 2.80E+06, a pH de 2.0 de 3.00E+06.
Las UFC con adición de enzima (+) para YPD fue de 3.82E+08, para GD a diferentes valores de pH fue: a pH 5.8 de 2.54E+08, a pH 5.5 de 2.30E+08, a pH 4.6 de 1.28E+08.
La determinación de las UFC para YPD y para GD a pH 5.8, 5.5 y 4.6 se realizó a las 24 horas después de haber sido incubadas, debido a que mostraron un rápido crecimiento a diferencia de los pH 3.8, 2.8, 2.3 y 2.0 que no mostraron crecimiento. En ambos casos se observó diferencias significativas (p<0.05).
Los resultados de los valores promedio de la Tabla 1 fueron graficados en la Fig. 2 como valores de digestibilidad in vitro (DA) con referencia al medio YPD (100%) los que igualmente mostraron diferencias significativas (p<0.05) entre los tratamientos sin enzima a valores de pH de 5.8, 5.5, 4.6, 3.8, 2.8, 2.3, 2.0; así con enzima YPD, a pH 5.8, 5.5 y 4.6. A un pH de 5.8 la digestibilidad de la solución de harina de garbanzo (GD) con presencia de enzima mostró un valor de 66.5±11.9%, sin enzima 60.8±3.3%. La disminución del pH del medio afecta la digestibilidad de GD, para el caso de tratamiento con enzima a partir de valores de pH de 4.6, y a valores menores de 3.8, la digestibilidad in vitro es insignificante. Sin presencia de enzima solo hay efecto a pH 5.8, a valores menores el efecto es muy bajo.
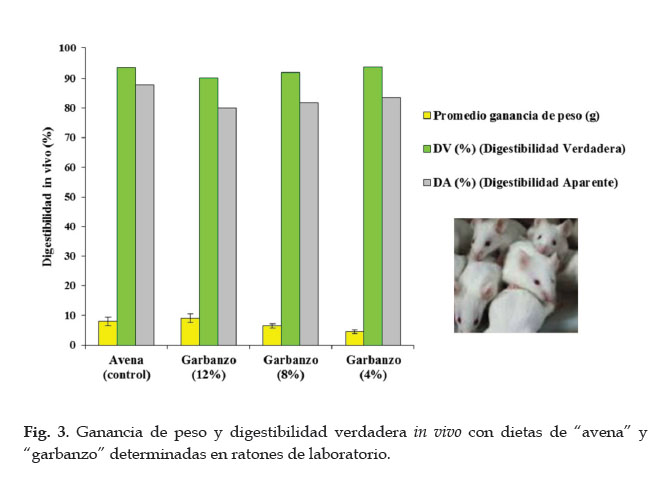
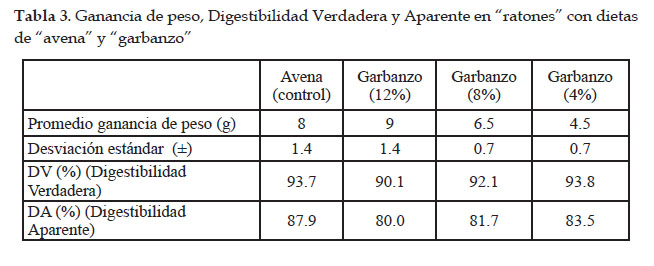
En la Fig. 3 se muestra la digestibilidad in vivo, observándose una disminución de ganancia de peso con referencia al control al disminuir el porcentaje de harina de "garbanzo" en las dietas de 12% al 4%. Asimismo, una digestibilidad verdadera (DV) para el control ("avena" comercial) mostró un valor de 93,7% y para las dietas utilizando de 12% a 4% de harina de "garbanzo", mostraron valores entre 90,1 y 93,8%. La Digestibilidad Aparente (DA) para el control fue de 87,9% y para las dietas utilizando de 12% a 4% de harina de "garbanzo", mostraron valores entre 80,0 y 83,5%. En ambos caso los resultados mostraron diferencias estadísticamente significativas (p<0.05).
Discusión
La composición del medio de cultivo influencia en la producción de biomasa del organismo modelo S. cerevisiae, conforme se observa en la Tabla 1 y Fig. 1. Reflejándose en una mejor biodisponibilidad del extracto de levadura con peptona que, en conjunto representan una proporción de 3% en el medio YPD con y sin enzima, comparado con el medio GD a diferentes valores de pH. El extracto de levadura es un autolizado de levadura que aporta según ficha técnica con proteína entre 62,5 a 73,8 %, aminoácidos, vitaminas y minerales; y la peptona es un hidrolizado enzimático animal de origen porcino con una mezcla de aminoácidos libres y péptidos que aporta según ficha técnica hasta con 81,8% de proteína y aminoácidos.
De acuerdo a Martin Barry (2005) las vías metabólicas de biosíntesis del organismo modelo se inician a partir de doce metabolitos precursores o intermediarios básicos, que mediante el consumo de ATP, nucleótidos reducidos (NADPH+H+), nitrógeno y azufre, se transforman en vitaminas, NADP+, cofactores y en unidades estructurales de las macromoléculas. Los doce metabolitos precursores constituyen un puente metabólico entre reacciones de degradación y de síntesis, y la biodisponibilidad del nitrógeno proteico es un elemento primordial.
La diferencia de capacidad de asimilación de materias con diferente contenido y tipo de proteína observadas en la Fig. 1, debe tomar en consideración la naturaleza propia de la levadura con diversidad de linajes. Al respecto Warringer et al. (2011) y Goddard & Greig (2015) sostienen, al perder contacto con nichos naturales, se adaptaron a entornos creados por el hombre. Las levaduras S. cerevisiae y sus parientes silvestres más cercanas, rastrean la base genética e importantes eventos de cambios fenotípicos. Por ejemplo según reporta Warringer et al. (2011) la población de S. cerevisiae en África Occidental es fenotípicamente única, con una abundancia extrema de alelos de bajo rendimiento, caracterizada por una señal de terminación de traducción prematura en Gal3 causando incapacidad para utilizar la galactosa. Hay que tener presente que las levaduras se han utilizado para fermentaciones de alimentos y bebidas durante miles de años y numerosas cepas diferentes están disponibles para cada proceso específico. Sin embargo, la naturaleza y el alcance de la diversidad fenotípica y genética así como sus adaptaciones específicas se han comenzado a dilucidar. En S. cerevisiae la domesticación es más pronunciada en las cepas de cerveza, probablemente porque viven continuamente en su nicho industrial, permitiendo solo una mezcla genética limitada con poblaciones silvestres y un contacto mínimo con ambientes naturales. En este sentido los genomas de levadura de cerveza muestran patrones complejos de domesticación y divergencia (Gallone et al., 2018).
Kim & Kim (2017) en un estudio sobre el efecto de un medio mínimo y complejo en los perfiles metabólico de S. cerevisiae, encontraron que los niveles de aminoácidos, esenciales para la síntesis de proteínas y el crecimiento celular, fueron significativamente más altos en el medio complejo que en los medios de cultivo mínimos. En contraste, los niveles de azúcares, alcoholes de azúcar y ácidos grasos mostraron ser significativamente más altos en los organismos cultivados en el medio mínimo que en el medio complejo. Estos resultados sugieren que las células preparan su metabolismo para la supervivencia en los medios mínimos, mientras que participan activamente en el rápido crecimiento de los medios complejos. De esto se puede explicar los resultados del crecimiento de S. cerevisiae en el medio YPD y GD mostrado en la Fig. 1 con la limitante que implica utilizar harina de "garbanzo" como fuente proteica de una forma menos eficiente que un medio puro con extracto de levadura y peptona como fuente proteica y dextrosa como fuente de carbono. En este sentido como mencionan Kim & Kim (2017) parece que los microorganismos cultivados en los medios mínimos tienden a acumular los metabolitos de almacenamiento de energía (ácidos grasos, azúcares y alcoholes de azúcar) para asegurar su supervivencia en condiciones de inanición y en los medios complejos, tienden a usar los aminoácidos para la síntesis de proteínas y el crecimiento celular.
En la Fig. 2, se observó que la enzima digestiva proteolítica presente en el medio mejora la digestibilidad proteica del organismo modelo hasta por 24 h que se realizó en conteo, a un pH no menor de 4,6; debido a una mayor actividad proteolítica. Existe el antecedente que S. cerevisiae ha demostrado ser notablemente tolerante a los ácidos, con valores de pH tan bajos como 1.0 por hasta 4 h (Scevola et al., 2003). Hay que tener en cuenta por otro lado que S. cerevisiae produce fitasa cuya actividad, se debe, al menos en parte, a la acción de las fosfatasas ácidas represibles (RAP, por sus siglas en inglés), que son secretadas por las células de levadura y, por lo tanto, permiten la hidrólisis del fitato (mio-inositol hexakisfosfato, InsP6) en medios de crecimiento (Haraldsson et al., 2005). Se reporta que el grano seco de "garbanzo" posee elevado contenido de proteína (17 a 22%), aumentando cuando es descascarado (25,3-28,9 %), asimismo posee una abundante cantidad de fitatos (Aguilar-Raymundo & Vélez- Ruiz, 2013). Los experimentos con animales han sugerido que el InsP6 en los alimentos vegetales contiene complejos con minerales esenciales en la dieta, como calcio, zinc, hierro y magnesio, y los hace biológicamente inaccesibles para su absorción (Reddy et al. 1982). Los complejos son más resistentes a la digestión proteolítica a bajo pH (Cheryan & Rackis, 1980). Por lo que no se descarta en el presente experimento la acción de la fitasa producida por el microrganismo modelo, para permitir la biodisponibilidad de los minerales mejorando su crecimiento, cuya acción a pH bajo no ha sido posible en contexto de 24 h de incubación a 30 ºC. Este criterio es variable ya que según los reportes de Haraldsson et al. (2005) diferentes cepas de levadura S. cerevisiae presentan diferencia en su capacidad de degradación de InsP6. Este aspecto es concordante con lo reportado por Landry et al. (2006), quienes mencionan que S. cerevisiae ocupa numerosos hábitats y que las poblaciones han adquirido importantes variaciones genéticas.
La digestibilidad verdadera de harina de garbanzo (DV) observada en la Tabla 2 y Fig. 3, indican que para el control 93,7% es un valor alto, asimismo mostró una mayor ganancia de peso (0,6 g/día), comparado con las dietas con harina de "garbanzo" presente en 12%, 8% y 4%, que mostraron una ganancia de peso menor de 0.53, 0.43 y 0.30 g/día, respectivamente. Los valores de DV de 90,1 a 93,8% de las dietas que utilizaron de 12% a 4% de harina de "garbanzo" mostraron valores de intermedios a ligeramente altos. La determinación de los valores de digestibilidad altos (93 a 100%), intermedios (86 a 92%) y bajos (70 a 85%) han sido reportados por (Singh & Singh, 1991; Alid et al. 1981; Hackler, 1979).
La Digestibilidad Aparente (DA) para el control de 87,9% y los valores de 80,0 y 83,5% utilizando de 12% a 4% de harina de "garbanzo", son menores debido a que no consideran en su estimación el N metabólico. De acuerdo a criterio de Silva et al. (2003), no basta con determinar el contenido proteico y digestibilidad aparente para evaluar la calidad de los insumos proteicos, sino que es necesario realizar evaluaciones biológicas como PER: Relación de Eficiencia Proteica, NPU: Utilización Neta de las Proteínas y DV: Digestibilidad Verdadera. En este caso tratando de encontrar una analogía solo se ha utilizado la DV y DA para referenciarlo con la digestibilidad determinada empleando el organismo modelo S. cerevisiae, en donde no se puede evaluar el consumo de N ni el N excretado como el caso de las ratones de laboratorio.
En este sentido la DA obtenida in vitro con el organismo modelo S. cerevisiae a pH 5,8 con adición de enzima con un valor de 66,5±11,9 %, es menor que la DA obtenida in vivo con ratones utilizando harina de "garbanzo", cuyos valores fueron entre 80,0 y 83,5%. Esto ha sido influenciado debido a que el medio de cultivo GD para el organismo modelo in vitro fue preparado por filtración y centrifugación para tener un caldo que facilite el posterior recuento en placa, así como la harina de "garbanzo" estuvo en una proporción del 3%, lo cual no permitió un mayor porcentaje en la DA. Por otro lado la DA in vivo con los ratones la proporción de harina de "garbanzo" utilizada fue de 4% a 12%.
Debido a que los mecanismos de absorción en humanos pueden ser diferentes que en levaduras, no está garantizado que resultados representativos obtenidos en levaduras sean extrapolables a seres humanos. De los resultados obtenidos con S. cerevisiae como organismo modelo para evaluar la digestibilidad proteica, en comparación con el método in vivo, permite inferir la existencia de analogía, la cual es recomendable sea ampliada con investigaciones adicionales, debido a que constituye una alternativa de bajo costo, que ayudaría a superar limitaciones experimentales y objeciones éticas por el uso de animales.
Agradecimientos
Expresamos nuestro agradecimiento a la Universidad Nacional de Trujillo por el financiamiento otorgado: Proyecto de Investigación-2018.
Contribución de los autores
V.V.: Dirección de la investigación, redacción y revisión, evaluación de la digestibilidad proteica del garbanzo in vitro; J.V.: Redacción y revisión final del texto; C.R.: Evaluación de la digestibilidad proteica del garbanzo in vitro; M.L.: Desarrollo experimental con ratas de laboratorio; L.M.: Mantenimiento de la cepa de Saccharomyces cerevisiae, preparación de medios de cultivo; M.L.: Evaluación de la digestibilidad proteica del garbanzo in vitro. Todos los autores hemos leído el manuscrito final y autorizamos su publicación.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Citación: Vásquez, V.; C. Rojas; M. Luján; M. Cholán; M. Mercedes & J. Vásquez. 2019. Evaluación de digestibilidad proteica in vivo e in vitro utilizando Saccharomyces cerevisiae (Saccharomycetaceae) como organismo modelo. Arnaldoa 26 (3): 1125-1142 2019. http://doi.org/10.22497/arnaldoa.263.26318
Literatura citada
Aguilar-Raymundo, V. G. & J. F. Vélez-Ruiz. 2013. Propiedades nutricionales y funcionales del "garbanzo" (Cicer arietinum L.). Temas selectos de Ingeniería de Alimentos. 7(2): 25-34. [ Links ]
Alid, G.; E. Yanez, E.; J. M. Aguilera; F. Monckeberg & C. O. Chichester. 1981. Nutritive value of an extrusion texturized peanut protein. Journal of food Science. 46(3): 948-949. [ Links ]
A.O.A.C (Association of Official Analytical Chemists). 1990. Official Methods of Analysis. 15th ed.; Association of Official Analytical Chemists: Arlington, VA. [ Links ]
Boye, J.; R. Wijesinha-Bettoni & B. Burlingame. 2012. Protein quality evaluation twenty years after the introduction of the protein digestibility corrected amino acid score method. The British Journal of Nutrition. 108: 183-211. [ Links ]
Cheryan, M. & J. J. Rackis. 1980. Phytic acid interactions in food systems. Critical Reviews in Food Science & Nutrition. 13(4): 297-335. [ Links ]
Martin Barry, A. M. D. 2005. Control de metabolismo de Saccharomyces cerevisiae en la síntesis de Glutatión. Doctoral dissertation, Granada: Universidad de Granada. [ Links ]
Dolezalova, J. & L. Rumlova. 2014. A new biological test of water toxicity–yeast Saccharomyces cerevisiae conductometric test. Environmental toxicology and pharmacology. 38(3): 977-981. [ Links ]
FAO & FINUT (Organización de la Naciones Unidas para la Alimentación y la Agricultura & Fundacion Iberoamerica de Nutrición). 2017. Evaluación de la calidad de las proteínas de la dieta en la nutrición humana. Consulta de expertos. Estudio FAO Alimentación y Nutrición 92. Pp. 240. [ Links ]
Gallone, B.; S. Mertens; J. L. Gordon; S. Maere; K. J. Verstrepen & J. Steensels. 2018. Origins, evolution, domestication and diversity of Saccharomyces beer yeasts. Current opinion in biotechnology. 49: 148-155. [ Links ]
Goddard, M. R. & Greig, D. 2015. Saccharomyces cerevisiae: a nomadic yeast with no niche?. FEMS yeast research. 15(3): 1-6. [ Links ]
Hackler, L. R. (1977). Methods of measuring protein quality: A review of bioassay procedure. Cereal Chemistry. 54(4): 984-995. [ Links ]
Haraldsson, A. K.; J. Veide; T. Andlid; M. L. Alminger & A. S. Sandberg. 2005. Degradation of phytate by high-phytase Saccharomyces cerevisiae strains during simulated gastrointestinal digestion. Journal of agricultural and food chemistry. 53(13): 5438- 5444. [ Links ]
Herrera-German, J.; Mercedes-Chávez, L. & Vásquez- Villalobos, V. (2018). Modificación de un horno eléctrico doméstico a incubadora de laboratorio controlada con Arduino. Agroindustrial Science, 8(1), 57-66. [ Links ]
Kachroo, A. H.; J. M. Laurent; C. M. Yellman; A. G. Meyer; C. O. Wilke & E. M. Marcotte. 2015. Systematic humanization of yeast genes reveals conserved functions and genetic modularity. Science. 348(6237): 921-925. [ Links ]
Karathia, H.; E. Vilaprinyo; A. Sorribas & R. Alves, R. 2011. Saccharomyces cerevisiae as a Model Organism: A Comparative Study. PLoS one 6(2): 1-10. [ Links ]
Kim, J. & K. H. Kim. 2017. Effects of minimal vs. complex media on the metabolite profiles of Escherichia coli and Saccharomyces cerevisiae. Process Biochemistry. 57: 64-71. [ Links ]
Landry C. R.; J. P. Townsend; D. L. Hartl & D. Cavalieri. 2006. Ecological and evolutionary genomics of Saccharomyces cerevisiae. Molecular ecology. 15(3): 575-591. [ Links ]
Leser, S. 2013. The 2013 FAO report on dietary protein quality evaluation in human nutrition: Recommendations and implications. Nutrition Bulletin. 38(4): 421-428. [ Links ]
Malca, O.; A. Lucas; F. Arbaiza; C. Carcelén & H. San Martín. 2006. Comparación de dos técnicas para determinar la digestibilidad proteica de insumos y alimentos comerciales para caninos. Revista de Investigaciones Veterinarias del Perú, 17(2), 96- 103. [ Links ]
Meng, D.; P. Zhang; S. Li; C. T. Ho & H. Zhao. 2017. Antioxidant activity evaluation of dietary phytochemicals using Saccharomyces cerevisiae as a model. Journal of functional foods. 38: 36-44. [ Links ]
Oprea, E.; L. L. Ruta; I. Nicolau; C. V. Popa; A. D. Neagoe & I. C. Farcasanu. 2014. Vaccinium corymbosum L. (blueberry) extracts exhibit protective action against cadmium toxicity in Saccharomyces cerevisiae cells. Food Chemistry. 152: 516-521. [ Links ]
Reddy, N. R.; S. K. Sathe & D. K. Salunkhe. 1982. Phytates in legumes and cereals. Advances in food research. 28: 1-92. [ Links ]
Reeves, P. G.; F. H. Nielsen & G. C. Fahey Jr. 1993. AIN-93 purified diets for laboratory rodents: Final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN- 76A rodent diet. Journal. Nutrition. 123(11): 1939- 1951. [ Links ]
Rodriguez, J.; I. Perne; K. Schmidt & C. Posten. 2004. Simple Metabolic Model of Saccharomyces Cerevisiae in Fed-Batch Culture to Study the Cellular Nitrogen Uptake. IFAC Proceedings Volumes. 37(3): 153-158. [ Links ]
Schaafsma, G. 2012. Advantages and limitations of the protein digestibility-corrected amino acid score (PDCAAS) as a method for evaluating protein quality in human diets. The British Journal of Nutrition. 108: 333-336. [ Links ]
Scevola, D.; L. Perversi; C. Cavanna; C. Candiani; F. Uberti; B. Castiglioni & P. Marone. 2003. Acid tolerance and fecal recovery following oral administration of Saccharomyces cerevisiae. Journal of chemotherapy. 15(2): 143-147. [ Links ]
Silva, W.; T. Arbaiza; F. Carcelén & O. Lucas. 2003. Evaluación biológica en ratas de laboratorio (Rattus norvegicus) de fuentes proteicas usadas en alimentos comerciales para perros. Revista de Investigaciones Veterinarias del Perú. 14(1): 18-23. [ Links ]
Singh, B. & U. Singh. 1991. Peanut as a source of protein for human foods. Plant Foods for Human nutrition. 41(2): 165-177. [ Links ]
Tavano, O. L.; S. I. da Silva Jr; A. Demonte & V. A. Neves. 2008. Nutritional responses of rats to diets based on chickpea (Cicer arietinum L.) seed meal or its protein fractions. Journal of agricultural and food chemistry. 56(22): 11006-11010. [ Links ]
Tavano, O. L.; V. A. Neves & S. I. da Silva Júnior. 2016. In vitro versus in vivo protein digestibility techniques for calculating PDCAAS (protein digestibility-corrected amino acid score) applied to chickpea fractions. Food Research International. 89(1): 756-763. [ Links ]
Tucker, C. L. & S. Fields. 2001. A yeast sensor of ligand binding. Nature Biotechnology. 19(11): 1042-1046. [ Links ]
Warringer, J.; E. Zörgö; F. A. Cubillos; A. Zia; A. Gjuvsland; J. T. Simpson; A. Forsmark; R. Durbin; S. W. Omholt; E. J. Louis; G. Liti; A. Moses & A. Blomberg. 2011. Trait variation in yeast is defined by population history. PLoS Genetics. 7(6): 1-15. [ Links ]
Recibido: 13-VI-2019
Aceptado: 29-VII-2019
Publicado online: 31-IX-2019
Publicado impreso: 30-XII-2019