Introducción
Swietenia macrophylla King (Meliaceae) "caoba" es un árbol maderero de los bosques neo-tropicales, se extiende desde el sur de México hasta la cuenca meridional amazónica de Bolivia, Brasil y Perú (Barrena & Vargas, 2004).Es considerada una de las especies maderables más valiosas del mundo, por ello su demanda crece y sobrepasa la oferta disponible aumentando la presión sobre esta especie, lo que ocasiona una disminución de las poblaciones naturales y su extinción comercial a lo largo de su área de distribución (Reynel et al., 2003).
Las poblaciones naturales de caoba se encuentran fraccionadas y aisladas, lo cual está produciendo una pérdida en la calidad genética de la especie (Campos et al., 2009). Un factor limitante es la baja germinación (10 al 70%) lo cual reduce su propagación sexual (Quinto et al., 2009), además de ensayos insuficientes de selección basados en características fenotípicas y genotípicas, resultan en plantaciones de alta heterogeneidad (Prado et al., 2012). Con este panorama diversas instituciones vienen promoviendo su reforestación y establecimiento de plantaciones a partir de su propagación vegetativa, pero en un área de dispersión reducida (Daquinta et al., 2004), lo cual no soluciona el mantenimiento de su homogeneidad.
El uso de las técnicas de cultivo in vitro en los programas de reforestación es una posibilidad que aliviaría la presión de deforestación porque a partir de segmentos nodales, se incrementaría de forma rápida el número de individuos, y de material vegetal genéticamente estable (Delgado et al., 2008; Gutiérrez & Oliva, 2003; Uribe et al., 2008). Además, el uso de auxinas, en esta técnica, ayuda a la diferenciación de las raíces; y las citoquininas estimulan la división y diferenciación celular, el crecimiento de las yemas laterales, el control de la biogénesis y función de los cloroplastos (Taiz & Zeiger, 2002; Yaronskaya et al., 2006), la expansión de los cotiledones, así como la inducción de la formación de brotes en cultivos vegetales (Ascón -Bieto & Talón, 2013; Martinez, 2002).
Las experiencias, en el país, sobre la micropropagación de caoba está limitada a las tesis de Gómez (2008) que utilizó diferentes concentraciones de BAP, ANA y AIA sin encontrar diferencias en la longitud del brote, número de nudos y número de hojas y el trabajo de Valdivia (2010) demostró que 0,5 mg. L-1 de BAP induce 3,3% de explantes brotados. Sobre las experiencias internacionales tenemos el de Carranza et al. (2013) quienes controlaron la contaminación por microorganismos con 15 g de Ca(ClO)2. Y obtuvieron el 70% de brotes con 2 mg. L-1 de BAP en combinación con 1 mg. L-1 de AIB, no obtuvo enraizamiento cuando utilizó ANA. Según Rodriguez et al. (2003), trabajando con caoba y cedro, al utilizar 6-Bencilaminopurina a 0,50 mg. L-1 se obtiene mayor calidad de los explantes y buenos niveles de multiplicación en ambas especies. Además, reportan que con el ácido indolbutírico a 0.50 mg. L-1 el enraizamiento logró resultados muy favorables, también Collado et al (2004) lograron el establecimiento de vástagos vigorosos de caoba con una concentración de 0.2 mg. L-1 6-BAP, en cambio Rojas-Vargas & HineGómez (2019) no encontrando diferencias significativas en la inducción de brotes cuando utilizaron cinco concentraciones diferentes de BAP. Para Bacusoy & Masías (2019), en la fase de multiplicación, la mejor respuesta fue con en medio WPM con 3,33 brotes, un diámetro del tallo de 0. 27 cm y una altura de planta de 1,52 cm, sin embargo, en la fase de enraizamiento la mejor respuesta se obtuvo con 2mg de AIB sin carbón activado.
Con lo expuesto el estudio se justifica para desarrollar el uso del cultivo in vitro en su micropropagación y así producir grandes volúmenes de plantas a corto plazo lo cual posteriormente nos permitirá suministrar semilla vegetativa de alta calidad genética en el establecimiento de plantaciones comerciales y posteriormente ser reintroducidas a los hábitats en los que ha desaparecido completamente, por eso el objetivo de esta investigación fue establecer un protocolo de desinfección y de micropropagación in vitro de "caoba", Swietenia macrophylla King (Meliaceae) y teniendo como objetivos específicos el de evaluar las concentraciones de hipoclorito de sodio e hipoclorito de calcio en relación con el tiempo para la desinfección de explante y posteriormente evaluar las concentraciones de ácido naftaleno acético (ANA) y bencilaminopurina (BAP) para las fases de multiplicación y enraizamiento del explante.
Materiales y métodos
Se utilizó la solución stock de MS (Murashige & Skoog, 1962) a la cual se le añadió agar (8 g/L), sacarosa (30 g/L) y reguladores de crecimiento de acuerdo a los diferentes tratamientos propuestos. Finalmente se midió el pH el cual fue ajustado a 5,7 con HCl o KOH al 0,1 N; luego los medios de cultivo fueron distribuidos en volúmenes de 40 ml a magentas, seguidamente se procedió a su esterilización en autoclave a 121 °C y una presión de 1,3 Kg/cm2, durante 20 minutos, manteniéndose luego en un lugar estéril hasta su posterior uso.
Se utilizaron plantones de dos meses de edad obtenidos de semillas botánicas de caoba recolectadas de árboles ubicados en el Jardín Botánico de la Ciudad de Jaén. Las semillas también procedieron del mismo lugar.
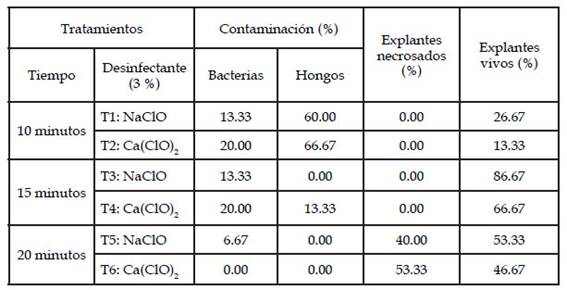
Los segmentos nodales de 3 cm de longitud, que se obtuvieron de los plantones, fueron desinfestados con agua destilada estéril, alcohol etílico al 96% por 3 minutos, hipoclorito de calcio (Ca (ClO)2 ) e hipoclorito de sodio (NaClO), ambos al 3% más tres gotas de tween 80 durante 10, 15 y 20 minutos, según los tratamientos (Tabla 1), y luego repicados en tubos de ensayos y magentas que contenían MS/2, llevándose luego estos al cuarto de incubación.
Tabla 1 Tratamientos para la fase de desinfección de los explantes de S. macrophylla King. provenientes de plantas de vivero.
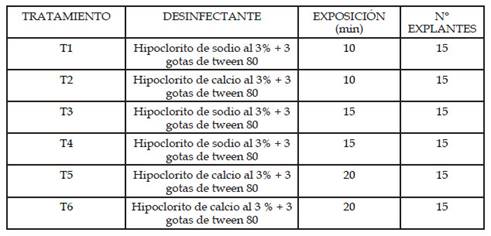
Las semillas se lavaron con agua destilada estéril, alcohol etílico al 96% por 30 segundos, luego se enjuagó con agua destilada estéril y se colocaron en soluciones de hipoclorito de sodio al 1,5 % más 3 gotas de tween 80 durante 20 minutos en constante agitación. Posteriormente se liberaron de la testa y fueron nuevamente sometidas a alcohol etílico al 70% por 30 segundos, hipoclorito de sodio al 0,5% más 3 gotas de tween 80 durante 10 y 20 minutos (Tabla 2). Las semillas fueron introducidas en MS/2, llevándose luego estos al cuarto de cultivo para su incubación y posterior germinación. Transcurrido 45 días, las plántulas más vigorosas producto de la germinación in vitro fueron utilizadas como donadores de explantes.
La evaluación para los explantes obtenidos del vivero se realizó después de 15 días de sembrado y aquí se tuvo en cuenta el porcentaje de contaminación, número de explantes quemados (necrosis) y porcentajes de explanes vivos. En relación a las semillas las variables evaluadas fueron el porcentaje de contaminación y porcentaje de germinación.
Para la fase de crecimiento se utilizaron explantes provenientes del tratamiento de la fase de desinfección, y también se trabajó con los provenientes de las semillas germinadas in vitro. Se repicaron a magentas y tubos de ensayo conteniendo los medios de cultivo en estudio (Tabla 3). Las variables evaluadas fueron el número de hojas por explante, longitud del brote en milímetros y el número de brotes por explante. Estas evaluaciones se realizaron cada 15 días durante mes y medio.
*Se utilizaron las fórmulas completas de los medios de cultivo.
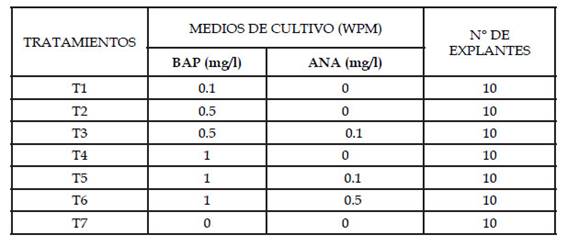
Para la fase de multiplicación, las yemas axilares obtenidas de la fase de crecimiento, fueron cortadas en segmentos de 1 a 1,5 cm de longitud con una yema axilar y luego introducidas en los tratamientos respectivos (Tabla 4). Las variables evaluadas fueron el número de hojas por explante, longitud del brote en milímetros y el número de brotes por explante. La evaluación se realizó cada 15 días después de haber colocado los explantes en los medios de cultivo durante un periodo de 50 días.
Tabla 4 Tratamientos ensayados en la fase de multiplicación para las yemas axilares de S. macrophylla King
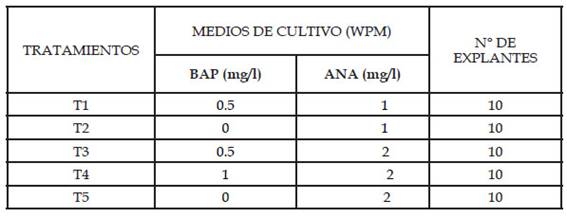
La fase de enraizamiento se inició cuando los brotes producidos en la fase anterior alcanzaron 1,5 cm de longitud en promedio, los cuales fueron aislados y repicados en magentas y tubos de ensayos conteniendo los medios de cultivo según los tratamientos de la Tabla 5; Las variables evaluadas fueron el número de raíces por explante y la longitud de raíz principal (mm). La evaluación se realizó a los 50 días después de la siembra.
Tabla 5 Tratamientos ensayados en la fase de enraizamiento para los explantes de S. macrophylla King
Para el presente trabajo se aplicó el Diseño Completamente al Azar (DCA) con arreglo factorial, considerando un explante por repetición para todos los tratamientos de cada una de las fases de la micropropagación. Los datos de cada una de las variables se sometieron a un análisis de varianza (ANOVA), con un nivel de significancia del 5%. Para ello se usó el programa estadístico SPSS Statics 25.
Resultados
Desinfección de los explantes:
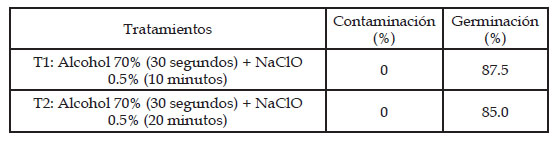
Según se observa en la Tabla 6, los desinfectantes utilizados no permiten la contaminación de las semillas (0 %), pero también se observa que a mayor tiempo de exposición a NaOCl 0,5% por veinte minutos, disminuye el porcentaje de germinación.
Tabla 6 Porcentajes de germinación de las semillas de S. macrophylla, después de los tratamientos de desinfección
Los segmentos nodales introducidos, previos tratamientos de desinfestación, muestran contaminación cero para T5 y T6, pero al mismo tiempo presentan elevada necrosis lo cual se manifiesta en menos del 53,33 % de explantes vivos, según se observa en la Tabla 7. El mejor tratamiento fue T3 con 86,67% de explantes vivos.
Discusión
Fase de desinfección de los explantes:
Aunque los problemas en el establecimiento in vitro de especies leñosas, se debe en gran medida a la contaminación microbiana de los explantes provenientes del invernadero, los resultados obtenidos sugieren que la contaminación presente en el material vegetal de caoba puede ser evitado al utilizar NaClO. Varios autores han utilizado exitosamente el cloro en cultivos en los que la contaminación y la fenolización del tejido dificultan el establecimiento de los explantes (Romero, 2000a; Romero, 2000b).
Los resultados, de la Tabla 6 y Tabla 7, superan a los descritos por Abdelnour & Muñoz, (2005) en Tectona grandis, al obtener 31,67% de explantes vivos, los cuales fueron previamente desinfestados en hipoclorito de calcio al 4 % por 10 minutos. Mroginski et al. (2000) al emplear 1,8 % de NaOCl por 30 minutos encontraron un 65% de explantes vivos en el establecimiento in vitro de yemas axilares de Toana ciliata (Meliaceae) de dos años de edad. Flores et al. (2009) aplicaron hipoclorito de sodio al 10% durante 10 minutos en explantes de caoba, obteniendo un 86% de explantes vivos. En cambio, Carranza et al. (2013) al aplicar 15 g de hipoclorito de calcio durante 20 minutos logró alcanzar un 95% de explantes vivos de caoba, estos resultados son opuestos a esta investigación, dado que a mayor concentración de hipoclorito de sodio y calcio en interacción con más tiempo de exposición los explantes se oxidan y necrosan. Los desinfectantes se utilizan en una concentración en la cual debe haber un efecto controlador de los contaminantes, sin que haya deterioro de los tejidos, desde luego que el grado de desinfección superficial obtenido depende no solo de la concentración del producto, sino también del tiempo de exposición de los tejidos al desinfectante (Mroginski & Roca, 2000), así como de la procedencia del material (Rathore et al., 2007).
Fase de crecimiento:
l éxito del cultivo in vitro radica en la composición del medio de cultivo utilizado; los resultados de esta investigación muestran que el medio WPM es el más eficiente para el cultivo in vitro de caoba, el cual permitió obtener las tasas más altas respecto a la variable número de hojas, longitud y número de brotes (Figuras 1,2,3). El medio de cultivo Woody Plant Medium (WPM) tiene en su composición una baja concentración en sales Mg+ (1.875 mM), Cl(1,3 mM), si lo comparamos con el MS, y es utilizado para el cultivo de plantas leñosas que presentan toxicidad en altas concentraciones de sales. Parada & Villegas (2009) afirman que el CaCl2 es considerado tóxico para especies leñosas, motivo por el cual reformularon el medio WPM como WPMm, el cual carece de cloruro de calcio. A su vez la solución hidropónica la Molina presenta altas concentraciones de Ca (3,75 + mM), NH4 (13.57 mM), (1.12Mm) (Rodriguez et al., 2014) Las altas concentraciones de sales que presentan el medio hidropónico y MS, disminuyen el potencial osmótico del medio evitando así una mayor hidratación de los brotes y como consecuencia dificultan la absorción de agua y de nutrientes. El potencial osmótico del medio de cultivo tiene efecto directo en el crecimiento de los explantes, pues conforme se reduce también es menor la absorción de agua y nutrientes, lo que dificulta el crecimiento y multiplicación de brotes (Silva et al., 2004). Si bien los tres tratamientos mostraron igual número de brotes (Figura 2) e inclusive el medio MS y WPM mostraron número de hojas iguales (Figura 3), en la experiencia los brotes más grandes y las hojas fenotípicamente más verdes y grandes corresponden a los del medio WPM.
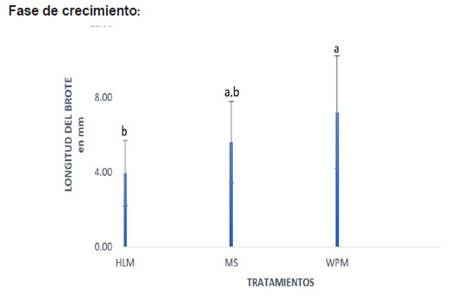
Fig. 1 Longitud del brote de S. macrophylla King según tratamientos. El medio WPW permitió obtener una longitud promedio de 7.20 mm respecto a los medios MS y HLM. Existen diferencias estadísticamente significativas entre tratamientos, puesto que el valor de significancia es menor al 0.05 según ANAVA.
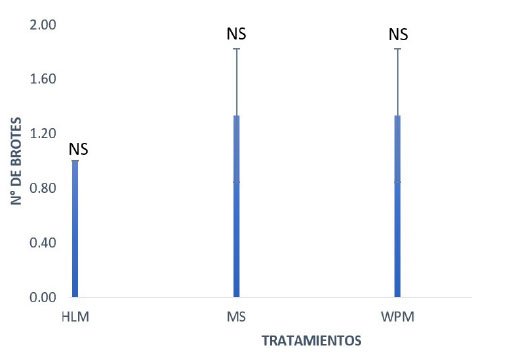
Fig. 2 Número de brotes por explante de S. macrophylla King según tratamientos. Se aprecia el consolidado de los tratamientos con sus respectivos promedios en donde no existe diferencias significativas entre los tratamientos. La figura nos muestra que todos los medios de cultivo empleados en el experimento como el WPW, MS y HLM proporcionan el mismo número de brotes.
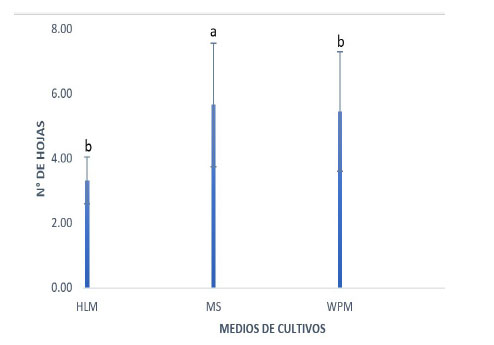
Fig. 3 Número de hojas por explante de S. macrophylla King según tratamientos. Se aprecia el consolidado de los tratamientos con sus respectivos promedios en donde si existe diferencias significativas dado que el valor de significancia es menor al 0.05 según ANAVA. La figura muestra que los medios de cultivo MS y WPM utilizados en el experimento permitieron desarrollar mayor número de hojas; pero los explantes expuestos al medio WPM mostraron hojas de un tamaño fenotípicamente grandes durante el experimento.
Fase de multiplicación:
Si bien, no se encontró diferencias significativas entre los tratamientos respecto al número de brotes (Figura 5), el T4 (1 mg/l de BAP) permitió obtener para la variable longitud del brote las tasas más altas con respecto a los demás tratamientos (Figura 4), se obtuvo un promedio de 8 mm de longitud. Estos resultados son superiores a los obtenidos por Carranza et al. (2013) quienes trabajando con caoba alcanzaron un promedio de 1,7 mm de longitud durante 21 días al añadir 2 mg/l de BAP en combinación con 1mg/l de AIB. Y Collado et al. (2004) quienes reportaron un 63,9 % de explantes brotados con 0,2 mg/l de BAP empleando ápices y segmentos nodales de caoba. En la investigación de Huamán et al. (2012) sobre propagación in vitro de segmentos nodales de cedro (Cedrela odorata L.) obtenidos a partir de semillas botánicas, obtuvieron explantes de mayor altura. Las concentraciones de 0,5 mg/l de BAP y 0,1 mg/l de ANA. En la obtención de plantas in vitro de caoba obtener un buen tamaño y follaje confieren a la planta mayores posibilidades de sobrevivir durante la aclimatación en los invernaderos, debido a que estos dos parámetros están relacionados con una mayor capacidad fotosintética. En tanto que plantas con mayor número de nudos permite tener un mayor coeficiente de multiplicación.
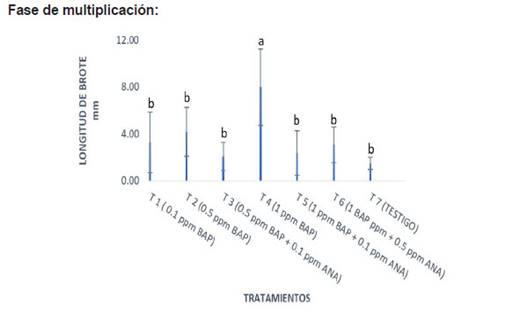
Fig. 4 Longitud del brote de S. macrophylla King según tratamiento. Se aprecia el consolidado de los tratamientos con sus respectivos promedios. El tratamiento T4 que contenía 1 ppm de BAP permitió un mayor crecimiento en longitud del brote, mientras que el promedio más bajo fue proporcionado por el tratamiento 7 (Testigo). En esta fase se obtuvo las diferentes longitudes del explante por cada tratamiento, presentando estas diferencias estadísticamente significativas entre tratamientos puesto que el nivel de significancia es inferior a 0.05 % según ANAVA.
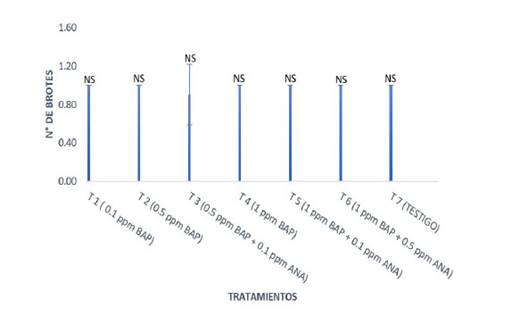
Fig. 5 Número de brotes por explante de S. macrophylla King según tratamientos en etapa de multiplicación. La figura muestra que no hay diferencias estadísticas significativas entre los promedios. Esto se debe porque cada explante en los distintos tratamientos permitió originar números de brotes proporcionales.
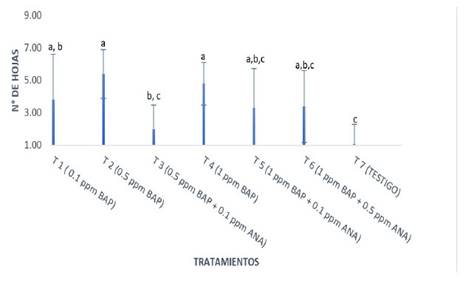
Fig. 6 Número de hojas por explante de S. macrophylla King según tratamientos en la etapa de multiplicación. La figura muestra el consolidado de promedios según tratamientos respecto al número de hojas, los promedios más altos se obtuvieron en T2 y T4 dando 5.40 y 4.80 respectivamente. En los tratamientos si existe diferencias estadísticamente significativas respecto a la variable número de hojas puesto que el valor de significancia es menor de 0,05 según ANAVA.

Fig. 7 Plántulas in vitro en la etapa de multiplicación con medio WPM. Tratamiento 4 (1 mg/l de BAP).
Los requerimientos de citoquinina en las plantas in vitro son extremadamente variables y las respuestas a la inducción de brotes dependen del contenido endógeno de cada especie y del tipo de explante utilizado. La aplicación de reguladores de crecimiento al medio de cultivo va a depender del tipo de diferenciación que se desea obtener (Bernal et al., 2009),
En este estudio las concentraciones BAP de los tratamientos T2 (0,5 mg/l) y T4 (1 mg/l) fueron los que proporcionaron altas tasas de longitud de brotes (Figura 4), esto se explica porque las citoquinina aplicadas en bajas concentraciones, promueve no solo la división celular sino también la brotación y elongación de las yemas (Collado et al., 2004) o según Ascon-Bieto y Talón (2013), la diferenciación de yemas vegetativas (caulogénesis) es promovida por balances auxina/citoquininas favorables a las citoquininas, mientras que los balances favorables a las auxinas inducen la formación de raíces (rizogénesis). Debemos tener en cuenta que, en las plantas, ninguna hormona tiene el control exclusivo de un determinado proceso fisiológico. La interacción entre citoquininas y auxinas regula la neoformación de órganos. Aunque la organogénesis es el resultado de una interacción entre el material vegetal (explanto), el medio de cultivo y las condiciones ambientales, las fitohormonas desempeñan el papel principal.
Fase de enraizamiento:
Para lograr que las plantas micropropagadas sobrevivan al proceso de aclimatación y trasplante a campo definitivo es necesario que estas tengan un buen número y tamaño de raíces; por eso al evaluar el desarrollo radicular de las plantas se observó que solo el tratamiento T2 (1 mg/L ANA) presentó las tasas más altas de porcentajes de enraizamiento (30%, Figura 8,9). Otros investigadores como Huamán et al. (2012) obtuvieron 100% de enraizamiento en cedro utilizando 0,5 mg/l de BAP y 0,5 mg/l de ANA, pero Carranza et al, (2013) no logró enraizamientos con caoba y en Tectona grandis sólo se logró 13,3% al utilizar 3 mg/l de ANA según Abdelnouir & Muñoz, 2005). Como se ve la inducción de raíces no depende solo de la fitohormona sino de otros factores de la planta, así Silva et al. (2010) indican que no todas las auxinas naturales o sintéticas pueden inducir primordios radicales in vitro. En algunas plantas se dificulta el enraizamiento aún en presencia de auxinas, siendo otros factores los que influyen en la inducción de raíces. Algunas especies no necesitan pasar por la etapa de enraizamiento y emiten sus raíces en el mismo medio de cultivo donde desarrollan yemas nuevas, ocurriendo el proceso de multiplicación y enraizamiento en forma simultánea (Sánchez et al., 2004). Azcón - Bieto & Talón (2013), afirman que cada órgano presenta una sensibilidad diferente a la auxina. Si tenemos en cuenta la concentración de hormona que produce la máxima respuesta, hemos de concluir que las raíces son más sensibles que las yemas, y estas más sensibles que los tallos. Los factores de los que depende la sensibilidad son muy diversos, pero los que probablemente desempeñen un papel más importante son la concentración de receptores hormonales, la efectividad de la unión receptor-hormona y la cadena de acontecimientos que sucede después de dicha unión.
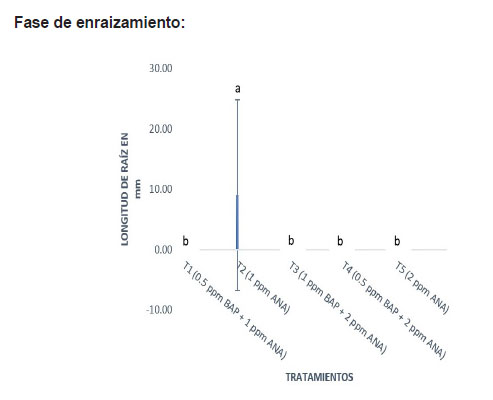
Fig. 8 Longitud de raíz por explante de S. macrophylla King según tratamientos. La figura muestra el consolidado de promedios según tratamientos respecto a la longitud de raíces, los tratamientos T1, T3, T4, T5 no indujeron la formación de raíces, en cambio hubo inducción de raíces fue el tratamiento T2 (1 ppm ANA) y con una longitud de 9 mm en promedio.
Conclusiones
En la fase de desinfección de explantes de caoba provenientes de plantones de vivero, la aplicación de NaClO al 3% durante 15 minutos (T3), permite reducir significativamente la contaminación de los explantes por microorganismos brindando un porcentaje de explantes vivos del 87% (T3).
La concentración de NaClO al 0,5 % durante 10 minutos (T1) permite obtener un 0% de contaminación de semillas y una tasa de germinación de un 87,5%.
El mejor tratamiento en la fase de crecimiento fue el T3 que contenía las sales del medio de cultivo WPM (Woody Plant Medium) permitiendo un promedio de longitud de brote de 7.20 mm y un promedio de cinco hojas por explante.
En la fase de multiplicación in vitro, el medio WPM suplementado con 1 mg/l de BAP (T4) permitió generar longitud de brotes más desarrollados alcanzando un promedio de 8 mm de longitud y a la vez permitió el desarrollo de hojas grandes y un número promedio de cuatro hojas por explante.
En la fase de enraizamiento in vitro de explantes de caoba con el medio WPM suplementado con 1 mg/l de ANA (T2) fue el único tratamiento que estimulo la aparición de raíces en los explantes, proporcionando una longitud promedio de 9 mm y un número de raíces promedio en una unidad.












 uBio
uBio