Introducción
La gran familia Lamiaceae tiene siete subfamilias. La subfamilia Nepetoideae con 3400 especies y 105 géneros a su vez tiene tres tribus (Drew et al., 2011): Elsholtzieae, Ocimeae y Mentheae, esta última con 65 géneros. La tribu Mentheae se caracteriza químicamente por poseer terpenoides volátiles y un ácido fenólico llamado ácido rosmarínico que hace que estas plantas sean aromáticas y con propiedades medicinales (Wink, 2003, Amoah et al., 2016). Las Mentheae además se pueden clasificar en 3 subtribus: Menthinae (43 géneros), Salviinae (10 géneros) y Nepetiinae (12 géneros) (Bräuchler et al., 2010; Drew et al., 2012). En Perú los géneros de Mentheae son Clinopodium (20 especies), Hedeoma (1 especie), Lepechinia (11 especies), Mentha (4 especies, introducidas), Minthostachys (8 especies), Rosmarinus (1 especie, introducida) y Salvia (80 especies, 1 introducida)(Zarucchi, 1993; Ulloa et al., 2004; Granda 2010; Sagástegui & Rodríguez, 2012). Clinopodium, Hedeoma, Mentha y Minthostachys pertenecen a la subtribu Menthinae, mientras que Lepechinia, Rosmarinus y Salvia pertenecen a la subtribu Salviinae. Además, 50 especies de Mentheae son endémicas a Perú (Rodríguez, 2006).
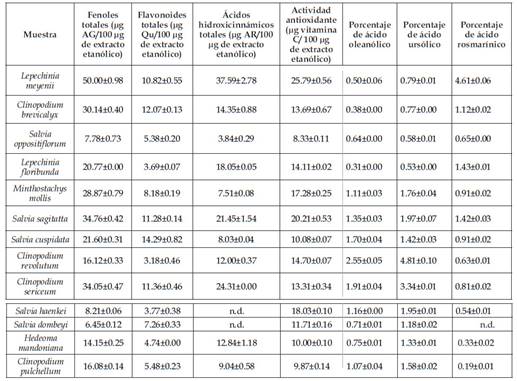
En la presente comunicación se evaluó el contenido de fenoles totales (Gálvez et al., 2015), flavonoides totales (Bag et al., 2015); ácidos hidroxicinnámicos totales (Stefan et al., 2013) y la capacidad antioxidante total (Prieto et al. 1999, Bag et al., 2015). Además, por cromatografía uhplc, se cuantificó el contenido en ácidos triterpénicos, ursólico y oleanólico (Srivastava et al., 2010) y ácido rosmarínico (Venskutonis et al., 2017) en trece especies peruanas de la tribu Mentheae (Cuadro 1).
Materiales y métodos
Parte Experimental
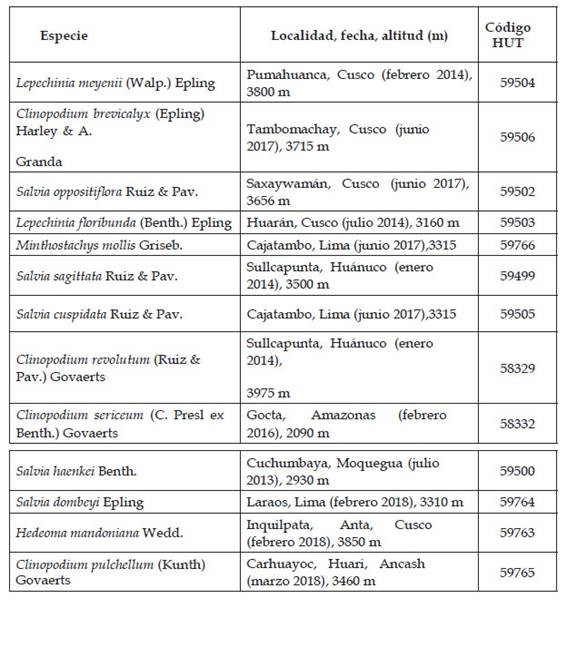
Material Vegetal: Se colectó en los departamentos de Cusco, Ancash, Lima, Amazonas, Huánuco y Moquegua en las localidades, fechas y altitudes que aparecen en el Cuadro 1 (colector: C. Serrano F. s.n.). Los ejemplares de Herbario se determinaron y depositaron en el Herbarium Truxillense (HUT), Universidad Nacional de Trujillo, Perú; además se incluyen fotos de todas las especies (Anexos 1-3).
Cuadro 1 Especies de la tribu Mentheae (Lamiaceae) estudiadas, indicando información de la colección y códigos de depósito en el herbario HUT.
Productos Químicos y equipamiento básico:
Todos los reactivos y solventes utilizados fueron de grado analítico. El acetonitrilo (Merck) fue de grado HPLC. Estándares de ácidos cafeico (Aldrich), rosmarínico (Aldrich), oleanólico y ursólico (Chromadex). Baño ultrasónico (JeioTech). Rotavapor (Buchi R210). Estufa (Memmert UNB). Espectrofotómetro visible (Thermoscientific Genesys 20).
Preparación de extractos etanólicos
50 mg de vegetal pulverizado se sometieron a baño ultrasónico por 5 minutos con 1 mL de etanol x 3 veces. Se filtró. Se aforó a 5 mL con etanol. Con 2 mL se determinó la masa total extraída en estufa a 40°C y el resto del extracto se almacenó a 4°C hasta la realización de los análisis subsecuentes.
Determinación de fenoles totales
Se utilizó el método de Folin Ciocalteau (Gálvez et al. 2005), 50 ó 100 μL de extracto se diluyeron hasta 2 mL con agua. Luego se agregó 100 μL de Reactivo de Folin Ciocalteau (Merck) en dilución (1:10) en agua + 200 μL de solución de Na2CO3 al 20%. Se esperó 30 minutos en oscuridad y luego se midió la absorbancia a 765 nm. La curva de calibración se hizo empleando solución de ácido gálico de 0.1 mg/mL. El análisis se ejecutó por triplicado.
Determinación de flavonoides totales
Se empleó el método del cloruro de aluminio (Bag et al. 2015). A 50 μL de extracto se agregó 0.1 mL de AlCl3 al 10%, 0.1 mL de acetato de sodio 0.1 M, 1.5 mL de etanol y agua suficiente para completar 6 mL. Se mezcló bien. Se midió absorbancia a 415 nm. Luego se hizo otra secuencia igual a la anterior, pero en lugar de los 0.1 mL de AlCl3 al 10% utilizar 0.1 mL de agua. I también se midió la absorbancia a 415 nm. La diferencia de lecturas se utilizó para los cálculos. La curva de calibración se hizo utilizando una solución de quercetina (1 mg/10mL). El análisis se ejecutó por triplicado.
Determinación de ácidos hidroxicinnámicos totales
Se empleó el método de Arnow (Stefan et al., 2013). Sobre 20 a 300 μL de extracto se le agregaron 2 mL de HCl 0.5 M, 2 mL del reactivo de Arnow , 2 mL de NaOH al 8.5% y agua suficiente para completar 11 mL. Se mezcló bien y se leyó a 505 nm. Además se hizo una secuencia de compensación utilizando 2 mL de agua en lugar del reactivo de Arnow. La diferencia de lecturas se utilizó para los cálculos. El reactivo de Arnow se preparó disolviendo 10 g de nitrito de sodio, 10 g de molibdato de amonio en agua hasta 100 mL. La curva de calibración se hizo con ácido rosmarínico de 0.1 mg/mL en etanol del 20%. El análisis se ejecutó por triplicado.
Determinación de la capacidad antioxidante total
Se trabajó con el método del azul de molibdeno (V) a partir de molibdeno (VI) (Prieto et al., 1999; Bag et al., 2015). A 100 μL de extracto se agregó 1 mL de reactivo de fosfomolibdato, 1 mL de agua y se calentó en estufa a 80°C por una hora. En este tiempo se desarrolló el color. Luego se diluyó con 5 mL de agua y la lectura se hizo a 695 nm. El reactivo de fosfomolibdato consisitió de una solución que contiene molibdato de amonio (4.66 g/L), Na3PO4.12H2O (10.64 g/L) y H2SO4 concentrado 32.61 mL/L. La curva de calibración se hizo con solución de ácido ascórbico de 100 μg/mL. El análisis se ejecutó por triplicado.
Cuantificación de AR en 13 Mentheae en extractos etanólicos
50 mg de vegetal pulverizado se sometieron a baño ultrasónico por 5 minutos con 1 mL de etanol x 3 veces. Los filtrados se aforaron a 5 mL con el mismo solvente. Este filtrado nuevamente se filtró a viales a través de membrana de teflón de 0.22 µm. Condiciones DAD-UHPLC (Dionex Thermoscientific Ultimate 3000 UHPLC con software Chromeleon 7.2) (Venskutonis et al., 2017): Columna RPC18 Zorbax Rapid Resolution de 100 x 2.1 mm x 1.8 µm. Temperatura de separación: 40°C. Flujo: 0.4 mL/minuto. Gradiente: a) H2CO2 al 0.1 %; b) MeCN; (tiempo, %b)): (0,0); (1,0); (6,40); (9,100); (13,100); (14,0); (17,0). DAD: 200-500 nm; UVVis 1: 254 nm; UVVis 2: 330 nm; UV Vis 3: 280 nm; UV Vis 4: 370 nm. La cuantificación se hizo con las lecturas obtenidas a 330 nm. Paralelamente se ejecutó curva de calibración con ácido rosmarínico estándar (Aldrich) de 2, 1.5, 1, 0.5 y 0.2 mg/ mL con una linearidad de 0.999. El análisis se ejecutó por triplicado.
Cuantificación de ácidos triterpénicos en 13 especies de Mentheae en extractos etanólicos
Se utilizaron las mismas soluciones que para el caso de la cuantificación de ácido rosmarínico. Método cromatográfico: (Dionex Thermoscientific Ultimate 3000 UHPLC, con software Chromeleon 7.2) (Srivastava et al. 2010): Columna Phenomenex Lichrospher RPC18 25 x 0.46 cm x 5 µm. Tiempo de análisis: 20 minutos. Temperatura: 30°C. Modo de elución: isocrático (MeCN: agua, 8:2). DAD: 200-400 nm, longitud de onda detective a 209 nm. Curva de calibración con estándar mixto de AO y AU (Chromadex) de 2, 1, 0.5 y 0.3 mg/ mL de AO y AU. El análisis se ejecutó por triplicado.
Todos los análisis fitoquímicos se efectuaron en el laboratorio de Química Orgánica de la Universidad Nacional de San Antonio Abad del Cusco (UNSAAC), Cusco, Perú.
Resultados y discusión
La especie con mayor actividad antioxidante y a la vez mayor contenido en ácido rosmarínico es Lepechinia meyenii "Puna Salvia", planta muy importante en el sur andino del Perúen un libro de nombre particularmente sugerente "Superación de la enfermedad en las alturas de los andes del Perú" (Hahold et al., 1990), que es un estudio hecho en la provincia de EspinarCusco en altitudes de 3800 a 4500 msnm muestra a esta planta como la tercera planta medicinal de mayor utilización en comunidades cuya salud entonces dependía casi exclusivamente en el empleo de plantas medicinales. Un estudio reciente (Crespo et al., 2019) describe la presencia de ácido p-coumárico, ácido cafeico y ácido rosmarínico en L. meyenii como inhibidores de enzima tirosinasa. Por otro lado, la especie con mayor contenido en ácidos triterpénicos es Clinopodium revolutum "Flor de Arena" o "Te Indio", especie medicinal de la sierra del centro y norte de Perú, que sin embargo muestra una actividad antioxidante moderada y bajo contenido en ácido rosmarínicoes difícil explicar los efectos depurativos y desintoxicantes de esta especie en base a su alto contenido en ácido triterpénicos puesto estas moléculas no se disuelven en agua y la manera como se usa la planta es precisamente, la decocción acuosa, se requieren mayores estudios. En todo caso, ambas especies, L. meyenii y C. revolutum, de todas las especies estudiadas, son las de mayor "reputación etnofarmacológica" tanto en los sistemas medico tradicionales del sur y norte del Perú, respectivamente. Al respecto, Serrano et al. (2016) coinciden con esta aseveración y resultados referidos a esta especie C. revolutum por presentar una elevada concentración de metabolitos bioactivos. Todas las demás plantas muestran resultados entre estas dos especies extremas. Lepechinia floribunda y Salvia sagitatta son también importantes en su contenido en ácido rosmarínico y en su capacidad antioxidante mientras que Clinopodium brevicalyx, Salvia sagitatta, Salvia cuspidata y Clinopodium sericeum son importantes por su contenido en flavonoides. Así la presente comunicación provee una base para posteriores estudios en este importante grupo de plantas medicinales.












 uBio
uBio