Introducción
La familia Solanaceae contiene especies de importancia económica, tales como Solanum tuberosum L., Solanum lycopersicon L. y varias especies de Capsicum L., las cuales son utilizadas en la alimentación del hombre (D’Arcy, 1972; Knapp, 2002a; Särkinen et al., 2015). Las Solanaceae tiene una distribución cosmopolita, pero, la mayoría crecen en el Neotrópico, está representado por 90 géneros y entre 3000-4000 especies (D’Arcy 1991; Knapp et al. 2004). Para el Perú se reportan 538 especies distribuidas en 42 géneros, con un endemismo de 208 taxa (Brako & Zarucchi, 1993; Knapp et al., 2007; Ulloa Ulloa et al., 2004). Las especies de esta familia crecen generalmente en la vegetación secundaria, en zonas disturbadas, pudiendo ocupar una gran variedad de hábitats, desde los desiertos hasta las selvas tropicales (Heywood et al., 2007). Los miembros de la familia Solanaceae son muy diversos en términos de hábito, morfología y ecología, que van desde árboles, arbustos, lianas, epífitas y hierbas anuales, y además muestran una alta variación en cuanto a caracteres de flores y frutos (Knapp, 2002b; a).
Las flores son estructuras complejas con múltiples partes implicadas principalmente en la atracción del polinizador, donación del polen y recepción de la misma (Buchholz et al., 1935; Fernández et al., 2009); como consecuencia de ello hay una integración fenotípica, funcional, de desarrollo y/o correlaciones de rasgos genéticos (Pigliucci, 2003). Por lo tanto, la morfología floral puede evolucionar en respuesta al síndrome de polinización (Muchhala, 2003; Schemske & Bradshaw, 1999; Smith et al., 2008), conllevando a la selección de determinados rasgos florales (Barrett, 2013; 1862; Hansen et al., 2007, 2012; Ibañez et al., 2018; Knapp, 2002a). Este proceso de selección de rasgos florales contribuidos por los diversos visitantes florales circundantes es dinámico y recíproco, donde las características florales también son responsables de la evolución de un polinizador (p. e. "colibríes", "murciélagos", "lagartijas", "mariposas", "abejas") reflejando una alta complejidad y diversa historia evolutiva de la polinización (Cozien et al., 2019; Faegri & Van der Pijl, 1966; Vereecken et al., 2012; Waser et al., 1996). Esta complejidad evolutiva se ha visto influenciada también por la distribución de las flores a lo largo del eje floral, la edad y el tiempo de envejecimiento de las mismas (Bissell & Diggle 2008; Dudley et al. 2018; Knapp, 2002a). Otro mecanismo que ayuda a la perpetuidad de la especie es la dispersión de las semillas, en ello las características de los frutos juegan un rol sumamente importante (Knapp, 2002b; Levin et al., 2003).
Por lo tanto, el estudio de los caracteres florales es de importancia crítica para comprender verdaderamente la variación de la diversidad floral (Knapp, 2002a). Sin embargo, estos tipos de estudio tienen que desarrollarse necesariamente en hábitats naturales donde las especies están sometidas a procesos de selección constante como los Andes (Arroyo et al., 1983). Sin duda, los procesos de selección en hábitats andinos son más complejos debido a que la variación altitudinal juega un rol determinante reflejado en una heterogeneidad climática (Arroyo et al., 1983; Luebert & Weigend, 2014; Salazar-Tortosa et al., 2019), por ello este trabajo tiene el propósito de contribuir al conocimiento sobre la variación de la morfología de la flor y el fruto en una de las familias más importantes y en uno de los lugares más diversos y evolutivamente dinámicos.
Materiales y métodos
Área de estudio
El área de estudio abarca las localidades de San Daniel con coordenadas 10°25’40’’S-75°26’09’’O (2400 m), cuya vegetación corresponde a un bosque montano; Tunqui con coordenadas 10°17’49’’S-75°30’54’’O (1900 m), cuya vegetación es un bosque premontano; y Paujil con coordenadas 10°18’41’’S-75°15’53’’O (450 m), cuya vegetación es un bosque amazónico. Las tres localidades se encuentran ubicadas dentro del Parque Nacional Yanachaga Chemillén (PNYCH), en la provincia de Oxapampa, departamento de Pasco, Perú, evaluada durante los meses de Feb-Mar del 2009.
Colecta, determinación y toma de datos
Se realizó una colecta general, abarcando las tres localidades de estudio, en la cual se obtuvo un total de 47 especies de la familia Solanaceae, encontrándose en floración y/o fructificación. Las determinaciones de géneros y especies se realizaron mediante el empleo de claves taxonómicas y literatura especializada (Knapp 2002b; Leiva-González 2018; Macbride 1962; Plowman et al. 1998; Sawyer 2001), así como la consulta con ejemplares de los herbarios HOXA, USM, F y MO. Todos los ejemplares colectados fueron depositados en el herbario USM (Anexo 1 y 2). Se colectaron 5 individuos por especie de las cuales de cada uno se seleccionó al azar una flor y/o fruto para medir 10 variables cuantitativas con el uso de un vernier; para las especies con menos de 5 individuos se tomaron datos para más de una flor o fruto por individuo hasta completar las 5 mediciones. Algunas flores y frutos que no fueron medidos en el campo se preservaron en alcohol al 50% para su posterior análisis. En cuanto a los datos cualitativos se analizaron 12 variables.
En todos los ejemplares colectados para cada una de las 47 especies de Solanaceae registradas, se tomaron mediciones y se anotaron características relacionadas a la flor y fructificación de las mismas. estas variables se agruparon como cuantitativas (n = 10): DMF = diámetro máximo de la flor, LT = longitud del tubo de la corola, LS = longitud del sépalo, LP = longitud del lóbulo del pétalo, LF = longitud del filamento, LA = longitud de la antera, LE = longitud del estilo, LFR = largo del fruto, AFR = ancho del fruto y el NSFR = número de semillas del fruto; y cuantitativas (n = 12): SF = simetría de la flor, FF = forma de corola, CPI = color del interior del pétalo, CPE = color externo del pétalo, IA = inserción de las anteras, DA = dehiscencia de las anteras, PERC = posición del estambre respecto a la corola, TFR = tipo de fruto (cápsula, baya redonda, baya cónica y baya oblonga), CFR = color del fruto, PFR = pubescencia del fruto, POV = pubescencia del ovario y PE = pubescencia del estilo.
Análisis de datos
Se realizó el test de Shapiro para determinar la normalidad de los datos, obteniendo que nuestros datos no tienen una distribución normal, por lo que se realizaron pruebas no paramétricas. Se realizó el test de Kruskal Wallis para las variables cuantitativas, a fin de encontrar diferencias significativas a nivel altitudinal para cada variable. Se determinó la media aritmética de las variables de cada especie. Se realizó un análisis de correlación de Spearman con los datos morfométricos evaluados en función de la altitud. Para el análisis de las variables cualitativas se realizó la prueba de chi-cuadrado para determinar si existen diferencias significativas entre las localidades que se encuentran a diferente elevación. Los análisis se realizaron con los paquetes estadístico R, PAST (Hammer et al., 2001) y Excel.
Resultados
Se midieron 223 flores y 196 frutos en 47 especies pertenecientes a 10 géneros de Solanaceae (Figura 1, Anexo 1). El género Solanum se registró en todo el gradiente de elevación, mostrando predominancia en los bosques premontano y montano de Tunqui y San Daniel respectivamente. De tal manera que, en Paujil (bosque amazónico) la predominancia de Solanum se ve disminuida en un 50% respecto a las otras localidades. Asimismo, se observó que los bosques montanos presentan un mayor número de géneros y especies (Figura 1).
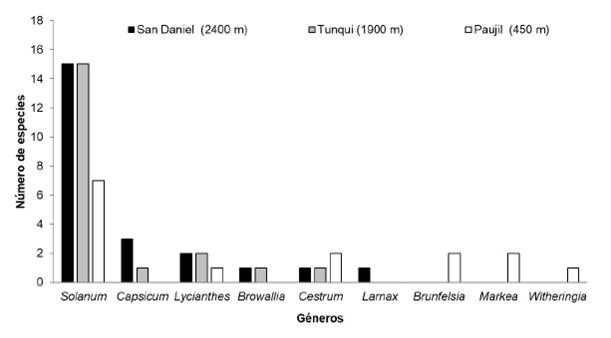
Fig. 1 Número de especies por género de Solanaceae en tres localidades del ParqueNacional Yanachaga-Chemillén (Perú).
Existe una relación entre la variable forma de corola y la altitud (χ² = 36.686, p = 2.028e-06). De las cuatro formas de corola registradas (Figura 2), la forma hipocrateriforme se encuentra en mayor proporcion a menor altitud (450 m). La forma rotada está presente en las tres localidades, siendo mas frecuente a mayores altitudes (1900 m y 2400 m).
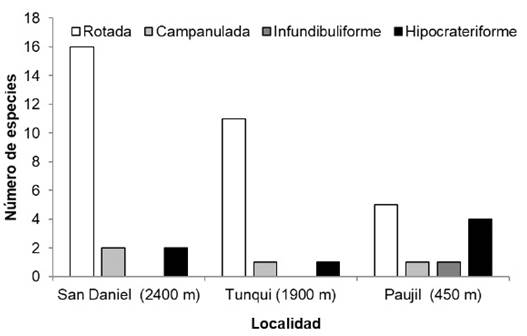
Fig. 2 Formas de la corola de las especies de Solanaceae en tres localidades del Parque Nacional Yanachag-Chemillén (Perú).
El color del pétalo muestra ciertas tendencias en su patrón de coloración con respecto a la altitud tanto para el color externo del pétalo ( χ² = 30.928, p = 3.167e-06) como para el interno (χ² = 43.22, p = 9.317e-09). Se observa que a mayores altitudes (bosque montano y premontano) predomina el color de pétalo blanco. Tambien se puede observar el predominio del color amarillo de los pétalos en zonas de baja elevación (Bosque amazónico), el color morado de los pétalos parece ser constante en los tres niveles altitudinales (Figura 3).
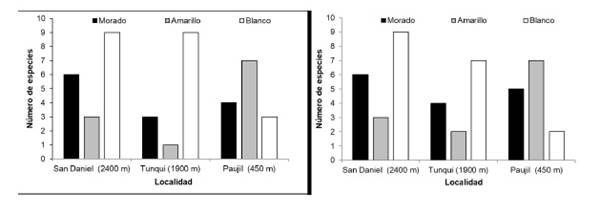
Fig. 3 Color del lado interno (izquierda) y externo (derecha) del pétalo de las especies de Solanaceae en tres localidades del Parque Nacional Yanachaga-Chemillén (Perú).
Solo tres taxones (1.4%) presentaron flores zigomorfas, y las restantes 44 especies (98.6%) presentaron flores actinomorfas. Con respecto al tipo de dehiscencia de las anteras, se encontró que en localidades con mayor altitud es más frecuente el tipo de dehiscencia longitudinal (Anexo 1).
En San Daniel (2400 m) se registró todas las formas de fruto, siendo el fruto baya redondeada el mas frecuente en las tres localidades.
El test de Kruskal Wallis mostró que las variables florales longitud del tubo de la corola (p = 0.00036), longitud del sépalo (p = 0.00295), longitud del lóbulo del pétalo (p = 0.00002), longitud del filamento (p = 0.00056) y la longitud del estilo (p = 0.0006), no son independientes respecto a los tres niveles altitudinales evaluados. Para determinar la relación de estas variables con la altitud, se obtuvieron los índices de correlación de Spearman en función de las localidades (LT = -0,151; LS = -0,116; LP = 0,295; LF = -0,186; LE = -0,005). La mayoría de las variables no mostraron correlación con la altitud, pero cabe resaltar a las variables longitud del tubo de la corola (LT), longitud del estilo (LE) y la longitud del sépalo (LS) que mostraron una relación inversa con la elevación altitudinal dada por las localidades (Figura 4). La longitud del tubo de la corola va desde 0.3 mm (Solanum) hasta 8.5 mm (Markea).
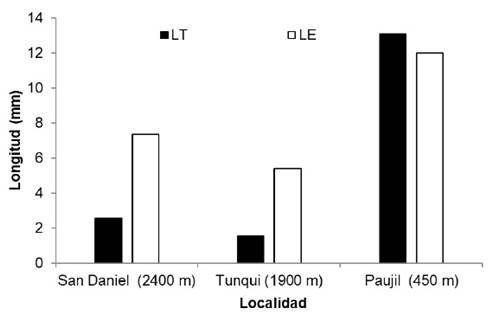
Fig. 4 Longitud del tubo de la corola (LT) y longitud del estilio (LE), en flores de especiesde Solanaceae en tres localidades del Parque Nacional Yanachaga-Chemillén (Perú).
Los taxones Brunfelsia grandiflora subsp. grandiflora D. Don, Brunfelsia grandiflora subsp. schultesii Plowman, Markea ulei (Dammer) Cuatrec . , Cestrum microcalyx Francey, Cestrum sp. y Browallia americana L. presentan longitud del tubo de la corola y longitud del estilo de mayor dimensión que los otros taxones evaluados (Anexo 1).
Las especies Solanum sessiliflorum Dunal (Paujil); Solanum caricaefolium Rusby (San Daniel) y Solanum leucopogon Huber (Tunqui) tienen medidas florales equivalentes en la mayoría de las variables analizadas (Anexo 2), y son de distintos niveles altitudinales; comportándose como equivalentes ecológicos. Las especies Solanum grandiflorum Ruiz & Pav. (Paujil), Solanum quitoense Lam. y Solanum sycophanta Dunal (Tunqui) se caracterizan por presentar estructuras florales (LA, LP, DMF) de mayor dimensión asi como frutos grandes con numerosas semillas.
Los individuos de Solanum anceps Ruiz & Pav. de San Daniel y Tunqui presentaron mayor similitud en los caracteres del fruto, pero los individuos de Paujil (bosque amazónico) fueron mas pequeños pero con mayor cantidad de semillas (Anexo 1). Sugiriendo una variación de las características del fruto a nivel intraespecifica en función a la altitud (p = 0.00176).
Discusión
Los bosques montanos albergan mayor cantidad de especies y géneros de Solanaceae, respecto a los bosques amazónicos. Este patrón de diversidad obtenido concuerda con lo reportado en la literatura (e.g. Gonzáles, 2015; Särkinen et al., 2015).
La predominacia de las diferentes forma de corola en cada nivel altitudinal está influenciado por el mayor número de especies del género Solanum presentes en San Daniel y Tunqui, ya que este género se caracteriza por presentar corolas rotadas (D’Arcy 2001; Macbride 1962), mientras que en Paujil (450 m) la disminución en especies de este género implica también menor presencia de la corola tipo rotada en esta localidad.
La coloración de la corola es un parámetro muy variable, generalmente influenciado por la luminosidad (Foster et al. 2006; Smith et al. 2008). Además es un carácter muy vinculado con la atracción de los polinizadores (Knapp, 2002a). La frecuencia de colores claros como el blanco y amarillo y oscuros como el morado podrían ayudar a explicar su vínculo con sus polinizadores.
La diferencia entre la presencia de flores zigomorfas y actinomorfas encontradas en este estudio servirá para un futuro análisis de los síndromes de polinización, ya que la simetría floral resulta ser un factor importante (Citerne et al., 2010; Jabbour et al., 2009; Sargent, 2004; Sauquet et al., 2017), por ejemplo, los vertebrados tales como "colibríes" y "murciélagos" son conocidos por su preferencia de flores simétricas (Stiles, 1985; Stiles et al., 1992) y estas diferencias en simetría de las flores de Solanaceae son probablemente también percibidas por polinizadores vertebrados, sin embargo, aún no está muy claro si la forma o el color de la flor es el factor más importante (Knapp, 2002a), como si se conoce para otras familias de plantas (Varela & Taisma, 2007).
El proceso de polinización implica una serie de acontecimientos, donde uno de ellos es la donación del polen; la estructura floral que está relacionada directamente con este acontecimiento son los estambres y principalmente las anteras, por ello el tipo de dehiscencia va a estar relacionada al tipo de polinización (Quesada-Aguilar et al. 2008). Se sabe que en el género Solanum tanto los filamentos como las anteras son las que manifiestan una mayor variación (Knapp, 2002a), pese a ello, en la actualidad esta interacción ecológica es poco conocida. La presencia de dos tipos de dehiscencia (poricida y longitudinal) que tienen las especies de Solanaceae nos indican que pueden existir básicamente dos tipos de polinización, y la frecuencia de estos tipos de dehiscencia nos podría indicar el predominio de uno u otro tipo de polinización en un determinado lugar.
La mayor diversidad de formas de frutos a mayores altitudes está influenciada por la alta diversidad de especies de Solanaceae a estas altitudes (Särkinen et al., 2015).
El amplio rango de partes florales en las Solanaceae indudablemente implica mayor diversificación en los síndromes de polinización, el cual esta sujeto a diferentes patrones de desarrollo (Nishino, 1978). La longitud del estilo es un carácter muy variable a nivel interespecífico dentro de la familia Solanaceae, pero también algunos estudios han registrado variación intraespecifica altamente correlacionada con el sistema de polinización (Quesada-Aguilar et al., 2008).
Browallia americana es la única especie con poblaciones numerosas, probablemente influenciada por presentar anteras versátiles que le permiten una mayor efectividad en su relación con los visitantes florales (Cocucci, 1999).
La flor de la especie Markea plowmanii Hunz. comparte pocas características con las flores del resto de especies de Solanaceae probablemente por presentar un hábito hemiepífito y estar confinado a las partes altas del dosel del bosque, para el cual debe de presentar síndromes de polinización y mecanismos de dispersión específicos. Su simetría bilateral de la corola, el pétalo adaxial ligeramente expandido, sus flores de color claro, largamente tubulares y amplias, sugieren su polinización por "murciélagos" (Simmons et al., 2007; Voss et al., 1980).
Los resultados permiten concluir que la familia Solanaceae comprende especies con una gran diversidad de formas florales, en los tres diferentes niveles de evaluación; donde se pueden abordar diferentes enfoques de desarrollo y evolutivos, como la simetría floral, forma, tamaño y color de las flores, inclusive la presencia de indumento en las partes florales como el androceo y gineceo que seguramente están implicados con los síndromes de polinización, así como, la cantidad de semillas vinculadas con los procesos de dispersión. A pesar de encontrar diferencias significativas entre los niveles altitudinales, se ha registrado correlaciones débiles para cada uno de las variables, los cuales se podrían confirmar con un muestreo más intensivo y en mayor cantidad de rangos altitudinales.












 uBio
uBio 


