Introducción
Las plantas medicinales poseen diversas propiedades físicas, químicas y biológicas que ayudan a tratar enfermedades y mejorar la salud de las personas (Costa et al., 2020), debido a esto, han desempeñado un papel crucial en la elaboración de la medicina moderna, dando soporte a la salud humana por muchos años. Sus efectos farmacológicos probados en diversos laboratorios se deben a grupos fitoquímicos presentes en los metabolitos secundarios, presentándose como una alternativa en los tratamientos farmacológicos actuales. Conociendo además que el 80% de la población mundial depende de la medicina tradicional (Ajayi et al., 2019; Bourhia et al., 2019; Cimanga et al., 2018).
Actualmente, las plantas medicinales necesitan ser evaluadas para determinar su toxicidad, debido a su probable utilidad en el campo de la medicina. Por ello, se debe incluir estudios de toxicidad empleando bioindicadores, para determinar la seguridad y tolerabilidad antes de la evaluación de su eficacia terapéutica en humanos. Los datos de toxicidad aguda, subaguda y subcrónica los brinda la Organización de Desarrollo Económico y de Cooperación (OCDE), que define la toxicidad aguda como todos aquellos efectos negativos que ocurren dentro de un período corto de tiempo (24 horas) después de la administración oral y a la toxicidad subaguda como los efectos negativos que se producen por la administración oral diaria repetida (Cimanga et al., 2018; Costa et al., 2020; Lagarto Parra et al., 2001).
Artemia salina y Daphnia magna son modelos biológicos utilizados para los estudios de toxicidad aguda. La prueba de letalidad de Artemia salina es un indicador preliminar de la toxicidad general de los compuestos vegetales que nos permite calcular la dosis letal media (DL50) (Costa et al., 2020). Estos braquiópodos, conocidos como “camarones de salmuera” son muy utilizados en estudios de toxicidad debido a su facilidad de cultivo, disponibilidad, bajo costo y adaptación a condiciones desfavorables. A. salina es un invertebrado filtrador no selectivo, convirtiéndose en un bioindicador excelente debido a su alta sensibilidad a los contaminantes ambientales (Asadi et al., 2019; Balalakshmi et al., 2017; Bhuvaneshwari et al., 2018; Danabas et al., 2020). Las pruebas de A. salina pueden detectar también la toxicidad de los principios activos de las plantas (El Fels et al., 2016).
Physalis peruviana L. generalmente conocida como “uchuva” es una planta perenne que pertenece a la familia Solanaceae y al género Physalis. Su fruto es fuente de nutrición saludable y muy deleitable. Presenta una baya jugosa, que debido a sus compuestos bioactivos es de gran interés comercial. También, presenta una envoltura llamada cáliz acrescente que sirve de protección contra insectos, aves y condiciones adversas para su desarrollo. Los cálices de P. peruviana debido a sus propiedades anticancerígenas, antimicrobianas, inmunomoduladoras y antiinflamatorias, son utilizadas en su mayoría como fuente medicinal.
Diversas investigaciones comprobaron que el extracto etanólico crudo y algunas fracciones del cáliz presentan actividad antiinflamatoria y antioxidante (BallesterosVivas et al., 2019; Bazana et al., 2019; Bernal Rodriguez et al., 2019; Dong et al., 2019). Los componentes relacionados con la salud incluyen antioxidantes, ácidos grasos poliinsaturados, vitaminas A, B, C, E y K1, fitoesteroles y minerales esenciales (Ramírez et al., 2013).
Debido a la importancia de utilizar el extracto acuoso de cálices de P. peruviana L., como tratamiento natural y seguro para muchas enfermedades, en la presente investigación se evaluó su toxicidad en el bioindicador Artemia salina para brindar mayores alcances de seguridad en su uso.
Material y métodos
Material Biológico: 240 larvas de Artemia salina obtenidas de un acuario. 05 kilogramos de frutos de “aguaymanto” Physalis peruviana L. con cálices en perfecto estado de fitosanidad comprados en el Mercado la Hermelinda - Trujillo.
Medio de crecimiento: agua de mar del balneario de Huanchaco Trujillo, debidamente filtrada y autoclavada (Damasceno et al., 2017).
Tamaño Muestral: Fue calculado en base a los tratamientos y el número de repeticiones. En este experimento, se empleó 08 tratamientos y 03 repeticiones por tratamiento, con un total de 24 unidades experimentales. Se utilizó un diseño experimental completamente aleatorizado, donde cada concentración es un tratamiento y cada tratamiento se repitió tres veces. Se empleó un total de 10 larvas del tercer estadio de A. salina para cada unidad experimental que se colocaron adecuadamente en un vial Eppendorf de 2 ml conteniendo las diferentes concentraciones (Gutner-Hoch et al., 2019).
Diseño de exposición: se eligieron 08 concentraciones incluyendo al control: 0, 50, 250, 500, 2500, 5000, 12500 y 25000 ppm del decocto de cálices de “aguaymanto” P. peruviana; luego se procedió a incorporar 10 larvas del tercer estadio y se incubo a temperatura ambiente por 48 horas.
Obtención de larvas de tercer estadio de Artemia salina: Los quistes de A. salina fueron comprados en un acuario ubicado en el distrito de Florencia de Mora, Trujillo. Se procedió a incubar en una pecera con 1 L de agua de mar filtrada y autoclavada con 1g de quistes, a temperatura ambiente con un régimen de luz continuo (luz blanca) y una fuerte aireación obtenida con un motor de ventilación de acuario estándar. Al cabo de 48 horas se obtuvieron las larvas del III estadio (Caldwell et al., 2003; Costa et al., 2020; Cruzeiro et al., 2017; Demarchi et al., 2020; El Fels et al., 2016; Libralato et al., 2016; Martínez et al., 2015; Rekha et al., 2018; Sánchez et al., 2020; Swarnkumar & Osborne, 2020; Wang et al., 2017; Yun et al., 2019; Zhu et al., 2017).
Preparación de decoctos: para la obtención del decocto se trabajó a partir de frutos maduros de “aguaymanto” Physalis peruviana. Se retiró manualmente los cálices de los frutos, seleccionando aquellos con mejores características visuales y sin evidencias de enfermedades. Los cálices fueron lavados y desinfectados con hipoclorito de sodio al 0,5% por 10 minutos, se dejaron secar a temperatura ambiente y en sombra por 24 horas. Posteriormente, se colocaron en una estufa de laboratorio a 50°C por 3 días. Los cálices secos fueron homogenizados con ayuda de un molino doméstico, luego se tamizó para eliminar restos demasiado grandes que puedan causar interferencias. Se colocó a calentar 500 ml de agua destilada en un vaso de precipitación hasta su ebullición, luego se agregó 25 gr de cálices molidos y tamizados, dejándose interactuar por 10 minutos. A continuación, se agregó 500 ml de agua destilada fría para luego filtrar 2 veces con Papel Whatmann N°1 (Ajayi et al., 2019; Bourhia et al., 2019; Cimanga Kanyanga et al., 2018; Cruzeiro et al., 2017; Pereira et al., 2017), constituyendo la solución madre a una concentración de 25000 ppm. Finalmente, a partir de esta solución se prepararon todas las concentraciones utilizadas: 0, 50, 250, 500, 2500, 5000, 12500 y 25000 ppm utilizando como solvente agua de mar filtrada y autoclavada, veáse Figura 1 (Lagarto Parra et al., 2001).
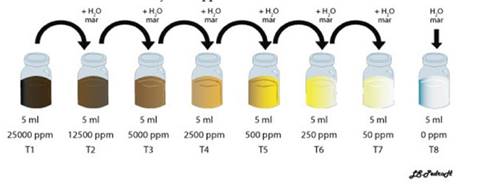
Fig. 1 Esquema del diseño experimental de las diferentes concentraciones de decocto de cálices de “aguaymanto” Physalis peruviana L.
Ensayo de toxicidad: se utilizaron 24 tubos Eppendorf en soportes, donde se colocaron los diferentes tratamientos, cada bloque de tubos contenía agua de mar filtrada y autoclavada con 10 larvas de III estadio de A. salina. Después de 48 horas, se determinó el número de larvas muertas para cada pocillo. La larva se consideró muerta cuando no se observaba movimientos constantes de los apéndices durante por lo menos 10 segundos, así como velocidad de nado reducida, véase Resultados (Araújo et al., 2017; Asadi et al., 2019; Balalakshmi et al., 2017; Cimen, Danabas, & Ates, 2020; de Melo da Silva et al., 2016; Libralato et al., 2016; Madhav et al., 2017; Martínez Medina et al., 2015; Mesarič et al., 2015; Raju et al., 2020; Sánchez-Montes et al., 2020; Swarnkumar & Osborne, 2020; Wang et al., 2017; Zhu et al., 2017). Figura 2
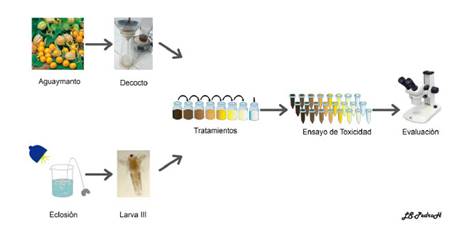
Fig. 2 Diseño de exposición del decocto de cálices de Physalis peruviana L. “aguaymanto” sobre larvas del tercer estadio de Artemia salina
Registro de datos: el ensayo duró 48 horas, durante la cual se dejó interactuar al decocto en sus diferentes concentraciones con las larvas del III estadio de Artemia salina a temperatura ambiente.
Análisis Estadístico: con los datos obtenidos se realizaron los cálculos para determinar la dosis letal media DL50 del decocto de cálices de “aguaymanto” sobre larvas del tercer estadio de A. salina, así como una gráfica de tendencia de la toxicidad de las diferentes concentraciones. Se utilizó el software libre R para realizar el análisis de regresión Probit con una PE≤0.05.
Resultados
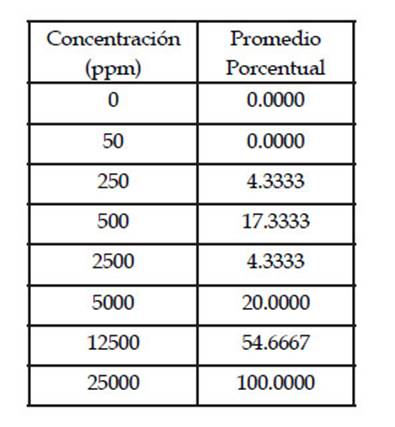
Se analizan las larvas del estadio III de A. salina, luego de 48 horas de exposición a los 08 tratamientos considerados (Tabla 1)
Tabla 1 Promedio porcentual de mortalidad de larvas III de Artemia salina a las 48h de exposición a las diferentes concentraciones de decocto de cálices de “aguaymanto” Physalis peruviana L.
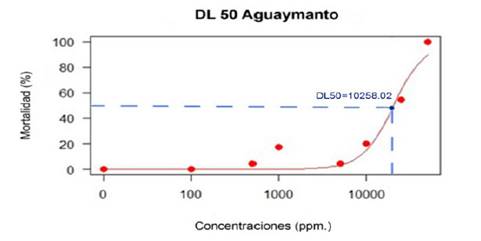
En la Figura 3 se muestra la curva de dosis letal media (DL50) del decocto de cálices de “aguaymanto” Physalis peruviana L. calculada con el programa R, con los datos de los nauplios del III estadio larval de A. salina, el valor de la DL50 fue de aproximadamente 10000 ppm. (10258,02 exactamente).
Discusión
Los resultados de la presente investigación indican que la dosis letal media, DL50, del decocto de cálices de P. peruviana L. tiene un valor de 10258,02 ppm., considerado valor alto en un extracto vegetal, como tóxico cuando es inferior a 1000 ppm. (Lagarto Parra et al., 2001).
Otras investigaciones realizadas sobre la toxicidad de extractos obtenidos de plantas podemos mencionar al aceite esencial de Eugenia stipitata (EsEO), con DL50 de 812,45 ppm, que sugiere un potencial tóxico en ratones junto con sus posibles efectos sobre los parámetros hematológicos, bioquímicos e histológicos de los órganos (Costa et al., 2020).
Investigaciones similares fueron realizadas en plantas del género Physalis por Lagarto Parra en el 2011, en extractos de Physalis peruviana L. evaluados con el bioensayo de A. salina, considerándose con actividad biológica a un valor de DL50 inferior a 1000 ppm, esta diferencia se debería a que los extractos se prepararon de diferentes partes de la planta y con metodologías distintas a la utilizada en la presente investigación. Chandra et al. en el 2019, prepararon extractos etanólicos de diferentes partes de la planta de P. peruviana L. mostrando una actividad no tóxica (Ade Chandra et al., 2019). En contraste a la anterior investigación, Sanabria & Gualdrón en 1997, proponen que P. peruviana L. posee una elevada toxicidad debido a la presencia de lactonas terpénicas, caso similar se presentó en la investigación de Oktavia, et al. en el 2017 determinaron que el extracto etanólico, al 70%, es tóxico para A. salina (Oktavia et al., 2017; Sanabria & Gualdrón, 1997). Podemos inferir que los extractos etanólicos de las diferentes partes de P. peruviana L. son tóxicos según la evaluación con A. salina, esto se debería a los principios activos que se obtienen con esta metodología de extracción. Por otra parte, los extractos acuosos de las diferentes partes de P. peruviana L., como los obtenidos por Gibson et al. en el 2012, no presentan toxicidad incluso siendo la supervivencia de A. salina similar a la de los controles negativos lo cual coincide con los resultados de nuestra investigación (Gibson et al., 2012). Por ello se puede inferir que los decoctos de cálices de Physalis peruviana L. presentan baja toxicidad, por lo cual, se debe realizar más investigaciones para su uso, con un bajo riesgo como tratamiento natural promisorio para múltiples dolencias.












 uBio
uBio