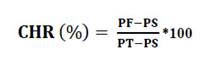Introducción
Químicamente el concepto relacionado con la salinidad incluye el efecto de todas las sales solubles, tanto las necesarias para la alimentación de las plantas, como las que son perjudiciales. Un suelo es considerado salino cuando tiene un exceso de sales solubles, entendiéndose como sales los diferentes componentes químicos que forman parte de los nutrientes y de los requerimientos de las plantas, bien sea porque se encuentran en la solución o precipitadas en el suelo (Campos, 2009; Golldack et al., 2014).
Se ha comprobado que los efectos de la salinización en los suelos inhiben el crecimiento de muchos cultivos, atacando estados fenológicos de iniciación del crecimiento de las plantas como la germinación, periodo crítico en la vida de la planta, en el que aumenta su sensibilidad a la salinidad. Dos ejemplos claros son la germinación de la “cebada” y el “trigo”, que no toleran salinidades superiores a 4-5 dS/m a 25 °C (Zhu, 2001).
Royo & Cantero (1996), plantearon que la superficie agrícola del planeta afectada por salinidad y/o alcalinidad es de alrededor de mil millones de hectáreas; lo que varía, desde valores de 230 millones hasta casi mil millones de hectáreas, estando presente en todos los continentes.
Otras estimaciones indican que un tercio de la superficie mundial bajo riego (unas 230 millones de hectáreas) se encuentran afectadas en mayor o menor grado por la salinidad, proyectándose que el área de tierra agrícola afectada por la salinidad se duplicará en los próximos 35 años (Florez et al., 1996; Gilliham et al., 2018).
Dentro de las investigaciones sobre el particular, puede mencionarse a Ortiz et al. 2002, quienes para optimizar la tolerancia a la salinidad en cultivos, utilizaron métodos de mejora y selección tradicionales así como la producción de organismos modificados genéticamente. La base de esta línea de investigación está hoy sustentada en la identificación e incorporación de genes procedentes de parientes silvestres tolerantes, la domesticación de plantas halófilas silvestres y la identificación de caracteres relacionados con la tolerancia empleando marcadores moleculares, así como la incorporación de genes cuya expresión modifica mecanismos bioquímicos y fisiológicos involucrados en la tolerancia (Vintimilla, 2017 y Gilliham et al., 2018).
Meriño et al. (2018) trabajando con el ”garbanzo” (Cicer arietinum L.) especie sensible a la salinidad, encontraron la existencia de diferencias en cuanto al grado de tolerancia a este tipo de estrés, de acuerdo a los tipos de cultivares experimentados. Asimismo, Ortíz et al. (2002) y Tenhaken (2015), demostraron que la salinidad afecta el crecimiento y producción de los cultivos al reducir el potencial hídrico de la solución del suelo, disminuyendo así la disponibilidad de agua, y al crear un desequilibrio nutritivo dado la elevada concentración de elementos (Na+, Cl-) que pueden interferir con la nutrición mineral y el metabolismo celular. Asimismo, encontraron que los diversos efectos observados a distinta escala, desde reducción de turgencia y crecimiento hasta la pérdida de la estructura celular por desorganización de membranas e inhibición de la actividad enzimática, son el producto combinado de estrés hídrico, toxicidad iónica y desequilibrio nutricional.
Por otra parte, Hasegawa et al. (2000) encontró que una célula vegetal expuesta a un medio salino equilibra su potencial hídrico perdiendo agua, lo que produce la disminución del potencial osmótico y del potencial de turgencia, hecho que genera señales químicas (aumento del Ca2+ libre intracelular, síntesis de ABA,) los que desencadenan posteriores respuestas adaptativas. Datta & Jong (2000), trabajando el tema de tolerancia a la salinidad en plantas encontraron que la acumulación de solutos orgánicos e inorgánicos a nivel intracelular reducen el potencial osmótico celular, así como la reducción en la conductividad hidráulica de las membranas, posiblemente por disminución del número o apertura de los canales de agua (acuaporinas).
Anon, 1986, en sus estudios sobre estrés salino encontraron que los cambios inducidos por el estrés salino en la ultra estructura, morfología y desarrollo de tejidos especializados (endodermis y exodermis) de la raíz reflejan los cambios adaptativos conducentes al control de la absorción y transporte de agua y iones a la parte aérea.
En cuanto al contenido hídrico relativo Kramer (1974), menciona que el porcentaje de agua máxima que puede contener una hoja a plena turgencia arroja un resultado para el CHR de alrededor de 60% a 70%, estando el estado hídrico de la hoja íntimamente relacionado con variables fisiológicas, tales como la turgencia de las hojas, el crecimiento, la conductancia estomática, la transpiración, la fotosíntesis y la respiración.
En nuestro país, La Rosa et al., 2011, trabajando con la especie Hibiscus rosa sinensis L. (Malvaceae) sobre suelo agrícola introducido en el cerro “El Agustino”, distrito El Agustino, Lima, Perú, encontró valores de CHR de entre 43% y 53%; mientras que Borjas et al., 2015, trabajando con dos variedades de olivo Olea europea L, en el valle desértico de Cañete-Perú, determino que el CHR para estas variedades estuvo en el nivel de 63% y 78%.
Buscando una solución a la problemática agroecológica actual sobre salinización de suelos y estrés abiótico salino en plantas, se propuso el establecimiento de un sistema experimental de quelite Amaranthus hybridus L., una de las malezas de mayor distribución en los diferentes pisos ecológicos de nuestro país, con la finalidad de medir su respuesta a la máxima tolerancia a concentraciones de cloruro de sodio, cuyos resultados nos permitirán servir de base para su análisis genético futuro y por tanto ser utilizada esta planta como material en investigaciones biotecnológicas y de ingeniería genética relacionadas con la productividad agronómica de plantas cultivadas.
El objetivo planteado en la presente investigación fue determinar la respuesta máxima tolerable de cloruro de sodio del quelite a través del peso seco, peso fresco, peso turgente y contenido hídrico en relación a las concentraciones de 60, 90, 135, 180 y 220 mM/L de NaCl.
Material y métodos
El estudio se llevó acabo en el Laboratorio de Ecología y Medio Ambiente de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo, Perú, ubicado en el primer piso del Pabellón de Ciencias Biológicas Ciudad Universitaria; así como en la unidad de hidroponía del campo experimental de Ecología.
Las semillas, fueron obtenidas de plantas de quelite que crecen como malezas en el campo experimental de Ecología, las que previo al experimento fueron seleccionadas y superficialmente desinfectadas con hipoclorito de sodio al 5% por 3 minutos, luego fueron sembradas en bolsas de germinación de polietileno de 2 kg de capacidad con suelo agrícola exento de NaCl (Fig. 1 y 2) en un número de tres semillas por unidad experimental, y en donde al final de las dos primeras semanas de crecimiento se hizo el correspondiente raleo dejando sólo a la planta más vigorosa. A partir de la tercera semana las plántulas semanalmente eran regadas con soluciones de 60, 90, 135, 180 y 220 mM/L de NaCl, Como testigo se utilizó agua destilada con una conductividad eléctrica igual a 0 dS/m. Experimentalmente se utilizó un diseño experimental completamente aleatorizado con 3 repeticiones. Los datos se analizaron con la prueba estadísticas de ANOVA.
La recolección de las muestras para el análisis se realizó durante la época de floración después de iniciada la fase experimental; luego se realizaron las siguientes medidas fisiológicas: peso fresco, peso turgente y peso seco para determinar el CHR (Contenido Hídrico Relativo) y analizar el estrés generado por el sistema salino.
La medida del Contenido Hídrico Relativo (CHR) foliar se calculó por medio del método gravimétrico, siguiendo la metodología propuesta por Mena-Petite et al., 1999. Para ello, en primer lugar se determinó el peso fresco (PF) de las hojas tras la cosecha. Posteriormente las muestras se introdujeron en vasos de precipitación con agua destilada y se sometieron a refrigeración a 4ºC; transcurridas 24 horas se anotaron el peso turgente (PT). Por último, el peso seco (PS) se determinó a las 72 horas luego de introducir el material en estufa a 80ºC.
El Contenido Hídrico Relativo se calculó mediante la siguiente fórmula:
Resultados
El estudio del régimen hídrico de las plantas en condiciones salinas es de gran importancia, ya que las que mejor economicen este importante recurso para la vida, tendrán mejores rendimientos. El CHR es la expresión más usada para medir el nivel de agua de un tejido. Es la medida del contenido de agua respecto al total que este puede almacenar; se expresa como porcentaje y permite conocer el estado hídrico de la planta. Se relaciona con el potencial hídrico porque éste y sus componentes, potencial de presión y de solutos, son función del volumen de agua del protoplasma.
Los resultados de la presente investigación permitieron observar una disminución en la velocidad del crecimiento de las plántulas, pérdida de intensidad en el color verde de las plántulas, amarillamiento de las hojas, caída de hojas y yemas (Fig. 3). Asimismo, en el Cuadro 1 y Figuras 5, 6, 7 y 8, puede observarse que en la mayoría de las concentraciones salinas, las plantas mostraron valores bajos del CHR en el estadio de floración estudiado, indicando que en estas condiciones la eficiencia en el uso del agua disminuye, notándose sus efectos en el estadio de desarrollo de floración los que fluctuaron entre 27,07% y 44,91% en el CHR.
Cuadro 1 Resultados de las medidas fisiológicas: peso fresco, peso turgente y peso seco para determinar el CHR (Contenido Hídrico Relativo) y analizar el estrés generado por el sistema salino sobre el quelite.
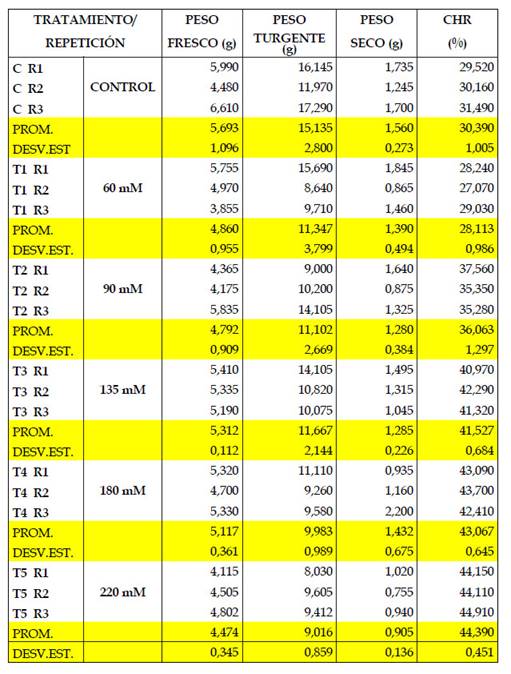
Fig. 5 Peso fresco de hojas de Amaranthus hybridus L., en muestras de plantas en la época de floración.
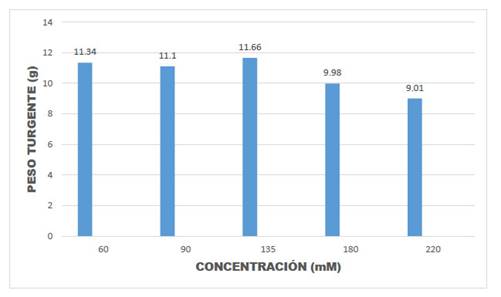
Fig. 6 Peso turgente de hojas de Amaranthus hybridus L., en muestras de plantas en la época de floración.
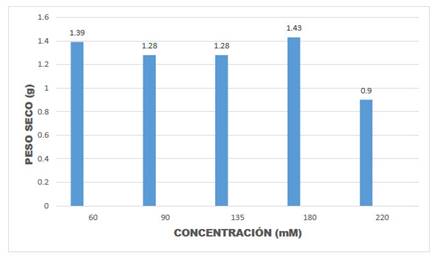
Fig. 7 Peso seco de hojas de Amaranthus hybridus L., en muestras de plantas en la época de floración.
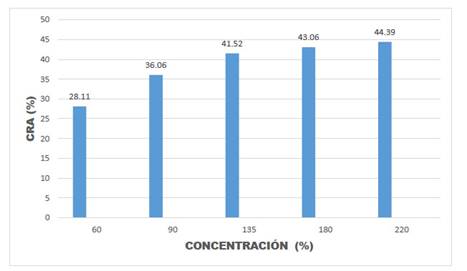
Fig. 8 Valores del coeficiente hídrico relativo (CRA) en porcentaje de hojas de Amaranthus hybridus L., en muestras de plantas en la época de floración.
En el Cuadro 1 se observa también que valores de 60 mM, representa a una concentración con respuestas casi similares al desarrollado por plantas normales. De igual modo se ha notado que los valores de la desviación estándar entre repeticiones están dentro de los valores considerados como normales (Cuadro 1). Del mismo modo, la prueba de ANOVA demuestra que la diferencia entre repeticiones a nivel de las diversas concentraciones salinas no es significativa (p=0,5684, para peso fresco; p=0,6395, para peso turgente y p=0,6038, para peso seco).
Discusión
Según Barrs & Weatherley (1962) y Acevedo et al. (1998) la resistencia al estrés hídrico en las especies de cultivo está asociada al grado en que éstas regulan el contenido de agua y el potencial hídrico foliar durante el estrés. La capacidad de una planta para mantener su estado hídrico a medida que el potencial hídrico del suelo disminuye constituye una adaptación al déficit hídrico. Esta capacidad se refleja en el contenido relativo de agua (CRA), en el potencial de solutos (ψs) de los tejidos y en el ajuste osmótico (AO).
Esta afirmación, se relaciona con los resultados de los parámetros hídricos calculados en la presente investigación, donde el contenido hídrico relativo a turgencia cero resultó en un 44,91% y a una concentración de NaCl de 220 mM, esto indica que la planta inicia la plasmólisis celular con una pérdida de un 55,09% del contenido hídrico relativo, esto significa que el quelite Amaranthus hybridus L., es una planta moderadamente tolerante al estrés salino.
Este resultado concuerda también con los encontrados por La Rosa et al., 2011, quien determinó CHR de 34% y 55% trabajando con Hibiscus rosa sinensis L., donde la respuesta primordial es el ajuste osmótico que esta planta realiza a nivel radicular, lo cual se refleja en la irregularidad del potencial hídrico, así como en la disminución del % CHR foliar, siendo estos parámetros los que indican la capacidad de la planta para mantener un equilibrio en su estado hídrico a pesar de las condiciones estresantes, de déficit hídrico. La explicación fisiológica, bioquímica y molecular de este tipo de comportamiento fue explicada por Gupta & Huang (2014).
Sobre el particular, Azcon & Talón (2001), plantean que especies con menores valores promedio de elasticidad de la pared celular son más tolerantes al estrés hídrico generados por la presencia de salinización en los suelos, al ser más elásticas sus células, ya que presentan una alta tasa de ajuste que les sirve para retener agua a diferentes potenciales hídricos.
En relación con la tolerancia a la salinidad en investigaciones en “trigo”, se ha demostrado una disminución de la tolerancia a la salinidad a medida que transcurren las distintas fenofases del cultivo, demostrándose que el factor genético que controla la tolerancia a la salinidad pudiera estar localizado en el genoma DD, aspecto que ha sido señalado por Amor et al., 2001; Mano & Takeda, 2001, y Acevedo et al., 2003.
Por otro lado, Gucci et al. (1999) trabajando con plantas de “olivo”, demostraron que el CHR en muestras de raíces estas muestran valores que se encuentran en el rango normal para esta especie, el que fluctúa entre 75% y 80%; situación que no se refleja en los contenidos hídricos en las hojas los que se mantienen constantes como respuesta a algún tipo de regulación. Resultados casi similares fueron encontrados en plantas de “olivo” por Borjas et al., 2015, con valores de 68% y 74%.
Asimismo, D’Anna et al. (2003), al comparar el peso fresco y el peso seco de plantas de fresa, determinaron un comportamiento inversamente proporcional a la concentración de sal, similares a los encontrados en la presente investigación.
Prazak (2001), sostiene también en relación al tema que una ineficiente economía del agua en las plantas cultivadas en condiciones salinas ocurre, debido a la aparición de un estado de sequía fisiológica, que no se debe a la falta de agua en el suelo, sino a que la planta no puede absorberla con facilidad porque el suelo posee una alta concentración de sales y, por tanto, valores del potencial hídrico tan bajos, que pueden llegar a ser inferiores al potencial de la célula, limitando la absorción del agua y si este fenómeno se produce por mucho tiempo, la planta puede morir.
Afirma también, que la importancia práctica del estudio de la tolerancia a la salinidad en el germoplasma disponible, basado en el régimen hídrico, radica en el manejo sustentable de los recursos fitogenéticos en áreas afectadas por el estrés, donde las medidas de rehabilitación mediante el lavado son además de costosas, de muy difícil ejecución, debido al mal drenaje y a la proximidad del manto freático a la superficie del suelo, por lo que este monitoreo en dicho germoplasma permitiría seleccionar el material con mayores perspectivas de crecimiento y rendimiento.
Por otra parte, Vintimilla (2017) trabajando con el “tomate de árbol” (Solanunm betaceum), en relación a la tolerancia a la salinidad de esta especie encuentra que el screening de variedades en las especies pudiera servir como base para el mejoramiento genético por selección y/o por otras técnicas genéticas; similares comportamientos fueron determinados por Muns (2005). Por ejemplo, actualmente, se desarrollan proyectos de investigaciones de introducción y validación de variedades de “trigo” con tolerancia a la salinidad y a la sequía, sobre la base de indicadores fenológicos, fisiológicos, bioquímicos y moleculares, con vistas a mitigar el problema de los suelos salinos y lograr, de esta manera, un acercamiento a su rentabilidad.
Finalmente, remarcaremos que el ajuste osmótico es un proceso que consiste en la acumulación activa de solutos en tejidos de la planta en respuesta a una disminución de la disponibilidad de agua. Con ello se disminuye el potencial de solutos y el potencial hídrico total de tallos, hojas, y raíces (Turner & Jones, 1980; Girma & Krieg, 1992). Como resultado, las plantas pueden absorber agua a potenciales hídricos del suelo menores y mantener la presión de turgencia y la actividad fisiológica relacionada al contenido hídrico en los tejidos (Hsiao et al., 1976; Blum & Sullivan, 1986; Ludlow et al., 1990).
Conclusiones
El contenido hídrico relativo de agua en las hojas de Amaranthus hybridus L. (Amaranthaceae), muestra una relación inversa entre concentración salina y valores de CHR en porcentaje que condicionan su tolerancia al estrés salino.
Amaranthus hybridus L., es una especie moderadamente resistente al estrés hídrico generado por concentraciones salinas.
Los resultados obtenidos en la presente investigación son la base para realizar estudios futuros de la respuesta a la salinidad a nivel genético, con aplicación a plantas cultivadas de importancia alimentaria.





![Bird diversity and noteworthy records from the western side of the Porculla Pass and the Huancabamba-Chamaya river sub-basin, northwest of Peru [with Erratum]](/img/en/next.gif)






 uBio
uBio