Introducción
Existen diferentes géneros bacterianos en el suelo que fijan nitrógeno atmosférico y establecen una interacción simbiótica con leguminosas, formando nódulos en sus raíces (Ormeño-Orrillo et al., 2015). Los más estudiados son Mesorhizobium (Zgadzaj et al., 2016; De Meyer et al., 2015), Bradyrhizobium (Helene et al., 2015), y especies de la familia Rhizobiaceae tales como Rhizobium spp. (Alam et al., 2015) y Ensifer spp. (Li et al., 2016).
Ensiffer spp. ha sido aislado de nódulos radiculares de diversas leguminosas, tales como Sesbania (Li et al., 2016), Trigonella (Eardly et al., 2017), Glycine, Astragalus (Yan et al., 2016) y especies de Medicago procedentes de distintas regiones bioclimáticas (Djedidi et al., 2011). En nódulos de Medicago sativa L., se han identificado Ensifer meliloti y Ensifer medicae, siendo E. meliloti el principal microsimbionte encontrado (RamírezBahena et al., 2015).
Así mismo, algunos de estos géneros son considerados promotores del crecimiento vegetal, ya que no solo fijan nitrógeno atmosférico, sino que también pueden aumentar la biomasa de las plantas a través de la producción de sideróforos (Scagliola et al., 2016), solubilización de fosfato inorgánico (Kuan et al., 2016), actividad antagonista (Naureen et al., 2017), actividad desaminasa (ACC) (Rangel et al., 2017) y producción de fitohormonas (Olanrewaju et al., 2017).
La producción de fitohormonas, principalmente del ácido indol-3-acético (IAA) (Paque & Weijers, 2016), es una de las características resaltantes del género Ensifer. En el estudio realizado por Kisiel & Kępczyńska (2016), evaluaron la capacidad in vitro de E. meliloti para producir IAA a partir de triptófano y demostraron un mejor crecimiento de M. sativa L. Además, se han diseñado cepas de esta especie bacteriana con el fin de sobre producir IAA y mejorar tanto el crecimiento como la expresión del gen nifH (Bianco et al., 2014). Por otra parte, E. meliloti redujo los daños en M. sativa L. frente a condiciones de estrés por sequía (Defez et al., 2017), deficiencia de hierro (Kallala et al., 2018). Además, según Ramírez-Bahena et al. (2015), este microrganismo tolera la acidez, duplicando el número de nódulos radiculares por planta, siendo una característica muy importante para la agricultura de regiones con suelos ácidos. También, se ha estudiado la co-inoculación en condiciones de invernadero junto a bacterias del género Delftia que conllevó a resultados favorables para el crecimiento de M. sativa L. (Morel et al., 2015).
M. sativa L., es una leguminosa perenne forrajera distribuida a nivel mundial y es una de las principales fuentes de alimento para el ganado. Se ha demostrado que los rizobios presentes en esta planta pueden aumentar su valor nutricional (Jafari et al., 2018), además, favorecer el establecimiento de nuevas comunidades bacterianas al ser intercaladas con otros cultivos, permitiendo aumentar el contenido de nitrógeno, potasio, fósforo y carbono (Zhang et al., 2018). Por tales motivos, M. sativa L. es considerado como un alimento sostenible para la agricultura (Kulkarni et al., 2018).
La identificación de especies nativas de Ensifer relacionadas simbióticamente con M. sativa L. permite la selección de cepas con potencial de uso en el área agrícola. Además, es importante destacar la capacidad de adaptación ambiental de las bacterias propias de una determinada región, ya que esto garantiza la subsistencia de la planta. En la provincia de Trujillo (Perú), no se han reportado estudios referentes al aislamiento de Ensifer spp. Por tal razón, la presente investigación tuvo por objetivo determinar las características fenotípicas de E. meliloti y E. medicae (Rhizobiaceae) aislados de nódulos radiculares de M. sativa L. (Fabaceace) cultivada en áreas agrícolas de la Provincia de Trujillo en el Perú; siendo esta la base de estudios posteriores, en donde se seleccionen a estas especies en base a su mayor promoción del crecimiento vegetal, para la formulación de inoculantes microbianos.
Material y métodos
Material biológico
Sistemas radiculares completos con nódulos activos, de 60 plantas de Medicago sativa L. recolectadas de áreas agrícolas de los distritos de Laredo (8°07’35,1”S, 78°56’52,4”W), Moche (8°08’33,2”S, 78°59’45,6”W) y Simbal (8°00’23,7”S, 78°49’33,5”W) de la provincia de Trujillo, Perú (Figura 1).
Recolección y transporte de nódulos radiculares de las plantas
A través de un muestreo dirigido, se seleccionaron 20 plantas de M. sativa L., previamente identificadas taxonómicamente, las cuales estuvieron en estado de prefloración, tuvieron mayor follaje y no presentaron síntomas y/o signos de alguna enfermedad; de las cuales se extrajo los sistemas radiculares completos con presencia de nódulos activos. Se recolectaron los nódulos con parte de raíz o raicilla y fueron envueltos en papel de aluminio e introducidos en frascos con gel de sílice anhidra para ser transportados (Koskey et al., 2018).
Aislamiento e identificación fenotípica de Ensifer spp.
Los nódulos recolectados fueron rehidratados (Somasegarán & Hoben, 1994), para ser luego desinfectados con etanol 70% (v/v) e hipoclorito de sodio al 1% (v/v) (Kang et al., 2018).
Se seleccionó un nódulo activo y se procedió a triturarlo, en condiciones de asepsia, para luego ser cultivado mediante estriado en medio agar levadura manitol (YMA) con rojo de congo. Los cultivos fueron incubados en oscuridad a 28°C durante 7 días (Somasegarán & Hoben, 1994; Kang et al., 2018).
Las colonias típicas (circulares, convexas, opacas, a veces translucidas y mucilaginosas) de los cultivos que crecieron, fueron sembrados nuevamente en YMA con rojo de congo, se realizó la tinción Gram, para comprobar la pureza de las células Gram negativas. A los cultivos aislados se realizaron pruebas bioquímicas descritas en el Manual de Bacteriología Determinativa de Bergey tales como; catalasa, oxidasa, glucosa, sacarosa, ornitina, citrato, D-Arabinosa, L-Triptófano, dulcitol; así como también, características como movilidad, crecimiento en el medio Luria Bertani y en medio líquido levadura manitol (YMB) al 2% (Brenner et al., 2005) y 3% de NaCl (Rome et al., 1996). Además, se evaluó la resistencia antibiótica frente a ácido nalidíxico (Wang et al., 2002).
También, se evaluó cualitativamente la producción in vitro de ácido indol-3acético, para ello los cultivos bacterianos se inocularon en 5 mL de (YMB) suplementado con L-Triptófano (2,5 g.L-1) e incubados a 28°C durante 3 días. Transcurrido el tiempo de incubación, se centrifugó a 8000 rpm durante 5 minutos; luego 2 mL del sobrenadante se mezcló con 4 mL del reactivo de Salkowski y se incubó en oscuridad a 28°C durante 30 minutos (Kang et al., 2018).
Resultados y discusión
A partir de nódulos radiculares de 60 plantas de Medicago sativa L. (Fabaceae) recolectadas en áreas agrícolas de la provincia de Trujillo, Perú, se aisló 14 cultivos bacterianos pertenecientes al género Ensifer; de los cuales ocho fueron identificados como Ensifer meliloti y seis como Ensifer medicae (Rhizobiaceae), cuyas características fenotípicas diferenciales se describen en la Tabla 1.
Tabla 1 Características fenotípicas diferenciales de cultivos de Ensifer meliloti y Ensifer medicae aislados a partir de nódulos de Medicago sativa L. en áreas agrícolas de Trujillo, Perú
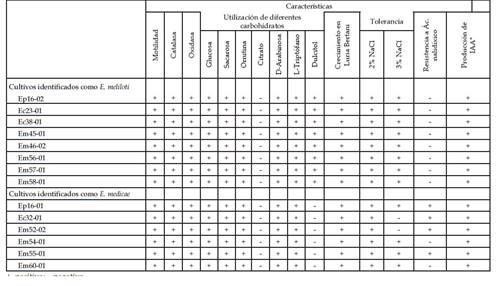
+, positivo; -, negativo
*IAA: Ácido indol-3-acético
De acuerdo a las características macro y micromorfológicas observadas, los cultivos bacterianos aislados a partir de nódulos de M. sativa L. pertenecierón al género Ensifer; su presencia en esta leguminosa es por la capacidad de establecer una interacción simbiótica y formar nódulos en su sistema radicular debido a la especificidad de los factores Nod secretados por las bacterias en respuesta a los flavonoides liberados por la planta (Peck et al., 2006). Además,lo observado concuerda con lo descrito en el Manual de Bacteriología Determinativa de Bergey donde Brenner et al. (2005) especifican a este género como bacilos Gram negativos cortos, que sembrados en agar levadura manitol (YMA) con rojo de congo forman colonias circulares, convexas, opacas, a veces translúcidas, mucilaginosas, que no absorben el rojo de congo, característica distintiva de la familia Rhizobiaceae (Somasegarán & Hoben, 1994).
La diferenciación del género Ensifer con el género Rhizobium se pudo observar con el crecimiento de los cultivos bacterianos en el medio Luria Bertani (LB). Rhizobium no crece en este medio a excepción de R. hainanense y R. tropici, por ello la prueba de tolerancia al 2% NaCl (Brenner et al., 2005) y la utilización de L-Triptófano (Peck et al., 2006) permitió distinguir totalmente estas dos especies de Rhizobium del género Ensifer ya que R. tropici no crece a estas condiciones de salinidad y R. hainanense no es capaz de asimilar este compuesto.
La capacidad de utilización del dulcitol (Wang et al., 2002) y la tolerancia al 3% de NaCl (Rome et al., 1996) permitió diferenciar las especies de Ensifer. Así, en este estudio se aislaron las especies de E. meliloti y E. medicae; estos datos concuerdan con los hallazgos de Ramírez-Bahena et al. (2015) e Iglesias et al. (2007) en donde se encontró a ambas especies nodulando las raíces de M. sativa L.
Cabe mencionar que los cultivos Ep1601, Em54-01, Em55-01 y Em60-01 fueron considerados como E. medicae a pesar de crecer en NaCl al 3% porque al igual que en lo investigado por Rome et al. (1996) esta especie puede ser variable bajo esta concentración de NaCl. Así mismo, se tuvo en cuenta la resistencia frente al ácido nalidíxico (Wang et al., 2002) obteniéndose que los cultivos Em54-01 y Em60-01 fueron sensibles frente a este antibiótico, a pesar de ser identificados como E. medicae.
Ramírez-Bahena et al. (2015) encontraron que la especie de Ensifer aislada en mayor cantidad a partir de los nódulos de M. sativa L. fue E. meliloti; esto concuerda con lo encontrado en esta investigación. Sin embargo, también hay estudios en donde se encontró únicamente a E. meliloti nodulando a M. sativa L. (Djedidi et al., 2011; Kang et al., 2019), lo cual puede explicarse por la especificidad que tienen los rizobios con las leguminosas. Además, se ha demostrado una mejor eficiencia de E. meliloti para nodular a M. sativa L., mientras que, E. medicae es más eficiente nodulando M. truncatula (Kazmierczak et al., 2017).
Las especies del género Ensifer tienen la capacidad para adaptarse a diferentes condiciones bioclimáticas (Djedidi et al., 2011), así como también promover el crecimiento vegetal a través de diversos mecanismos como es la producción de fitohormonas (Defez et al., 2019). En esta investigación, la identificación de cultivos bacterianos aislados a partir de los nódulos de M. sativa L., da paso a la selección de especies con actividad promotora de crecimiento vegetal útil en el sector agrícola.
Conclusiones
Las plantas de Medicago satival (Fabaceae) cultivadas en áreas agrícolas de os distritos de Laredo, Moche y Simbal de la provincia de Trujillo, Perú presentaron bacterias con capacidad de nodulación, que correspondieron a Ensifer meliloti y Ensifer medicae (Rhizobiaceae) con características fenotípicas diferenciales a nivel de especie. Además, se evidenció el hecho que una misma especie de leguminosa, fue infectada por dos especies de Ensifer.
Esta investigación es el primer reporte de características morfológicas de simbiontes de M. satival cultivadas en el norte del Perú.












 uBio
uBio