Introducción
Los humedales costeros están distribuidos principalmente en regiones áridas en Sudamérica. En la zona costera central del Perú, lagunas tropicales someras forman parte del corredor biológico del Pacífico Este. Las cianobacterias, constituyen un grupo de procariontes fotoautotróficos oxigénicos de distribución amplia, con roles estructurales y funcionales diversos, siendo el conocimiento de sudiversidad mediante la caracterización de sus especies (morfotipos) en poblaciones naturales de condiciones ecológicas definidas (ecotipos) esencial para la comprensión de los procesos dinámicos relacionados con los ciclos biogeoquímicos en humedales. La diversidad cianobacterial y la presencia de microalgas como las rodofitas en lagunas tropicales es aún poco conocida en nuestro país. El grado de adaptación o aclimatación delas cianobacterias aunado a su plasticidad fenotípica le permite colonizar diversos hábitats con el desarrollo de morfotipos específicos en su ciclo de vida (Komárek 2014).
Las especies del genero Rhabdoderma Schmidle et Lauterborn con morfotipos coloniales y distribución extensa han sido reportadas para el plancton y el bentos lacustre de aguas dulces, salobres así como marinos, de regiones templadas (Canadá, USA, Rusia, Noruega), tropicales (Brasil, lagos africanos), fuentes termales (Japón, Parque Nacional de Yellowstone) (Stein & Borden 1979; Komárek &Anagnostidis 1998; Kupriyanova et al., 2003; Sant´Anna et al., 2004). En algunos taxa cianobacteriales cosmopolitas como Phormidium retzii, las cepas de esta cianobacteria filamentosa, similares en morfología y microhabitats fueron posteriormente diversificadas y sin correlación por la proximidad geográfica evidenció su rango de distribución restringida (Casamatta et al., 2003). Sin embargo, la validación decepa unicelular halotolerante Halothece,de distribución restringida (pozas de evaporación encostas marinas) y con variabilidad morfológica estuvo en congruencia con sus investigaciones moleculares justificando su definición específica como H. californica (Margheri et al., 2008). Investigaciones de cianobacterias eurihalinas con variabilidad fenotípica han sido reportadas en varios hábitats costeros de nuestro país como Aphanothece halophilica, Pleurocapsa entophysaloidesy Romeria gracilis (Montoya & Golubic 1991; Montoya, 2009).
El objetivo de la presente investigación fue evaluar la variabilidad fenotípica de las morfoespecies Rhabdoderma lineare y Porphyridium purpureum que forman floraciones, así como su tolerancia a gradiente de salinidad, temperatura y pH. Estos datos ecológicos de poblaciones naturales en laguna somera costera son importantes para futuras investigaciones sistemáticas, además las especies R. lineare y P. purpureum constituyen nuevos registros para la diversidad cianobacterial y microalgal de nuestro país.
Material y Métodos
El humedal tropical de Puerto Viejo está localizado en la región costera central entre los 69 y 73 km al sur del departamento de Lima. La evaluación de la flora cianobacterial y microalgal se evaluó mediante colecciones estándar realizadas en forma irregular entre 2005 y 2010. El registro de los parámetros físico químicos (pH, salinidad, temperatura) de muestras de la columna de agua se realizó "in situ" simultáneamente con las colecciones. El pH fue obtenido mediante varillas analíticas indicadoras (Merck), los fosfatos (iones ortofosfato) fueron medidos con cintas analíticas (Merck) en mg L-1. Los nitratos fueron detectados mediante un test para nitratos (La Motte, modelo NCR) en mg L-1. La medición de la salinidad (NaCl) se realizó mediante un salinómetro AO T/C. Submuestras fueron secadas en condiciones naturales, otras fijadas y preservadas en formalina 5%. Datos morfométricos de las especies, su rango de variación, así como las microfotografías secuenciales de los diferentes morfotipos vegetativos y reproductivos fueron realizados para la identificación de las especies con bibliografía especializada (Geitler, 1932; Komárek & Anagnostidis 1998; Kumano, 2002; Komárek et al., 2003; Joosten, 2006; Eloranta & Kwandrans 2007; Komárek et al., 2014).
Resultados
Área de estudio
El humedal de Puerto Viejo está formado por una variedad de lagunas superficiales con un rango amplio en la calidad de sus aguas (dulces, salobres y salinas). El humedal está expuesto a un régimen hidrológico anual con periodos de inundación y desecación. La disminución gradual del nivel del agua en las lagunas origina pozas, charcas y acequias generalmente en el verano, que está relacionado con la desecación lagunar. El ecosistema acuático muestreado, la Laguna Grande, localizada en la zona norte del humedal (12° 33’19.64"S, 76° 42’46.09"O), es superficial y parcialmente efímera en verano, con un área aproximada de 60 km2y máxima profundidad entre 3y 4 m. En la presente investigación, el rango de pH osciló entre 8 y 9, la gradiente de salinidad entre 13 y 20 ppt NaCl en verano (marzo) y otoño (mayo), con rango de temperatura entre 25 y 33 ºC, fosfatos entre 5 y 10 mg L-1y nitratos entre 0.66 y 0.88 mg L-1. Esta laguna colinda con el cerro La Bruja en el límite sur y debido a los vientos en la columna de agua esta recibe partículas de polvo liberados del cerro que contribuyen a enriquecer sus aguas. El sedimento es fangoso, areno arcilloso, con sales de cloruro y carbonato de sodio y con detritus microbiano y de macrófitas como Baccopa monieriy halófitas como Distichlis spicata y Sesuvium portulacastrum que quedan sumergidas en época de inundaciones. Debido a su estructura somera de la laguna, los vientos causan disturbancia en sus aguas con la remoción y resuspensión del sedimento y bentos que en época de inundación causa la turbidez de sus aguas (Fig.1).
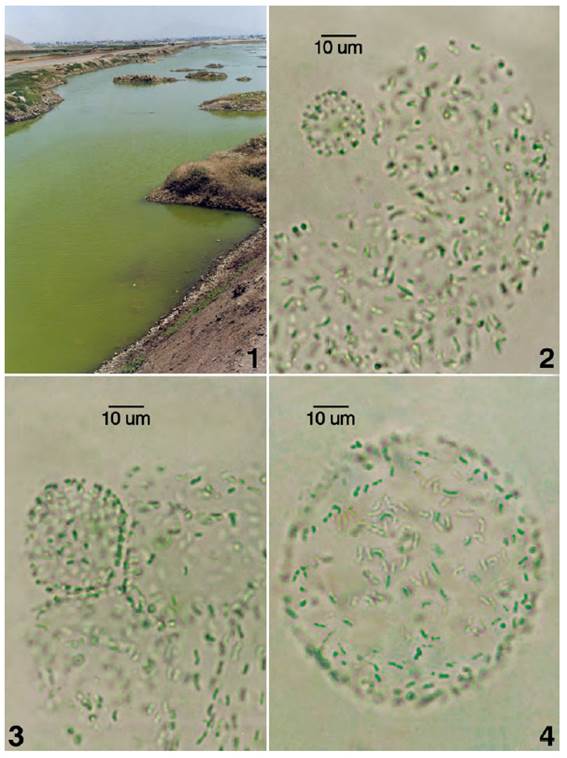
Fig.1. Laguna Grande del humedal de Puerto Viejo, Lima, con floración de comunidades planctónicas cianobacteriales y microalgales. Figs. 2-3. Secuencia de desarrollo colonial de Rhabdoderma lineare con colonias hijas por fragmentación de talo irregular adulto. Fig.4. Talo colonial esférico de R. lineare.
Caracterización de la morfoespecie Rhabdoderma lineare Schmidle et Lauterborn (Synechococcaceae, Chroococcales). Figs. 2-8. Se reporta para nuestra diversidad cianobacterial la presencia de la morfoespecie colonial R. lineareen la laguna Grande de los humedales de Puerto Viejo. La investigación evidenció la plasticidad fenotípica con variantes morfológicas, sus formas transicionales complementado con datos ecológicos de sus poblaciones planctónicas como sigue:
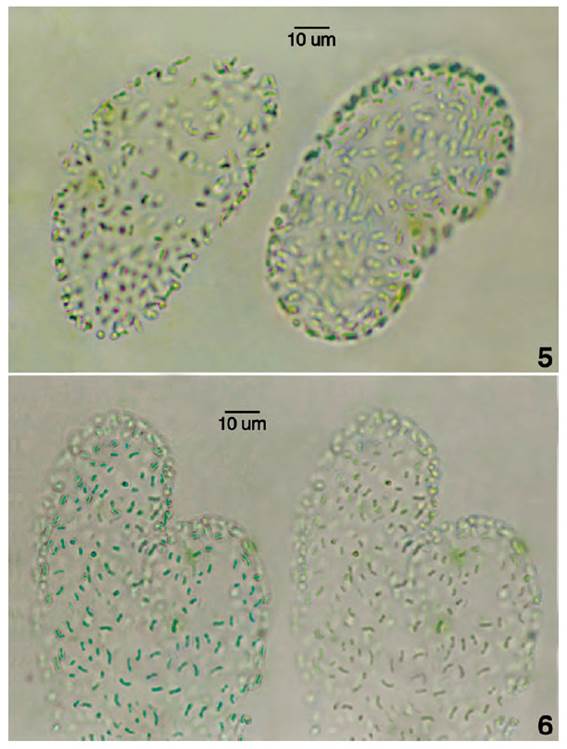
Figs. 5-6. Variabilidad de talos coloniales de R. lineare. Fig. 5. Colonias ovoides de extremos atenuados y redondeados. Fig. 6. Colonia adulta lobulada en diferentes planos para reconocer su distribución celular.
Colonias adultas mucilaginosas redondeadas, ovoide lobuladas, oval elongadas o lobuladas irregularmente, colonias jóvenes en su mayoría redondeadas u ovoides. Mucilago colonial delgado o denso, bien definido, homogéneo e incoloro. El mucílago gelatinoso llega a ser difluente, amorfo, en los márgenes coloniales donde fue reconocido por células libres en sus bordes. Diámetro colonial de (6) 27-112 (84) µm y longitud colonial de 86 a 150 µm. Células cilíndricas, oval elongadas, curvadas, en forma de barra, sigmoides, verde olivo, azules verdes o azulado pálido. Contenido celular homogéneo o finamente granulado y ápicecelular redondeado. Células distribuidas en forma irregular y generalmente distantes, espaciadas o dispuestas en forma laxa en el interior colonial y densas en la periferia colonial. Algunas células están distribuidas más o menos en la misma dirección. Diámetro celular de 0.7a 1.1 µm y longitud celular entre (1.1) 2.1 - 7.5 (8.5) µm. División celular por fisión binaria perpendicular al eje longitudinal, algunas células con plano de división orientado ligeramente oblicuo en células curvadas. Las células hijas pueden adquirir la forma de "v", posteriormente adquieren posición paralela con mucilago evidente o distribuidas en la periferia tangencialmente a la superficie colonial. Las divisiones celulares consecutivas resultan en la formación de cadenas celulares por generaciones subsecuentes que permanecen unidas formando seudofilamentos cortos. Reproducción colonial por bipartición con fragmentación en subcolonias o desintegración irregular de colonias con liberación de mucílago.
Rhabdoderma lineare forma floraciones de tonalidad verdosa (Fig.1), colonizando ambientes salinos y eutróficos con rango de pH de 8 a 9, rango de salinidad entre 13 y 20 ppt NaCl en verano (marzo) y otoño (mayo) con rango de temperatura entre 25 y 33 ºC, fosfatos entre 5 a 10 mg L-1 y nitratos de 0.66 a 0.88 mg L-1. R. lineare coexiste con la especie planctónica Romeria gracilis. La colonización cianobacterial nos permite comprender su función ecológica en éstos hábitats inestables. Los morfotipos planctónicos de las poblaciones naturales de Rhabdoderma lineare en verano y otoño, exhibieron variación morfológica celular, con células ovoides cortas en colonias esféricas hasta células elongadas curvadas formando cortos seudofilamentos en colonias ovoides, elongadas, ovoides lobuladas o irregulares. Las células cortas fueron registradas en altas salinidades a fines del verano. Las células de mayor tamaño (elongadas) fueron halladas a comienzos de otoño inmediatamente después del inicio del periodo de inundación cuando el afloramiento de las aguas subterráneas disuelve gradualmente el sedimento parcialmente seco y expuesto formando pozas temporales que posteriormente confluyen en la laguna Grande.
Caracterización de la morfoespecie de Porphyridium purpureum (Bory) Drew & Ross (Porphyridiales, Porphyridiaceae). Figs. 9-11. Células esféricas u ligeramente ovoides libres o dispersas, de color rojizo, vinosas, verde rojizas o verdes plomizas con cloroplasto axial estrellado con lóbulos periféricos o irregulares, pirenoide central y rodeado de gránulos de almidón. División celular por fisión. Células de (7.5) 10.7 a 18 (19.3) µm de diámetro, rodeadas de mucílago individual, incoloro, alcanzando de 9.6 a 21.4 µm de diámetro. El mucílago confluente con el mucilago individual de células vecinas llega a alcanzar de 26.7 a 48 µm de diámetro, reconociéndose la matriz mucilaginosa incolora con las células embebidas.

Figs. 7-8. Plasticidad fenotípica colonial y celular R. lineare. Fig. 7. Colonias ovoides y curvadas en diferentes planos, distribución celular laxa y formación de seudofilamentos. Fig. 8. Colonia adulta irregular lobulada.
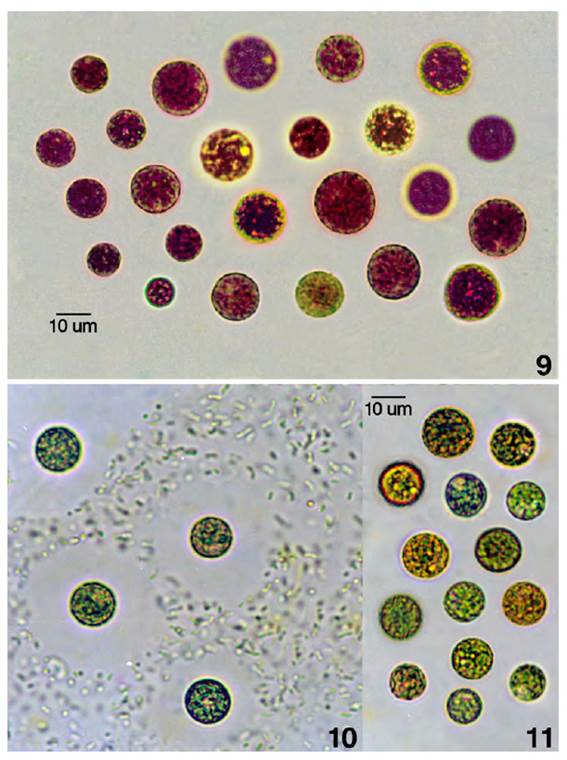
Figs. 9-11. Talos unicelulares de Porphyridium purpureum. Fig. 9. Poblaciones planctónicas con células rojizas (ficoeritrina) con plasticidad fenotípica en sus dimensiones celulares. Fig. 10. Células aisladas y rodeadas de mucílago individual sobre colonia de R. lineare. Fig. 11. Células rojizas virando a verdosas por adaptación cromática.
Las células rodeadas del mucílago gelatinoso fueron mejor reconocidas cuando se distribuyen sobre colonias de R. lineare. Las células de mayores dimensiones en condiciones desfavorables pueden ser consideradas como aplanosporas (estados latentes). Poblaciones de P. purpureum dispersas como las planctónicas o bentónicas. Estas últimas sobre las superficies coloniales sumergidas de R. lineare, por reducción del nivel de agua, exhiben adaptación cromática con las células de tonalidad verdosa.
Discusión y conclusiones
Las condiciones ambientales inestables como escenarios de la biosfera al cual han estado expuestas las cianobacterias durante los eventos de su historia evolutiva larga y rica (Precámbrico) causaron una extensa diversificación de especies con variabilidad morfológica y ecológica que actúan con estrategias de vida temporal y espacialmente exitosas (espectro de nichos y ecotipos). El alto grado de plasticidad fenotípica que exhiben las especies cianobacteriales y algales dificulta la separación de especies por la interpretación morfológica específica por cual es necesario el registro de sus datos ecológicos (Komárek & Komárková - Legnerová, 2007). La variabilidad fenotípica de genotipos idénticos que evidenciaron divergencia morfológica en géneros cercanos no siempre es reflejada en la diversidad genética según Palinska et al. (1996). La investigación de las relaciones filogenéticas de algunas cepas cianobacteriales establecieron que la caracterización morfológica y molecular fueron congruentes (Rajaniemi-Wacklin et al., 2005). Es conocido que los caracteres morfológicos están sujetos a la dinámica e integración evolutiva como el patrón de evolución paralela o convergente y la plasticidad fenotípica, que en los talos simples (unicelulares) puede conducir a una diversidad baja también evidenciada en algas verdes cocoides (Lewis & Flechtner, 2004).
Las características morfológicas representan diferencias y adaptaciones fenotípicas potenciales en respuesta acondiciones fluctuantes en ecosistemas lagunares someros. Estos cuerpos de agua en nuestro litoral están expuestos a fluctuaciones anuales del régimen hídrico como la inundación estacional (afloramientos) relacionada con la gradiente de nutrientes en la columna de agua y a periodos de desecación. En las lagunas costeras las fuerzas hidrodinámicas y aeólicas, la disturbancia de sedimentos (bioturbancia), aunada a la gradiente de salinidad, así como la dinámica del sestón están asociadas con las floraciones del fitoplancton (Scheffer, 2004; Oseguera et al., 2010). En las floraciones de R. lineare, por su naturaleza transicional se reconocieron en forma frecuente la reproducción por fragmentación colonial (origen de colonias hijas) aunada a la desintegración colonial (colonias irregulares), distribución irregular de los seudofilamentos (origen por divisiones celulares consecutivas) y la separación celular. La disminución del nivel de agua en la laguna Grande que origina pozas temporales en el periodo de desecación (verano) puede inducir en la comunidad planctónica la formación ocasional de poblaciones bénticas en los sedimentos que se reducen a costras biológicas secas en periodos de desecación. Durante el periodo de inundación gradual (inicio de otoño) por filtración del agua subterránea, las costras bentónicas secas o ligeramente humedecidas hidratan el mucílago colonial quedando resuspendidas en la columna de agua. De esta manera, los talos coloniales, fragmentos o células que estuvieron en estado de reposo fisiológico en los sedimentos pueden ser inoculados (stock) en la columna de agua y con sucesivas divisiones celulares favorecen el desarrollo de floraciones. La habilidad de las matas cianobacteriales que toleran la desecación y adquieren ventajas en periodos de hidratación aun en periodos de condiciones subóptimas ha sido documentada por Fleming et al. (2007).
La morfoespecie R. lineare en los humedales costeros, exhibió variaciones plásticas intraespecíficas que reflejaron su plasticidad fenotípica con caracteres celulares y coloniales transicionales dependientes del estado del ciclo de vida y del hábitat fluctuante. Por consiguiente, R. lineare es tipificada por su ecotipo eutrófico, alcalino, eurihalino y halofílico en humedal costero. La variación temporal (verano/otoño) en R. lineare fue reconocida por su variación morfológica intraespecífica que refleja su plasticidad fenotípica con implicancias ecológicas y fisiológicas. La plasticidad fisiológica ha sido reconocida como una ventaja morfológica para la adquisición de recursos que incrementa su adaptación para la supervivencia en ambientes fluctuantes. El material de estudio de Puerto Viejo (colonias ovales, elongadas, irregulares lobuladas; células cilíndricas de ápices redondeadas) es próximo a la descripción original de la especie tipo R. lineare de Schmidle (1900) quien estableció colonias curvadas huecas, ápices celulares redondeados, distribución celular en una capa y formación de cadenas cortas o seudofilamentos.
La similaridad de Rhabdoderma con otros géneros planctónicos como Rhabdogloea Schröder, de colonias subesféricas u elipsoidales, células fusiformes, cilíndricas, ligeramente curvadas o sigmoides, distribuidas en forma distante, uniforme o irregular, algunas veces orientadas en la misma dirección y rara vez forman pseudofilamentos (Komárek, 2003; Joosten, 2006). Sin embargo, las diferencias entre los autores citados se basan en la forma celular con ápices atenuados y en que las células cilíndricas los ápices son redondeados. La principal diferencia de éste género con el material de estudio R. lineare se basa en las formas coloniales adultas lobuladas e irregulares y en la forma celular no atenuada o fusiforme. El género planctónico Lemmermanniella Geitler también similar a Rhabdoderma, tiene colonias esféricas, ovoides u elipsoidales, células cilíndricas, de ápices redondeados, fusiformes, rectas o curvadas, densamente distribuidas en la periferie o en forma irregular. Sin embargo, R. lineare es más próxima a la especie L. flexa Hindák de colonias esféricas, ovales o elípticas, células cilíndricas algo curvadas, con seudofilamentos aunque no llega a desarrollar colonias lobuladas e irregulares como la cepa de estudio R. lineare. Algunas especies del género Aphanothece Nägeli tienen cierta similitud con Rhabdoderma, siendo A. bacilloidea Gardner con colonias esféricas elongadas, células cilíndricas y de forma sigmoidea y ápices redondeados similares a las colonias de L. flexa con excepción de las células irregularmente distribuidas. Sin embargo, A. bacilloidea tiene similitud con las colonias jóvenes de R. lineare y L. flexa.
En relación a las especies de Rhabdoderma registradas para hábitats salinos tenemos a R. curtum (Setchell) Komárek et Anagnostidis con células fusiformes que la relacionan mejor con Rhabdogloea y fue citada para zonas costeras salinas pantanosas y litorales marinos en California, USA, Europa, Portugal, Grecia (Komárek & Anagnostides, 1998). También, R. rubrum (Alvik) Komàrek et Anagnostidis, con frecuentes células en hileras, ha sido reportada para aguas salinas en regiones costeras marinas europeas (Noruega). Sin embargo, cepas halófilas y alcalofílicas de R. lineare han sido aisladas de lagos sódicos (Africa y Rusia) y que florecen a pH 9-10 siendo extremófilas al igual que las cianofitas asociadas como Microcoleus chthonoplastes y Spirulina. Estas comunidades cianobacteriales son consideradas como relictos de la biota ancestral preservados bajo condiciones extremas como productores primarios dominantes (Kupriyanova et al., 2003). La especie de estudio R. lineare floreció en condiciones con rango alcalino de pH 8 - 9. Sin embargo, la laguna Grande registra un rango de pH entre 7 y 10.5 siendo considerada la más alcalina en la zona sur de los humedales. R. lineare ha sido reportada para el plancton de zonas templadas como lagos de Canadá y Estados Unidos, República Checa, Suecia (Komárková- Legnerová & Cronberg, 1994), reservorios en São Paulo, Brasil (Sant’Anna et al., 2004), lago africano Magadi y lago de Chilganta, Rusia (Kupriyanova et al., 2003). R. lineare de los humedales de Puerto Viejo incrementa su distribución en hábitats salinos costeros del Pacífico Este de Sudamérica evidenciando su gradiente biogeográfica.
Considerando que la mayoría de especies de formas coloniales en la naturaleza, crecen en cultivos con formas unicelulares perdiendo la característica colonial natural intrínseca, la clasificación taxonómica y nomenclatura binomial basado en el fenotipo natural constituye es un método de reconocimiento y comprensión de la diversidad cianobacterial, además como criterios fenotípicos (caracteres morfológicos) pueden utilizarse para la identificación de poblaciones naturales. Debido a la variabilidad fenotípica de R. lineare es apropiado obtener la información filogenética para la mejor visión y diagnosis de la especie, así como discernir la presencia de especies cripticas o variedades en lagunas someras. La mayoría de cianobacterias y microalgas con taxa planctónicos marinos y de agua dulce tiene distribución cosmopolita debido a que sus células aisladas, esporas o porciones del talo colonial son más factibles de ser dispersados a grandes distancias (Finlay, 2002). No obstante, la distribución de algunas especies se generaliza con distribución global, algunos autores consideran que la ecología y distribución geográfica tienen impacto significativo en las poblaciones locales. El empleo de herramientas moleculares ha demostrado diferencias entre especies morfológicamente idénticas y bien distribuidas (Lewis & Flechtner, 2004). La sistemática cianobacterial contribuye a la delimitación específica evidenciando en algunos casos una mayor diversidad que avala la diversidad críptica en las cianobacterias (Engene et al., 2018). Las especies crípticas en la sistemática cianobacterial ha sido demostrada para la cianobacteria cosmopolita Phormidium retzii (cepas de localidades distantes y cercanas) no distinguibles por caracteres morfológicos y la carencia de similaridad en la secuencia molecular avala que cepas de P. retzii poseen distribución restringida (microhabitats) con diversificación posterior (capacidad de dispersión). La morfoespecie R. lineare de distribución cosmopolita probablemente incluya especies crípticas con variedades de distribución en laguna costera alcalina y salina como la laguna Grande que las hace próxima a las cepas extremófilas africanas con influencia en sus tendencias o patrones biogeográficos.
En ecosistemas salinos han reportado la influencia de la gradiente de salinidad en la morfología celular, las diferencias significativas en las dimensiones celulares con células pequeñas a mayores salinidades en comparación con las de baja salinidad, así como los cambios en forma, como fueron citados para las cepas cianobacteriales Cyanothece o Aphanothece de pozas solares de evaporación en Israel (Dor & Hornoff, 1985). Margheri et al. (2008) determinaron la dependencia de la morfología celular de la salinidad del medio de cultivo siendo las células de mayor diámetro y ligeramente más cortas a salinidades mayores para Halothece californica. En las poblaciones naturales investigadas de R. lineare, las diferencias leves en tamaño celular fueron reconocidos según la literatura. La plasticidad fenotípica en R. lineare demostró estar relacionada con sus habilidades adaptativas que le proporcionan estrategias viables de vida para una exitosa colonización en lagunas costeras.
Las Rhodophyta constituyen un grupo diverso por su exitosa radiación adaptativa, apoyado en el registro de uno de los fósiles más antiguos (1.2 billones de años) entre los eucariontes fotosintéticos que incluye numerosos linajes unicelulares mesofílicos como el de Porphyridium (Porphyridiophyceae), entre otros. P. purpureum tiene una distribución amplia en ecosistemas marinos y terrestres, aguas dulces, salobres, marismas y orillas de ríos. Los organismos fotosintéticos han desarrollado varios sistemas de captura de la radiación para asegurar una eficiente transferencia energética y P. purpureum tiene estrategias en su maquinaria fotosintética con ficobilisomas (complejos de ficobiliproteinas) y proteínas del complejo de fotopigmentos (clorofila, carotenoides) que estabilizan sus funciones y favorecen su adaptación como se presenta en las células rojizas (ficoeritrina) de los humedales costeros. El genoma de P. purpureum ha demostrado una diversidad de historias evolutivas con origen genético de procariontes y eucariontes que ha enriquecido el árbol fotosintético de la vida (Bhattacharya et al., 2013; Muñoz-Gómez et al., 2017).
La microalga Porphyridium muestran un gran potencial para cultivos comerciales porque acumulan ficoeritrina (complejo pigmento proteico), exopolisacáridos y ácidos grasos polinsaturados. Varias microalgas pueden cambiar su capacidad de acumular compuestos secundarios bajo condiciones de estrés como alta intensidad luminosa o limitación de nitrógeno. Li et al. (2019) demostraron en P. purpureumque las respuestas diferenciales a las concentraciones bajas de nitrógeno (3.5 mM) promueven la secreción de mucílago (compuesto de exopolisacáridos), así mismo el incremento de iluminación y temperatura estimula esta secreción como se reconoció en las células verdosas en la laguna Grande a fines del verano (marzo) cuando las floraciones coloniales de R. lineare decaen y pasan a estados sumergidos o bentónicos. La limitación de nitrógeno también puede inhibir la síntesis de ficoeritrina, que fue reconocido en las células verdosas de P. purpureum y podría explicarse por la reducción de nutrientes posterior a las floraciones.
Según Sheath (2003), las mayores dimensiones celulares de P. purpureum, de 7 a 16 µm de diámetro, son alcanzadas en la fase estacionaria de cultivos y las más pequeñas (5 a 10 µm de diámetro), en la fase exponencial. Las células P. purpureum en poblaciones naturales del humedal de estudio alcanzan un rango ligeramente mayor (7.5) 10.7 a 18 (19.3) µm donde las células de mayores pueden considerarse como estadíos latentes (aplanosporas) en ambientes inestables y someros. Existen registros de P. purpureumcon células de 8 a 15 µm de diámetro liberando mucílago por la adhesión mutua del mucílago, las células se agregan en forma irregular (Eloranta & Kwandrans, 2007; Kumano, 2002). Sin embargo, cuando se secan toma el aspecto de costra que también puede considerarse como estado de latencia en los humedales costeros.












 uBio
uBio 

