Introducción
Durante un largo periodo de tiempo, las plantas han sido una valiosa fuente de productos naturales para el mantenimiento de la salud humana, especialmente en la última década, con los estudios más intensivos para las terapias naturales. Alrededor del 80% de las personas de los países desarrollados utilizan la medicina tradicional (Ponmurugan, 2013). Se han aislado alrededor de 12,000 compuestos procedentes de organismos vegetales y se estima que constituyen tan sólo el 10% de los metabolitos secundarios.
El Enterococcus faecalis es un coco Gram positivo, anaerobio facultativo, inmóvil y no esporulado. Su tamaño oscila entre 0,5 y 0,8 micrómetros y es habitante normal del tracto gastrointestinal humano. Esta bacteria ha atraído recientemente la atención de diversos investigadores porque ha sido identificada como una causa frecuente de infecciones periapicales persistentes responsables de la endocarditis bacteriana entre el 5 y 15% de los casos (Reyes, 2012; Pardi et al., 2009). Es la especie más frecuente en piezas dentales con tratamiento de conductos, con una prevalencia superior al 90% (Jiménez et al., 2014). Se ha demostrado que puede sobrevivir a la instrumentación químico mecánica de los conductos radiculares, colonizando los túbulos dentinarios a una profundidad de 300 micras (Carrero et al., 2015)facultative anaerobic, unsporulated coccus whose habitat is the gastrointestinal tract. It can also be found in the hepatobiliary tract, the vagina, and wounds on soft tissues. It has been shown that due to its high virulence, E. faecalis can penetrate the dentinal tubules, surviving chemical-mechanical instrumentation, colonize them at a depth of 300 Μm and re- infest the canals even after being obturated, but the source of infection is not clear. The objective of this study was to determine the frequency and resistance profile of E. faecalis in the oral mucosa of patients attending dental consultation. METHODS: samples were collected from the gingiva, gingival sulcus, palate, tongue, and cheeks of 200 adult subjects attending dental consultation. E. faecalis was identified by means of a screening that included catalase, hemolysis in agar blood, bile esculin, 6.5% NaCl, and PYR, confirming by a Microscan panel (DadeBehring.
Una característica notable de E. faecalis la constituye su capacidad para sobrevivir y crecer en microambientes que pudieran ser tóxicos para bacterias, en particular zonas con altas concentraciones de sales (6,5% de Cloruro de Sodio), temperaturas extremas (15-60ºC) (Pardi et al., 2009).
El E. faecalis puede sobrevivir en condiciones ambientales en las que el pH es similar o superior a 11,5, valores similares a los que proporciona el hidróxido de calcio (Rodriguez & Pumarola, 2009). Su eficaz bomba de protones le permite controlar su pH interno (Vallejo, 2015). Posee numerosos factores de virulencia tales como gelatinasas y serina, proteasas, adhesinas como sustancia de agregación, proteína de superficie enterococcica (ESP), feromonas, proteína de adhesión al colágeno o ACE y antígeno A, y polisacáridos, tanto de su pared celular como de su cápsula (Carrero et al., 2015)facultative anaerobic, unsporulated coccus whose habitat is the gastrointestinal tract. It can also be found in the hepatobiliary tract, the vagina, and wounds on soft tissues. It has been shown that due to its high virulence, E. faecalis can penetrate the dentinal tubules, surviving chemical-mechanical instrumentation, colonize them at a depth of 300 Μm and re- infest the canals even after being obturated, but the source of infection is not clear. The objective of this study was to determine the frequency and resistance profile of E. faecalis in the oral mucosa of patients attending dental consultation. METHODS: samples were collected from the gingiva, gingival sulcus, palate, tongue, and cheeks of 200 adult subjects attending dental consultation. E. faecalis was identified by means of a screening that included catalase, hemolysis in agar blood, bile esculin, 6.5% NaCl, and PYR, confirming by a Microscan panel (DadeBehring.
La gelatinasa es una metaloproteinasa hidrofóbica con la capacidad de romper insulina, caseína, hemoglobina, colágeno y fibrina (Carrero et al., 2015)facultative anaerobic, unsporulated coccus whose habitat is the gastrointestinal tract. It can also be found in the hepatobiliary tract, the vagina, and wounds on soft tissues. It has been shown that due to its high virulence, E. faecalis can penetrate the dentinal tubules, surviving chemical-mechanical instrumentation, colonize them at a depth of 300 Μm and re-infest the canals even after being obturated, but the source of infection is not clear. The objective of this study was to determine the frequency and resistance profile of E. faecalis in the oral mucosa of patients attending dental consultation. METHODS: samples were collected from the gingiva, gingival sulcus, palate, tongue, and cheeks of 200 adult subjects attending dental consultation.
E. faecalis was identified by means of a screening that included catalase, hemolysis in agar blood, bile esculin, 6.5% NaCl, and PYR, confirming by a Microscan panel (DadeBehring. La adhesión a la superficie de la dentina constituye un paso esencial que determina el potencial patógeno de este microorganismo. La dentina contiene colágeno y otras proteínas, se sugiere que las proteasas sintetizadas por E. faecalis así como la proteína de unión al colágeno (Ace) pudieran participar o por lo menos influir en la adhesión bacteriana, y por lo tanto permitir que la bacteria colonice el conducto radicular (Pardi et al., 2009). Cuando esta especie crece en biopelículas, puede ser hasta mil veces más resistente a la acción de los antimicrobianos que cuando se halla como bacteria planctónica (suspendida en un medio líquido y no adheridas a ninguna superficie) (Reyes, 2012).
El Perú posee una gran biodiversidad de especies vegetales y frutos nativos, la mayoría de ellos no industrializados. (Leiva et al., 2008).
La Musa sp. (Musaceae) también conocido como el “plátano” es una fruta tropical conocida e importante fuente de alimentos en el mundo. Desde su casa Pacífico Sur occidental nativo, la planta de “banano” se extendió a la India por el año 600 ac y más tarde se extendió por todo el mundo tropical. Es posiblemente la cosecha cultivada más antigua del mundo (Ponmurugan, 2013). La familia Musaceae presenta los siguientes componentes químicos no alimenticios: fructosanos, ácido fenólico, antocianinas, terpenoides, esteroides alcaloides aislados como la amina alcalóidica y alcaloides indólicos, además la savia de plátano está constituida por agua en un 85%. En el extracto de la hoja posee una mezcla de polihidroxifenoles y taninos, además posee propiedades antibióticas, contra el Mycobacterium phlei y Rhodococcus (Ortiz, 2012). Los compuestos fenólicos son constituyentes importantes del fruto porque exhiben actividad antioxidante por inactivación de radicales libres o prevención de la descomposición de hidroperóxidos en radicales libres (Ponmurugan, 2013). Presenta un látex que es de consistencia lechosa en cuyo estudio fitoquímico se han determinado componentes más característicos, encontrándose proteínas, gomas, mucilagos, saponinas, almidón, resinas,compuestos reductores, coumarinas, flavonoides, esteroides y triterpenoides, algunos de los cuales tienen importancia desde el punto de vista farmacológico (Saravia et al., 2011).
Los flavonoides son pigmentos naturales presentes en los vegetales y que protegen al organismo del daño producido por agentes oxidantes, como los rayos ultravioletas, la polución ambiental, sustancias químicas presentes en los alimentos, etc. El organismo humano no puede producir estas sustancias químicas protectoras, por lo que deben obtenerse mediante la alimentación o en forma de suplementos (Martínez et al., 2002).
Debido a este hecho se han descrito efectos protectores en patologías tales como diabetes mellitus, cáncer, cardiopatías, infecciones víricas, úlcera estomacal y duodenal, e inflamaciones, También son antivirales y antialérgicas, antitrombótica y antiinflamatorias (Martínez et al., 2002) Actúan como estabilizadores de la membrana protegiendo de forma eficaz la estructura y función de las células por tanto impiden que las radiaciones ultravioletas y los radicales libres ataquen piel, mucosas y otros tejidos además de ayudar a la recuperación de las zonas lesionadas (Burgos, 2015)before the damage induced by cyclophosphamide in meristem cells of Allium cepa (onion.
Posee propiedades medicinales eficaces, como el jugo del tallo que se utiliza en afectaciones nerviosas como la epilepsia, la histeria, en la disentería y la diarrea. Varios oligosacáridos que comprenden fructosa, xilosa, galactosa, glucosa y manosa se producen naturalmente en plátano por lo que es un excelente probiótico para el crecimiento selectivo de bacterias beneficiosas en el intestino. Ayuda en la lucha contra la diarrea y la disentería y promueve la curación de las lesiones intestinales en la colitis ulcerosa (Ponmurugan, 2013). Se ha estimado que Musa comprende alrededor de 70 especies y más de 500 variedades, y nuevas especies aún por descubrir (Martins et al. , 2009).
Los microorganismos tienden a ubicarse en zonas específicas del conducto radicular, que garanticen su supervivencia, así como también el poder de expresar los factores de patogenicidad que les permitan agregarse, penetrar y colonizar los tejidos afectados (Herrera et al., 2008).
En el tratamiento de la patología pulpo-periapical, uno de los objetivos fundamentales del tratamiento endodóntico consiste en conseguir la máxima eliminación de los microorganismos residentes en los conductos radiculares de los dientes a tratar (Rodriguez & Pumarola, 2009). El medio que permite cumplir mayormente este objetivo es la combinación de la instrumentación (limpieza mecánica de las paredes dentinarias internas del canal mediante instrumental endodóntico estandarizado) y la irrigación de los conductos mediante soluciones que posean capacidad antiséptica; pero, que no sean excesivamente irritantes para el tejido conectivo periapical (Rodriguez & Pumarola, 2009).
Se demostró en un estudio que Musa paradisiaca presenta actividad antibacteriana eficaz seguido de Musa acuminata contra infecciones multiresistentes causadas por patógenos nosocomiales (Ponmurugan, 2013). A su vez otra investigación realizada en India demostró el amplio espectro antibacterianoenlosmicroorganismosGram positivas: Bacillus subtilis, Staphylococcus aureus, Pseudomonas aeruginosa y bacterias Gram negativos: E. Coli, Proteus vulgaris, Salmonell typhi, Klebsiella pneumoniae y Salmonella paratyphi con mayor capacidad frente a P. vulgaris y S. paratyphi (Venkatesh et al., 2013). Y también fue comprobada su propiedad bactericida, en especial frente a M. tuberculosum (Ortiz, 2012).
A lo largo de los últimos años, se han realizado estudios para la erradicación del Enterococcus Faecalis, bacteria altamente resistente a los antibióticos y sobre todo a la medicación intraconducto durante el tratamiento endodóntico en piezas necróticas, existen pocos estudios empleando la Musa acuminata por lo que el resultado podría contribuir en poder encontrar una alternativa de inhibir al Enterococcus faecalis, y así, disminuir los fracasos endodónticos causado por este microorganismo, por lo que el objetivo del estudio es evaluar la efectividad antibacteriana in vitro del extracto etanolico de la Musa acuminata frente al Enterococcus faecalis ATCC 29212.
Materiales y Métodos
El estudio fue experimental y se realizó en el Laboratorio de Microbiología y Farmacognosia de la Facultad de Medicina Humana de la Universidad Privada Antenor Orrego del Distrito de Trujillo, Provincia de La Libertad - Perú.
Preparación del inóculo:
Se hicieron diluciones de cada una de las cepas en caldo de triglicolato estéril, hasta que se obtuvo una turbidez semejante al tubo del Nefelómetro de Mc Fraland (suspensión experimental) que corresponde a 108 bacterias / ml.
Cultivo de la cepa:
El cultivo de las cepas se realizó en el laboratorio de Microbiología de la Universidad Privada Antenor Orrego. Las cepas estándar de E. Faecalis ATCC 29212, fueron cultivadas en medio agar Müller Hilton e incubadas a 37° por 24 horas en microanaerobiosis (5 a 10% de CO2) en jarra Gaspak.
Obtención del extracto etanólico de la Musa acuminata
Recolección:
Se recolectaron los tallos de la Musa acuminata en el Distrito de Laredo, Provincia de Trujillo,Departamento de la Libertad. Ubicado a 8° 5’31’’S78°57’39.54’’ O y 89 msnm de Altitud.
Selección:
Se procedió a hacer la selección de la materia vegetal con el objeto de obtener sólo los de tamaño uniforme y separar las partes deterioradas.
Identificación:
La planta medicinal seleccionada, se llevó al Herbario Truxillensis de la Universidad Nacional de Trujillo para su identificación taxonómica.
Clasificación Taxonómica:
Todas las especies de bananos y plátanos comerciales pertenecen a la familia musácea, la cual se encuentra subdividida en tres subfamilias: Musoideae, Strelitroideae y Heliconoideae. La subfamilia Musoideae se divide en los géneros: Ensete y Musa. El primero agrupa a las hierbas monocarpicas con numero cromosómico de nueve y no producen frutos comestibles, el segundo, el género Musa está constituido por cuatro secciones: Australimusa, Callimusa, Rhodochlamys y Eumusa.
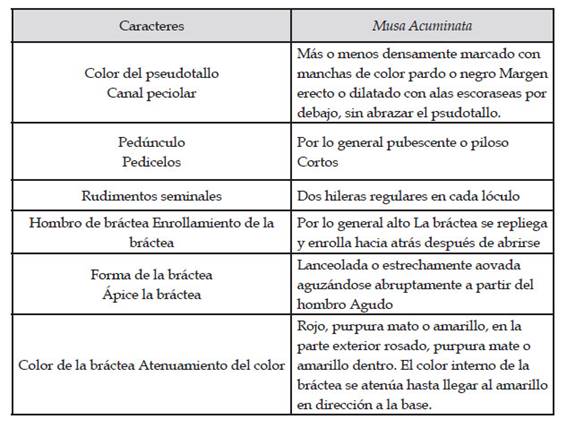
La sección Eumusa es la de mayor importancia económica, ya que la mayor parte de los cultivares de “banano” y “plátano” son producto de esta evolución del género Musa. Sus cultivares tuvieron su origen es dos especies silvestres, Musa acuminata y Musa balbisiana, dando origen por poliploidía e hibridación a los “plátanos” y “bananos” cultivados (Sierra, L. 1993). Musa acuminata es una planta de porte bajo, con pseudotallos delgados y un sistema foliar reducido. Presentan una coloración parduzca que se convierte en manchas heterogéneas claramente definidas en las láminas de las hojas y una coloración vino uniforme en las vainas internas del pseudotallo. Los racimos crecen horizontalmente, son pequeños con dedos muy delgados que producen semillas. Cuadro 1.
Lavado y desinfección: Los tallos recolectados fueron lavados minuciosamente.
Extracción de la savia Musa acuminata:
La savia de Musa acuminata fue extraída mecánicamente del material vegetal exprimiendo y dejando caer las gotas de savia, posteriormente, ésta se filtró utilizando algodón y el filtrado se guardó en frascos de color ámbar, de inmediato se llevó al laboratorio.
Preparación del Extracto Etanólico de la savia de Musa acuminata:
Después de obtener la savia del plátano se procedió a llevar la savia a baño maría durante 40 minutos para evaporar el agua que contiene la savia. Posteriormente se colocó 150mL de alcohol de70°. Se prepararon dos extractos alcohólicos por maceración durante 8 días a 37°C en estufa; luego se filtró varias veces con papel filtro whatman número 40 y se obtuvo la solución etanólica de la M. acuminata. Después fue sometido a un rotavapor a 40°C hasta obtener un extracto seco. A partir de ese extracto se procedió a hacer las diluciones correspondientes, para obtener los extractos al 50% y 100%.
Preparación de los extractos:
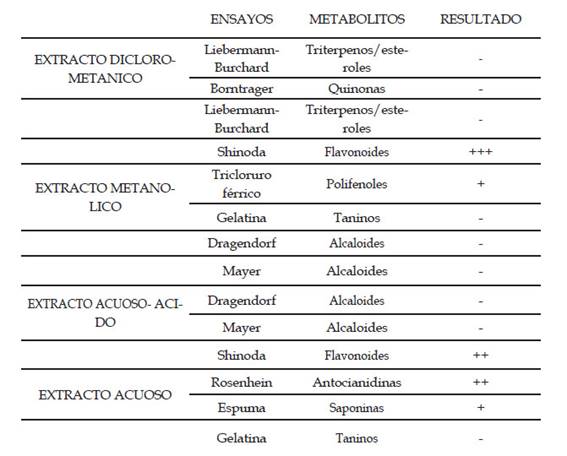
Para la preparación de los 4 tipos de extractos (diclorometánico, metanólico, acuoso ácido y acuoso) se tomaron 20 ml de la savia y se colocaron respectivamente en 12 cápsulas de porcelana, para posteriormente llevarlos a extracto blando con ayuda de una estufa. Se disolvió el extracto blando en 20 ml. de cada solvente utilizando tres cápsulas para cada uno respectivamente. Los extractos se filtraron y guardaron en frascos ámbar para su posterior utilización.
De la Determinación de la Concentración Mínima Inhibitoria (CMI):
Se determinó la CMI mediante la técnica de microdilución en tubos, los cuales se dividieron en 4 grupos: el extracto etanólico de M. acuminata al 50%, 100%, un control positivo con clorhexidina al 0,12% y un control negativo sin extracto. En cada tubo había 0,7mL de cada concentración a los cuales se agregó 0,3mL de la cepa E. Faecalis ATCC 29212, posteriormente se incubaron en microanaerobiosis por 24 horas en jarra Gaspak a 37° C. Luego de 24 horas de incubación se determinó las UFC, para lo cual se sembró 0,1 mL de las soluciones de cada uno de los tubos procesados en placas de Petri con agar Muller Hilton, distribuyéndola en toda la superficie de la placa con ayuda de una asa de Driglasky, dichas placas fueron colocadas en jarra Gaspak y llevados a una estufa por 24 hrs. A 37° C en condiciones de microanaerobiosis, todo el procedimiento se llevó a cabo dentro del diámetro de 10 cm de la llama de un mechero. Finalmente, se procedió a la observación del crecimiento bacteriano mediante el conteo de las Unidades Formadoras de Colonias. Considerando Inhibición: < de 30 UFC, no inhibición > de 30 UFC.
De la determinación de la susceptibilidad antibacteriana:
Se determinó mediante el método de Kirby Bauer a través de la difusión de discos antibacterianos. Se prepararon discos de papel filtro estériles, los cuales se sumergieron dentro de las concentraciones experimentales y la solución control. Se prepararon las placas Petri con medio Agar Muller Hilton, sobre las cuales se sembró el E. Faecalis ATCC 29212, la siembra se realizó por la técnica en camada utilizando hisopos estériles embebidos en los cultivos de la respectiva bacteria; se procedió al sembrado en camada en placas de Petri conteniendo Agar Muller Hilton, se hisopeó uniformemente sobre toda la superficie del agar, girando cada placa 30 grados 10 veces aproximadamente. Previamente se prepararon discos de papel de filtro estériles de 6mm de diámetro, los cuales fueron sumergidos dentro de las concentraciones 50%, 100% del extracto etanólico de M. acuminata y clorhexidina al 0,12% por un periodo de una hora, luego con una aguja estéril estos se colocaron sobre los cultivos de E. Faecalis ATCC 29212 en las placas de Petri previamente preparadas; todo el procedimiento se llevó a cabo dentro del diámetro de 10 cm de la llama de un mechero; se realizaron 12 repeticiones para cada concentración experimental y grupos control, por un periodo de 10 minutos. Posteriormente, las placas se voltearon de posición y se incubaron en microanaerobiosis utilizando la jarra Gaspack, con el método de la vela, mediante el cual se obtiene un ambiente aproximadamente de 5 a 10% de CO2, a una temperatura de 37°C por 24 horas. La lectura se llevó a cabo a las 24 horas mediante la inspección visual de cada placa, tomando el registro en mm de los halos de inhibición del crecimiento de E. Faecalis.
Todo fue registrado en una ficha de recolección de datos donde se anoto: El conteo de las UFC y el Promedio de halos de inhibición expresada en milímetros (mm) empleando la Escala de Duraffourd siendo Nula (-): para un diámetro inferior a 8mm; Sensible (= +): para un diámetro comprometido entre 8 a 14mm; Muy sensible (= ++): para un diámetro entre 14 y 20 mm; Sumamente sensible (+++): para un diámetro superior a 20 mm.
Análisis estadístico
Se empleó el método estadístico de aná- lisis de varianza (ANOVA) de un diseño completamente aleatorizado utilizando la prueba F. Luego se usó una prueba de com- paraciones múltiples empleando la prueba de DUNCAN. Ambos con un nivel de sig- nificancia de 5% (p < 0,05)
Resultados
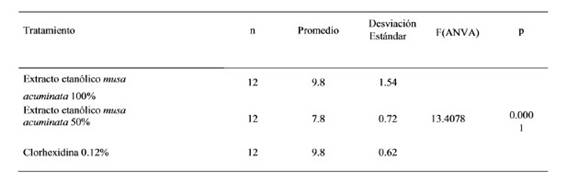
La evaluación de la susceptibilidad del E. Faecalis frente al extracto de Musa acuminata se presenta en la Tabla 1 y se encontró semejanza entre el extracto etanólico al 100 % (9,8 mm) con la clorhexidina al 0,12% (9,8 mm), siendo menor al 50% (7,8 mm), con una diferencia altamente significativa. En la tabla 2 se presenta la Prueba de comparación múltiple que fue altamente significativa para la susceptibilidad bacteriana.
Tabla 1 Promedio de los diámetros de los halos de inhibición del extracto etanólico de la Musa acuminata frente al Enterococcus Faecalis ATCC 29212 in vitro
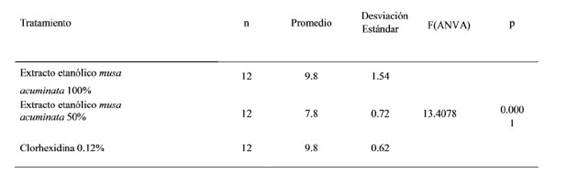
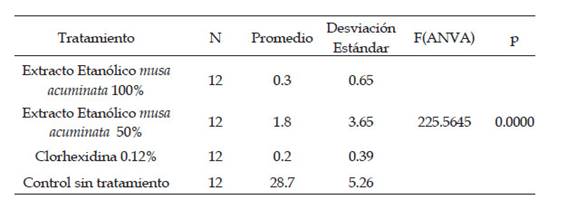
En la tabla 3 se presenta la CMI del extracto etanólico de la Musa acuminata frente al E. faecalis siendo semejante la concentración del 100% (0,3 UFC) con la clorhexidina al 0,12% (0,2 UFC). En la prueba de comparación múltiple para la CMI al 100%, 50% y clorhexidina al 0,12% hay diferencia significativa entre ellos tal como se presenta en la Tabla 4.
Discusión
En este estudio se determinó el efecto antibacteriano del extracto etanólico de la Musa acuminata frente al E. faecalis a través de la concentración mínima inhibitoria y la susceptibilidad antibacteriana. Los resultados encontrados concuerdan con Bonilla et al. (2020) donde demostraron el efecto antibacteriano de la M. acuminata al 30% frente al Staphylococcus aureus; pero, su estudio lo realizaron en Artemia salina así como lo hallado por Venkatesh et al. (2013), esto puede deberse a uno de los componentes químicos de la M. acuminata como los flavonoides presentes en los vegetales, estos actúan como estabilizadores de la membrana protegiendo de forma eficaz la estructura y función de las células; por lo tanto, impiden que las radiaciones ultravioletas y los radicales libres ataquen piel, mucosas y otros tejidos, además de ayudar a la recuperación de las zonas lesionadas (Burgos, 2015)before the damage induced by cyclophosphamide in meristem cells of Allium cepa (onion. De esta manera, podemos deducir que la M. acuminata no sólo participa en la destrucción de las células bacterianas, sino también participa sobre las células del huésped infectado ayudándolo a combatir la infección, proporcionando células de defensa. También, posee efecto inmuno modulador demostrado por (Ortiz, 2012), quien comprobó la propiedad bactericida de la savia de Musa acuminata - individualmente y asociada con kanamicina y etionamida. Por lo tanto, no sólo tiene efecto antibacteriano, sino también antiinflamatorio, entre otros.
Dentro de las limitaciones evidenciadas, una de ellas fue la fase de recolección de la savia del “plátano”, para que la hierba del “plátano” presente sus metabolitos secundarios como los flavonoides, es necesario un buen riego y el tipo de tierra donde sea cultivada. Si no presenta estas condiciones para su óptimo desarrollo, es probable que carezca de la presencia de estos metabolitos, así como en el momento de extraer la savia del tallo del plátano, no se logra obtener mucho zumo. Por todo ello, la medicina alternativa da un gran avance en la odontología, y al demostrar que el extracto etanólico de M. acuminata presenta efecto antibacteriano in vitro frente al E. faecalis ATCC 29212, constituye un avance importante de la investigación, en la búsqueda de nuevas alternativas terapéuticas para combatir al E. faecalis en tiempos donde la resistencia bacteriana va en aumento por el uso indiscriminado de los antibióticos. Sin embargo, cabe resaltar que dicha bacteria fue cultivada en un medio planctónico por lo tanto nos sirve de referencia para poder ejecutar estudios posteriores donde se utilice el extracto sobre biopelículas de E. faecalis.
Conclusiones
La M. acuminata presenta efecto antibacteriano in vitro frente al E. faecalis ATCC 29212, siendo la concentración mínima inhibitoria el 50% del extracto etanólico y la susceptibilidad fue al 100%. Así mismo, se recomienda realizar estudios con otras partes como las cascaras y frutos, y sobre biopelículas de E. faecalis.












 uBio
uBio