Introducción
Las lagunas de Mejía ubicadas en la provincia de Islay, departamento de Arequipa, al sur de las costas del Perú, vienen siendo protegidas por el gobierno peruano, desde 1982 en la categoría de Zona Reservada y desde el 24 febrero de 1984 como Santuario Nacional, dentro del Sistema Nacional de Áreas Protegidas por el Estado, SINANPE, lo que le confiere al área el carácter de intangible (SERNANP, 2020). Desde 1992 cuenta con el reconocimiento internacional como Sitio Ramsar (Ramsar, 2021) y junto con el río Tambo, constituyen un área importante para aves por Birdlife Internacional (Franke et al., 2005), A nivel regional el interés por su conservación se menciona en la Estrategia Regional para la Conservación y utilización Sostenible de la Diversidad Biológica y la Política Regional del Ambiente de Arequipa (Alcantara et al., 2013).
En estas lagunas y en base a numerosos estudios de Hughes (1968), Hughes (1970). Hughes (1976), Hughes (1979), Pulido (1982), Myers (1983), IUCN (1983), Rios et al. (1984), Hughes (1984), Pulido (1987), Morrison, et al. (1989), Blokpoel et al. (1989), Pulido & Dourojeanni (1990), Hughes (1991), Pulido et al. (1996), González & Málaga. (1997), Franke et al. (2005), Vizcarra (2008), Hogsas et al. (2010), Málaga (2011), Carmona et al. (2013), O’Hagan & Williams (2019), entre otros, se ha identificado numerosas especies de aves residentes y migratorias, provenientes de diferentes latitudes. Estas lagunas presentan hábitats de gran importancia en casi 2,000 km de costa que tienen condiciones ambientales óptimas para el normal desarrollo de las poblaciones de aves residentes y migratorias (Pulido et al. 2020). Esto se evidencia con la presencia de más de 212 especies de aves entre residentes y migratorias que llegan a Mejía de otras áreas del Perú, desde Sur América, Norte América y la región Austral. El Perú posee el mayor número de especies de aves en el mundo, con aproximadamente 1,874 especies (Plenge, 2020); de este local 134 son migratorias, de las que un 35% ocurren en Mejía.
La conservación de estas especies está directamente relacionada con los esfuerzos que se hace para resguardar el área protegida y garantizar el mantenimiento de los niveles de agua (SERNANP, 2020) así como la conservación de la flora que constituye parte fundamental de los diferentes hábitats que garantizan la preservación de la diversidad biológica en la ecorregión del Desierto del Pacífico (Brack & Mendiola, 2000; Britto, 2017; Chicalla-Ríos 2021).
El objetivo del presente estudio es analizar el estado actual de la conservación de los hábitats del Santuario Nacional de las Lagunas de Mejía y los cambios que han sufrido entre el 1970 y el 2021, tanto por factores físicos como antropogénicos, así como el seguimiento al mantenimiento de las condiciones naturales debido a las medidas de conservación adoptadas por el Estado.
Material y métodos
Área de estudio
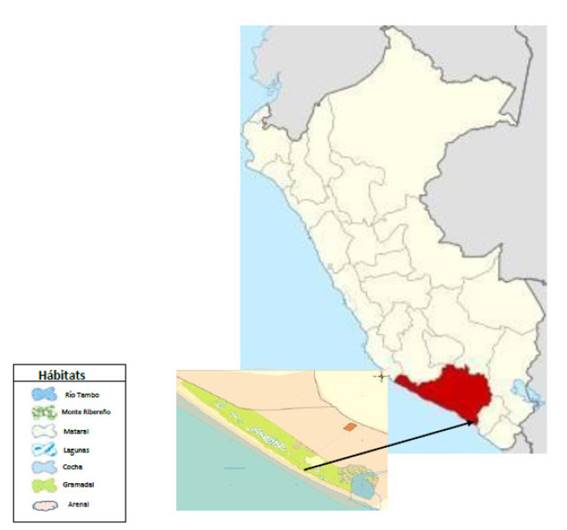
En el departamento de Arequipa, provincia de Islay, entre los distritos de Mejía y Dean Valdivia, se encuentran situadas las lagunas de Mejía, uno de los ambientes acuáticos ornitológicamente más ricos de las costas del Pacifico Sur, donde en 1984, se estableció el Santuario Nacional de las Lagunas de Mejía, sobre una extensión de 690.6 ha. Geográficamente está comprendido entre los 17° 07” LS - 17° 07’ 03” LS - 71° 49’ 49” W - 71° 53’ 19” W.
Los límites del Santuario son: por el norte el Balneario de Mejía; por el este, la carretera afirmada Mejía, La Curva - Bombón y terrenos de cultivo; por el sur, las áreas de cultivo de Bombón y por el oeste, la línea de playa del océano pacifico (SERNANP, 2020).
El Santuario se encuentra dentro del área de influencia de la cuenca del río Tambo y forma parte del sistema hidrográfico de la vertiente del Pacífico. Debido a la extensión y la relativa amplitud de la cuenca húmeda, existen excedentes hídricos que se pierden en el Océano Pacifico principalmente en el periodo de lluvias, pero también existen déficit durante el período de estiaje (ANA, 2019). El Santuario está ubicado en una zona de transición entre la biocenosis de las playas arenosas influenciada por la corriente peruana, las lagunas costeras y el monte ribereño de la eco-región del desierto costero (Pulido, 1982). Según ONERN (1974) el área de estudio corresponde a la zona de vida Desierto Superárido -Templado cálido, en el Sistema de Holdridge (1978). Pulgar Vidal (1996) la incluye en la región de Chala o Costa; Brack & Mendiola (2000) y Britto (2017) la clasifican en la ecorregión de Desierto del Pacífico.
La temperatura media anual es de 19.8°C siendo el promedio mensual máximo de 23.9°C y el mínimo de 15.7°C. La humedad relativa en la franja cercana al litoral es de más de 76%. Se registra un promedio de 5.8 horas de sol y día y una radiación solar promedio de 398 cal. Gr/ cm²/día (SERNANP, 2020).
Análisis de la reducción del área
El trabajo de toma de datos de campo y la preparación de los mapas del área fue elaborada tomando como base el Mapa Político del Perú a escala 1/1’000,000, Cartas Nacionales de Mollendo, Mejía y Punta de Bombón a escala 1/100,000. El mapa de fotointerpretación fue elaborado en base de fotografías aéreas a escala 1/17,000, procedentes del Servicio Aerofotográfico Nacional de la Fuerza Aérea Peruana; se efectúo la delimitación de las zonas más características del Santuario, de acuerdo a la presencia de vegetación típica, sobre un área total fotointerpretada de 690.6 ha (Fig 1).
Evaluación de flora y fauna silvestre
La flora silvestre predominante es halofítica, herbácea y de porte pequeño. Conforman comunidades que pueden ser graminales o totorales, así como también asociaciones de tipo gramíneas - Salicornia, graneas - Scirpus y gramíneas - Typha. La vegetación arbórea y arbustiva se encuentra únicamente en la formación monte ribereño. Se ha identificado 63 especies de plantas; 45 especies terrestres que corresponden a 23 familias y 18 especies acuáticas “algas”. La colecta, preservación e identificación de especies de plantas terrestres estuvo a cargo del Dr. Asunción Cano, Profesor y Conservador de Plantas del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. Los recorridos por las lagunas se efectuaron entre las 07.00 y 10.00 horas, teniendo en cuenta que observaciones efectuadas durante los años últimos pasados, indican que en este tipo de ambiente no existen variaciones significativas de las poblaciones de aves durante esas horas. Para las observaciones de aves se utilizaron binoculares (7 x 35) y la Guía de campo de Schulenberg et al. (2010) “Aves de Perú”, y para la clasificación taxonómica se siguió a Plenge (2021), en “List of the birds of Peru”. Esta información fue complementada mediante registros históricos, para lo cual se recurrió a las fuentes de información bibliográfica; respecto a la variación estacional de las especies, evidencias de aves en proceso reproductivo y en proceso de migración. Así mismo, a nivel cualitativo se registraron las especies que habitan en los terrenos de cultivo adyacentes al Santuario, así como también en la formación de monte ribereño a ambas orillas de la desembocadura del rio Tambo.
Resultados y discusión
Origen de las Lagunas
Se conocen dos hipótesis para determinar el origen de las lagunas. La primera del Proyecto REHATIC (1983) que sostiene que las lagunas son artificiales y empezaron a formarse en 1940 por efecto de las escorrentías y de las filtraciones de agua provenientes de las irrigaciones de adyacentes. Si esto fuera verdad (Myers, 1983) no disminuiría en ningún modo la importancia del área para aves migratorias. La segunda hipótesis es que las lagunas sean de origen natural y que existieron antes de que empezaran las irrigaciones. Las lagunas se habrían formado por efecto de la creciente estacional de las aguas del rio Tambo (Myers, 1983).
No obstante, Ríos et al. (1984) sostienen que, durante los meses de mayor descarga, parte del agua que trae Tambo inunda las Pampas de Iberia alimentando las lagunas ya existentes. Argumentan también que las lagunas reciben agua de la napa freática de la cuenca, de tal manera que no puede afirmarse categóricamente que las lagunas tienen un origen exclusivamente artificial. Las evidencias geográficas sugieren que las lagunas de Mejía, probablemente, se vieron influenciadas por corrientes de aguas subterráneas y escorrentías superficiales que influyeron en el flujo del nivel de agua.
Desde 1975, el proyecto de Rehabilitación de Tierras Costera (REHATIC) del Ministerio de Agricultura, ha efectuado acciones de drenaje en áreas adyacentes a las lagunas, sobre una extensión aproximada de 2,000 ha, con el fin de integrarlas al desarrollo agrícola y ganadero. Más de 1,000 ha fueron recuperadas para la agricultura durante los años de 1980 a 1990, lo que, ha afectado a las poblaciones de aves acuáticas, tanto migratorias como residentes (Anatidae, Podicipedidae, Rallidae, Ardeidae, Charadriidae) disminuyendo su hábitat.
El avance de la alternativa de desarrollo escogida afectó seriamente la conservación de este importante ambiente acuático. Las obras de drenaje, iniciadas por el Proyecto REHATIC en 1975, con el fin de integrar estas áreas al desarrollo agrícola y ganadero, se ha hecho a pesar de que los suelos de la zona no presentan vocación ganadera, ni agrícola (ONERN, 1974). Las obras efectuadas han provocado el desecamiento de aproximadamente 1,000 ha de totorales y gramadales, hábitat preferido de numerosas aves de ambientes acuáticos (Rallidae, Anatidae, Ardeidae). Otros factores como el pastoreo extensivo de ganado vacuno, caprino y ovino han degradado aceleradamente los suelos. La caza furtiva de especies de importancia cinegética, la extracción de totora que es un área de anidación de aves acuáticas (Anatidae, Rallidae), la tala de especies de monte ribereño (Baccharis sp., Tessaria sp.), área de anidación de paserinos granívoros e insectívoros, han incidido negativamente sobre los niveles de las poblaciones de aves. Así también, muchas especies de aves que cumplen una importante función en los sistemas antrópicos, controlando las plagas de insectos, se han visto afectadas por efecto de la contaminación de residuos de insecticidas (órgano - clorados).
Historia de la conservación de las lagunas
El primer ornitólogo que ha estudiado las lagunas de Mejía y sobre todo las poblaciones de aves es el destacado naturalista Robin Hughes, quien desde 1950 y hasta 1991 residió en Mollendo. Sus artículos científicos, conocidos internacionalmente, han permitido que ornitólogos peruanos y extranjeros; se interesen por estudiar este importante ecosistema costero como lugar de excepcional concentración de aves residentes y de descanso temporal para aves migratorias en la costa sur del Perú.
En diciembre de 1979, los pobladores del balneario de Mejía, conjuntamente con PRODENA AREQUIPA, liderado por el conservacionista Mauricio de Romaña, enviaron un memorial al Ministro de Agricultura, solicitándole se declare como Santuario Nacional a las lagunas de Mejía. En febrero de 1980, la Dirección General Forestal y de Fauna envió un equipo de biólogos a las lagunas de Mejía, para que evalúen la zona. En julio del mismo año otro equipo de biólogos fue a Mejía para completar la toma de datos de campo. Luego de evaluar los informes y preparar la información cartográfica correspondiente, en enero de 1982, el Ministerio de Agricultura estableció la Zona Reservada de las Lagunas de Mejía, mediante Resolución Ministerial N° 00061-82-AG- DGFF. En setiembre de 1982 y marzo de 1983 el Instituto Nacional Forestal y de Fauna a través de la Dirección de Flora y Fauna Silvestre, inicia el estudio de las aves de ambientes acuáticos en las lagunas de Mejía colaborando con la Academia de Ciencias de Filadelfia en el Proyecto sobre anillamiento de Aves Migratorias de Orilla Marina (Myers, 1983; Pulido & Dourojeanni, 1990).
Estos estudios contribuyeron a conocer más ampliamente algunos aspectos sobre la distribución y la migración de las aves de orilla arenosa marina y de las lagunas. Así mismo, reafirmó la necesidad de adoptar medidas más severas para la conservación de estos ambientes. En 1983 la Comisión de Ecología de la Unión Internacional para la Conservación de la Naturaleza y sus Recursos (UICN), visita las lagunas de Mejía, redactando un informe en el que recomienda se preserve y restaure el área, la cual debe mantener muestras de lagunas, de orilla arenosa marina y una zona de amortiguamiento entre las lagunas y las áreas de drenaje efectuadas por el Plan REHATIC.
Sobre la base de los estudios y recomendaciones efectuadas en febrero de 1984, por el Instituto Nacional Forestal (INFOR), la Academia de Ciencias de Filadelfia - EE. UU y la Comisión de Ecología de la UICN, la Dirección General Forestal y de Fauna, eleva el informe final al Ministerio de Agricultura, proponiendo se declare el área en mención, como Santuario Nacional de las Lagunas de Mejía, sobre una extensión de 690.6 ha, incluyéndola dentro del Sistema Nacional de Áreas Protegidas del Perú (Decreto Supremo N° 015-84-AG del 09 de marzo de 1984).
En tanto, en marzo y abril de 1984, la consultora ILACO (1984) efectúo un estudio ecológico e hidrológico de las lagunas, sugiriendo que los recursos de agua necesarios para el mantenimiento de las lagunas provendrían de tres fuentes: a) Río Tambo y Océano Pacifico, b) Aguas provenientes de las irrigaciones (excesos), c) Drenaje de las aguas (canales). El mismo estudio indica que durante enero, febrero y marzo, el mismo río Tambo puede proveer de agua a las lagunas.
Finalmente, en 1984, con el apoyo de World Wildlife Fund, se elaboró el Plan Maestro del Santuario Nacional de las Lagunas de Mejía, el cual presentó los primeros lineamientos técnicos y de política para la protección y manejo del área (Ríos et al, 1984). Desde entonces la administración nacional de áreas protegidas ha tenido a su cargo el manejo y es responsable de la conservación de la diversidad biológica que alberga el Santuario Nacional de las Lagunas de Mejía.
Descripción de los hábitats de Santuario:
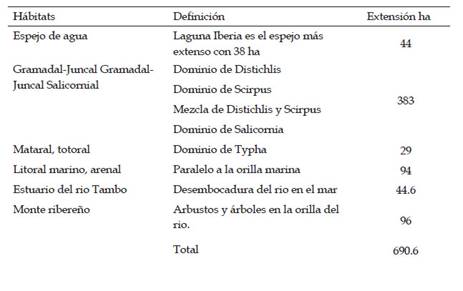
El Santuario Nacional de las lagunas de Mejía abarca una extensión de 690.6 ha (Tabla 1) y está conformado por seis hábitats, que son de importancia para la conservación del total de especies de aves migratorias y residentes que llegan temporal o definitivamente a vivir en este ecosistema típico del desierto costero.
Arenal: También denominada litoral marino, está constituida por una larga franja de suelo arenoso de 100 a 200 metros de ancho paralelas a las lagunas y a las playas marinas, alcanzando una extensión de 7.78 Km. de longitud y aproximadamente 98 ha de extensión. La arena de playa es una faja longitudinal plana, que presenta pequeñas dunas, paralela a la línea de playa en el límite oeste del Santuario; por el sector este, llega a tener contacto con la comunidad de gramadales y las lagunas. Se agrega, además, 0.71 ha de dunas, situada frente al límite este de la laguna en proceso de desecación. El sector adyacente a la desembocadura del río Tambo se caracteriza por una fuerte acumulación de residuos sólidos por las mareas, restos de vegetación varada por el mar de procedencia marina y terrestre las cuales son usadas como fuente de energía por la población local. Carece de vegetación y es frecuentado como lugar de descanso y alimentación por aves de orilla marina, especialmente migratorias. Entre ellas tenemos al gallinazo cabeza roja, Cathartes aura jota, especies de las familias Scolopacidae, Charadriidae, Laridae, Rynchopidae, siendo los más característicos Haematopus palliatus, Charadrius vociferus, Charadrius nivosus, Arenaría interpres.
Gramadales, pastizal, juncal. Está conformada por comunidades vegetales de gramadales, juncales y pastizales que abarca un área de 383 ha y son lAs siguientes:
Gramadal. Esta formación es dominada por la grama salada Distichlis spicata y ocupa una extensión de 19.47 ha; se encuentra extendida por todo el Santuario, asociada con especies de la familia Graminae, con otras especies vegetales como Salicornia fruticosa, Scirpus americanus y Paspalum vaginatum o en asociaciones gramadal - Salicornia, gramadal - Scirpus, gramadal - Typha, así como conformando el sotobosque en el monte ribereño con otras especies de herbáceas. Los gramadales se encuentra generalmente bordeando el complejo de humedales: entre la zona de playas, los juncales y totorales que bordean los cuerpos de agua de las lagunas. Hacia la zona agrícola se encuentra comunidades de grama Paspalum vaginatum, asociado con el junco en bordes no definidos; con Salicornia fruticosa, Scirpus americanus, o distribuidas bajo la denominación de terrenos sin cultivo, superficie húmeda y superficie semihúmeda. En general el relieve es plano y conformado en su mayor parte por Distichlis spicata. Se encuentra muy influenciada por los cambios en el nivel del agua de las lagunas y es la formación vegetal predominante en el Santuario. Se han identificado siete especies de gramíneas, donde destaca por su abundancia Distichlis spicata. Casi todas las especies de aves sean residentes o migratorias, utilizan este hábitat, permanentemente las primeras y temporalmente las segundas. En esta zona anida Burhinus superciliaris “huerequeque”. Es muy frecuentada por Bubulcus ibis, Egretta alba, Egretta caerulea, Nycticorax nycticorax y Paserinos como Anthus peruvianus, Sicalis luteola, Pyrocephalus rubinus, Hirundo rustica, Leistes bellicosus, Zonotrichia capensis.
Juncales. Está dominado por el “junco o tuto” Scirpus americanus, una planta que puede llegar a medir hasta 2 m en lugares muy húmedos y tan solo 30 cm en lugares muy secos. Esta especie suele crecer sola o asociada con la “grama salada” Distichlis spicata y la “grama dulce” Paspalum vaginatum. Es menos frecuente encontrarla asociada a Portulaca oleracea, Sesuvium portulocastrum y Heliotropium curassavicum. Los juncales se distribuyen en suelos inundados cercanos a las lagunas central y sur, en forma de parches en la zona norte, bordeando el totoral y algunos sectores cercanos al monte ribereño y en zonas que permanecen inundadas la mayor parte del tiempo. Estas asociaciones son sitios de anidación y de refugio para las aves residentes como garzas, pollas de agua, patos y gallinetas. Se han observado a Anas bahamnesis y Anas geórgica, refugiarse en estas zonas, conjuntamente con sus polluelos, Egretta thula y Scolopacidae de tamaño mediano como Tringa flavipes y Tringa melanoleuca.
Gramadal con Scirpus. Comprende una franja sinuosa de superficie húmeda, ubicada en la zona central del límite este del Santuario. Estas asociaciones vegetales han sido agrupadas, siendo muy pocos los lugares donde sus límites están bien definidos. Esta frecuentemente inundada debido al cambio en los niveles de agua de las lagunas. Conformada mayormente por gramadales y Scirpus americanus, áreas barrosas y superficiales blanquecinas de naturaleza salitrosa. La vegetación es siempre verde y de porte pequeño. Se encuentra durante todo el año a Sicalis luteola y Anthus peruvianus especies que anidan en esta formación vegetal. Es también frecuente en épocas de migración, volar sobre esta área a numerosos individuos de Hirundo rustica y Pygochelidon cyanoleuca.
Gramadal con riachuelo: Áreas planas, con cobertura vegetal de porte pequeño y con escasas áreas de espejo de agua, proporcionan un contraste adecuado en relación con las áreas muestrales anteriores lo que permite determinar preferencias de habitas diferentes, principalmente, de aves acuáticas migratorias que llegan al Santuario. Es el hábitat preferido de Charadrius vociferus, Charadrius nivosus, Tringa flavipes, Tringa melanoleuca, Anthus peruvianus, Zonotrichia capensis, Leistes bellicosus, Muscisaxicola maclovianus, Pyrocephalus rubinus.
Salicornia: comprende una superficie semihúmeda de suelos salinos, en la parte central del límite este del Santuario, donde la especie predominante es Salicornia fruticosa una planta suculenta, halofítica muy característica en ambientes salinos en la costa peruana. Abarca un área inundada, ocasionalmente, por exceso de escorrentías superficiales. Presente en amplias zonas salitrosas con manchas blanquecinas de forma irregular. Ocupa un área de 57.51 ha. La distribución de la flora es heterogénea y a manera de pequeños montículos de porte pequeño. La vegetación predominante está compuesta por la asociación entre la “verdolaguilla” Salicornia fruticosa y la “grama salada” Distichlis spicata; en algunos lugares más húmedos con otras especies como el “junco” Scirpus americanus y la “grama dulce” Paspalum vaginatum. Ocupa un área de 6.00 ha, en el borde este de la laguna grande. En esta zona es muy frecuente observar especies de garzas Bubulcus ibis, Nycticorax nycticorax así como por Sicalis luteola, Leistes bellicosus.
Matarales o totorales. Conformada por la especie dominante la “matara o totora” Typha angustifolia, una herbácea erguida que enraíza en suelos inundados, de vegetación densa y siempre verde, ubicada en la parte sur y también en otros parches más pequeños distribuidos en diferentes lugares y en los drenes del Santuario. Abarca una extensión de 28 ha. Los totorales se encuentran permanentemente inundados, lucen densos y compactos, y alcanzan fácilmente 3 metros de altura, por lo cual no dejan espacio libre para el crecimiento de otras especies; llegando a cubrir drenes o espacios lagunares con bastante velocidad. Está asociada en los bordes por gramadales y por juncales de Scirpus americanus de porte mediano. La presencia de cobertura vegetal densa y de mayor tamaño ofrece protección y refugio para las aves. Estas características la convierten en áreas de anidación y nidificación de aves, o de protección, ante las inclemencias ambientales y eventualmente ante la caza furtiva. En el extremo sur se encuentra situada junto a dos áreas pequeñas de chilco Baccharis salicifolia de 1.33 ha y de carrizo de 0.77 ha, lo que le confiere importancia como lugar de refugio de aves coloniales y anidación de anátidos, rállidos, láridos, entre otros. Muchas aves como: Pardirallus sanguinolentus, Fulica rufifrons, Nycticorax nycticorax, Ardea alba, Egretta thula, Anas georgica, Chroicocephalus cirrocephalus, pueden observarse aquí con relativa facilidad.
Espejo de agua de las lagunas: Las lagunas se encuentran ubicadas en posición paralela al mar y su mantenimiento se debe a las escorrentías superficiales y el aporte de la napa freática. Están constituidas por tres complejos de lagunas con 44 ha: la laguna Mejía, que tiene 4 ha, de espejo de agua y rodeada de zonas barrosas debido a que son directamente afectadas por el sistema de drenajes; la laguna Iberia con 38 ha, es el principal cuerpo de agua, que ha sido intersecada por la invasión de junco con la formación de tres espejos de agua; y la laguna Boquerón, de 2 hectáreas, un complejo de pequeñas lagunas que tienen influencia directa del río Tambo. Las lagunas se caracterizan por la significativa variación en los niveles de agua tanto por acción de las escorrentías superficiales, como por la elevación de la napa freática, Es importante señalar que, en 1970, la laguna central era una sola, con vasos comunicantes que facilitaban el discurrir de las aguas, en épocas en que el nivel de las mismas aumentaba ya sea por filtraciones o por exceso en la venida de escorrentías superficiales. En las lagunas se encuentra la mayor cantidad de especies de aves tanto residentes como migratorias como es el caso de Rollandia rolland, Anas bahamensis, Spatula cyanoptera, Gallinula galeata, Fulica americana, Ardea alba, Egretta caerulea, Egretta thula, Phalaropus tricolor, Phalaropus lobatus. Hughes, (1979) y Myers (1983b) indican que las migratorias neárticas visitan todos los habitas de la región, pero una diversa cantidad de ellas llegan a las áreas barrosa de las lagunas costeras, donde no encuentran competencia de las especies residentes a excepción de Charadrius vociferus. Los bordes están conformados por gramadales, totorales de Scirpus sp. y herbáceas de porte muy pequeño. La cobertura vegetal de Scirpus sp. de porte mediano proporciona una relativa protección o refugio o determinadas aves acuáticas. Incluye además pequeñas áreas adyacentes de gramadales, totorales y zonas barrosas. Se pueden encontrar asociaciones de Ruppia sp. cerca de las orillas y algas flotantes de Chara sp. en las partes centrales de las lagunas; así como se ha detectado la presencia de tilapia (Oreochromis sp.) al interior de la laguna iberia, no obstante, no existen estudios acerca de su impacto sobre la biodiversidad en las lagunas. Adicionalmente se encuentran las costras delgadas de carbonato (caliche), que es una faja longitudinal, sinuosa y plana situada sobre la orilla este de la laguna. Presenta una apariencia blanquecina terrosa cuya superficie es bastante dura. Carece de vegetación y se encuentra eventualmente influenciada por el cambio en el nivel de las aguas de la laguna. Ocupa un área de 28.70 ha. El barrizal seco carece de vegetación y ocasionalmente es utilizada por Charadrius nivosus, Charadrius vociferus, Arenaria interpres, Actitis macularía, Pluvialis squatarola, Calidris alba y Calidris pusilla. El barrizal inundado es frecuentado por especies de Charadriidae y Scolopacidae, como Charadrius nivosus, Calidris alba y Calidris minutilla. Actualmente las imágenes satelitales disponibles en línea permiten estimar un área de 31.9 ha de espejo de agua en la laguna Iberia
Desembocadura del Rio Tambo. El río Tambo tiene una longitud de 276 km y su desembocadura se encuentra en el límite sur del Santuario. El estuario tiene un área protegida en el Santuario de 44.6. Presenta un régimen hídrico semejante al de los ríos costeros de la cuenca del Océano Pacífico: abundancia en el periodo normal de lluvias de diciembre - marzo y un estiaje marcado con déficit, durante el período agosto - diciembre. En su parte longitudinal distal discurre el rio Tambo con un área de 16.35 ha, que constituye fundamentalmente la desembocadura, cuyo cauce final es sujeto de algunas modificaciones ya sea por acción de la sobrecarga de agua dulce proveniente en época de lluvia (diciembre y marzo), de los Andes Peruanos, así como por el oleaje marino. La calidad de sus aguas no es buena para todos los cultivos, y en el periodo crítico o de déficit, esta calidad empeora, trayendo como consecuencia la salinización y/o degradación de los suelos. Es también importante hábitat del camarón de río, Cryphiops caementarius muy apreciado en el mercado regional; así como de peces que usan estos espacios para reproducción. El río Tambo forma una desembocadura variable, generalmente, a unos 2 Km. aguas arriba de la desembocadura se ensancha hasta alcanzar unos 200 m. En este lugar la pendiente es mínima y el flujo de agua es muy lento. En sus márgenes se pueden encontrar áreas con influencia de sus crecientes, con la presencia de grava, limos y arenas. Adicionalmente, se pueden encontrar ciertas especies herbáceas de porte pequeño y totora, aunque por lo general la vegetación es escasa e inclusive inexistente en su tramo final. El cono de deyección en la desembocadura del río Tambo, está conformado por grava, cantos rodados, arena y limos. La presencia de gramadales y herbáceas de porte pequeño, constituyen la vegetación característica de la zona; la superficie es ligeramente accidentada presentando algunas suaves ondulaciones. Muy influenciada por el cambio en el nivel de las aguas del río Tambo, así como por los excesos de agua provenientes de las escorrentías superficiales de los terrenos de cultivo aledaños ubicados en el límite sur - este del Santuario. Las arenas del río constituyen una pequeña faja longitudinal plana en el límite sur - oeste del Santuario, paralela a la línea de playa que parte en la margen izquierda del río Tambo. Esta zona varía, generalmente, de acuerdo a la orientación final que adopta la desembocadura del río. Presenta pequeñas dunas y carece de vegetación. El rio por esta razón tiene islas de diferentes tamaños que sirve como lugar de concentración de garzas, gaviotas y gaviotines. En época de migración se han podido estimar entre 10,000 y 15,000 ejemplares de gaviotines, en estas islas.
Monte ribereño: Se encuentra ubicado en la parte sur del Santuario. Es una de las formaciones vegetales más conspicuas ubicada a ambas márgenes del rio Tambo. Situado en la parte sur del Santuario a ambos márgenes del rio Tambo, en una franja de 40 a 100 m de ancho. En la margen derecha del río su ancho varía de 5 a 100m. Influenciada grandemente por la variación en los niveles de agua del rio, así como por las actividades agrícolas, en áreas vecinas. Ocupa una extensión de 96 ha. En la parte media longitudinal discurre el rio Tambo, cuyos niveles de agua varía anualmente durante dos períodos bien definidos, aumentando entre diciembre y abril que es la época lluviosa en la zona altoandina y disminuyendo entre mayo y noviembre, que es la época seca en los Andes. Es una zona muy dinámica por la acción del río, por lo cual su tamaño es variable. Es la zona con mayor diversidad de especies vegetales. Se caracteriza por su diversidad de especies arbóreas, arbustivas y herbáceas; entre las plantas predominantes se tiene a: Bachharis salicifolia, Tessaria integrifolia, Equisetum bogotense, y Salix humboldtiana. Es el hábitat preferido de aves granívoras e insectívoras como palomas, pericos, chotacabras y paserinos. La parte correspondiente al Santuario se encuentra degradada por la acción del hombre, debido a que el impacto de la agricultura es permanente a las comunidades protegidas en el Santuario. Es una zona afectada por la extracción de leña y ampliación de la frontera agrícola lo que ha llevado a la pérdida de diversidad vegetal y a la disminución de la protección o defensa ribereña. Extensión de monte ribereño en el SNLM en 2020
Alrededor del Santuario:
Terrenos sin cultivo. Se denomina a la zona de relieve plano ubicada en la parte media del límite este y sur del Santuario. Todo el límite este está conformado por la carretera de Mollendo a la Curva. Esta área ocupa una extensión de 78.70 ha, en donde se desarrollan actividades agrícolas de cultivos permanentes de alfalfares. Conformada por vegetación rala en donde se puede observar gramadales y algunas herbáceas talofíticas, bordeada de totorales de Typha angustifolia, así como de Baccharis salicifolia, Tessaria integrifolia y Salix humboldtiana. Ocasionalmente influenciada por los excesos de agua provenientes de las escorrentías superficiales de los terrenos agrícolas de la irrigación adyacente. Los canales de regadío son de trazo rudimentario, no habiéndose observado, la construcción de canales de concreto u otra infraestructura de riego. También se ha determinada áreas muy influenciadas por actividades de pastoreo, principalmente de ganado vacuno y caprino, que han compactado el suelo. Ocupa una extensión de 22.89 ha.
Terrenos cultivados. Existen terrenos bajo cultivo dentro del área protegida, estos han sido reclamados por propietarios adyacentes, son invasiones del ANP o han sido adjudicados o establecidos por las autoridades agrarias. La mayor parte son arrozales o cultivos de “maíz”, “frejol” y “zapallo”.
Conservación de hábitats
La condición de Santuario Nacional en que se encuentran los diferentes tipos de hábitats que rodean a las lagunas, como los valores tangibles son muy importantes y su conservación es largamente justificada. Los valores científicos, educativos, estéticos, recreativos de reaprovechamiento de nutrientes, protección de especies residentes, migratorias y en peligro de extinción y el mantenimiento de reservas comunes de genes, son razones reales y valederas para su conservación (Pulido & Bermúdez, 2018).
Así también para el manejo del área, la variación en los niveles de agua de las lagunas, favorece la existencia temporal de una mayor variedad de hábitats, como zonas barrosas húmedas o secas, en donde confluyen especies de Charadriidae, Scolopacidae, Laridae, tanto migratorias como residentes (Bayly et al., 2018).
Otro aspecto importante está relacionado con la protección, gestión y restauración de la vegetación ribereña la cual debe ser una prioridad para el desarrollo e implementación de las estrategias de conservación en ambientes modificados por humanos, ya que constituyen áreas de refugio para especies endémicas, amenazadas y en vías de extinción (Gomes et al., 2017; Banville et al., 2017; Hidalgo & Ugarte, 2020).
Pero tan importante como todo lo expresado y en alguna medida conocido, es el desarrollo de una fuerte e inequívoca ética sobre la conservación de las lagunas y de los recursos vivos que alberga. En ese sentido, la estabilidad social y económica, son prerrequisitos de largo alcance para asegurar el establecimiento de una adecuada política enfocadas en el tratamiento de problemas ambientales y el uso de los recursos naturales (Urquiza et al., 2019).
Las aves y especialmente las migratorias reflejan la salud de los ecosistemas, la interconexión ente el deterioro ambiental de un área y sus efectos directos en otras situadas a miles de kilómetros (Boyle, 2017). Las aves constituyen una pequeña parte del ecosistema, pero es la parte acerca de la cual conocemos algo (Pulido et al., 2020). De lo que nosotros conozcamos en nuestros ambientes acuáticos tropicales y de las aves asociadas con éstos, entonces podremos especular que está pasando en otros ambientes ya sea alto andinos, antárticos, neárticos o de los galápagos, que son los lugares de donde proceden las aves que habitan temporalmente en las lagunas de Mejía.
Las lagunas sufren el impacto por efecto de los contaminantes provenientes del desarrollo agrícola en áreas vecinas al Santuario, principalmente por agroquímicos, residuos sólidos y arrastre de sedimentos, que ingresan por filtración, así como por las escorrentías superficiales cuando la disponibilidad hídrica es alta.
Una característica de los ecosistemas acuáticos y los naturales en general, es que una decisión errada, no nos depara mucho tiempo para enmendarnos. En ese sentido los científicos, conservacionistas. Universidades y Organismos no Gubernamentales dedicados a la conservación, deben constituirse en la conciencia crítica de los políticos e instituciones estatales ejecutoras de las decisiones finales, sobre el uso y manejo del recurso.
Conclusiones
En los últimos 70 años la extensión del Santuario Nacional Lagunas de Mejía se ha reducido desde aproximadamente 2000 ha, a 690.6, que comprende el área actual protegida. Actualmente se mantienen en buen estado los hábitats: espejo de agua de las lagunas, gramadal-juncal, mataral, arenal, desembocadura del río Tambo y monte ribereño. La conservación de la diversidad biológica depende fundamentalmente de las medidas de conservación que se han adoptado a través del Estado, así como la condición de Santuario Nacional como “Área Natural Protegida” brinda las garantías necesarias para la conservación de la diversidad biológica. En este estudio se evidencia que las presiones antropogénicas como la pérdida y el deterioro de hábitats por efecto del avance de la frontera agrícola está asociado al manejo inadecuado del recurso hídrico.












 uBio
uBio