Introducción
Los humedales costeros son ecosistemas muy importantes a nivel mundial por los servicios ecosistémicos que brindan; entre ellos, se encuentran el almacenamiento de agua, protección contra tormentas, mitigación de crecidas, estabilización de costas, control de la erosión, recarga de acuíferos, depuración de aguas y la estabilización de las condiciones climáticas (Secretaría de la Convención de Ramsar, 2013). Múltiples autores de diversas partes del mundo coinciden en que los humedales costeros son de gran importancia por albergar a una gran cantidad de organismos entre los que resaltan plantas, aves (migratorias y residentes), insectos, mamíferos y peces (Pineda, 2008; Heynes, 2014; Sonco, 2013; Medina-Rangel, 2011; Rosales, 2010; Rial, 2006; Vides, 2016; Pacheco et al., 2015). Lamentablemente, muchos humedales son vulnerables a las actividades antrópicas; desde 1 900 hasta el 2015 en todo el mundo han desaparecido aproximadamente un 64% de humedales debido a las actividades humanas (Convención de Ramsar sobre los Humedales, 2015). Como investigadores esto nos motiva a contribuir en su protección; una de las formas es estudiando su diversidad y recambio espacial de las especies vegetales. La diversidad se puede evaluar utilizando la riqueza de especies, patrones de diversidad (heterogeneidad y dominancia) dentro de una comunidad o área homogénea (Koleff et al., 2003; Sonco, 2013; Pineda, 2008) y la diversidad total dentro de un ecosistema compuesto por varias y distintas comunidades (Koleff et al., 2003; Sonco, 2013; Pineda, 2008). El recambio espacial evalúa el recambio de especies en un área determinada, así como la similitud que existe entre comunidades, dentro de una gradiente espacial (Anderson et al., 2011; Koleff et al., 2003; Moreno & Rodríguez, 2010; Vellend, 2001, los mismos que se encuentran en la revisión de Calderón-Patrón et al., 2012). Los estudios de la diversidad vegetal y recambio espacial nos permiten conocer la composición y características de las comunidades de plantas e inferir el impacto de los procesos antrópicos que allí ocurren, lo que permite a las entidades correspondientes tomar medidas adecuadas para su protección (Aponte & Ramírez, 2011).
En Perú, los humedales de la costa central se encuentran formando un corredor de diversidad biológica (Aponte & Cano, 2013) que permite tener un lugar de descanso a miles de aves migratorias (las cuales emplean la vegetación como refugio, sitio de anidamiento y zona de alimentación) y que alberga a más de 100 especies vegetales, así como a decenas de especies de mamíferos, arácnidos y reptiles (Aponte & Cano, 2013; Aponte & Ramírez, 2011; Arana & Salinas, 2003; Álvarez, 2007; Pacheco et al., 2015; Paredes et al., 2007; Paredes, 2010). Estos ecosistemas también son muy importantes en la costa peruana, debido a que brindan a la urbe diversos bienes y servicios ecosistémicos; por ejemplo, brindan forraje para su ganado, proveen de fibras para la producción de artesanías y brindan un espacio para actividades turísticas y recreativas (Aponte, 2017a).
En los humedales de la costa de Lima se han identificado de tres a cinco comunidades vegetales por humedal (generalmente juncales, vegetación acuática, gramadales y comunidades mixtas), las cuales presentan características distintivas en su estructura y composición; las actividades humanas que ocurren en estos ecosistemas (por ejemplo, la ganadería y agricultura en la riqueza y dominancia de las especies en las comunidades) suelen introducir nuevas especies o reducir el área de distribución de aquellas que ya subsisten en el humedal (Aponte & Ramírez, 2011); por esta razón, la información presentada en este estudio puede funcionar como indicadora de las perturbaciones humanas que allí ocurren.
El humedal de Carquín-Hualmay, es uno de los humedales que forma parte del corredor biológico costero de Lima; el conocimiento sobre su riqueza de especies vegetales lo ubica como el humedal con mayor riqueza de especies por unidad de área de toda esta región; este humedal se encuentra afectado en algunas zonas por contaminación por residuos sólidos, uso del suelo como zona de ganadería y el vertido de agua de uso doméstico (Aponte & Cano, 2018). Conocer los diferentes componentes de la diversidad de especies de plantas es importante ya que permite tener una base para que se realicen monitoreos constantes y evaluaciones del estado en el que se encuentra; facilitando a su vez desarrollar una apropiada gestión para su conservación. A la fecha, en el humedal Carquín-Hualmay no se han realizado evaluaciones de su diversidad vegetal a nivel cuantitativo (con índices y estimadores); por ello, el presente trabajo busca evaluar la diversidad vegetal y recambio espacial de dicho humedal. Esto nos permite tener una aproximación de la diversidad biológica que existe en este ecosistema y evaluar su dinámica; al ser la primera evaluación de este tipo en el humedal nos permite tener una aproximación complementaria a la de la riqueza y brindar a los tomadores de decisión nueva información para su gestión.
Materiales y métodos
Área de estudio
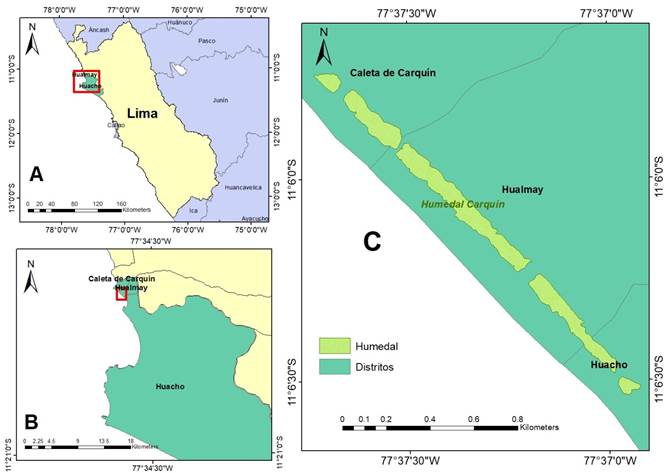
Se evaluó el humedal ubicado en los distritos de Carquín y Hualmay, los cuales pertenecen a la provincia de Huaura (Lima, Perú) al norte de Lima, en las coordenadas 11°06’06.62’’S - 77°36’50.01’’W (Figura 1); este humedal tiene 1 940 metros de largo y 60 metros de ancho promedio (la anchura que es variable a lo largo de la línea costera); se encuentra dividido por canales que abastecen con agua al humedal, los cuales se acumulan en algunos puntos donde las poblaciones aledañas aprovechan este recurso como zona de lavandería; además, posee una laguna de 200 metros de largo, junto con otros pequeños cuerpos de agua, los que varían a lo largo del año; en el humedal también se puede apreciar zonas de acopio de residuos sólidos; este ecosistema está compuesto por juncales, gramadales y comunidades mixtas (Aponte & Cano, 2018); entre estas comunidades vegetales, dispuestas a lo largo del humedal, las mismas se encuentran mezcladas y en extensiones cortas (por ejemplo: se pueden encontrar zonas donde la comunidad de Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller esta mezclada con Bacopa monnieri (L.) Wettst).
Métodos
Análisis de la vegetación
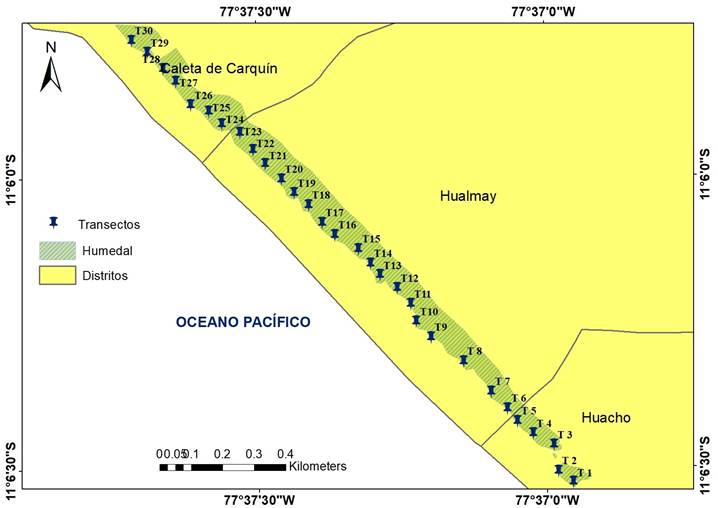
Se realizaron cuatro muestreos trimestrales, cada uno correspondiente a una estación del año (Dic 2018, Mar 2019, Jul 2019, Oct 2019, que corresponden a verano, otoño, invierno y primavera respectivamente). En cada estación del año se realizaron 30 transectos lineares de 10 m, distribuidos en todo el humedal. El método por transectos se aplicó al ser recomendado por su rapidez, la facilidad de aplicación y por la heterogeneidad de la vegetación (Mostacedo & Fredericksen, 2000), además porque ha sido empleado y sugerido en trabajos similares de diversidad (Aponte & Ramírez, 2011; Ramírez et al., 2010). Para ubicar los transectos lineares, se ubicaron primero 30 puntos equidistantes (distancia entre puntos: 64.4 m) en una línea paralela a la costa (Figura 2); utilizando como referencia cada punto, se ubicó de manera aleatoria cada transecto linear (utilizando coordenadas obtenidas con números aleatorios dentro de una parcela de 20 m x 20 m), el cual se trazó perpendicular a la costa. Esta distribución de los puntos permitió muestrear en todas las comunidades vegetales representativas del humedal.
En cada transecto linear se aplicó el método de point quadrat, método que permite caracterizar la vegetación de comunidades vegetales donde normalmente no es fácil diferenciar individuos, por ejemplo en herbazales, pastizales, bofedales y césped de puna (Mostacedo & Fredericksen, 2000); por cada transecto linear se evaluó un total de 50 puntos (espaciados cada 20 cm); en cada punto se registraron las especies presentes (identificación en campo y gabinete) tomando en cuenta aquellas especies que tocaron una varilla (1.5 metros de largo y 1 cm de diámetro). De forma paralela se recolectaron muestras botánicas de los transectos, según técnicas estandarizadas de colecta (Bridson & Forman, 1998). Posterior a ello estas fueron determinadas taxonómicamente con ayuda de guías de identificación y artículos especializados como Aponte & Cano (2018), Tello & Castillo (2010), Kahn et al. (1993). Las muestras fueron depositadas en el Herbario USM con el número de constancia N° 08-2020-USM-MHN. La investigación contó con el permiso N°1153-2018-MINAGRI-SERFOR-A-TFFS-LIMA.
Análisis de datos
Los datos obtenidos fueron analizados utilizando el software Past 2.17c; (Hammeret et al., 2001). Se estimó la diversidad y el recambio espacial de la siguiente manera:
a) Diversidad por transecto
Se consideró la riqueza de especies en los transectos evaluados y se calcularon los índices de Shannon-Wienner (H) y Simpson (1-D) tal como muestran las ecuaciones (1) y (2):
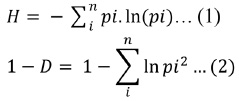
donde pi es la proporción entre el registro de la especie i con respecto al total de registros de todas las especies en el transecto lineal.
Como estimadores de diversidad del humedal se emplearon los estimadores de diversidad no paramétricos de Chao-2 (S Chao2 ) y Jackknife-1 (S Jacknife ) siguiendo las ecuaciones (3) y (4):
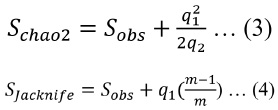
donde q 1 es el número de especies que fueron encontradas una vez en un solo transecto (especies únicas), q 2 es el número de especies que se encontraron una vez en dos transectos, m es el número de transectos totales (30) y S obs es el número de especies totales observadas.
b) Recambio espacial
Para hallar el recambio espacial de especies en el humedal, se emplearon los índices de Harrison ( β H ) y Jaccard (Ij) tal como muestran las ecuaciones (5) y (6):
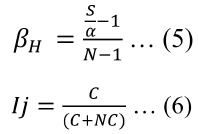
donde S es el número de especies, α es el promedio de especies por transecto, N es el número de transectos (en este caso, 30), C son el número de especies comunes y NC es el número de especies no comunes (la sumatoria de C y CN representan el número de especies totales del humedal, no se utilizó especies de otros humedales como no comunes). En el caso del Ij el valor que se utilizó fue el promedio de todas las comparaciones entre transectos.
c) Cobertura de la muestra
Adicionalmente, se estimó la cobertura (completeness) de la muestra, medida que nos indica el porcentaje de especies que se ha logrado muestrear con respecto a total de especies que existen en el área (Moreno y Pineda, 2015); para ello se utilizó el valor máximo de especies del humedal en cada muestreo, obtenidas mediante técnicas de extrapolación haciendo uso de la plataforma INEXT online (Chao et al., 2013; Chao et al., 2014; ; Chao et al., 2016; Chao & Jost, 2012; Colwell et al., 2012). La riqueza fue dividida entre el valor máximo estimado y multiplicada por 100, obteniendo así el porcentaje de cobertura de la muestra.
Comparación con otros humedales de Lima
A fin de comparar los datos obtenidos, se tomaron de la literatura los valores de los índices alfa, beta y la riqueza de cuatro humedales costeros de Lima: Humedal de Puerto Viejo, Humedal de Santa Rosa, Laguna El Paraíso y Albufera de Medio Mundo; los datos calculados en esos trabajos se obtuvieron utilizando una metodología similar, pero en un solo muestreo anual durante el 2009 (Aponte & Ramírez, 2011). Estos datos fueron comparados a los valores obtenidos en el presente estudio. Para ello se utilizó la matriz de datos del artículo en mención, con los que se calculó los valores de los índices de Simpson, Shannon-Wienner (en ambos casos se calculó el valor para cada uno de los 30 transectos por humedal; obteniendo así un promedio de diversidad por transecto) y Jaccard (en este caso, se calculó el resultado de la comparación entre los 30 transectos de cada humedal). Para cada índice se calculó los valores promedio y se realizó la comparación entre todos los humedales (incluyendo Carquín-Hualmay) mediante la prueba de Kruskal Wallis y la subsecuente comparación por pares con la prueba de Mann Whitney (cada vez que p fue <0.05), se eligió estas pruebas previa verificación de que la normalidad no se cumplía en el 100% de casos (p<0.05 en la prueba de Shapiro Wilk para algunas variables). Estas pruebas también fueron calculadas en el software PAST 2.17c. Para comparar el recambio espacial ( 𝛽 𝐻 ) no se hicieron análisis estadísticos, ya que únicamente se cuenta con un solo valor por humedal a comparar; el mismo fue tomado de Aponte (2017b).
Resultados
Diversidad por transecto
El valor promedio del índice de Simpson fue de 0.39. De todos los transectos (T), el valor más alto fue el T7 (con dominancia de Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller) en la estación de otoño (0.84); los valores más bajos se mostraron en los transectos con dominancia de Typha domingensis Pers. (totoral; T4) y Distchlis spicata Pers. (gramadal; T8, T10, T25, T26, T27).
El índice Shannon-Wienner, tuvo una tendencia poco marcada al aumento durante las cuatro estaciones evaluadas (Tabla 1). Su valor promedio fue de 0.66 decits/ind., presentando el valor más alto en el T7 para la estación de otoño (1.831 decits/ind.) y el valor más bajo en los T4, T10, T25, T26 y T27 (0.0 decits/ind. para todas las estaciones); los transectos mencionados coinciden con los valores descritos para el Índice de Simpson.
Los transectos con mayor riqueza fueron T7 y T30 (con 6 especies durante todas las estaciones, adicionalmente los transectos T24 y T11, presentaron 5 especies únicamente para primavera). Mientras que los transectos con menor riqueza fueron T4, T10, T25, T26, T27, T28 (con una especie para todas las estaciones, T8 tuvo una especie únicamente para verano). El promedio de la riqueza por transecto fue mayor en la época de primavera (2.93 especies/transecto, Tabla 1).
Los valores promedio de los estimadores de Chao-2 y Jackknife-1 fueron S Chao2= 23.9 y S Jacknife =22.6 respectivamente. Las estaciones con valores más bajos de diversidad del humedal fueron otoño (S Chao2 = 22.25, S Jacknife = 20.80) e invierno (S Chao2 = 21.80, S Jacknife = 21.80) donde el número de especies vegetales fue menor en comparación a las estaciones de verano (S Chao2 = 23.40, S Jacknife = 22.00) y primavera (S Chao2 = 27.02, S Jacknife = 25.70), las cuales presentaron valores más altos de diversidad del humedal (Tablas 1 y 2). La riqueza de las especies observadas para cada estación siempre estuvo cercana a la riqueza máxima esperada obtenida mediante las técnicas de extrapolación; el valor promedio de la cobertura de la muestra fue el 97.75% (Figura 3, Tabla 1).
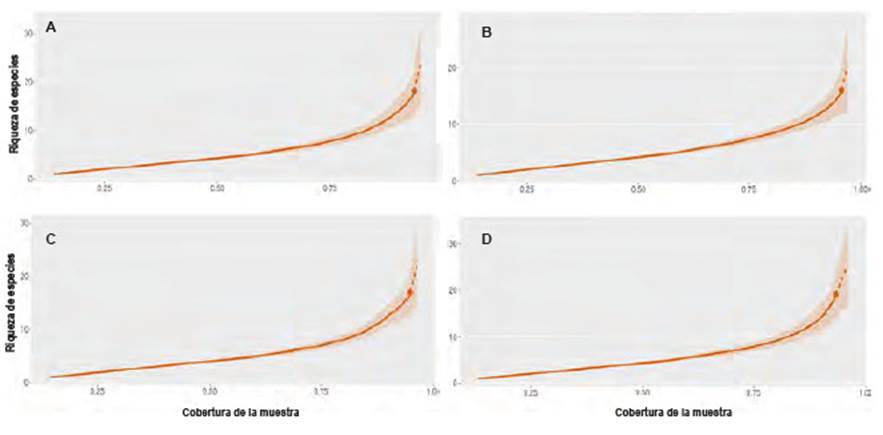
Figura 3 Cobertura de muestra y riqueza de especies para cada estación del año obtenidas por la técnica de rarefacción-extrapolación. Se aprecia que la cobertura de la muestra en todos los casos estuvo próxima al 95%. La zona sombreada corresponde a la región de máximos y mínimos. A = Verano, B = Otoño, C = Invierno, D = Primavera. Y la línea punteada es la extrapolación.
Tabla 1 Valores de los índices, estimadores y cobertura (%) de diversidad en el humedal de Carquín-Hualmay por estaciones y en promedio. Se presentan los valores promedio más menos desviación estándar. Las unidades de índice de Shannon-Wienner son: decits/ind.
| Verano | Otoño | Invierno | Primavera | Promedio | ||
|---|---|---|---|---|---|---|
| Diversidad por transectos | Especies | 2.63 ± 1.35 | 2.57 ± 1.30 | 2.70 ± 1.28 | 2.93 ± 1.31 | 2.71 ± 1.31 |
| Individuos | 54.60 ± 23.23 | 59.20 ± 30.65 | 60.03 ± 21.99 | 58.77 ±15.75 | 58.15 ± 22.91 | |
| Dominancia de Simpson | 0.66 ± 0.23 | 0.61 ± 0.25 | 0.61 ± 0.25 | 0.59 ± 0.23 | 0.62 ± 0.24 | |
| Índice Simpson | 0.34 ± 0.23 | 0.39 ± 0.25 | 0.41 ± 0.25 | 0.41 ± 0.23 | 0.39 ± 0.24 | |
| Índice de Shannon-Wienner | 0.58 ± 0.40 | 0.65 ± 0.46 | 0.71 ± 0.44 | 0.71 ± 0.42 | 0.66 ± 0.43 | |
| Diversidad del humedal | Chao-1 | 2.70 ± 1.49 | 2.57 ± 1.30 | 2.73 ± 1.35 | 3.00 ± 1.41 | 2.75 ± 1.39 |
| Riqueza | 17 | 15 | 16 | 18 | 16 | |
| Chao 2 | 23.4 ± 7.92 | 22.25 ± 7.92 | 23.25 ± 7.92 | 27.02 ± 8.59 | 23.98 ± 8.09 | |
| Jackknife 1 | 22.00 ± 2.92 | 20.80 ± 2.15 | 21.8 ± 2.56 | 25.73 ± 2.76 | 22.58 ± 2.60 | |
| Recambio espacial | Harrison | 0.18 | 0.17 | 0.16 | 0.18 | 0.17 |
| Jaccard | 0.25 ± 0.25 | 0.28 ± 0.26 | 0.30 ± 0.25 | 0.26 ± 0.23 | 0.27 ± 0.25 | |
| Cobertura de la muestra (%) | 98 | 99 | 98 | 96 | 97.75 | |
Durante el muestreo, en el total de transectos se encontraron 20 especies de plantas, distribuidas en 19 géneros y 14 familias (Tabla 2); 13 de ellas (65%) se visualizaron durante las cuatro estaciones muestreadas; las otras siete especies (35%) se presentaban indistintamente entre las estaciones. Asimismo, se pudo evidenciar que hubo especies que solo se visualizaron en una determinada estación, como es el caso de Azolla filiculoides Lam. en primavera y Ludwigia peploides (Kunth) P. H. Raven en verano. La especie Rorippa nasturtium-aquaticum (L.) Hayek fue registrada por primera vez en el humedal de Carquín-Hualmay.
Tabla 2 Especies de los transectos muestreados por cada estación (Verano=V, Otoño=O, Invierno=I y Primavera=P) en el humedal de Carquín-Hualmay. COL=colector, en todos los casos fue Leslie Carmen Alberca (LCA); NC= número de colecta; PR= Procedencia (In=Introducidas, I=Invasoras, IP=Invasora Potencial, N=Nativa). 1,2 Los nombres comunes fueron tomados de Ramírez y Cano (2010), Tello y Castillo (2010). 3 La denominación de la procedencia fue tomada de Aponte y Cano (2013). *Esta planta se considera naturalizada (tomado de https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearcheco).
| N° | Familias | Especie | Nombre común1,2 | PR3 | Estaciones | COL y NC |
|---|---|---|---|---|---|---|
| 1 | AMARANTHACEAE | Dysphania ambrosioides (L. Mosyaqun&Clemants) | Paico | I | V, I, P | LCA 20 |
| 2 | ARACEAE | Lemna minuta Kunth. | Lenteja de agua | N | I, P | LCA18 |
| 3 | ARALIACEAE | Hydrocotyle bonariensis Lam. | Paragüita | N | V, O, P | LCA 10 |
| 4 | ARALIACEAE | Hydrocotyle ranunculoides L.f. | Paragüita | IP | V, O, I, P | LCA 11 |
| 5 | ASTERACEAE | Enydra sessilifolia (Ruiz & Pav.) Cabrera | - | N | V, O, I, P | LCA 15 |
| 6 | AZOLLACEAE | Azolla filiculoides Lam. | Helechito de agua | IP | P | LCA 19 |
| 7 | BORAGINACEAE | Heliotropium curassavicum L. | Colita de escorpión | N | V, O, I, P | LCA 8 |
| 8 | BRASICACEAE | Rorippa nasturtium - aquaticum L. Hayek | Berros | *N | V, O, I, P | LCA 13 |
| 9 | CYPERACEAE | Eleocharis geniculata (L.) Roem. & Schult. | Junquillo | N | O, I | LCA 17 |
| 10 | CYPERACEAE | Cyperus laevigatus L. | Junco | N | V, O, I, P | LCA 12 |
| 11 | CYPERACEAE | Schoenoplectus americanus (Pers.) Volkart ex Schinz & R. Keller | Junco | N | V, O, I, P | LCA 5 |
| 12 | CYPERACEAE | Torulinium odoratum (L.) S. S. Hooper | Cortadera | I | V, O, I, P | LCA 16 |
| 13 | ONAGRACEAE | Ludwigia peploides (Kunth) P. H. Raven | - | IP | V | LCA 4 |
| 14 | POACEAE | Cynodon dactylon (L.) Pers. | Pata de perdis | IN | V, O, I, P | LCA 9 |
| 15 | POACEAE | Distichlis spicata (L.) Greene | Grama salada | N | V, O, I, P | LCA 1 |
| 16 | POACEAE | Paspalum vaginatum Swartz. | Grama dulce | N | V, O, I, P | LCA 2 |
| 17 | POLYGONACEAE | Rumex crispus L. | - | I | V, P | LCA 6 |
| 18 | PLANTAGINACEAE | Bacopa monnieri (L.) Wettst | - | N | V, O, I, P | LCA 3 |
| 19 | TYPHACEAE | Typha domingensis Pers. | Totora | N | V, O, I, P | LCA 14 |
| 20 | VERBENACEAE | Lippia nodiflora (L.) Michx | Lipia | N | V, O, I, P | LCA 7 |
Recambio espacial
Los valores promedio de los índices de Harrison y Jaccard fueron 𝛽 𝐻= 0.17 y 𝐼𝑗=0.27 respectivamente. La estación de invierno fue la que presentó menor recambio entre los transectos ( 𝛽 𝐻 y 𝐼𝑗 con valores de 0.16 y 0.30 respectivamente). Las estaciones de verano, otoño y primavera fueron las que presentaron mayor recambio de especies (Tabla 1).
Comparación con otros humedales de la costa de Lima
El humedal de Carquín-Hualmay presenta en promedio valores más altos en diversidad por transecto (1−𝐷 y 𝐻) exceptuando a El Paraíso (Figura 4 y 5). La prueba de Kruskal Wallis nos muestra que no hay diferencias entre humedales para el índice de Simpson (p=0.3804), al igual que para el índice de Shannon-Wienner (p=0.1811); para este último índice, se puede ver que el valor de la estación de verano de Carquín-Hualmay es más alto que el valor de la Albufera de Medio Mundo (mayor detalle de la comparación por pares en la Figura 5).
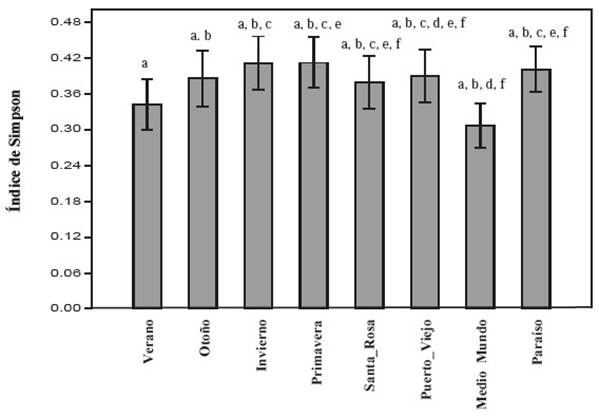
Figura 4 Comparación de la Diversidad por transecto mediante el Índice de Simpson entre humedal de Carquín - Hualmay y los principales humedales de la costa de Lima: Santa Rosa, Puerto Viejo, Medio Mundo y El Paraíso. Las letras asignadas (a, b, c, d, e, f) en el grafico corresponden a la evaluación por pares con la prueba no paramétrica de Mann Whitney.
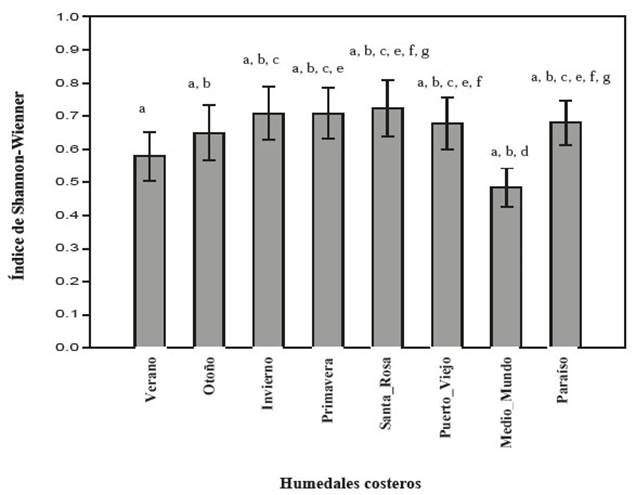
Figura 5: Comparación de la Diversidad por transecto mediante el Índice de Shannon-Wienner entre humedal de Carquín-Hualmay y los principales humedales de la costa de Lima: Santa Rosa, Puerto Viejo, Medio Mundo y El Paraíso. Las letras asignadas (a, b, c, d, e, f, g) en el gráfico corresponden a los resultados de la evaluación por pares con la prueba no paramétrica de Mann-Whitney.
Con respecto al recambio espacial se aprecia que los valores obtenidos para 𝛽 𝐻 en Carquín-Hualmay son mayores a la mayoría de humedales, solamente el humedal Medio Mundo lo supera (Figura 6). Los valores obtenidos con 𝐼𝑗 muestran que Carquín, Puerto Viejo y Paraíso son los que presentan mayor similitud (menor recambio) de especies a diferencia de Santa Rosa y Medio Mundo que presentan valores más bajos de similitud (p<0.05 para Kruskall Wallis; más detalle de la comparación por pares en la Figura 7).
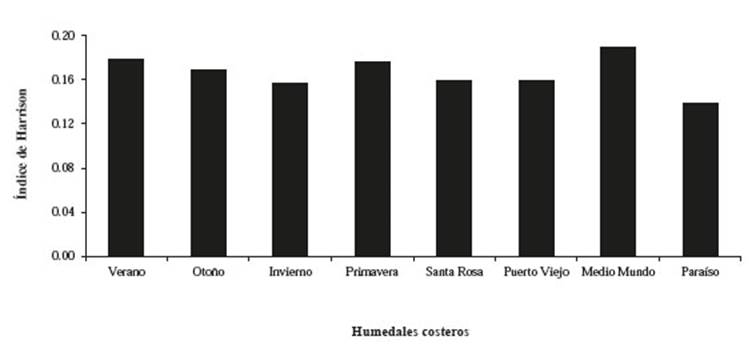
Figura 6: Comparación del Recambio espacial mediante el Índice de Harrison entre humedal de Carquín-Hualmay y los principales humedales de la costa de Lima: Santa Rosa, Puerto Viejo, Medio Mundo y El Paraíso.
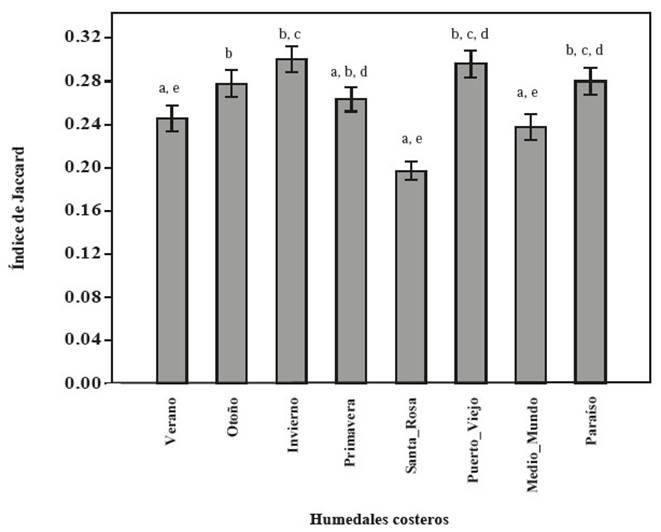
Figura 7: Comparación del Recambio espacial mediante el Índice de Jaccard entre humedal de Carquín-Hualmay y los principales humedales de la costa de Lima: Santa Rosa, Puerto Viejo, Medio Mundo y El Paraíso. Las letras asignadas (a, b, c, d, e) en el gráfico corresponden a los resultados de la evaluación por pares con la prueba no paramétrica de Mann-Whitney.
Discusión
El presente trabajo es el primero en evaluar durante cuatro estaciones (verano, otoño, invierno y primavera) a las comunidades vegetales en humedales costeros de Lima utilizando transectos y estimadores cuantitativos. De este modo, el trabajo permite visualizar cómo la diversidad varía estacionalmente, principalmente mediante la desaparición o aparición de especies vegetales. Esta variación observada en la vegetación podría estar ligada al sistema hidrológico, ya que este define las condiciones que se dan en este tipo de ecosistemas (Gerten et al., 2004), por lo que, si desaparecen los cuerpos de agua, algunas de las especies vegetales que crecen ahí, también desaparecerán y cuando los cuerpos de agua vuelvan a reaparecer (en determinada época del año), las especies vegetales también lo harán. Evaluaciones de los cambios hídricos en humedales costeros como Santa Rosa muestran una tendencia en la disminución hídrica en los meses de invierno, pero con incrementos y disminuciones que reflejan variabilidad a lo largo del año, sin un patrón claro (Castillo & Huamantinco, 2020). En el presente estudio, se apreció la disminución de los cuerpos de agua en la estación de invierno y por ende no se observaron algunas de las especies vegetales acuáticas en este periodo. La escasez de agua en invierno se debe a que la temporada de lluvias para la sierra peruana se produce durante los meses de enero a abril (Endara, 2016); estos eventos aumentan el caudal de los ríos que van hacia la costa y por consiguiente se crea un flujo subterráneo, desplazándose posteriormente a la costa (Castillo & Huamantinco, 2020). En los meses de invierno y primavera no se acumula agua de lluvias lo que podría explicar la disminución del nivel de agua en el humedal. Estudios complementarios del régimen hídrico y su relación con los cambios en las comunidades vegetales nos permitirán corroborar estas observaciones. Es importante mencionar que la distribución de los transectos durante los cuatro muestreos en campo fue muy particular debido las características propias del humedal (una franja costera poco ancha, donde las formaciones vegetales se mezclaban constantemente); ello nos obligó a priorizar la distribución de las parcelas manteniendo una distancia constante entre ellas, en vez de separarlas por tipos de comunidad. Ello, puede haber influido en las estimaciones de diversidad; sin embargo, consideramos que los puntos de muestreo representan bastante bien la vegetación de este humedal evaluado.
En comparación con los humedales estudiados en los trabajos de Aponte & Ramírez (2011) y Aponte (2017b), Carquín-Hualmay presenta valores más altos en diversidad por transecto (1−𝐷 y 𝐻), lo que significa que este ecosistema tiene un mayor número de especies por área de muestreo y que para cada punto de muestreo existe más de una especie. Para 𝛽 𝐻 únicamente la albufera de Medio Mundo presenta mayor recambio espacial que el humedal Carquín-Hualmay. Resulta interesante encontrar un patrón distinto a partir de 𝐼𝑗 (que también mide recambio espacial), el cual nos indica que Carquín se encuentra en el grupo de los que tienen menor recambio (alta similitud); mientras que Santa Rosa y Medio Mundo tienen alto recambio espacial (Figura 6 y 7). Esta diferencia puede estar relacionada a que 𝛽 𝐻 no distingue la identidad de las especies (solo utiliza el número de especies por parcela como indicador del recambio), mientras que 𝐼𝑗 si distingue la identidad de las especies evaluadas. Esta estimación debe estar influenciada también por la forma del área de estudio y la distribución de los transectos en campo: mientras que Carquín-Hualmay es una delgada franja costera (donde la distribución de los transectos fue de manera perpendicular a la costa) los otros humedales presentan una extensión mayor hacia la parte continental (lo que permitió colocar los transectos en varios sectores al interior). Esto último pudo influir en registrar una mayor variabilidad con índices como 𝐼𝑗 que aportan al análisis de recambio espacial incluyendo la identidad de la especie. Estos resultados concuerdan parcialmente con los patrones de riqueza vegetal en los humedales de la costa de Lima, donde Santa Rosa es el humedal con mayor riqueza de los humedales comparados, pero Carquín-Hualmay es el que le sigue junto a Pantanos de Villa (Aponte y Cano 2018); con un patrón distinto a partir del índice de 𝐼𝑗. Esto último no nos permite generalizar y afirmar que el recambio es mayor en Carquín-Hualmay, ya que esto depende del índice que se utilice y cómo este sea analizado e interpretado.
Los resultados obtenidos a partir de los estimadores de diversidad del humedal (S Chao2 y S Jacknife ) muestran un número menor al de las especies reportadas en estudios previos para este humedal (41 especies de plantas vasculares según Aponte y Cano, 2018). Los estimados mediante las técnicas de extrapolación muestran resultados máximos alrededor de las 30 especies. Esto, probablemente está relacionado a que a) el muestreo previo se hizo durante el año 2017, tiempo en el que las condiciones hídricas pudieron haber favorecido el muestreo de especies acuáticas, en especial en los cuerpos de agua poco frecuentes en la zona; b) gran parte de las especies no reportadas en los transectos este estudio (21, comparados con Aponte & Cano 2018), se encuentran en lugares muy puntuales y periféricos (generalmente cerca de la zona urbana) los cuales no fueron alcanzados con el diseño de muestreo en el presente estudio, ya sea porque los transectos, al ser ubicados de manera semialeatoria, no cayeron en dichos puntos o c) porque algunas especies, se encontraban en los espejos de agua cuyo muestreo no estuvo contemplado para este estudio (no se consideró las lagunas para hacer transectos; algunas de las especies que fueron reportadas en estudios previos para en estos hábitats son por ejemplo Wolffia columbiana H. Karst, Eichhornia crassipes (Mart.) Solms, Potamogeton striatus Ruiz & Pav.). La cobertura de la muestra nos indica que el muestreo actual reunió al 97.75% de la riqueza de plantas vasculares del área muestreada, por lo que las estimaciones realizadas son bastante representativas de la cantidad total de especies en el área de estudio y nos permiten confiar de los resultados obtenidos; muy probablemente la diferencia observada tiene que ver con la disminución del régimen hídrico, hipótesis que deberá ser corroborada con estudios complementarios. Todas estas consideraciones son importantes para planificar posteriores evaluaciones y diseños experimentales en el área de estudio y en humedales similares.
Aponte & Ramírez (2011) mencionan que, en los humedales de Medio Mundo, El Paraíso, Santa Rosa y Puerto Viejo, ya se han elaborado expedientes técnicos y se ha intentado categorizar dichas áreas. La Municipalidad de Carquín ya se encuentra realizando acciones para evitar que las actividades antropogénicas en la zona (como quema de basura, vertederos de residuos sólidos, ganadería, uso de los canales para lavado de ropa, entre otros) continúen dañando al humedal, y por ende a la diversidad de especies; pero también se ha visto modificaciones en el uso de suelo de sus alrededores que podrían afectar las condiciones hídricas del humedal. Para obtener un mejor resultado, es necesario un trabajo en conjunto con la Municipalidad de Hualmay ya que el humedal abarca a ambos distritos (y continúa entrecortadamente hasta Huacho, por lo que inclusive la intervención de su Municipalidad sería también necesaria). Es fundamental realizar estudios complementarios de diversidad referidos a los otros grupos de especies (aves, insectos, mamíferos, y otros) que habitan en el humedal Carquín-Hualmay. Esperamos que el presente estudio sea la puerta para que más colegas científicos despierten el interés por estudiar este asombroso ecosistema.












 uBio
uBio