Introducción
Los polihidroxialcanoatos (PHA) están ganando cada vez más atención en el mercado de polímeros biodegradables debido a sus propiedades prometedoras, como la alta biodegradabilidad en diferentes entornos, no solo en plantas de compostaje, y la versatilidad de procesamiento (Bugnicourt et al., 2014). Los polihidroxialcanoatos (PHA) son sintetizados por numerosas bacterias como compuestos de almacenamiento de carbono y energía, y son buenos candidatos para material plástico biodegradable (Lee, 1996). Los polihidroxialcanoatos (PHA) comprenden una gran clase de poliésteres que son sintetizados por muchas bacterias como un compuesto intracelular de carbono y energía (Lemos et al., 1998; Quillaguamán et al., 2005; Zinn et al., 2001). De hecho, entre los biopolímeros, estos poliésteres biogénicos representan un posible reemplazo sostenible para termoplásticos a base de combustibles fósiles (Lee, 1996). La mayoría de los PHA disponibles comercialmente se obtienen con cultivos microbianos puros cultivados en materias primas renovables (es decir, glucosa) en condiciones estériles, pero estudios de investigación recientes se centran en el uso de desechos como crecimientos medios de comunicación (Choi & Lee, 1999). El PHA puede extraerse de la célula bacteriana y luego formularse y procesarse por extrusión para la producción de rígidos y plástico flexible (Jendrossek, 2009), adecuado no solo para las aplicaciones médicas más evaluadas, sino también para aplicaciones que incluyen envases, productos moldeados, recubrimientos de papel, telas no tejidas, adhesivos, películas y aditivos de alto rendimiento (Lee, 1996).
Los polihidroxialcanoatos bacterianos (PHA) son polímeros isotácticos que desempeñan un papel fundamental en el metabolismo central, ya que actúan como depósitos dinámicos de carbono y equivalentes reductores. Estos polímeros tienen una serie de aplicaciones técnicas ya que exhiben propiedades termoplásticas y elastoméricas, haciéndolos atractivos como reemplazo de materiales derivados del petróleo (López et al., 2015). Son producidos y acumulados como gránulos intracelulares por diferentes géneros bacterianos (Dias et al., 2006), cuando en el medio hay abundancia de carbono (Dai et al., 2007) y déficit de elementos como nitrógeno, fósforo o magnesio, entre otros (Volova, 2004). Las bacterias productoras de PHA tienen un metabolismo versátil con actividad celulolítica (Grados et al., 2008), hidrólisis de polímeros como el almidón (Guzmán et al., 2017) y diazotrofia o fijación de nitrógeno atmosférico (Rojas et al., 2016; Rubio & Perla, 2012). Los PHA se acumulan en condiciones de desequilibrio nutricional (generalmente un exceso de fuente de carbono con respecto a un nutriente limitante, como el nitrógeno o el fósforo) (López et al., 2015).
Se ha informado que los productores de polihidroxialcanoatos (PHA) residen en varios nichos ecológicos que están expuestos de forma natural o accidental a alta materia orgánica o condiciones limitadas de crecimiento, como desechos lácteos, sitios contaminados con hidrocarburos, desechos de fábricas de pulpa y papel, desechos agrícolas, lodos de tratamiento activados plantas, rizosfera y efluentes industriales (Singh et al., 2014). Se cree que las bacterias utilizan la acumulación de PHA para aumentar la supervivencia y la tolerancia al estrés en entornos cambiantes y en entornos competitivos donde las fuentes de carbono y energía pueden ser limitadas, como las que se encuentran en el suelo y la rizosfera (Kadouri et al., 2005). En los cultivos agrícolas como Asparagus officinalis L. (Asparagaceae) “espárrago” existe una diversidad de bacterias fijadoras de nitrógeno (López et al., 1998), que aún no han sido investigadas, con la perspectiva de obtener cepas con mayor rendimiento en el polímero y que puedan ser utilizadas en la producción comercial con bajo costo. El ciclo de síntesis y degradación de PHA se ha reconocido como una característica fisiológica importante cuando se describieron originalmente estas vías bioquímicas, pero su papel en procesos bacterianos tan diversos como la regulación global y la supervivencia celular apenas comienza a apreciarse por completo (López et al., 2015). La biorremediación y la promoción del crecimiento de las plantas se presentan como ejemplos de aplicaciones ambientales en las que la acumulación de PHA ha sido explotada con éxito (López et al., 2015). El objetivo de esta investigación fue determinar el rendimiento de polihidroxialcanoatos producidos por bacterias fijadoras de nitrógeno aisladas de Asparagus officinalis L. (Asparagaceae).
Material y métodos
La investigación la población estuvo constituida por las plantas de Asparagus officinalis (“espárrago”) del fundo Josymar (50 ha) ubicada en Virú, Trujillo, Perú y se investigó una muestra no probabilística de 96 plantas de Asparagus officinalis colectadas durante noviembre a diciembre de 2016, el tamaño de muestra de las plantas de “esparrago” no fue calculado y se debió a la capacidad logística y de procesamiento de los investigadores. La población estuvo constituida por los aislamientos bacterianos fijadoras de nitrógeno, productoras de PHA y de los cuales se seleccionaron diez cultivos de bacterias seleccionadas, el cual fue calculado tomando en cuenta una prevalencia de 90 %.
Las 96 muestras de raíces, tallos y suelo rizosférico de “espárrago” se colectaron en el fundo Josymar, ubicado en el lote 10,6 del sector IV, Proyecto Especial Chavimochic en la provincia de Virú, Perú.
En el campo de cultivo de espárrago, cada cinco surcos se seleccionó la planta más vigorosa y se extrajeron aproximadamente 50 g de raíces con suelo rizosférico adherido, se depositaron en bolsas de polietileno debidamente identificadas e inmediatamente se transportaron en una caja térmica (10 ± 1ºC) hacia el Laboratorio de Microbiología y Parasitología: Biotecnología Microbiana de la Facultad de Ciencias Biológicas, Universidad Nacional Pedro Ruiz Gallo en Lambayeque.
Aislamiento de bacterias endófitas posibles fijadoras de nitrógeno
Las bacterias endófitas fijadoras de nitrógeno microaerófilas se aislaron de las raíces y tallos previamente desinfectados con lejía al 10% en el que fueron sumergidos por 2 min y luego enjuagados con agua destilada. El tejido fue depositado en papel secante para eliminar el exceso de humedad y luego fue llevado a bolsas de polietileno de 15 x 16 cm, donde fue macerado en 1 L de agua destilada. Con una jeringa se extrajo 1 mL, sembrándose inmediatamente una gota por doble puntura en los medios de cultivo semisólidos sin nitrógeno: NFb y LGI para Azospirillum spp., JNFb para Herbaspirillum spp., LGI-P para Gluconacetobacter spp. y JMV para Burkholderia spp.
Después de la incubación a 30 ± 2°C por 7 días, se seleccionaron los medios donde se observó una película blanquecina y el viraje del indicador de pH. Posteriormente se realizaron repiques (subcultivos) en similares medios dos veces consecutivas. Para el aislamiento de bacterias microaerófilas, a partir de las películas bacterianas se realizaron suspensión utilizando solución salina estéril y se sembraron en los medios de cultivo sólidos respectivos, incubando a 30 ± 2°C por 48 horas. Los diversos morfotipos de las bacterias aisladas se cultivaron nuevamente en medio semisólido (tercer subcultivo) y posteriormente en el medio sólido respectivo.
Aislamiento de bacterias rizosféricas posibles fijadoras de nitrógeno
Las bacterias rizosféricas fijadoras de nitrógeno aerobias y microaerófilas se aislaron de las raíces con suelo rizosférico previamente deshidratadas bajo sombra, a temperatura ambiente de 28 °C, durante 72 horas. Las raíces fueron fragmentadas con bisturí (5 cm), aleatoriamente se tomaron 10 g de raíces cortadas anteriormente, junto con el suelo adherido y se depositaron en frascos de 500 mL de capacidad, conteniendo 90 mL de solución salina esterilizada (NaCl 0,85 % p/v). Después de agitar manualmente durante 10 minutos, se tomaron alícuotas (una gota) y se sembraron mediante la técnica de agotamiento y estría sobre la superficie de medios sólidos sin nitrógeno, para aislar bacterias aerobias y mediante la técnica de puntura en medios semisólidos sin nitrógeno, para aislar microaerófilas.
Las bacterias aerobias fueron aisladas en los medios de cultivo sólidos LG para Azotobacter, LGD para Derxia y BEIJ para Beijerinckia spp. Después de la incubación a 30 ± 2°C por 2 días, con los morfotipos de las bacterias representativas se obtuvieron suspensiones en solución salina esterilizada y se sembraron en los medios sólidos respectivos. Las bacterias microaerófilas fueron aisladas de manera similar a la explicada en bacterias endófitas. Las colonias de bacterias endófitas y rizosféricas fijadoras de nitrógeno se cultivaron en agar nutritivo (extracto de levadura, peptonas, agaragar, cloruro de sodio y agua destilada a pH 6,8) a 30 ºC, durante 24 horas, se realizaron tinciones de Gram y se obtuvieron los cultivos puros.
La identificación del género de las bacterias rizosféricas y endófitas fijadoras de nitrógeno se realizó en función de las características morfológicas y fisiológicas según el Manual de Bergey de Bacteriología Sistemática. Con todas las bacterias se realizaron pruebas de catalasa, oxidasa y motilidad. Para bacterias aerobias del género Azotobacter, las pruebas fueron reducción de nitratos y acidificación de glucosa, sacarosa, maltosa y fructuosa. Para los géneros Derxia y Beijerinckia, las pruebas fueron producción de indol, utilización del citrato como fuente de carbono, crecimiento en 1% de peptona y acidificación de glucosa, sacarosa y manitol.
Detección, preselección e dentificación de bacterias productoras de gránulos de PHA
Los aislamientos con capacidad potencial de fijar nitrógeno atmosférico se cultivaron por triplicado en 5 mL de caldo para la producción de PHA: caldo fermentación con glicerol como fuente de carbono, a 30ºC en aerobiosis, con agitación constante (125 rpm). A las 24 y 48 horas se tomaron alícuotas de los cultivos, se realizaron frotices, se colorearon con Sudan Negro B, calentando durante 30 segundos hasta antes de la emisión de vapores. Después de 15 minutos se decoloraron con xilol (20 segundos), se secaron a temperatura ambiente (25 a 28 ºC) y se colorearon con safranina durante 1 minuto.
La presencia de gránulos grisáceos en el interior de las células bacterianas rosadas se consideró positivo para la detección de gránulos de PHA. Se cuantificó el número de células con gránulos de PHA en cinco campos microscópicos por cultivo bacteriano y se preseleccionaron e identificaron los diez cultivos con el mayor número de células con gránulos de PHA por campo microscópico a 100x. Estas bacterias se cultivaron en el caldo fermentación con glicerol como fuente de carbono, a 30ºC, durante 24 horas, con agitación constante (125 rpm) y se inocularon (10% v/v) en matraces con 180 mL de caldo. La incubación se realizó en similares condiciones y a las 12, 24, 36, 48 y 60 horas, se tomaron alícuotas para colorearlas con Sudan Negro B y determinar el tiempo requerido para alcanzar el mayor número de células con gránulos de PHA, se seleccionaron para la siguiente fase experimental de la investigación dos cultivos de bacterias con el menor tiempo.
Se realizaron dos ensayos: uno para seleccionar el cultivo bacteriano y el medio de producción de biomasa y PHA más adecuados; y el otro para determinar la cinética de la producción de biomasa y PHA con el cultivo bacteriano y medio de cultivo seleccionados.
El primer ensayo se realizó bajo un diseño completamente aleatorio (DCA), con arreglo factorial 2x2+3, investigando dos variables independientes: correspondientes al cultivo bacteriano (A), con dos niveles 1 y 2 y medio de cultivo (B), con dos niveles: balanceado y desbalanceado. Los tratamientos fueron cuatro con tres repeticiones, totalizando 12 unidades experimentales.
Obtención de la curva patrón para la cuantificación de biomasa y PHA
Las bacterias productoras de gránulos de PHA seleccionadas se cultivaron por triplicado en los medios de fermentación balanceado y desbalanceado durante 36 horas. Según (Becerra, 2013), asumiendo un rendimiento (Yx/s) en biomasa del 40% a partir del glicerol (5 g/L), se planteó la siguiente ecuación:
C3H3O3 + 2,225 O2 + 0,3NH3 1,2 CH2 O0,5 N0,5 + 3,25 H2O + 1,8 CO2
Ecuación N°1. Fermentación balanceada de bacterias productoras
Donde, por cada mol de carbono se necesitan 0,1 moles de nitrógeno en un medio balanceado. De esta manera, en el medio balanceado la relación C/N fue de 10 con (NH4)2SO4: 1,08 g/L y en el medio desbalanceado la relación C/N fue de 20 con (NH4)2SO4: 0,54 g/L.
Para la obtención del inóculo cada bacteria se cultivó en 2 mL del medio correspondiente a 30°C, durante 24 horas y posteriormente en 70 mL del mismo medio a 30°C, durante 24 horas (Guzmán et al., 2017). El inóculo (10%: 20 mL) se depositó en matraces de 250 mL de capacidad, conteniendo 180 mL del caldo correspondiente y se incubó a 30°C, durante 36 horas con agitación manual durante 10 minutos, cada 4 horas. Después, se tomaron muestras de 2 mL por triplicado, con la finalidad de determinar la absorbancia en el espectrofotómetro de luz visible (Model Tenso Med NV-203) a λ=600 nm (tubo 1) y para realizar diluciones decimales hasta 10-3 (tubos 2, 3, 4), a los que también se les determinó la absorbancia.
Los 194 mL restantes de cada uno de los caldos de cultivo se centrifugaron (Model GT 119-200) a 3000 rpm, durante 15 minutos (Guzmán et al., 2017). El sedimento o biomasa se lavó una vez con solución salina (NaCl 0,85% p/v) esterilizada, se centrifugó a 3000 rpm durante 15 minutos y deshidrató en la estufa (HINOTEK GRX- 9023ª Model), a 45°C, hasta obtener un peso constante (Baca et al., 2010).
La biomasa deshidratada se pesó y el valor obtenido se expresó en gramos por litro (g/L), correspondiendo a la absorbancia del tubo 1. Asimismo, el valor de la biomasa se dividió entre 10, 100, 1000, equivalentes a la absorbancia de los tubos 2, 3 y 4 (10-1, 10-2, 10-3). Con los valores obtenidos se determinó la ecuación de regresión, para calcular la biomasa de cada cultivo bacteriano.
Proceso fermentativo
En el proceso fermentativo (Becerra, 2013), el inóculo (10%: 20 mL) de las bacterias investigadas se llevó por triplicado a matraces de 250 mL en 180 mL del caldo de cultivo correspondiente, incubándose a 30°C, durante 36 horas, con agitación manual, durante 10 minutos, cada 4 horas. A partir del momento de la inoculación (0 horas) y cada 4 horas, hasta por 36 horas se tomaron por triplicado muestras de 1mL, para determinar la absorbancia en el espectrofotómetro de luz visible (Model Tenso Med NV-203), a 600 nm y los valores de la biomasa se calcularon en la ecuación de regresión de la curva patrón entre absorbancia y biomasa previamente obtenida.
Para cuantificar el PHA, los 190 mL restantes del caldo cultivado a las 36 horas, se centrifugaron a 3000 rpm durante 15 minutos. La biomasa celular obtenida, se lavó una vez con solución salina (NaCl 0,85% p/v), se centrifugó y deshidrató en estufa a 45°C, hasta obtener un peso constante, el cual se determinó con una balanza de precisión. Con la biomasa, se recuperó el PHA producido por cada bacteria. Según el protocolo de Law & Slepecky (1961), descrito por Cholula (2005), en el tubo con la biomasa deshidratada se agregó 1mL de hipoclorito de sodio al 5%, para debilitar la membrana celular y facilitar el proceso extracción.
Después de 2 horas, se adicionó 1mL de cloroformo, para separar la biomasa del polímero. Transcurridos 20 minutos los tubos se centrifugaron a 3500 rpm, durante 5 minutos y se extrajo el cloroformo con el polímero, se depositó en un tubo de 10 x 100 mm, previamente pesado (Pi) en una balanza de precisión y se llevó a estufa a 40ºC, por tiempo suficiente para la evaporación del cloroformo. El tubo conteniendo el PHA se pesó (Pf) y la diferencia entre este peso menos el peso inicial (Pi) constituyó el PHA obtenido.
Para verificar la naturaleza del polímero obtenido, las muestras se diluyeron en 1,5 mL de H2SO4 80%, se calentaron por 30 minutos a 90ºC en baño María, se enfriaron a temperatura ambiente (28ºC), se depositaron en celdas de cuarzo y se realizó un barrido en el espectrofotómetro de luz ultravioleta UNICO S-2150, en el rango de 220 a 250 nm. La absorbancia de un pico máximo a 235 nm fue considerada positiva para el PHA. A continuación, se leyó la absorbancia de cada muestra de PHA investigado a 235 nm (Guzmán et al., 2017).
El Y(p/x) es el coeficiente de rendimiento del producto en relación con la biomasa o cantidad del producto obtenido por cantidad de biomasa formada (g/g) y se calculó dividiendo los gramos de PHA entre los gramos de biomasa (Doran, 1998):
El cultivo bacteriano y el medio de cultivo con los que se alcanzaron el mayor rendimiento Y(p/x) se seleccionaron para determinar la cinética de la producción.
Cinética de la producción de biomasa y PHA
El proceso fermentativo para determinar la cinética de la producción de biomasa y PHA por el cultivo bacteriano en el medio de cultivo seleccionado se realizó de manera similar a lo explicado anteriormente, pero se colectaron muestras de 40mL, por triplicado a las 0, 8, 16, 24 y 32 horas para cuantificar la biomasa y PHA obtenidos y posteriormente se calculó el rendimiento Y(p/x).
Análisis estadístico
Los valores de la concentración de biomasa, PHA y rendimiento de las bacterias fueron ordenados en tablas para realizar las pruebas de normalidad y homogeneidad de varianzas. El análisis de varianza determinó las diferencias entre los tratamientos y la prueba de comparaciones múltiples de Tukey la significancia entre ellos. Se utilizó el software estadístico SPSS versión 15.0.
Resultados
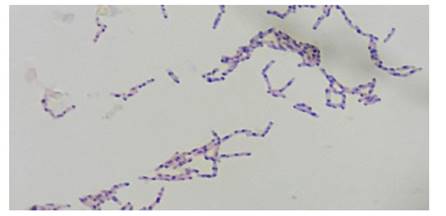
Las bacterias potencialmente fijadoras de nitrógeno o diazotróficas de raíces, tallos y suelo rizosférico de espárrago se aislaron en medios de cultivo sin nitrógeno, obteniéndose 427 cultivos puros. El 51,1% de las bacterias diazotróficas fueron rizosféricas y el 48,9 % endófitas. El 57,6% de bacterias fijadoras de nitrógeno se desarrollaron en el caldo fermentación, evidenciándose turbidez desde las 24 horas; correspondiendo el 65,9% a bacterias Gram negativas. En el 98,4% de los cultivos de bacterias que desarrollaron en el caldo fermentación se observaron gránulos de PHA teñidos con Sudan Negro B, entre las 24 y 48 horas (Figura 1), tal que 56,67 % de las bacterias fijadoras de nitrógeno se reconocieron como productoras de gránulos de PHA.
El rango en el número de células con gránulos de PHA por campo microscópico en las bacterias Gram negativas fue de 1 a 248 a las 24 horas y de 1 a 247 a las 48 horas. En las bacterias Gram positivas el rango fue de 1 a 183 a las 24 horas y 1 a 173 a las 48 horas.
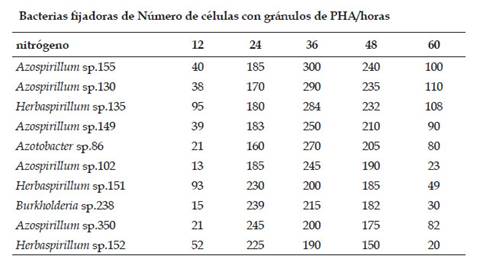
En la identificación fenotípica el 50% de las bacterias preseleccionadas correspondió al género Azospirillum sp., el 30% a Herbaspirillum sp., 10% a Azotobacter sp. Y 10% a Burkholderia sp., cuantificándose 170 a 248 gránulos de PHA a las 24 horas y 190 a 247 gránulos de PHA a las 48 horas. El tiempo en el que se cuantificó el mayor número de células con gránulos de PHA o tiempo óptimo de incubación (Tabla 1) fue de 24 horas (Azospirillum sp. 350; Herbaspirillum spp. 151, 152 y Burkholderia sp. 238) a 36 horas (Azospirillum spp. 155, 130, 149, 102; Herbaspirillum spp. 135 y Azotobacter sp. 86). Transcurrido este tiempo, el número de células con gránulos de PHA disminuyó. Los cultivos de Azospirillum spp. 155 y 130 se seleccionaron para obtener la biomasa y PHA, debido a que presentaron el mayor número de células con gránulos de PHA.
Con los valores de absorbancia obtenidos por triplicado con diferentes concentraciones de biomasa de Azospirillum spp. 130 y 155 en los medios de cultivo balanceado y desbalanceado, se obtuvieron 12 ecuaciones, entre las que se seleccionaron las 4 que presentaron los mayores valores en el coeficiente de determinación, manteniendo como patrón de referencia R2> 0,9.
En el proceso fermentativo, la absorbancia de la biomasa de Azospirillum sp. 130 osciló entre 0,06 y 0,1 en el medio balanceado, así como 0,07 y 0,13 en el medio desbalanceado valores correspondientes a 0,03 a 0,23 g/L y 0,06 a 0,30 g/L, respectivamente.
La absorbancia de la biomasa de Azospirillum sp. 155 osciló entre 0,09 y 0,12 en el medio balanceado, así como 0,100 y 0,169 en el medio desbalanceado, valores correspondientes a 0,14505 a 0,23379 g/L y 0,19554 a 0,49738 g/L respectivamente.
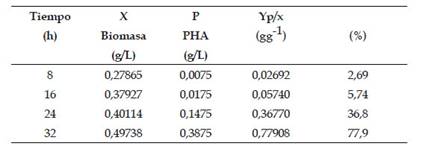
La concentración de PHA producido por Azospirillum se puede observar en la Tabla 2. El análisis de varianza del rendimiento Y p/x de la factorial 22 demostró alta significancia para el cultivo bacteriano (factor A), medio de cultivo (factor B) y la interacción AxB. Respecto al cultivo bacteriano (A) el mayor rendimiento correspondió a Azospirillum sp. 155; en cuanto al medio de cultivo (B) el mayor rendimiento se alcanzó con el desbalanceado. En la interacción AxB el mayor rendimiento se obtuvo con Azospirillum sp. 155 medio desbalanceado. Azospirillum sp. 155 en glicerol como fuente de carbono alcanzó un rendimieto Yp/x de 0,77908gg-1 o 77,9% a las 32 horas de fermentación (Tabla 2).
Discusión
Los polihidroxialcanoatos son polímeros de reserva de energía producidos por bacterias para sobrevivir períodos de inanición en hábitats naturales (Gasser et al., 2009). Se cree que las bacterias utilizan la acumulación de PHA para aumentar la supervivencia y la tolerancia al estrés en entornos cambiantes y en entornos competitivos donde las fuentes de carbono y energía pueden ser limitadas, como las que se encuentran en el suelo y la rizosfera (Kadouri et al., 2005). En las bacterias fijadoras de nitrógeno, el PHA sirve de protección al complejo nitrogenasa, actúa como un compuesto oxidable y también es un constituyente de la membrana citoplasmática (Anderson & Dawes, 1990). Estas bacterias acumulan el PHA como estrategia de supervivencia y regulación del metabolismo energético, tanto en simbiosis como en vida libre (Guzmán et al., 2017).
La presencia de gránulos de PHA en los aislamientos de Azospirillum spp. potencialmente fijadoras de nitrógeno coincide con los reportes de varios estudios en los que se reportó (Itzigsohn et al., 1995; Okon et al., 1995; Okon & Itzigsohn, 1995; Tal & Okon, 1985). La fijación de PHA se ha identificado como una propiedad fisiológica clave en Azospirillum brasilense, que contribuye a la adaptación de la rizosfera y a las habilidades de promoción del crecimiento de las plantas (Fibach- Paldi et al., 2012). Azospirillum también es considerada en la agricultura por su potencial como fijadora de nitrógeno (Tikhonovich et al., 2012). En la investigación se aisló Burkholderia sp. como productora de PHA, esto se vio reportado en otros estudios en los que se aisló de bagazo de caña (Lopes et al., 2014), entre otros (Chee et al., 2010; Lau et al., 2011; Pan et al., 2012). Burkholderia terricola fue reportada por Gasser et al. como productora de PHA (Gasser et al., 2009) y también como promotora de crecimiento (Pan et al., 2012). Con respecto al aislamiento Herbaspirillum sp. Se observo que producía PHA, esto es indicado en varios estudios en lo que se obtuvieron resultados similares (Catalán et al., 2007), este mismo género es indicado como promotor de crecimiento (Batista et al., 2016).
El PHA se observó en forma de gránulos teñidos con Sudan Negro B, los PHA son polímeros de ácidos hidroxialcanoicos o poliésteres de ácidos (R)-3-hidroxicarboxilicos (R)-HA que algunas especies de bacteria acumulan intracelularmente (Bugnicourt et al., 2014), en forma de gránulos, rodeados de una monocapa de fosfolípidos que contiene polimerasas y despolimerasas (López et al., 2015). La membrana lipídica de los gránulos de naturaleza hidrofóbica facilita la tinción con el Sudan Negro B. Este colorante lipofílico permite la detección in vivo de los PHA, evidenciando la naturaleza lipídica de los gránulos, que se colorean de gris a negro, en contraste con el rosado de las células vegetativas.
Los géneros de bacterias fijadoras de nitrógeno con el mayor número de células con gránulos de PHA fueron reportados previamente como productoras del polímero por Baca et al., 2010 (Azospirillum brasilense y A. lipoferum), la disminución del número de células con gránulos de PHA después de alcanzar el máximo también fue observada por Guzmán et al. (2017). Esta disminución es consecuencia de la degradación intracelular, como respuesta endógena de las bacterias para hidrolizar sus reservas de carbono acumuladas en formas de PHA, con la participación de las despolimerasas localizadas en la superficie de los gránulos.
El mayor rendimiento de PHA alcanzado en el medio desbalanceado se atribuye a que bajo condiciones desfavorables, las bacterias acumulan el polímero, como estrategia para regular la concentración de carbono y consumir poder reductor (Kadouri et al., 2005). La síntesis de gránulos de PHA es favorecida en medios de cultivo con exceso de carbono (Baca et al., 2010) y déficit de aeración, nitrógeno, fósforo, magnesio y azufre.
Azospirillum sp.155 alcanzó un rendimiento Yp/x de 0,77908 g/g lo que significa que 77,91 % del peso de la biomasa correspondió al PHA, la rentabilidad en la producción de PHA requiere que la cepa bacteriana acumule por lo menos 60% de masa celular con PHA. En este contexto, Azospirillum sp.155 se considera con potencial industrial, cuyo rendimiento podría aumentar con la optimización del medio de cultivo, condiciones de cultivo y separación del producto. En las raíces, tallos y suelo rizosférico de espárrago se aislaron bacterias potencialmente fijadoras de nitrógeno, que demostraron ser productoras de PHA, destacando Azospirillum sp. como potencial para la producción de biopolímeros.












 uBio
uBio