Introducción
Frente al problema de control de plagas, el hombre busca diversas formas de manejo, llegando a depender casi exclusivamente del control químico, dejando de lado otras alternativas y principalmente desconociendo la información del control biológico y las ventajas que posee en el “loche” que por su valor culinario (Cucurbita moschata), es usado desde épocas precolombinas como saborizante natural y de incomparable aroma en la preparación de platos autóctonos de la Costa Norte, dando fe de ello su constante representación en huacos de las Culturas: Cupisnique (1500 A.C.), Mochica, Lambayeque y Chimú (Andres, Ugás, & Bustamante, 2006). Las plagas agrícolas implican reducción en el valor o en el beneficio económico que se obtiene de la cosecha; puede tratarse de reducciones en cantidad de la cosecha, en la calidad del producto, o en el incremento de los costos de producción y el conocimiento de dichas plagas y malezas constituye la base para el ordenamiento y planificación de los cultivos, tal que, permita optimizar su gestión, tecnificación y producción en la perspectiva de la rentabilidad, competitividad, adaptabilidad y sustentabilidad (Bernal & Medina, 2018).
Es necesario contribuir al conocimiento del agroecosistema de C. moschata Duch (Cucurbitaceae). determinando las características del ecosistema del “loche” como los principales insectos plaga, controladores biológicos y fitopatógenos en dicho cultivo. El objetivo de este trabajo fue identificar los principales insectos plaga, controladores biológicos y hongos fitopatógenos en el cultivo de “loche”.
Material y métodos
El muestreo fue al azar, se tomaron cinco puntos de muestreo por cultivo, para lo cual en cada cultivo se determina el número de surcos y se divide entre cinco. Luego, se mide el ancho del terreno y se divide también entre cinco, haciéndose luego monitoreo con una distribución de todo el terreno como se muestra en la figura 1. Se hicieron cinco monitoreos siguiendo esta secuencia. La unidad del muestro fue un metro cuadrado, para lo cual se hizo un cuadrante de madera de metro por metro. Los monitoreos fueron en las fechas: de octubre a noviembre 2015.
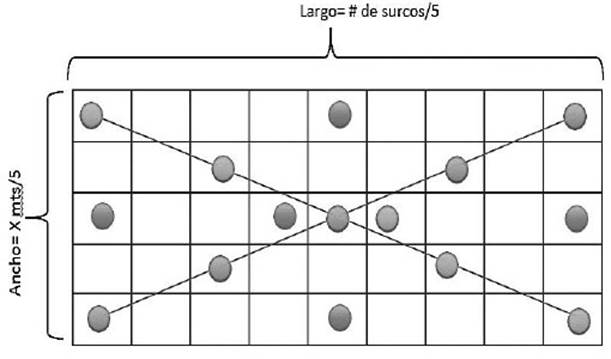
Figura 1 Distribución de los puntos de muestreo en cada terreno (los puntos indican el lugar de muestreo).
Se analizaron cinco puntos por monitoreo, se analizaron cuatro cultivos con las siguientes extensiones; Cultivo 01: media hectárea, Cultivo 02: dos hectáreas y media, Cultivo 03: una hectárea, Cultivo 04: tres hectáreas. Este muestreo es cuantitativo, por hábitat, lanzando cinco veces el cuadrante por unidad de superficie. El conteo de insectos hizo dentro del cuadrante, y además, se registraron el número de hojas con características de haber sido colonizadas por hongos, como coloración ceniza, presencia de quemaduras, y de color amarillento.
Para analizar la presencia de hongos fitopatógenos, se procedió a colocar las hojas que presentaban signos de enfermedad, en cámaras húmedas, durante cinco días, y posteriormente se hizo la tinción con azul de algodón, o hidróxido de sodio según el color de la colonia del hongo fitopatógeno. Se utilizo estadística descriptiva en el software Microsoft Excel.
Resultados
Fluctuación Poblacional de plagas en Cucurbita moschata Duch.
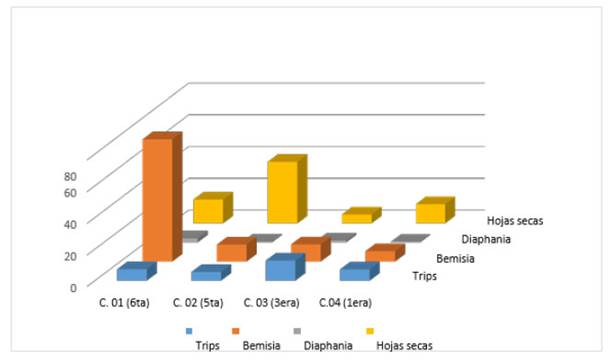
Fueron registrados las diferentes plagas, que se encontraron en el cultivo de C. moschata Duch con el fin de obtener datos sobre cuáles son las principales plagas que atacan dicho cultivo, y cuál es su fluctuación poblacional dependiendo de cada cultivo, cada cultivo tiene diferente edad, tal que el cultivo 01 de la sexta cosecha, el cultivo 02 de la quinta cosecha, el cultivo 03 de la tercera cosecha y el cultivo 04 de la primera cosecha (Figura 1), así se registra a Thrips tabaci, Bemisia tabaci, Diaphania nitidalis, Tetranynchus sp., y Liriomyza huidobrensis entre las principales plagas, y que causan mayores daños, teniendo la plagas más común y en mayor incidencia a Bemisia tabaci.
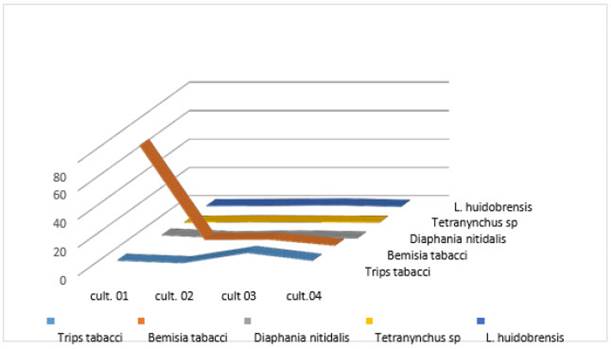
Figura 2 Fluctuación poblacional de las principales plagas encontradas en Cucurbita moschata Duch. en cuatro cultivos de diferentes etapas fenológicas.
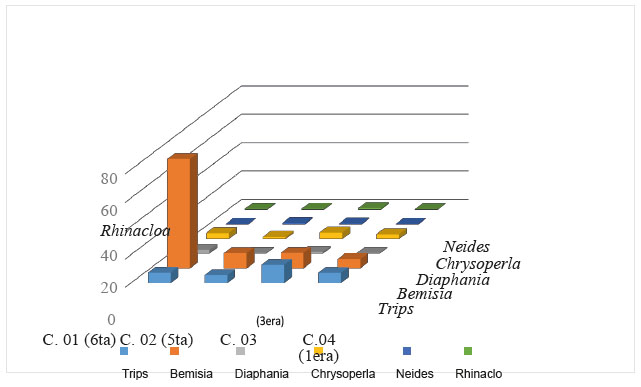
Se registraron los diferentes predadores en los diferentes cultivos de C. moschata Duch, en la figura 2 se muestran los principales predadores como son: Chrysoperla externa, Rhinacloa sp., Neides sp., Cicloneda sanguinea, Orius sp. donde Chrysoperla externa se encuentra en mayor proporción frente al demás predador es en todos los cultivos.
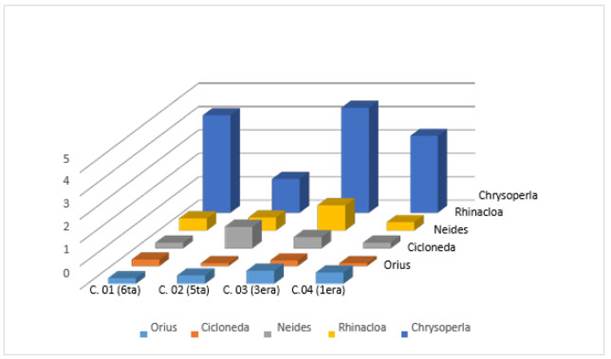
Figura 3 Fluctuación poblacional de los principales controladores encontrados en Cucurbita moschata Duch. En cuatro cultivos de diferentes etapas fenológicas.
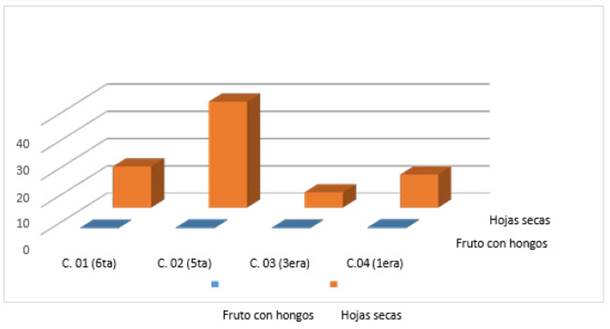
De igual manera se registraron el número de las hojas con signos de enfermedad, teniendo así, hojas con coloración marrón, con características polvorientas como ceniza, coloración amarillenta. Además, se registraron el número de frutos enfermos es decir que evidenciaban la colonización con hongos fitopatógenos estos presentaban colores como marrón, blanquecino, rosado, negro (Figura 4).
Fluctuación poblacional de insectos plagas comparadas con la cantidad de hongos fitopatógenos
Con los diferentes datos obtenidos se compararon las fluctuaciones poblacionales de los insectos plagas con mayor presencia como Thrips tabaci, Bemisia tabaci y Diaphania nitidalis con el número de hojas que presentan signos de estar atacados por hongos fitopatógenos (Figura 5), en esta figura se muestra hay diferencias radicales teniendo que Bemisia tabaci se presenta en mayor cantidad en comparación con el número de hojas atacadas por hongos fitopatógenos para el primer cultivo de la sexta cosecha, sin embargo, para el cultivo 02 de la quinta cosecha es al contrario, es decir, hay mayor número de hojas enfermas que numero de (B. tabaci) moscas blancas.
Fluctuación poblacional de insectos plagas comparadas con insectos predadores
Se compararon también, las fluctuaciones poblacionales de los insectos plagas con mayor presencia como: Thrips tabaci, Bemisia tabaci y Diaphania nitidalis con los insectos predadores con mayor presencia como, Crysoperla externa, Neides sp y Rhinacloa (Figura 6), en esta figura se muestra que es Chrysoperla externa la especie predadora con más presencia en todos los cuatro cultivos que tienen diferentes etapas fenológicas.
Discusión
Se encontró, que la plaga que más ataca al cultivo de “loche” es B. tabaci, donde dicho homóptero, familia Aleyrodidae, se encuentra principalmente en el envés de las hojas raspándolas, como lo reportan varios autores(Bernal & Medina, 2018; De Barro, Liu, Boykin, & Dinsdale, 2011; Oliveira, Henneberry, & Anderson, 2001), dicha plaga aumenta por malos manejos del cultivo, llegándose a poblaciones extremadas, además, se encontró que la presencia de Cicloneda sanguinea como predador de mayor incidencia frente a dicha plaga.
Thrips tabaci es un Thysanoptero plaga que ataca tanto a los brotes como a las flores, donde en flores puede causar los mayores daños acoplado a la presencia de plagas barrenadores de la flor (Sakimura, 1932). Diaphania nitidalis es una lepidóptero barrenador que ataca tanto a flores, tallos como a frutos (Valles, Capinera & Teal, 1991), siendo esta plaga la más perjudicial para el cultivo de C. moschata Duch ya que ataca directamente al fruto produciendo mayores pérdidas económicas.
En cuanto a Liriomyza huidobrensis se presenta en menor cantidad, referente a las anteriores, colocando sus larvas en las hojas, las cuales forman galerías, en las mismas, lo que disminuye la capacidad fotosintética de la planta(Weintraub & Horowitz, 1995).
En el caso de Diabrotica sp, el adulto perfora las hojas, y sus larvas se alimentan de raíces en especial en malezas como lo reporta Krysan, sin embargo, para certificar que también se le ha reportado como polinizador en menor grado, se le ha encontrado dentro de las flores succionando néctar, es decir, puede esta especie también jugar un rol importante como agente de polinización (Krysan, 1986). Entre los predadores con mayor densidad poblacional se ha encontrado a Chrysoperla externa, donde no solo el adulto Neuróptero, tiene carácter predador, sino además, las larvas presentan características muy voraces de acuerdo con varios autores(Albuquerque, Tauber & Tauber, 1994 Plant, 2007).
Además, se reporta la presencia de Rhinacloa sp. un mírido que tiene también características predadoras, al igual que Orius sp. y Neides sp, otro de los principales predadores que se reportan en este trabajo es Geocoris sp. que presenta características altamente voraces. Como se menciona anteriormente, Cicloneda sanguinea es un predador que tiene alta afinidad por B. tabaci, la “mosca blanca”, se ha encontrado en altas densidades relacionad a la presencia de dicha plaga en comparación con los otros predadores (Kajita, 1986).
Entre los hongos fitopatógenos encontrados, se reporta por primera vez a Cunninghamella spp, el cual es un hongo oportunista, que ataca a hojas, y sus colonias presentan coloración blanquecina, de aspecto seco, generalmente ataca por malos manejos de cultivo por ejemplo el exceso de humedad es un factor que aumenta el desarrollo de este hongo.
Además, se encontró a Colletotrichium sp, Memnoniella sp, que básicamente los síntomas más evidentes se dan en frutos deteriorándolos, produce la enfermedad denominada antracnosis, y necesita humedad y temperaturas de 24°C como condiciones óptimas. 16 además también se encontraron los hongos Fusarium sp, Alternaria sp.
Las hojas mostraron claras evidencias de la presencia mildiú polvoriento, donde los primeros síntomas de la enfermedad aparecen como manchas amarillas circulares que rápidamente cambian a blanco polvoso debido al crecimiento del hongo sobre la hoja, además, el hongo puede propagarse a los tallos causando defoliación de la planta, El mildiú polvoriento de las cucurbitáceas es causado por 2 especies de hongos, Erysiphe cichoracearum y Sphaerotheca fuliginea, donde este último prefiere temperaturas medias.
Bemisia tabaci ataca al cultivo de “loche”, ya que, en los cuatro cultivos analizados, se encontró causando raspaduras en el envés de las hojas. Thrips tabaci es una plaga que se presenta a lo largo de todo el cultivo y básicamente se ubica en los brotes más jóvenes, el daño es menor si no sobrepasa los 8 individuos/brote. Diaphania nitidalis, esta es la plaga que ocasiona mayor daño, ya que es un insecto barrenador que ataca al fruto, tallos y flores. Entre los controladores más comunes tenemos a Chrysoperla externa, Rhinacloa sp., Neides sp., Orius sp. y Cicloneda sanguinea. Entre los hongos fitopatógenos encontrados Cunninghamella spp., Colletotrichium sp., Memnoniella sp., Verticillium sp., Cladosporium sp., Stemphylium sp.












 uBio
uBio