Introducción
Zea mays L. var. canteño (Poaceae) “maíz morado”, es considerado una raza incipiente de maíz, utilizado de forma ancestral como una fuente de pigmentos y con capacidad antioxidante (Salvador-Reyes & Clerici, 2020). Su producción se ha incrementado en los últimos años, alcanzando 21 357 tn en un área de 3 883 ha según el MINAGRI (2017). Habiéndose desarrollado bebidas naturales para aprovechar sus capacidades nutricionales (Vásquez et al., 2014). Los nutrientes de esta planta han sido estudiados por Somavat et al. (2016), quienes reportan que el maíz morado tiene una cantidad de almidón más baja (63,4%) que el maíz amarillo (75,2%). Las antocianinas presentes en el maíz morado tienen alta capacidad antioxidante en contraste con el ácido gálico y ácido ascórbico, la cual se mantiene sobre los 30 frente a la exposición a 90% 2,2-difenil-1-picrilhidracilo (DPPH), un radical estable (Quispe et al., 2011). Este cultivo tiene afinidad por climas cálidos y secos, creciendo a altitudes medianas, cerca de los 2 000 msnm, principalmente en las regiones de la costa como Lambayeque, La Libertad, Ancash, Lima, Ica, Arequipa, Huánuco, Junín, y Apurímac (Salvador-Reyes & Clerici, 2020). En estas áreas existe predominio de suelos pobres en componentes orgánicos, con cantidades elevadas de sales y constantemente sometidos a estrés hídrico. En estas condiciones de estrés abiótico, la nutrición mineral puede incrementar la productividad de diferentes cultivos, como yuca, camote y maíz (Morales et al., 2018). En maíz morado, en efecto se ha observado que la aplicación de nutrientes como nitrógeno (N), puede inducir mejoras significativas en el crecimiento y desarrollo (Huallpa, 2019). Sin embargo, la adición de fósforo (P), no parece tener un efecto significativo sobre el crecimiento y rendimiento de maíz morado (Huallpa, 2019). Teniendo en cuenta que la absorción de P está relacionada con el desarrollo radicular e incremento de los componentes de rendimiento en maíz amarillo (Torres, 2015), los hallazgos reportados por Huallpa (2019), parecen deberse a problemas de absorción y la poca movilidad de P. En contraste, la aplicación de fertilizantes y bioestimulantes orgánicos son capaces de inducir mejoras sustanciales en el rendimiento de “maíz morado” (Bautista & Hernandez, 2019).
La estrategia de fertilización mineral vegetal puede ser implementada con la utilización de microorganismos benéficos como Rhizophagus irregularis, que permiten la absorción óptima de nutrientes incluso en condiciones desfavorables (Hidalgo et al., 2014). Este microorganismo es un hongo micorrícico arbuscular (HMA), perteneciente al filo Glomeromycota, siendo un simbionte obligado, que vive en asociación con más del 70% de las especies vegetales (Bundrett & Tedersoo, 2018). Estos microorganismos son capaces de absorber diferentes nutrientes minerales en intercambio por carbono y lípidos, y además pueden incrementar la resistencia de las plantas a factores de estrés biótico y abiótico (Chen et al., 2018). Entre los cultivos colonizados por este HMA se encuentra el maíz amarillo (Z. mays subsp. mays L.), que al ser colonizado mejora la arquitectura radicular, incrementa la biomasa y aumenta el contenido de elementos (N, P, K, Ca, Mg, S y Sr) y microelementos (Ramírez-Flores et al., 2019). En este tipo de maíz, los HMA también son capaces de aliviar el estrés relacionado al cadmio (Cd) y plomo (Pb) en condiciones de suelos calcáreos (Abou & Abo, 2020). Recientemente, Fasusi et al, (2021) han demostrado que la inoculación con diferentes HMA, es capaz de aumentar el diámetro de tallo, la longitud de tallo, el área foliar, el largo de la hoja, la tasa fotosintética, la colonización radicular y el número de esporas producidas en las raíces de la variedad Nelson Choice de maíz, lo cual hace que este cultivo sea óptimo para la multiplicación de HMAs. La asociación de micorrícica puede ser mantenida en sistemas a largo plazo, tal como lo demostró el estudio de Subramanian et al, (2019) en maíz amarillo.
Teniendo la asociación de R. irregularis con otras variedades de maíz y que se ha demostrado su asociación con diversos cultivos como sacha inchi, tomate, frijol y papaya (Hidalgo et al., 2014; Ramos et al., 2021; Hidalgo et al., 2019; Hidalgo et al., 2021), este HMA puede ser una gran alternativa para el cultivo de maíz morado. Sin embargo, la asociación de R. irregularis con maíz morado aún no ha sido estudiada, por lo cual el objetivo de este trabajo fue determinar el crecimiento y el porcentaje de micorrización en plantas de Z. mays L. var. canteño “maíz morado” inoculadas con diferentes cantidades de inóculo de R. irregularis a los 28, 35 y 42 días de crecimiento en condiciones de invernadero.
Materiales y métodos
Localización del estudio
El trabajo fue realizado en el Invernadero del Jardín Botánico de la Universidad Nacional de Trujillo, Trujillo, Perú, cuya ubicación geográfica es -8.114816208815618 de Latitud Sur y -79.03832626053867 de Longitud Oeste y a una altitud de 20 m.s.n.m., con una humedad relativa promedio de 80% y una temperatura de 21+-3°C.
Material biológico
Las semillas de Z. mays L. var. canteño fueron donadas por el Programa de Investigación y Proyección Social en Maíz de la Universidad Nacional Agraria La Molina. Lima, Perú.
El inóculo de R. irregularis, fue obtenido a partir del producto comercial AEGIS Micro Gránulo, donado por la empresa ATENS Agrotecnologías Naturales, S.L. Tarragona, España.
Germinación
Se seleccionaron semillas homogéneas, las cuales fueron desinfectadas con hipoclorito de sodio comercial al 2% durante 10 minutos. Luego, se enjuagó con agua destilada. Las semillas fueron germinadas en bandejas de Tecnopor con papel toalla absorbente. Se colocaron 20 semillas en cada bandeja, se agregó agua destilada y el sistema fue colocado en oscuridad hasta la germinación.
Sustrato
Se utilizó como sustrato una mezcla de arena de río y musgo en proporción 1:1. La arena de río fue cernida con un tamiz para homogeneizar su textura, después fue lavada con agua corriente por 8 horas para eliminar impurezas, tras lo cual se esterilizó en la estufa a 200° C, durante 3 horas, para eliminar los agentes patógenos. Luego, la arena fue mezclada con el musgo y el sustrato obtenido fue colocado en bolsas de polietileno de 3 kg. de capacidad.
Tratamientos
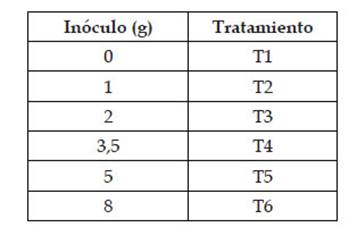
A los 7 días de germinación, se seleccionaron las plántulas de acuerdo a su homogeneidad en relación a tamaño de brote y raíz. Las plántulas fueron distribuidas en 6 grupos de forma aleatoria. En cada bolsa se realizó un orificio de 5cm de diámetro en el sustrato, en el cual se agregaron las diferentes cantidades de inóculo: 0, 1, 2, 3.5, 5 y 8 g del producto AEGIS Sym Microgránulo, utilizadas como tratamientos (Cuadro 1). Luego, se trasplantaron las plántulas asegurando el contacto de las raíces y los HMA. Las plántulas fueron regadas con la solución nutritiva La Molina.
Cuadro 1 Tratamientos según las cantidades de inóculo de R. irregularis aplicados a Z. mays L. var. canteño.
Evaluación
Las plantas fueron evaluadas a los 28, 35 y 42 días para medir la longitud de tallo, longitud de raíz, porcentaje de micorrización.
- Longitud de tallo
La longitud del tallo se determinó considerando la distancia entre el cuello y la yema radicular de la planta.
- Longitud de raíz
La longitud de raíz se determinó considerando la distancia entre el cuello y la yema apical de la planta.
- Porcentaje de micorrización
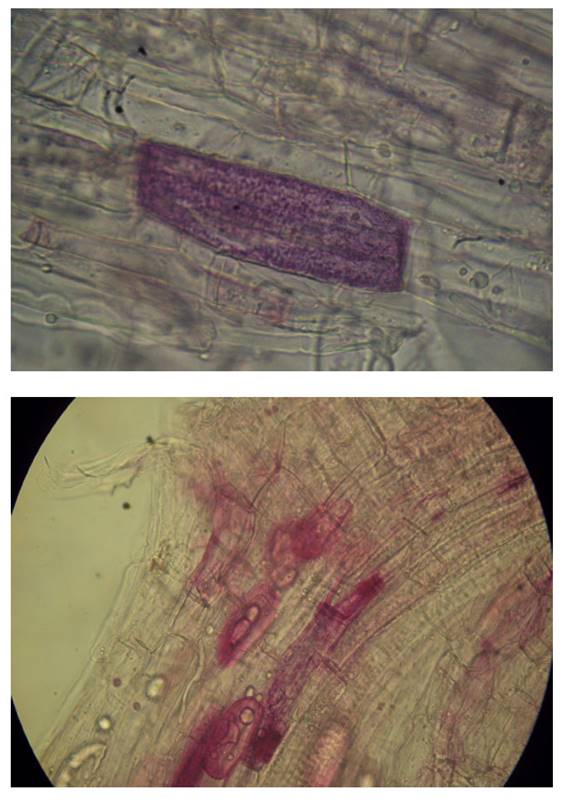
Para estimar el porcentaje de micorrización se utilizó el método de la Observación Microscópica de Phillips y Hayman (1970), dicho método consiste en la evaluación de hifas, arbúsculos, vesículas y esporas de R. irregularis en segmentos de 1 cm. de raicillas previamente coloreadas, con el método de los mismos autores y utilizando la fórmula descrita por Ferrera (1993).
%MI= (SI/SO)x100
%MI: Porcentaje de micorrización.
SI: Número de segmentos infectados.
SO: Número de segmentos observados.
Análisis de datos
Cada unidad muestral estuvo constituida por una bolsa conteniendo una planta de maíz. Cada tratamiento contó con tres repeticiones. Las plantas fueron cosechadas a los 28, 35 y 42 días para obtener los resultados. Luego, el análisis de los datos se realizó utilizando el software estadístico Minitab® 19.1. Se realizó el análisis de varianza (ANOVA) y la prueba comparación de medias de Tukey HSD. Además, se midió el índice de correlación entre la cantidad de inóculo, el porcentaje de micorrización y la longitud de tallos y raíces.
Resultados
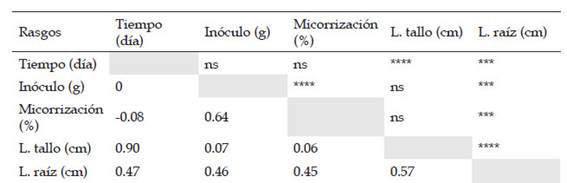
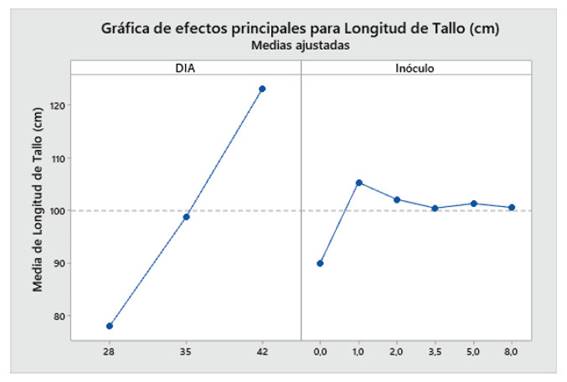
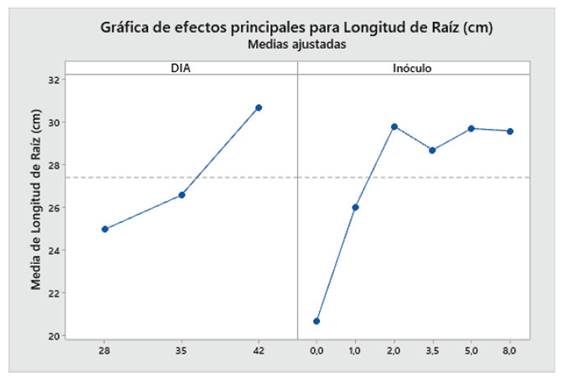
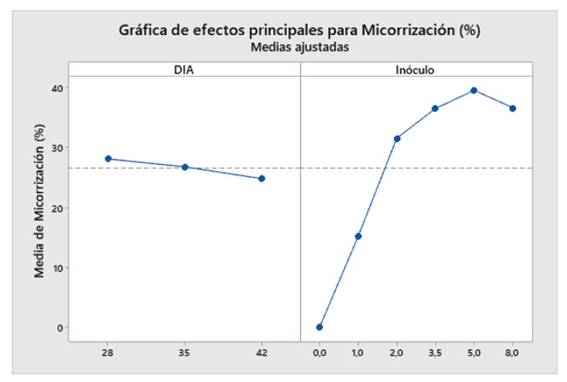
Los resultados revelaron que en el “maíz” var. canteño, el tiempo y la cantidad de inóculo, así como la interacción de estas variables independientes afectaron a las variables dependientes de crecimiento de longitud de tallo y raíz. Mientras que solo el factor inóculo indujo diferencias estadísticamente significativas en el porcentaje de micorrización (Tabla 1). En base a ello, la cantidad de inóculo de R. irregularis generó un incremento significativo en la longitud de tallo, raíz y en el porcentaje de micorrización. Por otro lado, el factor tiempo incrementó de forma significativa la longitud de tallo y la longitud de raíz, sin embargo, no afectó el porcentaje de micorrización. Además, se pudo observar que existe una posible relación positiva entre el tiempo con la longitud de tallo y raíz y quizás este mismo factor se asocia de forma inversa con el porcentaje de micorrización (Tabla 1).
Tabla 1 Análisis factorial del efecto de la cantidad de inóculo y tiempo sobre el porcentaje de micorrización de Z. mays L. var. canteño tratado con diferentes cantidades de inóculo de R. irregularis.
| Fuente de variación | Longitud del tallo | Longitud de raíz | Micorrización (%) |
| (cm) | (cm) | ||
| A: Inóculo (g) | |||
| 0 | 89.89b | 20.67b | 0c |
| 1 | 105.33a | 26.00a | 15.12bc |
| 2 | 102.11a | 29.79a | 31.56ab |
| 3.5 | 100.44a | 28.67a | 36.50a |
| 5 | 101.33b | 29.67a | 39.51a |
| 8 | 100.56c | 29.56a | 36.63a |
| B: Tiempo (días) | |||
| 28 | 77.94c | 24.94b | 28.09a |
| 35 | 98.72b | 26.56b | 26.78a |
| 42 | 123.17a | 30.67a | 24.82a |
| ANOVA | |||
| A | **** | **** | **** |
| B | **** | **** | **** |
| AB | *** | * | ns |
| CV (%) | 6.38 | 10.00 | 25.93 |
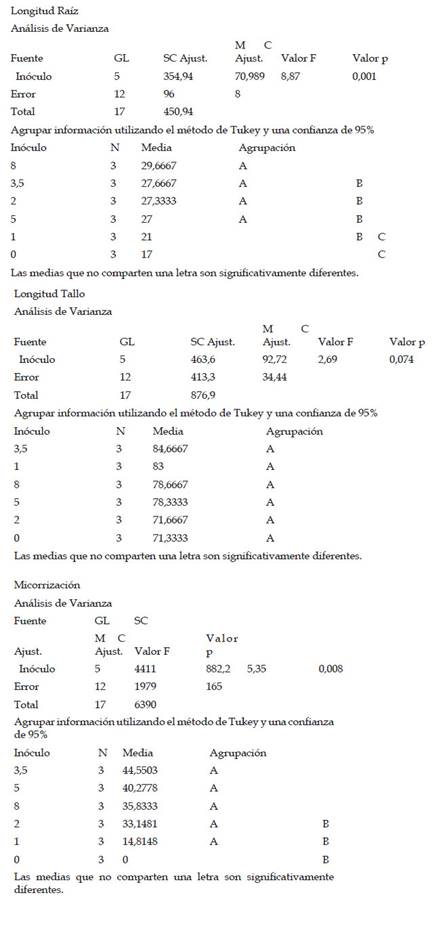
Las plantas de maíz var. Canteño fueron inoculadas con diferentes cantidades de inóculo de R. irregularis (0, 1, 2, 3.5, 5 y 8 gr.) evaluándose a diferentes tiempos (28, 35 y 42 días después de la inoculación) como se puede apreciar en la Fig. 1. Se puede observar que hay una relación inversamente proporcional entre el porcentaje de micorrización y el período de días después de la inoculación, por lo cual en el período de 28 días obtenemos más altos de manera general en todos los tratamientos: 0, 14.8, 33.1, 44.6, 40.3 y 35.8%; en contraste, observamos los menores valores del porcentaje de micorrización a los 42 días con medias de: 0, 16.7, 29.8, 29, 40.2 y 33.2% aunque no se aprecie diferencias significativas entre las medias de ambos como se nota en las letras que se observan en la gráfica (a y b). Sin embargo, el tiempo después de la inoculación no es el único factor que influye sobre el porcentaje de micorrización puesto que también contamos con las diferentes cantidades del inóculo, se observa que dicho factor no presenta un comportamiento uniforme con respecto a esta variable, pero podemos notar que principalmente la cantidad de inóculo correspondiente a valores intermedios como 2, 3.5 y 5 gramos puede generar valores más altos de porcentaje de micorrización como 44.6, 35.9 y 29% así como 40.3, 38.1 y 40.2 %, respectivamente. Por el contrario, la cantidad de 1 gramo de inóculo generó los valores más bajos, con: 14.8, 14.1 y 16.7%, que no mostraron diferencias significativas en comparación con el control sin inocular, por lo cual se puede considerar que las cantidades bajas de inóculo no serán suficientes para inducir una adecuada micorrización.
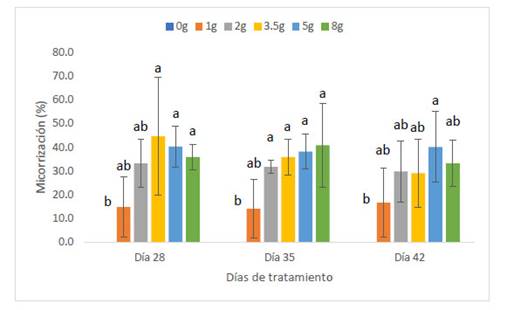
Fig. 1 Porcentaje de micorrización de Z. mays L. var. Canteño tratado con diferentes cantidades de inóculo de R. irregularis. Letras diferentes (a, b) indican diferencias significativas según Tukey HSD; barras verticales indican la desviación estándar.
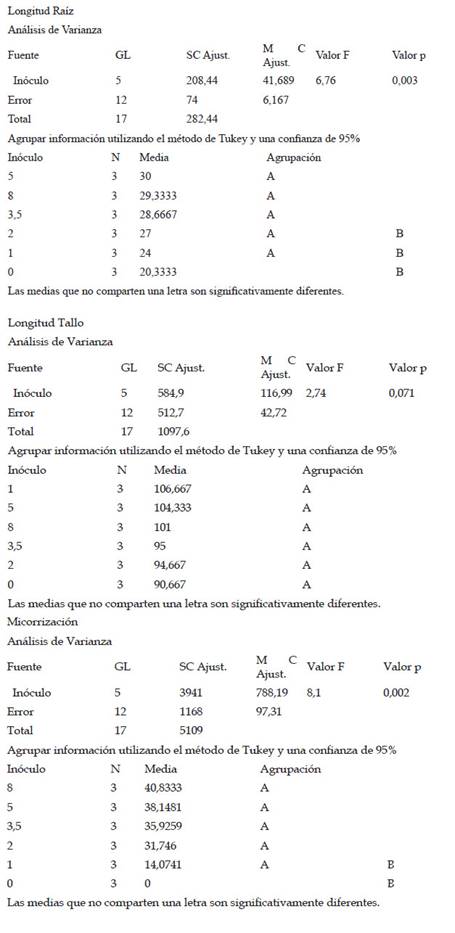
La longitud de raíz de las plantas de maíz (Z. mays L.) var. canteño expuestas a diferentes cantidades de inóculo de micorrizas de R. irregularis y tiempos de exposición evidenciaron diferencias significativas (p <0.05), como se puede apreciar en la Fig. 2. El tiempo de exposición tuvo una relación directamente proporcional sobre la variable en estudio. Es así que se obtuvieron los valores más bajos de longitud de raíz (17, 21, 27.3, 27.7, 27 y 29.7 cm) a los 28 días, en los cuales el tratamiento con 8 g de inóculo mostró valores estadísticamente similares a los tratamientos con 2, 3.5 y 5 g de inóculo, en tanto que indujo diferencias significativas con respecto a los tratamientos con 1g de inóculo y con respecto al control. En contraste, los valores mayores de longitud de raíz con: 24.7, 33, 35, 29.7, 32 y 29.7 cm fueron alcanzados a los 42 días, encontrándose diferencias significativas en las plantas que tratadas con 1 y 2g de inóculo, las cuales mostraron mayores valores de longitud de raíz según la prueba de Tukey HSD en contraste con los demás tratamientos, incluyendo el control. Aunque el comportamiento del factor cantidad de inóculo sobre la longitud de raíz no presenta un comportamiento que se pueda definir como directa o inversamente proporcional podemos notar que el valor máximo de longitud de raíz se obtuvo a la cantidad de 2 gramos de inóculo con un tiempo de exposición de 42 días, siendo estadísticamente superior a los valores obtenidos por el control sin micorrizas.
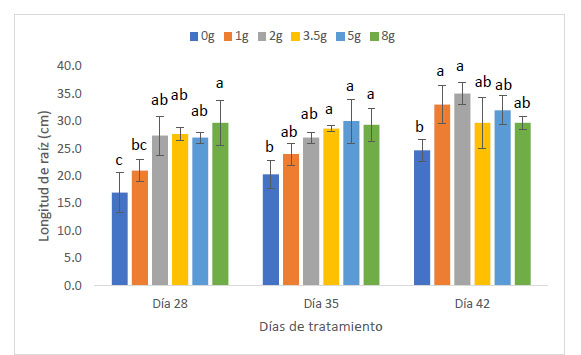
Fig. 2 Longitud de raíz de Z. mays L. var. Canteño tratado con diferentes cantidades de inóculo de R. irregularis. Letras diferentes (a, b, c) indican diferencias significativas según Tukey HSD; barras verticales indican la desviación estándar.
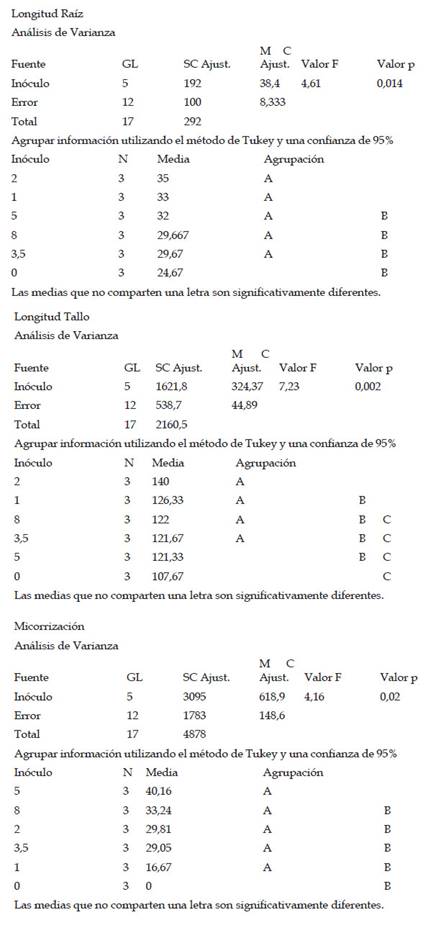
Con respecto a la longitud de tallo (cm), Las plantas de maíz (Z. mays L.) var. Canteño inoculadas con el HMA R. irregularis expuestas a diferentes tiempos de exposición y cantidades de las micorrizas presentaron diferencias significativas (p <0.05), tal como se aprecia en la Fig. 3. Para los tratamientos del día 28, 35 y 42 días de exposición se puede apreciar que existe una relación directa entre el tiempo de exposición y la longitud de tallo. Es así que se obtuvo los valores más bajos para los 28 días de exposición con 71.3, 83, 71.7, 84.7, 78.3 y 78.7 cm para las mismas cantidades de micorriza respectivamente, en este punto, todos los tratamientos mostraron longitud de tallo similar, sin observarse diferencias estadísticas inducidas por diferentes cantidades de inóculo. Los mismos resultados fueron observados al realizar la evaluación a los 35 días de tratamiento, en que también hay ausencia de diferencias estadísticamente significativas entre tratamientos. Esto contrasta con los resultados observados a los 42 días de tratamiento, en donde se pudieron observar diferencias estadísticas inducidas por las diferentes cantidades de inóculo, encontrándose los vales de 107.7, 126.3, 140, 121.7, 121.3 y 122 cm para las cantidades de 0, 1, 2, 3.5, 5 y 8 g de HMA respectivamente. En esta evaluación, se pudo observar diferencias significativas en la longitud de tallo de las plantas control, con respecto a las que recibieron 1 y 2 g de inóculo. Asimismo, las plantas tratadas con 3.5, 5 y 8 g de inóculo, no mostraron diferencias significativas con respecto a las plantas control, para longitud de tallo. En ese sentido, con respecto al factor cantidad de inóculo se observó que el valor más alto obtenido de la longitud de tallo fue de 140 cm. con 42 días de exposición y 2 gramos de micorrizas, así como se encontró el valor más bajo siendo 71.3 cm. a 28 días de exposición y 0 gramos.
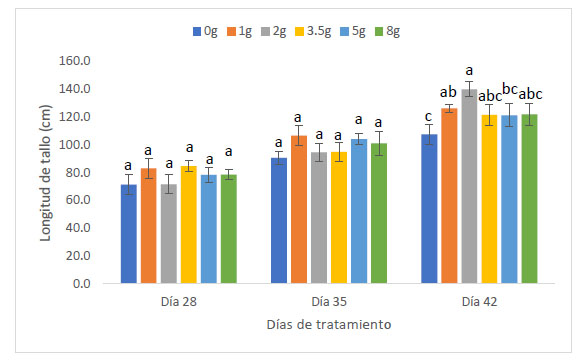
Fig. 3 Longitud de tallo de Z. mays L. var. Canteño tratado con diferentes cantidades de inóculo de R. irregularis. Letras diferentes (a, b, c) indican diferencias significativas según Tukey HSD; barras verticales indican la desviación estándar.
Para robustecer el análisis de correlación se incluyó a los factores número de días y cantidad de inóculo como variables de estudio (Tabla 2). Teniendo en cuenta esto, se encontró que la correlación entre la longitud de raíz con el número de días (0.47), la cantidad de inóculo (0.46), el porcentaje de micorrización (0.45) y la longitud de tallo (0.57) mostró valores estadísticamente significativos. Mientras que este mismo comportamiento se observó entre las variables longitud de tallo con el número de días y el porcentaje de micorrización con la cantidad de inóculo, ya que presentaron una correlación de Pearson de 0.90 y 0.64, respectivamente. En contraste, la correlación entre la longitud de tallo, la cantidad de inóculo y el porcentaje de micorrización no fue significativa.
Discusión
En Z. mays L. var. canteño, la cantidad de inóculo y tiempo afectaron de forma positiva la longitud de la raíz y del tallo, observándose un aumento del tamaño con la aplicación del inoculo en el tiempo (Tabla 1). Este comportamiento fue similar a lo reportado en maíz por Ramírez-Flores et al, (2019) y Renaut et al, (2020) para la raíz y para la longitud del tallo por Rasouli et al (2019). El incremento de la longitud del tallo y la raíz podría deberse a la movilización de los nutrientes de las hifas de R. irregularis por las células radiculares a fin mantener la homeostasis iónica tanto en la raíz como en el tallo, y con ello favorecer el crecimiento y desarrollo de ambos órganos (Izco 2004, Fundadora 2008 e Hidalgo-Rodríguez et al., 2019). Por otro lado, la tabla 1 reveló que el porcentaje de micorrización solo fue afectado de forma favorable por la aplicación de R. irregularis en Z. mays L. var. canteño. Esto puede deberse a la habilidad que tiene el maíz en establecer una eficiente relación simbiótica con R. irregularis (Ávila-Peralta et al., 2015).
La inoculación con R. irregularis logró distintos valores de porcentaje de micorrización dependiendo de factores como la cantidad y tiempos de exposición. En ese sentido, estudios relacionados hacen mención que se puede obtener diferentes porcentajes en plantas expuestas a R. irregularis lo que coincide con los resultados de Ramírez-Flores et al, (2019). De igual manera, se obtuvieron diferentes resultados en el porcentaje de colonización de micorrizas en otras investigaciones como la realizada por Maitra et al, (2021), quienes buscaron mejorar el porcentaje de micorrización utilizando diferentes tamaños de partículas de arena. El porcentaje de micorrización resulta ser una variable relevante para el estudio del efecto de las micorrizas y su interacción con el desarrollo fisiológico de las plantas, puesto que a mayor porcentaje se espera también una mayor cantidad de micorrizas relacionándose con su hospedero y logrando a su vez un mayor efecto promotor del crecimiento, las respuestas diferentes a la micorrización también se pueden deber a los diferentes genotipos de las plantas (Fasusi et al., 2021, Chu et al., 2013, Maitra et al., 2021 y Ramírez-Flores et al., 2019).
Los resultados obtenidos para la longitud de raíz de Z. mays var. canteño evidencian que las micorrizas son capaces de incrementar el crecimiento de las plantas como se ubica en la Fig. 2, lo cual coincide con los resultados de la investigación realizada por Liu et al, (2015) con la especie vegetal de Populus sp., utilizando la misma micorriza. Esto último se puede deber a que las micorrizas han promovido mejoras en la nutrición mineral de las plantas, lo cual ayuda a aumentar el valor de la longitud de raíz debido a que mejora el transporte de nutrientes minerales como el P que promueve el crecimiento de la raíz de las plantas, eso a su vez mejora también el crecimiento de las mismas lo que logra una modificación completa de la arquitectura como fue señalado en las investigaciones de Ramírez-Flores et al, en el 2019. Los resultados observados para esta variable también coinciden con lo encontrado en la investigación de Chu et al. en el 2013, donde también se encontró un incremento de la longitud de raíz como respuesta a la inoculación de las micorrizas lo cual puede deberse a que el P es un nutriente capaz de estimular el desarrollo radicular. Adicionalmente, Cattani et al, en el 2015 reportó que hubo un incremento significativo en la longitud de raíz para maíz inoculado con R. irregularis, lo que indica que la influencia sobre la nutrición mineral es la causante del incremento de la longitud de raíz (Cattani et al., 2015, Chu et al., 2013, Liu et al., 2015 y Ramírez-Flores et al., 2019).
También, pudo observarse que las plantas inoculadas con R. irregularis de Z. mays var. canteño, presentaron un incremento con respecto al promedio de la longitud del tallo, en contraste con las plantas que no recibieron las HMA. Esto coincide con lo reportado por Liu et al. (2015) para la misma variable en Populus sp., lo cual se puede atribuir a la mejora en los sistemas de absorción de nutrientes, relacionado con la mejora en la captación y transporte de K+, así como en la mejora del transporte de agua lo cual también promueve al desarrollo de la raíz. De la misma forma, en la investigación de Shang et al, (2018) se obtuvieron resultados similares en Gossypium hirsutum “algodonero” inoculado con R. irregularis e infectadas con Verticillium, a pesar de que las plantas estaban enfermas su crecimiento de tallo se incrementó con el uso de las HMA. Obteniéndose aumento en el crecimiento de las plantas, relacionado de forma directamente proporcional con la relación simbiótica entre las micorrizas y las plantas. Resultados similares en el crecimiento fueron observados en la investigación de Molina et al, en el 2021, en Glycine max “soya” inoculadas con micorrizas.
En base al análisis de correlación (Cuadro 2), el número de días y la cantidad de inoculo se asocian directamente con la longitud de tallo, raíz y el porcentaje de micorrización, demostrando que en Z. mays L. var. canteño, a mayor sea la cantidad de inoculo, mayor es la capacidad adaptativa de este cultivo a lo largo del tiempo, coincidiendo con Le Pioufle et al (2019). La alta afinidad que tiene este HMA con el maíz permite que el porcentaje de micorrización aumente con la cantidad de inóculo de R. irregularis (Ávila-Peralta et al., 2015). Asimismo, este comportamiento junto con el eficiente rol que cumplen las hifas de R. irregularis en la toma de iones en la rizosfera y al interior de la raíz como reservorios de nutrientes biodisponibles (Pandey et al., 2017 y Hu et al., 2019) contribuyen a mantener la homeostasis iónica a nivel de raíz y tallo, expresándose una mayor longitud de estos órganos.
Conclusiones
La inoculación con diferentes cantidades de inóculo de R. irregularis, produce incrementos en el porcentaje de micorrización y longitud de tallo y raíz en plantas de Z. mays L. var. canteño “maíz morado” inoculadas con diferentes cantidades de inóculo de R. irregularis a los 28, 35 y 42 días de crecimiento en condiciones de invernadero.
La longitud de tallo y raíz de Z. mays var. canteño “maíz morado”, a los 42 días de crecimiento, alcanzan sus valores más altos al ser inoculados con 2g de inóculo de R. irregularis.
El tratamiento con 5g de inóculo de R. irregularis induce el mayor porcentaje de micorrización en raíces de Z. mays var. canteño “maíz morado”.












 uBio
uBio