Introducción
En muchas áreas del mundo dedicadas a la agricultura y a la obtención de buenos rendimientos, además de poder cultivar una amplia variedad de especies, cada vez está teniendo más restricciones debido a la salinidad de los suelos (Goykovic & Saavedra, 2007). La salinidad engloba distintos procesos. Se puede distinguir la salinidad primaria o natural, debida a cambios climáticos, cambios geomorfológicos de sedimentación o erosión, o cambios en la hidrología superficial y subterránea; y la salinidad secundaria, debida principalmente al exceso de riego sin la instalación de sistemas de drenaje adecuados, o la sobreexplotación de los acuíferos (Camejo et al., 2000; Belinchón, 2020).
La salinidad, por lo tanto, es un estrés abiótico complejo que simultáneamente presenta componentes osmóticos e iónicos (Dell’Amico & Parra, 2005; Sam et al., 2003). Por ello, una concentración elevada de sales en el medio radical afecta negativamente el desarrollo de la planta, debido fundamentalmente a los efectos hiperosmóticos e hiperiónicos del estrés (Yeo, 1998). Además del componente hiperosmótico y oxidativo, también aparece un componente de toxicidad iónica, debida a la elevada concentración de elementos (Na+, Cl-), que pueden interferir con el metabolismo celular (Amini et al., 2007; Belinchón, 2020). Así, el aumento de Na+ inhibe la absorción de otros nutrientes al interferir con varios transportadores de membrana, como los canales selectivos de iones K+ (Farooq et al., 2017). En consecuencia, estos estreses abióticos producen diversos efectos, desde la reducción del crecimiento y la turgencia, hasta la pérdida de la estructura celular por inhibición de la actividad enzimática y el desequilibrio de las membranas (Gallaharsh et al., 2020; Vijayan, 2009).
A nivel mundial un bajo número de hortalizas presentan una alta demanda de consumo. Un cultivo representativo es el “tomate” (S. lycopersicum L.), su importancia radica en sus cualidades para integrarse en la preparación de alimentos (Higinio et al., 2014; Mujica et al., 2014). Las plantas de tomate que crecen en condiciones salinas, presentan disminución en la capacidad fotosintética (Fita et al., 2015), frutos de menor tamaño y peso (Saldaña et al., 2017) y se producen alteraciones en la síntesis de proteínas por modificaciones en la expresión de genes, como consecuencia de los excesos de sal (Fita et al., 2015). Cuando se somete el cultivo de tomate a condiciones salinas, las plantas pueden alcanzar alturas menores, disminución en el número de hojas y menor área foliar (Goykovic & Saavedra, 2007).
Para atenuar el efecto adverso de las sales en el desarrollo del cultivo del tomate existe una serie de prácticas agronómicas posibles de implementar, tales como la inoculación con micorrizas (Martínez et al., 2004; Goykovic & Saavedra, 2007). El principal aporte de la simbiosis a la tolerancia al estrés salino es su participación en la disminución de la toxicidad iónica (Belinchón, 2020). En este sentido, la existencia de transportadores que previenen la entrada de Na+ en la raíz, su exportación al exterior celular, y su compartimentación en la vacuola son esenciales (Chávez & González, 2009). Asimismo, diversos estudios han demostrado que la simbiosis en plantas sometidas a estrés salino participa en una mayor absorción de nutrientes, cambios en la acumulación de compuestos osmorreguladores, una mejora en las relaciones hídricas, o un aumento en la tasa fotosintética (Porcel et al., 2012; Torres et al., 2019; Soria-Colunga et al., 2010). Además, hay estudios que demuestran que las plantas sometidas a estrés salino e inoculadas con hongos micorrízicos arbusculares presentan un incremento significativo en la cantidad de biomasa y producción de fruto (Hidalgo et al., 2019; Abdel-Farid et al., 2020; Hegazi et al., 2017; Mohammad & Mittra, 2013). En relación a lo expuesto, el objetivo general de la investigación fue determinar el efecto de NaCl y R. irregularis sobre el crecimiento de plántulas de tomate (S. lycopersicum L.) en condiciones de invernadero.
Materiales y métodos
a) Material biológico
El trabajo fue realizado en el Invernadero del Jardín Botánico de la Universidad Nacional de Trujillo.
Para el estudio se utilizaron plántulas de tomate (S. lycopersicum L.) var. Río Grande de 15 días de germinadas obtenidas a partir de semillas certificadas, las cuales fueron colocadas en un sistema de germinación que consistió en recipientes de tecnopor con papel toalla absorbente como base.
La micorrización se realizó utilizando el inóculo de R. irregularis, el cual se obtuvo del producto comercial AEGIS Micro Gránulo, donado por la empresa ATENS Agrotecnologías Naturales, S.L. Tarragona, España (100 esporas/g).
b) Tratamientos
Se seleccionaron 90 plántulas, las cuales fueron distribuidas aleatoriamente en 9 grupos. El sustrato estaba constituido por arena de río y musgo. La arena de río fue cernida con un tamiz para homogeneizar su textura, después fue lavada con agua corriente por 8 horas para eliminar impurezas, tras lo cual se esterilizó en la estufa a 200° C, durante 3 horas, para eliminar los agentes patógenos. Luego, la arena fue mezclada con el musgo en proporción 1:1. El sustrato obtenido fue colocado en recipientes de polietileno de 1000 ml de capacidad.
Para realizar la inoculación, en los recipientes con sustrato se hizo un orificio de aproximadamente 3 cm de diámetro, para recibir a las plántulas. A continuación, se agregó a dicho orificio el inóculo de R. irregularis, de manera que las raíces estuvieron en contacto con el Hongo Micorrizico Arbuscular (HMA), según cada tratamiento (Cuadro 1).
Bajo condiciones de invernadero a una temperatura promedio de 25 ± 2°C y humedad relativa de 75 ± 2%, las plantas crecieron por 15 días y fueron regadas con la solución nutritiva La Molina de 2 a 3 veces por semana. Transcurrido ese tiempo, las plantas fueron sometidas a estrés salino, para lo cual éstas fueron regadas con solución nutritiva y NaCl que generen concentraciones de 0, 100 y 200 mM por un periodo de 30 días, tal como se indica en el Cuadro 1.
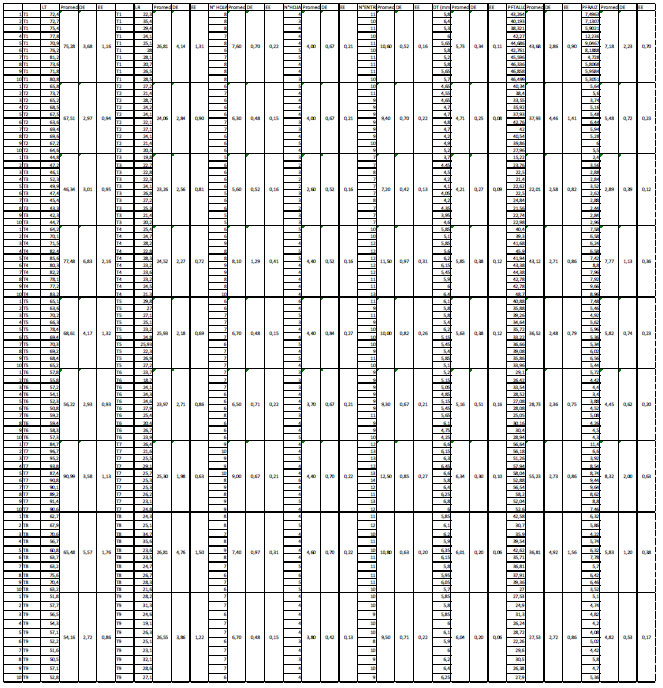
Cuadro 1 Tratamientos según cantidades de inóculo (g) de R. irregularis y concentraciones de NaCl (mM).
| Cantidad de inóculo (g) | |||
| NaCl (mM) | 0 | 1.5 | 3 |
| 0 | T1 | T4 | T7 |
| 100 | T2 | T5 | T8 |
| 200 | T3 | T6 | T9 |
c) Variables evaluadas
Después de 30 días de tratamiento, las plantas fueron evaluadas para determinar la longitud de tallo y de raíz, número de hojas frescas y hojas marchitas, número de entrenudos, diámetro del tallo, peso fresco de tallo y de raíz.
Longitud de tallo
Se determinó considerando la distancia entre el cuello y la yema apical de la planta, utilizando una regla milimetrada de 60 cm.
Longitud de raíz
Se determinó la longitud de raíz teniendo en cuenta la medida desde el cuello de la planta hasta el ápice de la raíz principal, utilizando una regla milimetrada de 60 cm.
Número de hojas frescas y hojas marchitas
Para evaluar el número de hojas frescas y marchitas, se realizó el conteo directo de las mismas.
Diámetro de tallo
El diámetro se midió en la parte media de este órgano, utilizando un Vernier de 0.05 mm de precisión.
Peso fresco
El peso fresco se determinó en tallo y raíz. Estos órganos fueron separados a la altura del cuello y ambos fueron inmediatamente pesados en una balanza analítica.
d) Análisis de datos
Una vez obtenidos los resultados, fueron ordenados en tablas y gráficos y se analizaron estadísticamente, para determinar si existen diferencias significativas entre tratamientos, mediante el análisis de varianza y la prueba de comparación múltiple Tukey HSD.
Resultados
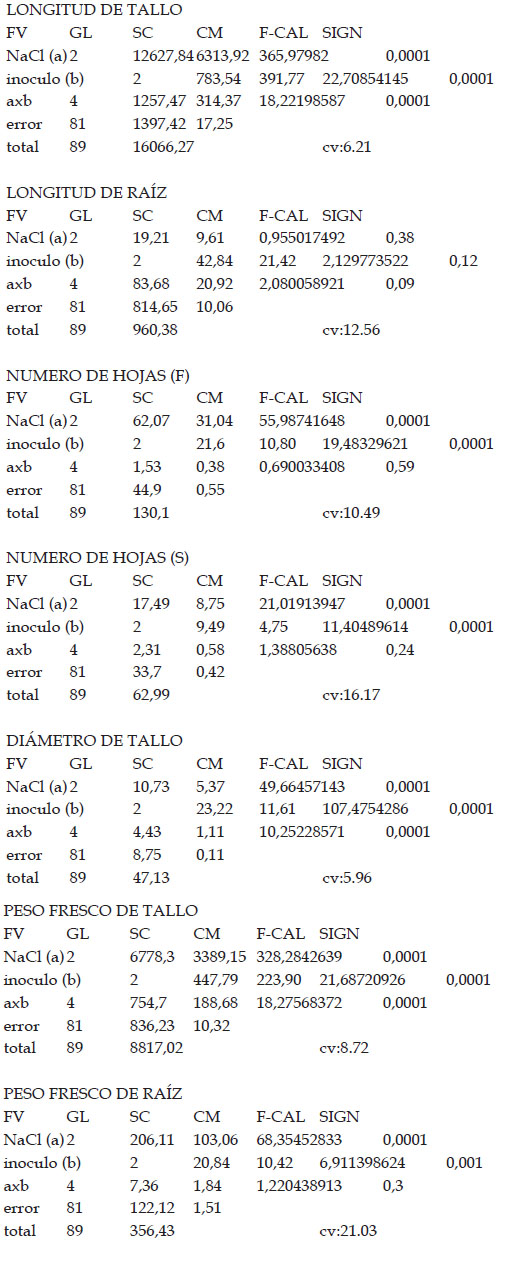
Los resultados muestran que los tratamientos indujeron diferencias estadísticamente significativas en las variables de crecimiento tomadas en cuenta en este trabajo. En efecto, al observar los efectos principales de los factores NaCl y cantidad de inóculo, se observan diferencias con respecto a longitud de tallo, número de hojas, número de entrenudos, diámetro de tallo, peso fresco de tallo y peso fresco de raíz. Con respecto a salinidad, las diferencias observadas incluyen una reducción de las diferentes variables a medida que la salinidad se incrementó, salvo la longitud de raíz, tal como se puede observar en la Tabla 1. En tanto que la cantidad de inóculo mostró un efecto variable, incrementando la longitud de tallo, el número de hojas, el número de entrenudos, el diámetro de tallo, el peso fresco de tallo y el peso fresco de raíz. Asimismo, se observó la presencia de interacción entre el factor cantidad de inóculo y salinidad en las variables de longitud de tallo, número de entrenudos, diámetro de tallo y peso fresco de tallo.
Tabla 1: Resultados de las variables de crecimiento y ANOVA de efectos principales según factores en Solanum lycopersicum L. tratado con 0, 100 y 200 mM de NaCl y con 0, 1.5 y 3 g de inóculo de Rhizophagus irregularis.
| Fuente de variación | Longitud del tallo (cm) | Longitud de raíz (cm) | N° de hojas (F) | N° de hojas (S) | N° de entrenudos | Diámetro del tallo (mm) | Peso fresco del tallo (g) | Peso fresco de la raíz (gr) |
| A: NaCl (mM) | ||||||||
| 0 | 81.25a | 25.54a | 8.23a | 4.27a | 11.53a | 5.97a | 47.34a | 7.76a |
| 100 | 67.20b | 25.60a | 6.80b | 4.33a | 10.07b | 5.45b | 37.09b | 5.71b |
| 200 | 52.24c | 24.59a | 6.27c | 3.37b | 8.67c | 5.14c | 26.09c | 4.06c |
| B: Inóculo (g) | ||||||||
| 0 | 63.04c | 24.71a | 6.50c | 3.53b | 9.07c | 4.88c | 34.54b | 5.18b |
| 1.5 | 67.44b | 24.81a | 7.10b | 4.17a | 10.27b | 5.55b | 36.12b | 6.01a |
| 3.0 | 70.21a | 26.22a | 7.70c | 4.27a | 10.93a | 6.13a | 39.86a | 6.32a |
| ANOVA | ||||||||
| A | **** | ns | **** | **** | **** | **** | **** | **** |
| B | **** | ns | **** | **** | **** | **** | **** | *** |
| AB | **** | ns | ns | ns | ** | **** | **** | ns |
| CV (%) | 6.21 | 12.56 | 10.49 | 16.17 | 7.10 | 5.96 | 8.72 | 21.03 |
El “tomate” var. río grande fue sometido por 30 días a estrés salino mediante diferentes concentraciones de NaCl, mostrando diferencias significativas (p<0.05) en la longitud de tallo. En donde las plantas inoculadas con 3 g de HMA R. irregularis libre de NaCl se obtuvo una longitud de tallo promedio de 91 cm (Fig. 1a). Mientras las plantas sometidas a la dosis de 200 mM de NaCl e inoculadas con 1.5 y 3 g de HMA R. irregularis mostraron un aumento del valor de la longitud del tallo de 56 y 54 cm respectivamente. A pesar de tener resultados satisfactorios en las plantas inoculadas y sometidas a 200 mM, el estrés salino logró afectarlas, disminuyendo el valor de la variable en estudio por debajo del tratamiento T1 (Fig. 1a). Por otro lado, la cantidad de inóculo de HMA R. irregularis no afectó la longitud de la raíz bajo las diferentes concentraciones de NaCl. Pese a no haber significancia, se obtuvo una mayor longitud de raíz con la inoculación de 3 g de HMA R. irregularis dentro de las concentraciones de 100 y 200 mM de NaCl, cuyos valores fueron de 27 cm para ambos tratamientos (Fig. 1b). En relación al número de hojas, se puede observar que existen diferencias significativas entre los tratamientos (Fig. 1c). En el cual, las plantas inoculadas con 3 g de HMA R. irregularis y sometidas a las concentraciones de 0, 100 y 200 mM de NaCl presentaron valores de 9, 7.4 y 6.7 hojas por planta. Sin embargo, estos datos nos reflejan una posible relación inversa entre el número de hojas con la concentración de NaCl y directa entre la cantidad de inóculo de HMA R. irregularis y el número de hojas (Fig. 1c). Por otro lado, las plantas sometidas a diferentes cantidades de inóculos bajo distintas concentraciones de NaCl no mostraron diferencias significativas en el número de hojas marchitas (Fig. 1d).
Las plantas de “tomate” S. lycopersicum L. var. Río Grande expuestas a estrés salino mediante la aplicación de diferentes concentraciones de NaCl durante 30 días, previamente inoculadas con el HMA R. irregularis, evidenciaron diferencias significativas (p <0.05) con respecto al diámetro de tallo promedio. En la concentración de 0 mM de NaCl se observó el aumento en el valor del diámetro de tallo al utilizar 3 gramos de inóculo con un valor de 6.335 cm con respecto al de 0 y 1.5 g con valores de 5.73 y 5.85 cm, respectivamente. Para la concentración de 100 mM de NaCl, las plantas tratadas con 1.5 y 3 gramos de inóculo mostraron un mayor valor de diámetro de tallo (5.625 y 6.005 cm. respectivamente) en comparación con las no inoculadas (4.705 cm.). De la misma forma, a la concentración de 200 mM de NaCl se manifiesta un incremento en el valor de la variable de estudio a medida que el inóculo va aumentando (4.21, 5.16 y 6.035 cm. para los tratamientos de 0, 1.5 y 3 gramos de inóculo respectivamente). Cabe recalcar que los tratamientos en los cuales se utilizaron 3 gramos de inóculo (Fig. 5), bajo condiciones de estrés salino no presentaron diferencias significativas.
Las plantas de tomate S. lycopersicum L. var. Río Grande han sido sometidas a estrés salino mediante la aplicación de diferentes concentraciones de NaCl durante 30 días, previamente inoculadas con el HMA R. irregularis, mostrando diferencias significativas (p <0.05) con respecto al peso fresco de tallo promedio (Fig. 6). Para la concentración de 0 mM de NaCl se observa que aumentó el valor del peso fresco de tallo al utilizar 3 gramos de inóculo con un valor de 55.232 gramos con respecto al de 0 y 1.5 gramos con valores de 43.678 y 43.124 gramos respectivamente. A la concentración de 100 mM de NaCl, las plantas tratadas con 0, 1.5 y 3 gramos de inóculo no mostraron diferencias significativas con valores de 37.926, 36.516 y 36.814 gramos respectivamente. Por otra parte, en la concentración de 200 mM de NaCl, para los valores de 1.5 y 3 gramos de inóculo se observó un mayor peso fresco de tallo (28.729 y 27.533 gramos respectivamente) en comparación a las que no recibieron micorrizas (22.012 gramos). Sin embargo, a pesar de agregar inóculo a las plantas, el estrés salino logró afectarlas (Fig. 6) disminuyendo el valor de la variable de estudio.
Las plantas de “tomate” S. lycopersicum L. var. Río Grande inoculadas con el HMA R. irregularis, fueron sometidas a estrés salino mediante la aplicación de diferentes concentraciones de NaCl durante 30 días presentando diferencias significativas (p <0.05), con respecto al peso fresco de raíz promedio (g) (Fig. 7). Para los tratamientos de 1.5 y 3 gramos de inóculo se denota un incremento en la variable de estudio (7.77 y 8.316 gramos respectivamente) con respecto al de 0 gramos (7.18 gramos) para la concentración de 0 mM de NaCl. En cambio, las plantas tratadas con 0, 1.5 y 3 gramos de inóculo no mostraron diferencias significativas para la concentración de 100 mM de NaCl con valores de 5.478, 5.816 y 5.834 gramos respectivamente, por lo que no se manifiesta una mejoría con la aplicación de las micorrizas. Por último, para los valores de 0 y 3 gramos de inóculo se encontró diferencias significativas a una concentración de 200 mM de NaCl con valores de 2.894 y 4.824 gramos respectivamente, lo que demuestra una mejoría al aplicar R. irregularis.
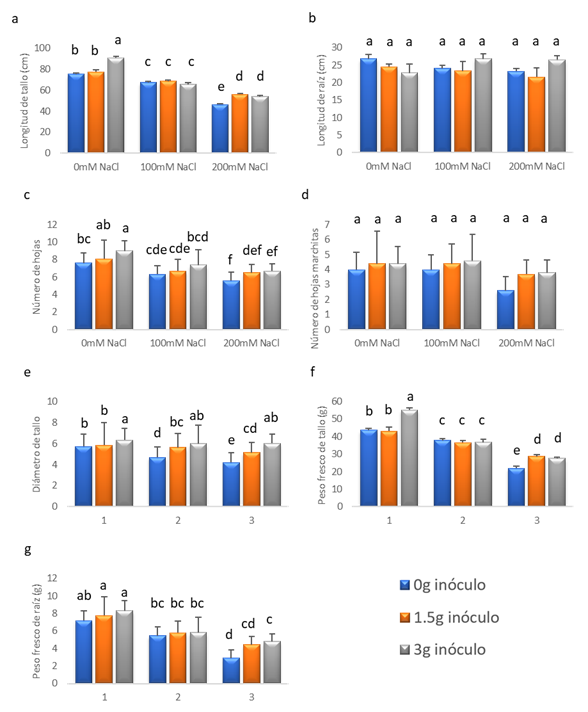
Fig. 1 Variables de crecimiento de Solanum lycopersicum L. tratado con 0, 100 y 200 mM de NaCl y con 0, 1.5 y 3 g de inóculo de Rhizophagus irregularis. a) Longitud de tallo. b) Longitud de raíz. c) Número de hojas. d) Número de hojas marchitas. e) Diámetro de tallo. f) Peso fresco de tallo. g) Peso fresco de raíz. Las letras diferentes (a, b, c y d) indican diferencias significativas; barras verticales indican el error estándar.
Discusión
En el “tomate” var. Río Grande, la concentración de NaCl afectó la longitud del tallo (Fig. 1a), observándose una reducción del tamaño a medida que se incrementa la concentración de NaCl (Abdel-Farid 2020). Esta disminución en el tamaño fue provocada principalmente por el desbalance nutricional ocasionado por una alta concentración y afinidad del ion Na+ por las proteínas transportadoras de nutrientes ubicadas en la raíz (Hammer et al. 2011). Sin embargo, las plantas inoculadas con HMA R. irregularis y sometidas a la concentración de 200 mM de NaCl mostraron una mejor resiliencia (Chao 2006). Bajo condiciones salinas, este mismo comportamiento se observó en Trigonella foenum-graecum al ser inoculada con Glomus intraradices (Evelin et al. 2012) y con Glomus irradicans en el cultivo de pimiento (Hegazi et al. 2017). La habilidad de tomar el ion Na+ por R. irregularis y la capacidad de la planta por mantener los niveles bajos en Na+ dentro del citoplasma de las células del tallo, facilitan la osmoregulación de nutrientes del tallo a las hojas (Hammer et al. 2011). A pesar que el NaCl modifica el fenotipado de la raíz a través de la limitación de la homeostasis hídrica y iónica (Dell’Amico & Parra 2005), la longitud de raíz de la var. Rio Grande no estuvo afectado por la concentración de esta sal y la adición de inóculo de R. irregularis no favoreció a este rasgo morfológico (Fig. 1b), Este comportamiento se debe principalmente a una baja selectividad de los transportadores de la membrana plasmática de la raíz por el Na+ en concentraciones altas de NaCl (Goykovic et al. 2007). Por el contrario, el número de hojas disminuyó en consecuencia al incremento de la salinidad (Goykovic et al. 2007). Pese a ello, la aplicación de R. irregularis aumentó el número de hojas dentro de cada concentración de NaCl (Fig. 1c). Siendo similar a lo reportado en el cultivo de pimiento, en el cual, Glomus irradicans incrementó el número de hojas bajo una concentración de 25 mM de NaCl (Hegazi et al. 2017). Esto puede deberse a la fuerte selectividad que tiene R. irregularis por el Na+, permitiendo la adquisición de Ca+2 y K+ por las raíces de tomate. El incremento de estos iones en las hojas mejora la estabilidad e integridad de la membrana celular, permitiendo el acceso y uso inmediato de los iones en proceso fisiológicos de vital importancia como la fotosíntesis y con ello permitir el crecimiento continuo y el aumento de las hojas bajo estrés salino (Hegazi et al. 2017). Por otra parte, el número de hojas secas no fue afectado por el contenido de inóculo y las concentraciones de NaCl. Por el cual, el cv. Río Grande manifestó tolerancia frente al estrés salino sometido (Ghanem et al 2008).
La inoculación de HMA con R. irregularis aumentó los valores obtenidos del diámetro de tallo; estudios relacionados hacen mención que con el uso de micorrizas en plantas expuestas a NaCl se obtiene un mayor grosor en tallo debido a una mejor tolerancia a la sal, a comparación de plantas no inoculadas con hongos micorrízicos arbusculares (Wu et al., 2010). De igual manera, Zulueta et al. (2020) reportan un aumento satisfactorio en el diámetro del tallo cuando se le inocula con HMA. Además, Díaz et al. (2016) hace mención que la concentración salina elevada impacta negativamente, de manera que la variable a estudiar decrece, pero el efecto de la micorriza favorece el crecimiento de diámetro de tallo. Según Ley et al. (2015) manifestó una influencia positiva por parte de las micorrizas en el desarrollo del grosor del tallo de la planta.
En contraste, Zhang et al. (2016) indica que al emplear HMA se muestra un aumento significativo en la variable anteriormente mencionada. Esto ocurrió independientemente de si hubo o no estrés salino, siendo en esta última condición donde se presentó un menor porcentaje de crecimiento, por lo que se puede inferir que la mejora inducida por la micorriza no está asociada al nivel de salinidad del suelo.
Los resultados obtenidos para el peso fresco del tallo de S. lycopersicum var. Río Grande evidencian que las micorrizas son capaces de incrementar su valor, demostrando nuevamente la capacidad promotora del crecimiento de dichos microorganismos, lo cual coincide con los resultados obtenidos en la investigación de Agüero (2018) para la Ocimum basilicum “albahaca”, aunque utilizando otra especie de HMA (Glomus spp.), sin embargo, esto no logró atenuar el marcado efecto en la disminución con respecto al tratamiento de 0 mM, esto último se puede deber a que la salinidad puede influir sobre múltiples fenómenos biológicos relacionados con el crecimiento vegetal como la fotosíntesis, absorción de iones, actividad de ácidos nucleicos entre otros. Esto a su vez coincide con lo encontrado en la investigación de Díaz-Franco en el 2016 para Sorghum en condiciones de estrés salino, esto se puede deber a que las micorrizas ayudan en la captación de nutrientes como parte de su asociación. Adicionalmente, Mendez (2017) reportó que, para S. tuberosum, en condiciones de invernadero la inoculación de micorrizas ayudó a promover el desarrollo de la parte aérea de las plantas.
Las plantas inoculadas con R. irregularis de S. lycopersicum var. Río Grande, presentaron un incremento con respecto al promedio del peso fresco de raíz, en contraste con las plantas que no recibieron las HMA. Esto coincide con lo reportado por Díaz-Franco (2016) para el mismo parámetro, lo cual se puede atribuir a la mejora en los sistemas de absorción de nutrientes, desencadenando una activación de mecanismos fisiológicos que estaban bloqueados por las condiciones de salinidad elevada. De igual manera, esta mejora también se observó en la investigación de Aguero (2018), en O. basilicum “albahaca” inoculadas con micorrizas y sometidas a estrés salino. De la misma forma, en la investigación de Mendez (2017) se obtuvieron resultados similares con S. tuberosum “papa”. Esto a su vez coincide con los hallazgos reportados por Toala en el 2021 para especies arbusculares. En contraste, Aguero et al. (2018) encontró una disminución, en la variable de estudio anteriormente mencionada, para la albahaca bajo condiciones de estrés salino inoculadas con HMA R. fasciculatum. Esto resulta ser contradictorio con lo descrito en las otras investigaciones, por lo cual se requiere considerar que la variación de especies de micorrizas puede ocasionar diferentes resultados en los parámetros morfométricos.
Por lo tanto, la salinidad ha sido un problema para el desarrollo de diferentes cultivos de interés agrícola. Se ha comprobado mediante diferentes investigaciones que las micorrizas son adecuados promotores de crecimiento ante el estrés salino mediante modulación a niveles fisiológicos y bioquímicos. Aunque aún se desconoce cómo las micorrizas logran dicho efecto, se ha propuesto que podría deberse a modificaciones a nivel de la arquitectura de las raíces mediante el mecanismo hormonal. Además de eso, también se incrementa la cantidad de agua que puede absorber la planta, así como la fotosíntesis que pueda realizar, ocasionando una mejora en el crecimiento total por acción de las micorrizas (Singh et al., 2018). Otro mecanismo involucrado en la mejora del desarrollo se puede deber a la capacidad que poseen las HMAs de mejorar la absorción de P, K, Ca y Mg y al mismo tiempo reducir la translocación de iones tóxicos (como Na + y Cl−) al brote. De esta forma, logran mejorar el transporte de los nutrientes necesarios y a su vez aislar aquellos iones que resulten perjudiciales para el desarrollo de las plantas (Rouphael et al., 2015).
Además, hay una mejora en la actividad enzimática, que a su vez incrementa la actividad metabólica mejorando los parámetros morfométricos como la longitud, aumento del peso fresco del tallo y las raíces en tomate bajo estrés salino. Adicionalmente, no solo mejora parámetros morfométricos, sino también los bioquímicos como las proteínas y el contenido de nutrientes. Finalmente, podemos inferir que las plantas que han sido expuestas a estrés salino e inoculadas con HMAs han sido capaces de adaptarse y cambiar sus mecanismos para afrontar los efectos adversos en condiciones de excesiva salinidad (Singh et al., 2021).
Conclusiones
Solanum lycopersicum L. “tomate” var. Río Grande, fue afectado por los niveles de salinidad de 100mM y 200mM NaCl, que indujeron reducción en la longitud de tallo, número de hojas, número de entrenudos, diámetro de tallo, peso fresco de tallo y raíz a los 30 días de tratamiento en condiciones de invernadero.
La inoculación con 1.5g y 3g de Rhizophagus irregularis indujo incremento en la longitud de tallo, el número de hojas, el número de entrenudos, el diámetro de tallo, el peso fresco de tallo y raíz en Solanum lycopersicum L. “tomate” var. Río Grande cultivado en condiciones de invernadero.
La inoculación con micorrizas ocasionó una reducción en la disminución de crecimiento ocasionada por la salinidad, promoviendo el crecimiento de Solanum lycopersicum L. “tomate” var. Río Grande.












 uBio
uBio