Introducción
La salinidad del suelo es un problema muy grave y en constante aumento en muchas partes del mundo, particularmente en las zonas áridas y semiáridas (Zelm et al., 2020). Grandes porcentajes de suelo dedicados a la agricultura, son naturalmente salinos (21%) o pueden ser salinizados (19,5%) (Pandolfi et al., 2016). Varias son las causas vinculadas con los procesos de salinización entre ellas principalmente; las sales solubles en agua de riego y fertilizantes utilizados en la agricultura (De Moraes et al., 2019; Pandolfi et al., 2016), el mal drenaje y la tala de vegetación arbórea, la baja precipitación y altas temperaturas de las regiones (Borbély et al., 2020).
La elevada concentración de sal en los suelos ejercen efectos directos sobre el crecimiento de las plantas; lo que puede implicar un disturbio en la toma y translocación de iones necesarios para su nutrición (Kissoudis et al., 2016), reducción en el potencial osmótico de la solución del suelo, el cual reduce la cantidad de agua disponible para la planta, causando sequía fisiológica (Chávez & González, 2009; Farooq et al., 2017) es decir, la planta tiende a perder agua por lo que ésta debe mantener un potencial hídrico más negativo que el suelo para asegurar la absorción de agua (Saldaña et al., 2017). Este déficit hídrico en las plantas provoca una serie de respuestas morfológicas y fisiológicas en sus diferentes estados fenológicos, las cuales pueden tener algún valor adaptativo y por lo tanto conferir un cierto grado de tolerancia al estrés (Abdel-Farid et al., 2020).
El NaCl es una de las sales más importantes en la salinización de los suelos, ya que se encuentra frecuentemente en terrenos de cultivo; por ello, muchos estudios han sido orientados al entendimiento de los mecanismos involucrados en sus sistemas de transporte y mecanismos regulatorios que median la homeostasis de Na+ en las plantas (Hessini et al., 2019). La alta concentración de NaCl conlleva a un desequilibrio de Na+ y Cl- causando toxicidad en la célula vegetal, dañando los orgánulos celulares y la membrana plasmática, la interrupción de la síntesis de enzimas y proteínas, así como de la fotosíntesis y respiración, afecta también a la división, crecimiento y supervivencia celular (Kissoudis et al., 2016; Liang, 2018)
Las plantas sometidas a estrés por NaCl han desarrollado mecanismos para evitar sus efectos y asegurar la supervivencia, entre ellos la exclusión de iones Na+ y Cl- en las hojas y mediante compartimentación en las vacuolas (Wani et al., 2020; Zelm et al., 2020). Los iones Na+ pueden entrar en las raíces pasivamente y por tanto las células de las raíces han de utilizar la energía para un transporte activo que devuelva el Na+ a la solución externa, por el contrario la membrana plasmática de la raíz es muy poco permeable al Cl- ; por ello algunas halófitas no excluyen los iones a través de la raíz, sino que por el contrario poseen glándulas salinas en la superficie de las hojas, así los iones Cl- son trasportados a estas glándulas en las que cristalizan y dejan de ser lesivas (Arif et al., 2020). Cuando el Na+ y Cl- aumentan en la vacuola, las plantas involucran en su metabolismo sustancias orgánicas osmoprotectoras o compatibles, esto con el fin de soportar el efecto osmótico ocasionado por estos iones (Chávez & González, 2009; Hernandez et al., 2000; Higinio et al., 2014). Estas sustancias compatibles, se acumulan a niveles osmóticamente significativos en el citoplasma celular sin causar inhibición enzimática (Farooq et al., 2017).
Diversos compuestos se encuentran agrupados dentro de estos solutos, tales como azucares (rafinosa, sacarosa y trehalosa), azucares reducidos o azucares alcoholes (sorbitol y manitol), aminas (glicina-betaína y algunas poliaminas), aminoácidos (prolina) (Zarco, 2005). La prolina es un aminoácido soluble el cual se sintetiza en plantas superiores, a través de dos vías, la vía Ornitina dependiente (Orn) y la vía ácido Glutámico (Glu) o glutamato dependiente. En la vía Orn, consiste en la trasnominación de la ornitina y es catalizada por la ornitina-o-aminotransferasa (OAT), dando lugar a dos posibles intermediarios 1-pirrolina-5-carboxilato (P5C) y 1-pirrolina-2-carboxilato (P2C), el cual se reduce a prolina. La segunda vía biosintética parece ser la más predomínate para la biosíntesis de prolina, sobretodo en bajo condiciones de estrés (Delauney, 1993), en esta vía la prolina es sintetizada a partir de ácido L-glutámico a través de dos intermediarios, glutámico-γ-semialdehído (GSA) y 1-pirrolina-5-carboxilato (P5C), dos enzimas catalizan esta vía, P5C sintetasa (P5CS) en el primer paso y P5C reductasa (P5CR) en la etapa final (Yoshiba, 1997).
Las plantas normalmente sintetizan prolina en pequeñas cantidades cuando estas crecen en condiciones óptimas, por el contrario, en condiciones de estrés salino se sabe que la cantidad de prolina aumenta (Selvakumar et al., 2018). Así la prolina se convierte en uno de los principales solutos compatibles involucrados durante el estrés salino, cuya función ha sido asociada a múltiples roles en la tolerancia de las plantas a este estrés; como sostener la turgencia de los tejidos para mantener optima la función celular (Abdel-Farid et al., 2020; Kumar et al., 2017), fuente de carbono y nitrógeno fácilmente disponible en la rehidratación celular, fuente de equivalentes de reducción (del catabolismo de prolina) para sostener la fosforilación oxidativa y la generación de ATP durante la recuperación del estrés (Dastogeer et al., 2020; Hernandez et al., 2000), en la detoxificación del exceso de NH4+ y ayuda a las células a superar la tensión oxidativa (cosechador de especies reactivas de oxígeno) (Hegazi et al., 2017). Además ayuda al control de la acidosis del citosol y puede mantener la proporción de NAD(P)+/NAD(P)H en valores compatibles con el metabolismo en condiciones normales, reduciendo los niveles de NAD celular y participando en el incremento de la relación NAD(P)+/NAD(P)H lo que probablemente aumente la actividad de la vía oxidativa pentosa fosfato, esto último proporciona recursos para soportar la demanda en el incremento de la producción de metabolitos secundarios, síntesis de nucleótidos, los que se generan aceleradamente para la división celular durante el alivio del estrés (Abdel-Farid et al., 2020).
Por otro lado; ciertos microorganismos, particularmente bacterias y hongos benéficos, parecen ser un componente fundamental dentro de estas nuevas alternativas de producción agraria. Estos microorganismos pueden mejorar el rendimiento de la planta en condiciones de estrés y como consecuencia mejorar el rendimiento (Cho et al., 2006; Evelin et al., 2012), por lo que recientemente se ha venido dando una nueva corriente de producción agrícola, enfocada a la agricultura sostenible y orgánica, tratando de sustituir las prácticas de producción convencional. Muchos investigadores han demostrado que los HMA mejoran el crecimiento de las plantas y la tolerancia a la salinidad , mediante el empleo de diversos mecanismos, tales como la mejora de la adquisición de nutrición (Farooq et al., 2017), la producción de hormonas del crecimiento de plantas, la mejora de las condiciones de la rizósfera del suelo (Al-Maliki & Al-Masoudi, 2018), la alteración de las propiedades fisiológicas y bioquímicas del huésped y la resistencia de raíces de la planta contra los patógenos del suelo (Farooq et al., 2017; Mohammad & Mittra, 2013)
Zea mays L. var. canteño “maíz morado” es una poácea originaria de América, ampliamente cultivada, por su importancia en la alimentación humana (Pandolfi et al., 2016). Constituyó uno de los principales alimentos de las numerosas tribus indígenas en la época precolombina y se le atribuyen diversas propiedades medicinales (Kumar et al., 2017). Su consumo disminuye la incidencia de enfermedad cardiaca coronaria, ateroesclerosis y ciertas formas de infarto y cáncer (Hessini et al., 2019; Moreira et al., 2020). Además, recientemente, se ha reportado que estos alimentos tienen actividad antioxidante y pueden mejorar los perfiles lipídicos en mamíferos (Al-Maliki & Al-Masoudi, 2018), es por ello que su demanda ha ido aumentando en los últimos años, generando interés en la investigación de esta especie, con el fin de incrementar su productividad (MINAM, 2011).
El mal manejo de las áreas de cultivo en el Perú, están ocasionando diversos problemas ambientales, uno de los más importantes es el aumento de sales en los suelos, por ello se vienen realizando numerosos estudios sobre la respuesta de las plantas ante el estrés salino. Una de estas respuestas, es la biosíntesis de solutos osmóticamente compatibles, dentro de ellos la prolina es uno de los más conocidos. Una de las herramientas biotecnológicas para contrarrestar el estrés salino lo constituyen los hongos micorrizicos arbusculares, como es Rhizophagus irregularis. Además, el efecto benéfico de R. irregularis se ha demostrado su asociación con diversos cultivos como sacha inchi, tomate, frijol y papaya (Hidalgo et al., 2014; Ramos et al., 2021; Hidalgo et al., 2019; Hidalgo et al., 2021), existiendo pruebas de su capacidad para promover la regulación iónica y osmótica al estar vinculados a la síntesis bioquímica de compuestos que hacen que la planta tolere este estrés (Ramos et al., 2021). Estudios han demostrado los HMA como R. irregularis incrementan la tolerancia ante el estrés por NaCl en plantas de maíz (Selvakumar et al., 2018) cultivo que por su adaptabilidad al agroecositema costero, viene siendo impulsado en nuestro país, donde un alto porcentaje de suelos dedicados a la agricultura se caracterizan por ser salinos; por otro lado, el cultivo de esta variedad de maíz, se viene impulsando en varias regiones del Perú (MINAM, 2011). Bajo estas perspectivas se hace necesaria la búsqueda de nuevas alternativas de manejo de este cultivo en suelos salinos. Por ello se propuso como objetivo cuantificar la cantidad de prolina en raíces y hojas de Z. mays L. var. canteño inoculado con R. irregularis y sometido a 0, 25, 50 y 100 mM de NaCl.
Material y métodos
Material biológico
Se utilizaron plántulas de Zea mays L. var. canteño de 7 días de germinadas obtenidas a partir de semillas donadas por el Programa de Investigación y Proyección Social en Maíz de la Universidad Nacional Agraria La Molina. Lima, Perú.
Para la micorrización se utilizó el inóculo de R. irregularis, el cual se obtuvo del producto comercial AEGIS Micro Gránulo, donado por la empresa ATENS Agrotecnologías Naturales, S.L. Tarragona, España.
Inoculación de plantas de Zea mays con R. irregularis y aplicación de NaCl
Para los diferentes tratamientos usados en este trabajo se seleccionaron 80 plántulas en base a su uniformidad en tamaño, las cuales fueron aleatoriamente distribuidas en 8 grupos. El sustrato estuvo constituido por arena de río y musgo. La arena de río fue cernida con un tamiz para homogeneizar su textura, después fue lavada con agua corriente por 8 horas para eliminar impurezas, tras lo cual se esterilizó en la estufa a 200° C, durante 3 horas, para eliminar los agentes patógenos. Luego, la arena fue mezclada con el musgo en proporción 1:1. El sustrato obtenido fue colocado en bolsas de polietileno de 3 kg. de capacidad. Para realizar la inoculación, en las bolsas con sustrato se hizo un orificio de aproximadamente 5 cm. de diámetro, para recibir a las plántulas. A continuación, se agregó a dicho orificio 2g del inóculo de R. irregularis, de manera que las raíces estuvieron en contacto con el HMA. Después, se procedió a regar las plantas, usando solución nutritiva La Molina con 0, 25, 50 y 100 mM de NaCl (Cuadro 1).
Cuadro 1 Tratamientos utilizados en Zea mays L. var. Canteño con las combinaciones de los factores inóculo de Rhizophagus irregularis y niveles de NaCl (mM).
| NaCl R. irregularis | 0 mM | 25 mM | 50mM | 100 mM |
| Sin inóculo | T1 | T2 | T3 | T4 |
| Con inóculo | T5 | T6 | T7 | T8 |
Los tratamientos, debidamente etiquetados, fueron instalados en el invernadero del Jardín Botánico de la Universidad Nacional de Trujillo. Las plantas fueron regadas 2 veces por semana a capacidad de campo con las soluciones respectivas, por 60 días.
Cuantificación de prolina
La cuantificación de prolina fue medida de acuerdo a lo descrito por Bates y col. (1973). De las plantas expuestas a los tratamientos antes mencionados, se pesó por separado 0.5 g de tejido fresco de raíces y hojas. Seguidamente cada muestra fue colocada en un mortero de porcelana y triturado en nitrógeno líquido. Para el homogenizado se usó 1 ml de ácido sulfosalicílico al 3%. El residuo fue removido por centrifugación a 13000 g por 10 min. Del sobrenadante del centrifugado se extrajeron 500 ul, el cual se hizo reaccionar con 500 ul de ácido acético glacial y 500 ul. de ninhidrina a 100ºC, por una hora. La reacción fue detenida en baño con hielo. El cromóforo conteniendo la prolina fue extraído con 1 ml. de tolueno. La prolina fue cuantificada en un espectrofotómetro Hewlett Packard 842, a 520 nm., usando L-prolina para la curva de calibración.
Porcentaje de micorrización
Para estimar el porcentaje de micorrización se utilizó el método de la Observación Microscópica de Phillips & Hayman, (1970), dicho método consiste en la evaluación de hifas, arbúsculos, vesículas y esporas de R. irregularis en segmentos de 1 cm. de raicillas previamente coloreadas, con el método de los mismos autores y utilizando la fórmula descrita por Ferrera (1993).
%MI= (SI/SO)*100
%MI: Porcentaje de micorrización.
SI: Número de segmentos infectados.
SO: Número de segmentos observados.
Análisis de datos
Cada unidad muestral estuvo constituida por una bolsa conteniendo una planta de maíz. Cada tratamiento contó con tres repeticiones. Las plantas fueron cosechadas a los 28, 35 y 42 días para obtener los resultados. Luego, el análisis de los datos se realizó utilizando el software estadístico Minitab® 19.1. Se realizó el análisis de varianza (ANOVA) y la prueba comparación de medias de Tukey HSD. Además, se midió el índice de correlación entre la cantidad de inóculo, el porcentaje de micorrización y la longitud de tallos y raíces.
Resultados
Según el ANOVA factorial, se observa que los tratamientos indujeron diferencias significativas en el nivel de prolina a nivel de hojas y raíces en “maíz” var. canteño (Tabla 1). En raíces, esta variación puede ser explicada por el efecto de la cantidad de NaCl. En tanto que la cantidad de prolina en hojas fue alterada por el contenido de inóculo y de NaCl. En efecto, someter las plántulas de maíz al NaCl promovió el incremento del contenido de prolina a nivel radicular y foliar, evidenciando posiblemente una relación directa entre la cantidad de NaCl con estos dos rasgos fisiológicos. En contraste, el análisis estadístico indica que la aplicación de R. irregularis redujo el contenido de prolina en hojas. De forma similar, el porcentaje de micorrización fue afectado por la presencia de inóculo de R. irregularis, así como por las concentraciones crecientes de NaCl, siendo ese factor, el que ocasionó una reducción estadísticamente significativa.
Tabla 1 Análisis de varianza factorial para cantidad de prolina en raíces y hojas en Zea mays L. var. canteño inoculado con Rhizophagus irregularis Schenk & Smith y sometido a NaCl.
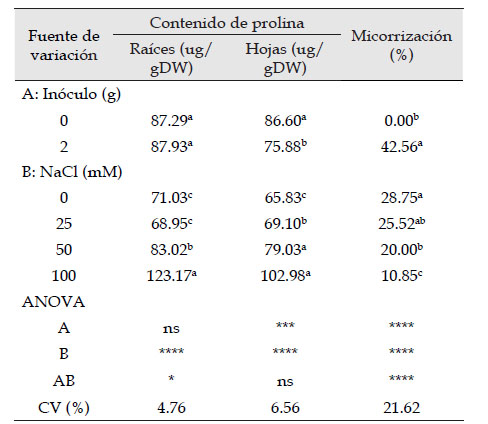
ns: no significativo; ***: p < 0.001; ****: p < 0.0001
A nivel radicular, las plantas de “maíz” var. canteño inoculadas con R. irregularis y expuestas a NaCl mostraron variación en los niveles de prolina, tal como se aprecia en la Fig. 1. Las plantas sometidas a 0 mM de NaCl mostraron un contenido de prolina en hojas promedio de 74.6 y 67.5 ug/gDW para las plantas no inoculadas e inoculadas, respectivamente, sin mostrar diferencias estadísticamente significativas entre estos valores. En las plantas sometidas a 25mM de NaCl, el nivel de prolina no mostró variaciones estadísticamente significativas al comparar las plantas inoculadas y no inoculadas, mostrando valores de prolina de 67,4 y 70,5 ug/g de tejido fresco, respectivamente. A partir de los 50mM de NaCl, la cantidad de prolina encontrada a nivel de raíces mostró incrementos significativos en relación a los valores inducidos por niveles inferiores de salinidad. De esta manera, se encontraron 83,4 y 82,3 ug/g de tejido fresco en plantas no inoculadas e inoculadas, respectivamente. Sin embargo, estos valores no mostraron variación estadísticamente significativa entre sí. La cantidad de prolina se incrementó a nivel que se incrementó la salinidad, de manera que en la concentración de Los mayores valores de prolina fueron inducidos por la concentración de 100mM de NaCl, con medias de: 123,3 y 131,5 ug/gDW para plantas no inoculadas e inoculadas, respectivamente. Estos valores tampoco mostraron diferencias significativas entre sí.
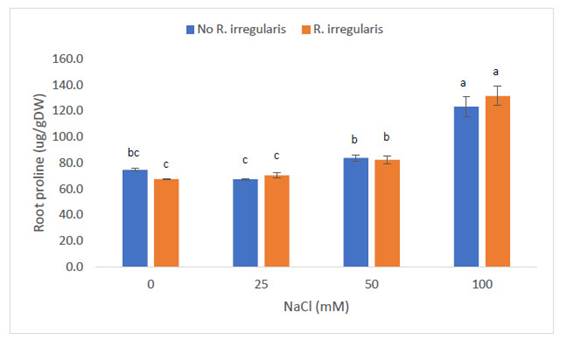
Fig.1. Contenido de prolina en raíces de Zea mays L. var. canteño tratado con Rhizophagus irregularis e inoculado con NaCl. Letras diferentes (a, b, c) indican diferencias significativas según Tukey HSD; líneas verticales sobre las barras indican la desviación estándar.
A nivel foliar, las plantas de “maíz” Z. mays L. var. canteño expuestas al inóculo de micorrizas de R. irregularis a diferentes concentraciones, así como diferentes estímulos de NaCl que presentaron diferencias significativas (p<0.05) con respecto al contenido de prolina en las hojas (ug/g de tejido fresco) como se puede apreciar en la Fig. 2. Se observa que los menores valores de prolina en hojas fueron inducidos por las concentraciones de NaCl de 0 y 25 mM, en plantas sin, o con R. irregularis (68.1, 63.6, 71.3 y 66.9 ug/g de tejido fresco). Al someter las plantas a concentraciones de 50mM de NaCl, el contenido de prolina se incrementó significativamente en las plantas no tratadas con micorrizas (80.5 ug/g de tejido fresco), en tanto, mantuvo los bajos niveles mostrados en plantas sometidas a menor cantidad de NaCl (77.5 ug/g de tejido fresco). Sin embargo, ambos niveles de prolina mostraron resultados similares estadísticamente. Los niveles de prolina inducidos por los tratamientos con 100mM de NaCl, fueron significativamente superiores a todos los tratamientos previos, tanto en plantas micorrizadas, como no micorrizadas (95.5 y 110.5 ug/g de tejido fresco, respectivamente). Al igual que con las concentraciones de sal anteriores, no hubo diferencias entre plantas tratadas con micorrizas o no en este nivel de salinidad. Es resaltante, sin embargo, que la concentración de prolina en las plantas micorrizadas, mantuvo valores similares a las plantas sometidas a 50mM de NaCl, es decir, no mostraron un incremento estadísticamente significativo en comparación con el grupo anterior.
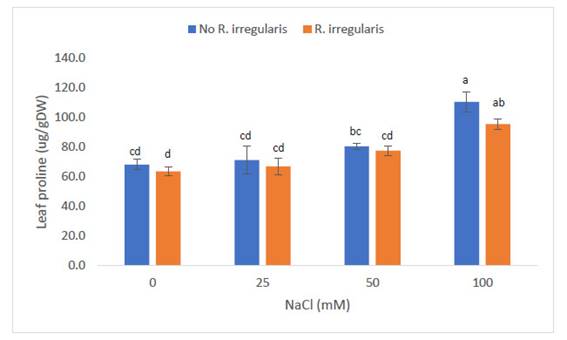
Fig. 2 Contenido de prolina en hojas de Zea mays L. var. canteño tratado con Rhizophagus irregularis e inoculado con NaCl. Letras diferentes (a, b, c, d) indican diferencias significativas según Tukey HSD; líneas verticales sobre las barras indican la desviación estándar.
El porcentaje de micorrización también mostró alteraciones entre los diferentes tratamientos, tal como puede apreciarse en la Fig. 3. En efecto, las concentraciones crecientes de NaCl ocasionaron reducciones estadísticamente significativas con respecto al nivel de prolina. Las plantas del grupo control mostraron un valor de 57,5% de micorrización, lo cual fue estadísticamente similar a las plantas sometidas a 25mM (51%). En contraste, la salinidad de 50mM, indujo una reducción en el porcentaje de micorrización con respecto al control (40%). Sin embargo, estos niveles fueron estadísticamente similares a los obtenidos en plantas sometidas a 25mM de NaCl. La reducción más notoria (21,7%), fue inducida por la salinidad de 100mM.
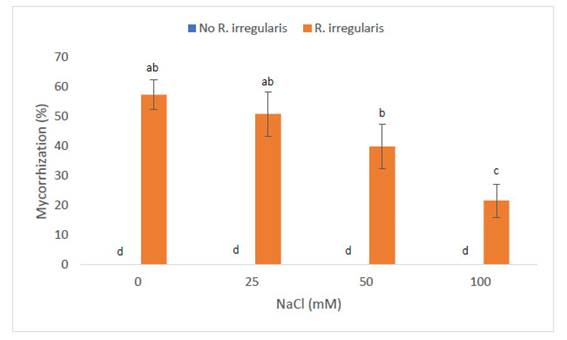
Fig. 3 Porcentaje de micorrización en Zea mays L. var. canteño tratado con Rhizophagus irregularis e inoculado con NaCl. Letras diferentes (a, b, c) indican diferencias significativas según Tukey HSD; líneas verticales sobre las barras indican la desviación estándar.
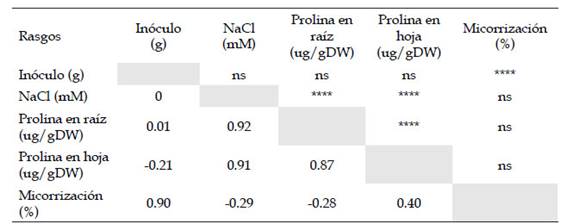
Se realizó el análisis de correlación de Pearson entre las variables dependientes e independientes tomadas en cuenta en el estudio, incluyendo inóculo, prolina en raíz, prolina en hoja, y porcentaje de micorrización. Se consideró estadísticamente significativa la correlación entre el NaCl con el contenido de prolina en raíces (0,92) y hojas (0,91). Este mismo comportamiento se observó entre el inoculo con el porcentaje de micorrización, ya que presentaron una correlación de Pearson de 0,90. Finalmente, el contenido de prolina en hojas y raíces se vincularon de forma relevante con un coeficiente de Pearson de 0,87 (Tabla 2).
Discusión
Para sobrevivir en condiciones adversas, las plantas manifiestan cambios adaptativos en su metabolismo con el fin de mantener su crecimiento (Selvakumar et al., 2018). La acumulación de solutos osmóticamente compatibles es una respuesta de las plantas al bajo potencial hídrico del suelo ocasionado por el incremento de sales, siendo la prolina uno de los compuestos más importantes (Chaman, 2007). Desde muy tempranos se ha sugerido que la capacidad para acumular prolina esta correlacionada con la tolerancia a condiciones salinas (Stewart et al., 1974). En el caso de Z. mays L. var. canteño, la cantidad de inóculo redujo de forma significativa el contenido de prolina en hojas (Tabla 1). Este mismo comportamiento fue reportado por Ruiz-Lozano et al. (1996) y Jahromi et al. (2007) en lechuga, donde las especies Glomus intraradices, Glomus desertícola y Glomus fascuculatum redujeron de forma significativa el contenido de prolina a nivel foliar. Esta conducta en “maíz” var. canteño se debe posiblemente a la habilidad selectiva que tiene R. irregularis para tomar el ion Na+ de la rizósfera (Hammer et al., 2011), facilitando el transporte nutrientes y agua a la raíz. En consecuencia, la homeostasis hídrica y iónica a nivel y foliar se normaliza durante estrés salino (Beltrano et al., 2013), reduciendo la biosíntesis de prolina en hojas (El Moukhtari et al., 2020). En cambio, el contenido de NaCl incremento en forma relevante la producción de prolina en raíces y hojas (Tabla 1). La acumulación osmorreguladora de prolina en hojas bajo condiciones salinas ha sido reportada en Z. mays (Sukma et al., 2018), Brassica rapa (Pavlović et al., 2019), Brassica oleracea (Pavlović et al., 2019) y Pistacia vera (Rahneshan et al., 2018) entre otros. Este mismo comportamiento se observó en las raíces de Brassica rapa (Pavlović et al., 2019), Brassica oleracea (Pavlović et al., 2019) y Pistacia vera (Rahneshan et al., 2018). A pesar del posible vínculo entre el NaCl y la prolina en raíces y hojas de Z. mays L. var. canteño (Tabla 1), muchos investigadores afirman que no existe tal relación per se. Sino que la prolina contribuye en la homeostasis redox, aumentando la actividad antioxidante y con ello mantener el crecimiento y desarrollo normal de zona radicular y foliar durante el estrés salino (Pavlović et al., 2019).
Estos resultados coinciden con lo encontrado en las figuras 1 y 2, donde se observa que aumenta el contenido de prolina a nivel de hojas y raíces como una respuesta fisiológica promovida por las micorrizas para afrontar los efectos del estrés que puede darse por el aumento de la concentración salina. Por lo tanto, la prolina cumple un rol muy importante en la respuesta frente al estrés salino, puesto que su incremento, permite prevenir la entrada de iones tóxicos a los tejidos y/o mantener el funcionamiento de bombas para excluir el exceso de NaCl. De esta manera se evita la inhibición enzimática (Garcia, 2003). Además, la prolina compensa osmóticamente los iones secuestrados en la vacuola ya que actúa como soluto osmóticamente compatible con el citoplasma celular (Polijakoff, 1994), permitiendo el movimiento del agua desde la solución del suelo a las raíces de la planta, manteniendo así la actividad metabólica y turgencia de los tejidos. Ejemplos como los estudios realizados en dos genotipos de caña de azúcar muestran el aumento en el contenido de prolina en raíces y hojas sometidas a 100 mM de NaCl. (Garcia, 2003). También podemos mencionar el trabajo realizado en plantas de maíz sometido a estrés salino, donde el contenido de prolina aumentó en los tejidos de hojas de varios genotipos de esta especie, acompañada por reducciones en la longitud de la raíz (7 mm en plántulas control en comparación con 4 mm cuando 100 mM NaCl), longitud de las células epidérmicas, y en la velocidad aparente de la producción de células (Delauney & Verna, 1993).
La influencia de la cantidad de NaCl como agente promotor del estrés salino en las plantas es apreciable en los parámetros evaluados, especialmente podemos señalar que en el parámetro de porcentaje de micorrización tiene una influencia ampliamente marcada como se aprecia en la Fig. 3. Se conoce que la endosimbiosis micorrízica es importante para promover el crecimiento de las plantas por lo cual se considera que puede ayudar a promover el crecimiento de las plantas mejorando la absorción de nutrientes (Evelin et al., 2012). Se puede resaltar que el estrés salino puede reducir el porcentaje colonización o crecimiento de hifas en las raíces de las plantas, lo cual se puede deber a una inhibición debida al efecto negativo de la salinidad sobre el crecimiento de las hifas de las micorrizas, esto coincide con los resultados encontrados para el estrés inducido por diferentes concentraciones de fósforo (P) en Z. mays por Nafady & Elgharably, 2018. De la misma forma coincide con los resultados obtenidos par NaCl con otras micorrizas como Glomus versiforme y G. mosseae por Zou & Wu en el 2011 donde se nota que el porcentaje de colonización por las micorrizas también disminuye con el incremento en la salinidad, esto también concuerda con los resultados reportados por Santander et al. en el 2019 quién trabajó con Lactuca sativa exponiendola a la micorriza arbuscular como consorcio (Claroideoglomus claroideum) donde al aumentar la concentración salina se disminuye el porcentaje de micorrización y esto último coincide con la investigación realizada por Jahromi et al. en el 2007 que trabajó con lechuga y uso como hongo micorrízico arbuscular a Glomus intraradices (Jahromi et al., 2017; Nafady & Elgharably, 2018; Santander et al., 2019; Zou & Wu, 2011). Aunque no se observa este mismo comportamiento para todos los casos como ocurrió en la investigación de Estrada et al. en el 2013 quienes realizaron una investigación sobre el efecto de las micorrizas R. intraradices, Claroideoglomus etunicatum y Septoglomus constrictum sobre Z. mays expuesto a condiciones de estrés salino por NaCl, donde aunque se incrementó la salinidad, se observó igualmente un aumento en el porcentaje de colonización, esto último también se nota en la investigación realizada por Krishnamoorthy et al., 2018 que trabajaron con diferentes tipos de micorriza arbuscular como R. intraradices y Massilia niastensis, donde cuando se incrementó la salinidad igualmente aumentó el crecimiento de las hifas en las raíces de las plantas lo cual contrasta con los resultados de la presente investigación (Chul et al., 2018).
En base a los resultados de la tabla 2, el aumento del NaCl, incrementa el contenido de prolina en hojas y raíces. Este patrón se debe a efecto potenciador que tiene la simbiosis entre “maíz” y R. irregularis en la biosíntesis de prolina durante el estrés salino (Abdel & Chaoxing, 2014). Este mismo comportamiento se observó entre la micorrización con la cantidad de inoculo, demostrando que existen una alta afinidad simbiótica entre R. irregularis y el cultivar de maíz morado (Ávila-Peralta et al., 2015). Por otro lado, el contenido de prolina en raíz y hojas se vinculan de forma positiva y esto es debido al mecanismo de respuesta rápida en la biosíntesis de prolina a nivel tisular en el maíz morado frente al estrés salino (González, 2005).
Conclusiones
La cantidad de prolina foliar y radicular de Zea mays L. var. canteño mostró cambios significaivos en plantas inoculadas con Rhizophagus irregularis y sometidas a 0, 25, 50 y 100 mM de NaCl.
El contenido de prolina aumentó en raíces y hojas de Zea mays L. var. canteño, mostrando incrementos en relación directa con el aumento de la concentración NaCl en los niveles de 25, 50 y 100mM.
La inoculación con Rhizophagus irregularis fue capaz de atenuar la cantidad de prolina foliar en Zea mays L. var. canteño en la concentración de 100 mM de NaCl.
El porcentaje de micorrización en Zea mays L. var. canteño disminuyó conforme se incrementaron las cantidades de NaCl.












 uBio
uBio