Introducción
La leishmaniasis es una enfermedad infecciosa provocada por Leishmania sp., un protozoario intracelular del tejido fagocítico mononuclear, que afecta a la piel y las mucosas (Bassler et al., 2019; Bogdan & Röllinghoff, 1998). La infección se inicia por la picadura de insectos del género Phlebotomus o Lutzomyia, cuyos hospederos son mamíferos como perros, roedores, otros animales salvajes y el hombre (Vaselec 2021; Geroldinger et al., 2019).
En el Perú, la leishmaniasis es la segunda enfermedad endémica de tipo tropical y la tercera causa de morbilidad por enfermedades transmisibles luego de la tuberculosis y malaria (Ampuero, 2000). Se presenta en dos formas clínico- epidemiológicas; la uta y la espundia, la uta es de naturaleza benigna y es endémica en ciertas zonas de la vertiente occidental del Pacífico entre 1200 hasta los 3000 metros de altitud sobre el nivel del mar; la espundia, por el contrario, es una forma más severa y es propia de los valles orientales de la selva baja y toda la llanura amazónica (Cubas et al., 2019).
Los fármacos para el tratamiento de leishmaniasis se basan en el antimonio pentavalente en la forma de estibogluconato de sodio “Pentostam” o antimoniato de meglumina “Glucantime”, lo que a menudo produce efectos tóxicos (Costing et al., 2020). En consecuencia, los habitantes con leishmaniasis alivian los síntomas con tratamientos populares, como ingerir y aplicar cataplasmas de extractos crudos de plantas, tanto para la forma sistémica de la enfermedad, como para el tratamiento de las infecciones de la piel (Passero et al.,2021; Odonne et al, 2009).
La evaluación científica de las plantas medicinales, se fundamenta en las costumbres populares que han proporcionado un valioso aporte a la medicina moderna, y en consecuencia al tratamiento de enfermedades causadas por parásitos protozoarios (Houël et al., 2022; Panda y Luyten, 2018) se han evaluado algunos metabolitos para demostrar la actividad sobre protozoos; tales como naftoquinonas, alcaloides, acetogeninas, iridoides, glicósidos, quinoides y flavonoides (Hilaire et al.,2022; Quílez et al., 2018).
La familia Piperaceae presenta tres géneros y 830 especies principalmente hierbas y arbustos, siendo muchas de ellas son nativas del Perú (León, 2006). El género Peperomia presenta cuatro especies (dolabriformis, velutina, confertifolia y brachyphylla). Peperomia dolabriformis fue descrita por primera vez en Huancabamba y está distribuida en los departamentos de La Libertad, Cajamarca, Lambayeque y Amazonas entre los 200 a 2000 m.s.n.m., se encuentran sobre rocas y en grietas de las mismas, así como en los bosques caducifolios donde comparte su hábitat con cactáceas (Pino, 2006). A ella se le atribuye propiedades cicatrizantes, antidepresivas, antiespasmódicas, etc. (Bussmann et al., 2011). El género Peperomia ha sido objeto de estudio en diversas investigaciones que describen propiedades para el control de la leishmaniasis y otras enfermedades (Martinez et al., 2019); se ha reportado el efecto leishmanicida in vitro del difenol llamado piperogalin, grifolín o ácido grifólico (Fournet et al., 1996).
Con la finalidad de mejorar la calidad de vida de las personas, en relación al tratamiento de las enfermedades antes mencionadas, la presente investigación evaluó el efecto leishmanicida del extracto butanólico de Peperomia dolabriformis “Congona de zorro” a diferentes concentraciones sobre la viabilidad de los promastigotos de Leishmania peruviana cepa LC-26.
Materiales y métodos
Material biológico
Peperomia dolabriformis “Congona de zorro” de la ACP (Área de Conservación Privada Lomas del Cerro Campana) Trujillo-Perú y Leishmania peruviana cepa LC-26 proporcionada por el Laboratorio de Protozoología del Departamento de Microbiología y Parasitología de la Universidad Nacional de Trujillo, Perú.
Recolección y secado de la muestra
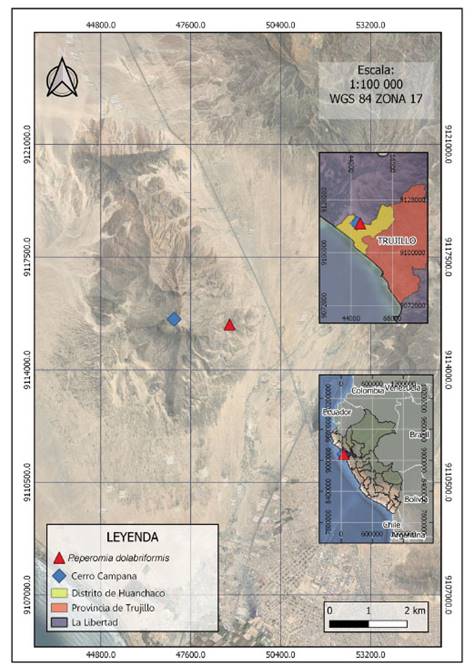
Las plantas enteras con inflorescencias de P. dolabriformis fueron recolectadas de las lomas costeras del cerro Campana, a una altitud entre los 200 a 400 m.s.n.m. del distrito de Huanchaco, provincia de Trujillo, región de La Libertad, Perú (Fig. 1) y fueron identificadas en el Herbarium Truxillense (HUT) de la Universidad Nacional de Trujillo con el código N° 58474. Luego se procedió a lavar la superficie de las flores, hojas, raíces y tallos con agua para eliminar partículas contaminantes y se dejó secar a temperatura ambiente por 24 horas. El secado se realizó en una estufa a 50 °C por 14 días.
Preparación del extracto butánolico de P. dolabriformis
Para la preparación del extracto butánolico se pulverizó la planta entera en un molino hasta obtener un polvo fino. La extracción se obtuvo con el equipo Soxhlet con el solvente butanol diluido al 70% con agua Milli Q. Por cada 100 g de muestra pulverizada se colocó 1 litro de solvente (alcohol butanol al 70%) (Immanuel et al., 2004). Se filtró en un sistema al vacío con un kitasato y embudo de Büchner, con un filtro de poro de 0,45 μm. El disolvente se evaporó en una cabina extractora de gases y se conservó a 4 ºC en una placa Petri.
Preparación del medio de cultivo bifásico para obtener promastigotos de L. peruviana cepa LC-26
La cepa de Leishmania peruviana LC-26 se replicó in vitro en 2 tubos de ensayo de 10 mL con tapa; se usó el medio bifásico compuesto por agar base enriquecido, más 10 % de sangre desfibrinada. Para ello, se pesó 4,0 g de agar sangre y se diluyó con 100 mL de agua Milli Q, luego se agregó
10 mL de sangre desfibrinada estéril sin anticoagulante, se homogenizó y se colocó 3,0 mL del agar sangre en el tubo de ensayo estéril y se dejó coagular. Luego, se realizó la suspensión celular utilizando 1000 µL de solución salina fisiológica al 0,9 %. Finalmente, se sembró 200 µL de la suspensión de promastigotos de L. peruviana en tubos de ensayo (Eperoni & McMahon-Pratt, 1989).
Preparación del medio monofásico para la exposición a los tratamientos
Para la exposición a los tratamientos se replicó la cepa obtenida del medio bifásico en un medio monofásico líquido; se usó 10 mL de MEM (minimum essential media) de la marca Gibco®, suplementado con suero bovino fetal al 10% en frascos de cultivo celular de 25 cm2. Estos fueron cultivados por 10 días a 27 °C hasta obtener una concentración celular de 106 células (Childs et al., 1978).
Diseño experimental para el ensayo leishmanicida
Se usó un diseño experimental en bloques completamente al azar. Se trabajó con el extracto butánolico de P. dolabriformis a concentraciones de 0,009 mg/mL, 0,09 mg/mL y 0,9 mg/mL, a partir de una solución madre de 100 mg/mL y buffer fosfato 1X como control negativo. Cada concentración representó un tratamiento y cada tratamiento se realizó por triplicado con 10 mL de cultivo de MEM con un total de 12 unidades experimentales mantenidas en una estufa a 27 °C (Bussmann et al., 2011). Posteriormente, se contabilizó el número de promastigotos vivos a las 24, 48, 72 y 96 horas constituyendo los bloques.
Toma de datos
Se procedió a contar en la cámara de Neubauer las células vivas dentro de cada tratamiento a las 24, 48, 72 y 96 horas. Para hallar el número de células vivas por cada tratamiento se usó la siguiente fórmula:
N.° de individuos/mL = N.10000/4. D (Alzamora et al., 2007)
Donde:
N: Número de células vivas
4: Número de cuadrantes contados
D: Factor de dilución.
Para evaluar el porcentaje de mortalidad del extracto butanólico de P. dolabriformis se usó la siguiente fórmula:
% de mortalidad = [100- (L2/L1) x 100] (Alzamora et al., 2007)
Donde:
L2 = Número de células viables después del tratamiento con el extracto
L1 = Número de células viables en el cultivo control (PBS)
Resultados y discusión
Al evaluar el efecto leishmanicida del extracto butanólico de Peperomia dolabriformis de los promastigotos de Leishmania peruviana cepa LC-26, se observa que en el control negativo con buffer PBS (Fig. 2A) hay un crecimiento exponencial de la cepa con formaciones tipo roseta, lo que evidencia una elevada actividad reproductiva. En las concentraciones de 0,009 mg/mL (Fig. 2B) a las 24 horas se observaron formaciones tipo roseta en menor cantidad y también células individuales, con la concentración de 0,09 mg/mL (Fig. 2C) evaluadas a las 24 horas se observaron promastigotos reunidos flotando en el medio de cultivo inmóviles y con la concentración de 0,9 mg/mL (Fig. 1D) se observaron promastigotos flotando en el medio de cultivo desde las 24 horas de exposición del extracto butanólico, lo que evidencia la muerte total de los promastigotos en el recuento con la cámara de Neubauer.
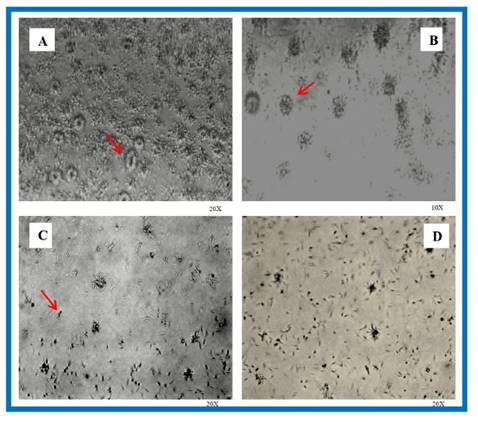
Fig. 2 Efecto de las diferentes concentraciones del extracto butanólico de P. dolabriformis sobre la viabilidad de L. peruviana cepa LC-26 a diferentes tiempos de exposición; A. L. peruviana expuesta al control (negativo) con buffer fosfato crecimiento exponencial con presencia de rosetas a las 24 horas; B. Tratamiento a la concentración de 0,009 mg/mL presencia de rosetas con menor número de promastigotos a las 24 horas; C. Tratamiento a la concentración de 0,09 mg/mL presencia de células individualizadas inmóviles a las 24 horas; D. Tratamiento a la concentración de 0,9 mg/mL a las 24 horas reducción total de rosetas y disminución de promastigotos.
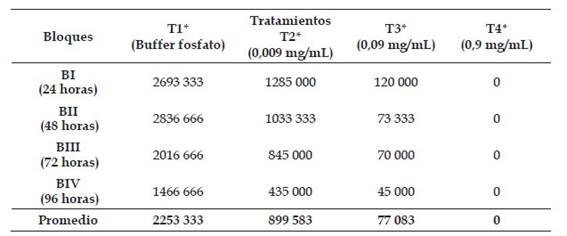
En la Tabla 1, se muestran los promedios de los promastigotos vivos de L. peruviana cepa LC-26 expuestos a diferentes concentraciones T1: Control negativo con buffer fosfato (PBS); T2: 0,009 mg de extracto butanólico de P. dolabriformis /mL; T3: 0,09 mg/mL; T4: 0,9 mg /mL y tiempos de exposición BI: 24 horas; BII: 48 horas; BIII: 72 horas y BIV: 96 horas evidenciándose una disminución de los promastigotos vivos con respecto al incremento de las concentraciones del extracto butanólico de P. dolabriformis ; así mismo los promedios de los promastigotos vivos fue disminuyendo a medida que aumentaba el tiempo de exposición al extracto butanólico, obteniendo el menor número de promastigotos vivos (77 083) a la concentración de 0,09 mg/mL, a la concentración 0,9 mg/mL ya no se observó la presencia de especímenes vivos.
Tabla 1 Promedios de promastigotos vivos de Leishmania peruviana cepa LC-26 expuestos a diferentes concentraciones y tiempos de exposición al extracto butanólico de P. dolabriformis
p<0,05
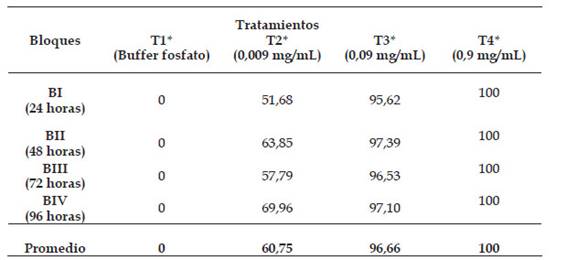
En la Tabla 2, se aprecia el efecto leishmanicida del extracto butanólico de P. dolabriformis a diferentes concentraciones T1: Control negativo con buffer fosfato (PBS); T2: 0,009 mg de extracto butanólico de P. dolabriformis /mL; T3: 0,09 mg/mL; T4: 0,9 mg/mL y tiempos de exposición BI: 24 horas; BII: 48 horas; BIII: 72 horas y BIV: 96 horas evidenciándose una eficacia del 100 % de mortalidad a la máxima concentración (T4: 0,9 mg/mL). En cuanto al control negativo T1, el porcentaje de mortalidad fue de 0 %.
Tabla 2 Promedios porcentuales de mortalidad de promastigotos de Leishmnania peruviana cepa LC-26 expuestos a las diferentes concentraciones y tiempos de exposición al extracto butanólico de P. dolabriformis
p<0,05
Los resultados obtenidos con las diferentes concentraciones y tiempos de exposición al extracto butanólico de P. dolabriformis (Tabla 1) muestran que a medida que aumenta la concentración y el tiempo de exposición (T1: control negativo; T2: 0,009 mg/mL; T3: 0,09 mg/mL y T4: 0,9 mg/mL), la viabilidad disminuye, lo que evidencia el efecto leishmanicida del extracto butanólico de P. dolabriformis.
Con respecto al control negativo el número de promastigotos vivos a las 72 y 96 horas se apreció una disminución de estos, pero se mantuvo a la concentración de 106 células resultados similares con los de (Steiger & Steiger (1977); Siripattanapipong et al., 2019) quienes reportaron la disminución de los promastigotos vivos debido al agotamiento de los nutrientes en el medio de cultivo. En los tratamientos T2 y T3 a las 72 y 96 horas, el efecto leishmanicida se incrementó por el efecto aditivo del agotamiento de nutrientes en el medio (Tabla 1).
Existen estudios que muestran que las Piperaceae contienen fitoconstituyentes y metabolitos secundarios con efecto antibacteriano, antifúngico, antiviral y antiparasitario, específicamente contra Trypanosoma y Leishmania (Ferreira et al., 2014; Scodro et al., 2015; Castro et al., 2015; Donfack et al., 2021). P. dolabriformis contiene sustancias como metabolitos fenólicos, flavonoides, glicósidos cardiotónicos, resinas, catequinas, triterpenos, esteroides, aceites esenciales y saponinas (Roncal & Saldaña, 2014). Es posible que el conjunto de estos o por lo menos uno de ellos ejerza el efecto leishmanicida. Los estudios de Vega et al. (2021) reportaron que los aceites esenciales del género Piper tienen acción antiparasitaria en Leishmania braziliensis y Tripanosoma cruzi.
Los diferentes tratamientos indican una relación directamente proporcional entre el incremento de la concentración del extracto butanólico de P. dolabriformis y el porcentaje de mortalidad (T1: control negativo; T2: 0,009 mg/mL; T3: 0,09 mg/mL y T4: 0,9 mg/mL) obteniéndose 0; 60,75; 96,66 y 100 % de mortalidad, respectivamente (Tabla 2). Estos resultados coinciden con el trabajo en P. galioides H.B.K oriunda del Perú y ampliamente estudiada por sus propiedades fitomedicinales; mostrando propiedades leishmanicida con el aumento de la concentración en los diferentes extractos (EtOAc, éter de petróleo, EtOH) (Mahiou et al., 1996; Mahiou et al., 1995).
Es importante mencionar que el efecto leishmanicida de los extractos vegetales dependerá del tipo de extracción que se utilice, ya sea con éter de petróleo, metanol, 1-butanol, etanol, etc. Estos compuestos químicos se usan como disolventes debido a su polaridad, por lo tanto, los fitoconstituyentes extraídos variarán en concentración y calidad; así lo demostraron Mahiou et al. (1996), quienes usaron diversos tipos de solventes en la extracción de metabolitos de la especie P. galioides y encontraron diferencias en la acción leishmanicida con una concentración de 100 μg/mL.
El efecto leishmanicida del extracto butanólico de P. dolabriformis probablemente se debería a la presencia de fenoles, como lo demostraron Oliveira et al. (2012), quienes aislaron el alquenilfenol gibbilimbol B de Piper malacophyllum y mostraron que altera la permeabilidad de la membrana plasmática de Leishmania, lo cual conduce a la fuga de iones y consecuentemente a la muerte celular.
Se ha reportado que los flavonoides pueden tener una fuerte actividad antiproliferativa contra la Leishmania porque inhiben las enzimas de la biosíntesis de poliaminas, lo que detiene el crecimiento celular; esto los convierte en fármacos potenciales para el tratamiento de todas las formas de leishmaniasis (Araujo et al., 2019).
Se ha reportado la actividad leishmanicida de los flavonoides por la interacción con el cofactor Mn2+ y el sustrato L-arginina, lo que inhibe la enzima arginasa de L. amazonensis; la arginasa es la enzima diana de la síntesis de poliaminas en Leishmania, por lo tanto, al no producirse las poliaminas se detiene el ciclo celular (Singh et al., 2014; Silva et al., 2012).
Es probable que los flavonoides totales, así como las catequinas de P. dolabriformis impidan las señales de la trascripción y traducción de Leishmania e inhiban el crecimiento celular in vitro (Vannier-Santos et al., 2008).
Los resultados encontrados del efecto leishmanicida de P. dolabriformis de las lomas del cerro Campana en la región La Libertad constituyen una nueva alternativa para la elaboración de nuevos fármacos en base a los principios activos de esta planta, por lo tanto, se debe continuar con las investigaciones fitoquímicas, evaluaciones in vivo y a futuro se convierta en una nueva opción para el tratamiento de la leishmaniasis.
Conclusiones
El extracto butanólico de P. dolabriformis tiene efecto leishmanicida sobre los promastigotos de L. peruviana cepa LC-26.
Existe una relación positiva entre las concentraciones del extracto butanólico de P. dolabriformis y el efecto leishmanicida sobre los promastigotos de L. peruviana cepa LC-26.
El extracto butanólico de P. dolabriformis a la concentración de 0,9 mg/mL ocasionó el 100% de mortalidad a los diferentes tiempos de exposición ensayadas.












 uBio
uBio