Introducción
Uno de los problemas de salud más frecuentes y graves que presenta la región norte del Perú, es la presencia del mosquito Aedes aegypti. Este mosquito es el vector principal de los virus del Dengue, Zika, Fiebre amarilla y Chikungunya (Cabezas & Donaires, 2017); presentándose como brotes epidémicos en varias zonas de Tumbes, Piura, Lambayeque y La Libertad. A. aegypti también, es un problema en la Selva peruana como en Amazonas, Loreto, Madre de Dios y Ucayali donde las constantes lluvias brindan las condiciones propicias para su propagación (Javier, 2018).
Aedes aegypti posee un ciclo biológico que consta de cuatro estadios: huevo, larva, pupa y adulto (Ramírez, 2019). Las hembras colocan los huevos en recipientes con agua estancada limpia, que se pueden encontrar dentro o fuera del domicilio (Villamar et al., 2020). Una vez eclosionados los huevos, las larvas pasan por cuatro estadios denominados: L1, L2, L3 y L4, estos se desarrollan en ambientes acuáticos al igual que su posterior fase de pupa, finalmente alcanza la fase adulta como un pequeño mosquito volador (Anoopkumar et al., 2017).
Para controlar el vector se viene utilizando insecticidas químicos, larvicidas y adulticidas siendo la única solución para prevenir las enfermedades que este mosquito transmite (Conde et al., 2015). Sin embargo, su uso no tuvo efecto significativo en la disminución de poblaciones de este mosquito (Cabezas et al., 2015). Por otro lado, se recomienda que productos químicos no deben ser utilizados de manera indiscriminada ya que su presencia representa un riesgo que afecta no solo al ambiente, sino que también a la salud humana (Villamar et al., 2020).
El larvicida comercial Temephos es el producto químico órganofosforado con más demanda para el control de poblaciones larvarias de A. aegypti (Valle et al., 2019). Además, este producto muestra una efectividad de 68,4%, a una concentración de 0,04 ppm. Fue el larvicida utilizado en ciudades del Perú como Lima y Trujillo durante la reaparición del mosquito A. aegypti en el año 2000 (Pérez, 2017). Sin embargo, el uso excesivo y constante de este producto generó la aparición de resistencia en poblaciones de A. aegypti (Terán et al., 2014). Para controlar este vector se realizan acciones de saneamiento, vigilancia de posibles criaderos y otros métodos (Valle et al., 2019). Dentro del control biológico se destaca el uso del Bacillus thuringiensis var. israelensis (Bti), una bacteria formadora de esporas (Ponce et al., 2018).
Bacillus thuringiensis (Bt) es una bacteria Gram positiva, cuya principal característica es la producción de cristales de naturaleza proteica, denominados δ-endotoxinas o proteínas Cry que le confieren la propiedad entomocida (Devidas et al., 2014; Velásquez et al., 2018). El modo de acción de estas proteínas se produce por medio de la ingesta de los cristales por las larvas, solubilizándose a nivel del intestino medio, el mismo que presenta un pH alcalino; de esta manera son liberadas las protoxinas, que son convertidas proteolíticamente en toxinas (Aguirre & Duarte, 2020; Llanos, 2021). Estas toxinas se adhieren a los receptores de las membranas del intestino medio, ocasionando la formación de poros generando daño en el epitelio (Carvalho et al., 2018; Viana et al., 2021). Estos poros ocasionan un influjo de iones de K+, disminuyendo el pH del medio y produciendo lisis celular osmótica a la larva que es incapaz de alimentarse (Castañet & Moreno, 2016). Este desequilibrio osmótico y fisiológico, también produce la filtración de los contenidos intestinales mezclándose con la hemolinfa provocando una sepsis y muerte del insecto (Liu et al., 2021).
En Armenia, Colombia se probó al Bti como un eficaz larvicida, el cual se encuentra dentro de los programas de control vectorial de ese país, pero se aconseja que se utilice solo en lugares urbanos donde pueden ser posibles criaderos de A. aegypti, este experimento concluye que el uso de Bti es bueno para el control de larvas de este mosquito, pero también sugieren no descuidar y explorar el control de los adultos ya que son vectores del dengue (Aguirre & Duarte, 2020).
En Brasil se hicieron estudios acerca de la eficacia de B. thuringiensis sobre A. aegypti, confirmando el gran efecto larvicida de B. thuringiensis en especial la cepa Bti (Dos Santos et al., 2018). Otro estudio en Brasil, demostró la eficacia de ciertos productos basados en B. thuringiensis obteniendo el 100% de larvas muertas, además lograron demostrar que poseen una alta persistencia de entre 15 a 30 días dependiendo de las condiciones ambientales que presenta cada zona (Nakazawa et al., 2020).
La presente investigación tuvo como finalidad evaluar el efecto bioinsecticida; así como la concentración máxima que produce el Bacillus thuringiensis H-14 var israelensis mutante sobre larvas III de Aedes aegypti.
Materiales y métodos
Preparación del bioinsecticida
Se empleó Bacillus thuringiensis H-14 var. israelensis (Bti), proporcionado por el laboratorio de Bionanotecnología y Reproducción Animal de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo-Perú. Se preparó el medio de producción a gran escala propuesto por Abarca et al. (1992). El Bti mutágeno se obtuvo con cloruro de hidroxilamina a la concentración de 20 ppm (Pedro et al., 2019), se colocó el Bti mutante en un medio fermentativo con 220 rpm de agitación a 30°C por 48 horas. Una vez terminado el proceso de fermentación, se centrifugó a 3500 rpm por 30 minutos eliminándose el sobrenadante, posteriormente se realizó el recuento en placa para la determinación de la concentración del bioinsecticida. El bioinsecticida estuvo conformado por cristales, esporas y restos celulares.
Obtención de adultos de Aedes aegypti
Se utilizaron huevos de A. aegypti provenientes de la ciudad de Bagua Grande. Los huevos fueron sumergidos en recipientes de 24x15x3 cm con 500 ml de agua potable declorada. Una vez eclosionados los huevos tras un periodo de 4 a 5 días, las larvas fueron alimentadas con conejina triturada y esterilizada. El agua de los recipientes se cambió cada 2 días hasta llegar al estadio de pupa. Luego se colocaron 20 pupas en 10 recipientes de 100 ml de capacidad con agua potable declorada, hasta obtener adultos, los mismos que fueron alimentados con sangre proveniente de un hámster (hembras hematófagas) y solución azucarada (machos fitófagos) (Rebaza et al., 2020).
Obtención de larvas III de Aedes aegypti
Tras la cópula de los adultos en las jaulas de cría, los huevos obtenidos fueron sumergidos en recipientes de 24x15x3 cm con 500 ml de agua potable declorada. Una vez eclosionados los huevos, las larvas fueron alimentadas con conejina triturada previamente esterilizada. El agua de los recipientes se cambió cada 2 o 3 días desde la eclosión hasta llegar al tercer estadio larval. Todo el proceso se realizó utilizando iluminación constante, provista por focos de 50 watts para mantener una temperatura a 26°C ± 1 (Blas et al., 2017).
Exposición de larvas III de Aedes aegypti a Bacillus thuringiensis H-14 var. israelensis mutante
Para el desarrollo de los bioensayos se utilizaron 300 larvas en estadio III de A. aegypti. Se trabajó con tres tratamientos o concentraciones distintas (16 560, 33 120 y 66 240 esp/mL) de Bti mutante y un grupo control. Se utilizó vasos de Tecnopor descartables con 100 ml de agua destilada y 25 larvas en estadio III de A. aegypti. A cada tratamiento se le adicionó una suspensión de Bti mutante con excepción del grupo control manteniendo las mismas condiciones ambientales. Cada tratamiento se realizó por triplicado. Finalmente se hizo el recuento de larvas muertas a las 24, 48 y 72 horas (Rebaza et al., 2020).
Análisis estadístico de la exposición de larvas III de Aedes aegypti a Bacillus thuringiensis H-14 var. israelensis mutante
Con los datos obtenidos a partir de los bioensayos, se realizó el Análisis de varianza y la prueba Tukey para determinar la existencia de diferencias significativas entre los tratamientos (Blas et al., 2017). Se utilizó el programa estadístico RStudio de uso libre para las pruebas estadísticas de análisis de varianza y prueba Tukey con una PE≤0.05.
Resultados
En la Tabla 1, se indica el promedio de larvas III de A. aegypti muertas después de la exposición a tres concentraciones diferentes C1, C2 y C3 (16 560, 33 120 y 66 240 esp/mL respectivamente) de B. thuringiensis H-14 var. israelensis (Bti) mutante y el grupo control a las 24, 48 y 72 horas. Se observó un mayor número de larvas III muertas a las 72 horas a la concentración de 66 240 esp/mL. El T2 con una concentración de 33 120 esp/mL, también obtuvo un alto número promedio de larvas III muertas a las 72 horas después de la exposición. En el grupo control no se reportaron larvas muertas.
Tabla 1 Número promedio de larvas muertas del III estadio de Aedes aegypti, expuestas a diferentes concentraciones de Bacillus thuringiensis H-14 var. israelensis mutante evaluadas a las 24,48 y 72 horas, bajo condiciones de laboratorio.
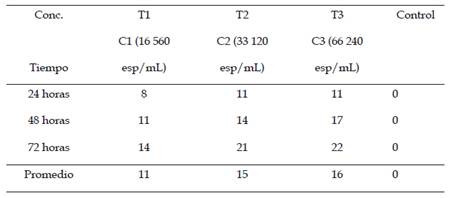
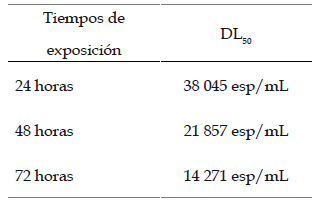
En la Tabla 2, se muestra la dosis letal media (DL50) de Bti mutante para los diferentes tiempos de exposición (24, 48 y 72 horas) de las larvas III de A. aegypti.
Tabla 2 Dosis Letal Media (DL50) de las diferentes concentraciones (esporas/mL) de Bacillus thuringiensis H-14 var. israelensis mutante sobre larvas del III estadio de Aedes aegypti a las 24, 48 y 72 horas, bajo condiciones de laboratorio.
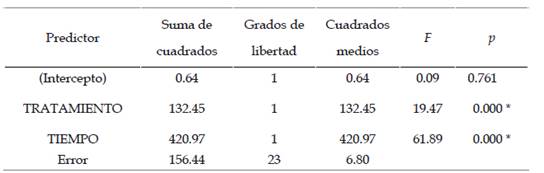
El Análisis de varianza de las diferentes concentraciones presente en la Tabla 3 en relación a la mortalidad larval de A. aegypti frente a la acción bioinsecticida de las diferentes concentraciones de Bti mutante (16 560, 33 120 y 66 240 esp/mL) presentaron diferencias significativas entre los tratamientos y entre los tiempos de exposición (24, 48 y 72 horas).
Tabla 3 Análisis de Varianza para la mortalidad de larvas del III estadio de A. aegypti expuestas a diferentes concentraciones de B. thuringiensis H-14 var. israelensis mutante en condiciones de laboratorio.
* Existe diferencia significativa
P.E. ≤ 0.05
Los datos obtenidos mediante la comparación de las distintas concentraciones de Bti mutante empleando la prueba Tukey (Tabla 4), evidenciaron la existencia de diferencias significativas entre los tratamientos T1-T2 y T1-T3, por otro lado, los tratamientos T2-T3 no presentaron diferencia significativa.
Tabla 4 Comparación de las distintas concentraciones de Bacillus thuringiensis H-14 var. israelensis mutante de los tratamientos mediante la prueba Tukey.
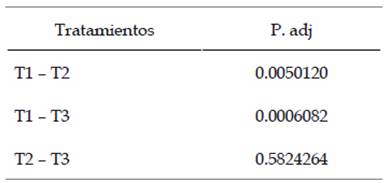
Leyenda:
T1 - T2: existe diferencia significativa
T1 - T3: existe diferencia significativa
T2 - T3: no existe diferencia significativa
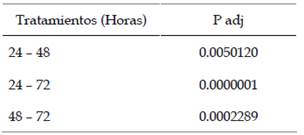
Mediante la prueba Tukey (Tabla 5) se compararon los tiempos de exposición de larvas III de A. aegypti a Bti mutante, demostrando la existencia de diferencias significativas entre los tiempos de exposición de los tratamientos.
Tabla 5 Comparación del tiempo (horas) de exposición de larvas III de Aedes aegypti frente a Bacillus thuringiensis H-14 var. israelensis mutante mediante la prueba Tukey.
Leyenda:
24 - 48: existe diferencia significativa
24 - 72: existe diferencia significativa
48 - 72: existe diferencia significativa
Discusión
La exposición de larvas III de A. aegypti frente a B. thuringiensis H-14 var. israelensis (Bti) mutante, a las distintas concentraciones y tiempos de exposición producen un efecto larvicida en A. aegypti, ocasionando una disminución significativa en la cantidad de larvas vivas en cada tratamiento (Tabla 1), además, se evidenció que a una mayor concentración de Bti mutante mayor es el número de larvas muertas, estos resultados concuerdan con los datos obtenidos por Blas et al. (2017).
El tiempo de exposición es una variable que influye sobre la acción biocida que posee Bti mutante, esto debido a que a mayor tiempo de exposición mayor es la mortalidad larval. El tiempo de exposición más eficaz fue de 72 h para los tres tratamientos empleados (Tabla 1), puesto que a un mayor tiempo de exposición ocurre una mayor acumulación de la δ-endotoxina ingerida por las larvas ocasionando un mayor porcentaje de mortalidad como lo reportado por Gama et al. (2013). Las toxinas generadas por Bti son altamente específicas para A. aegypti, estas actúan mediante ingestión en condiciones óptimas de pH y la presencia de enzimas proteolíticas en el intestino de las larvas, pueden ser hidrolizados los cristales formando una sustancia tóxica que actúa desintegrando el intestino medio de la larva llevándola finalmente a la muerte (Rebaza et al., 2020).
Para constatar la acción de una determinada sustancia y/o producto que se planea aplicar para el control de una población de insectos es necesario conocer su dosis letal media (Blas et al., 2017). Basados en los resultados obtenidos en el bioensayo se observa que la dosis letal media (DL50) (Tabla 2) va disminuyendo conforme va aumentando el tiempo de exposición. La DL50 las 24, 48 y 72 horas fueron de 38045, 21857 y 14271 esp/mL respectivamente, concordantes con los resultados obtenidos por Rebaza et al. (2020). La relación dosis letal media (DL50) y tiempo también son similares a los resultados obtenidos por Zavaleta (2010), donde evaluó el efecto de Bti cultivado en sanguaza.
El análisis de varianza (Tabla 3) presento diferencias significativas entre los tratamientos, debido a que es un método altamente sensible a las diferencias que puedan presentarse entre ellos; sin embargo, para conocer entre que tratamientos existen tales diferencias se aplicó la prueba de comparación de Tukey (Tabla 4) y (Tabla 5). Las diferencias presentes entre los tratamientos estuvieron sujetas a la concentración de Bti mutante, ya que al haber una mayor concentración habrá una mayor cantidad de cristales para ejercer su acción tóxica al ser consumidos por las larvas de A. aegypti.
La presente investigación, nos brinda una visión más clara acerca del potencial de Bti mutante como controlador biológico de A. aegypti, siendo utilizado como una alternativa para el control de vectores y la disminución del uso de insecticidas químicos, puesto que estos generan resistencia, causan daño a la población y contribuyen con la contaminación del medio ambiente. Es por ello, que se propone el uso de Bti mutante como principal alternativa para el control de A. aegypti.












 uBio
uBio 




