Introducción
A nivel mundial el cultivo de tilapia es una de las actividades más desarrolladas en la Acuicultura, debido a que la "tilapia" es una especie de rápido crecimiento, con eficiente conversión alimenticia y alta tasa de supervivencia. Zafra et al. (2019) reportan que el factor de conversión alimenticia en el cultivo de Oreochromis aureus fue de 1,30 con alimento del 35% de proteínas en 135 días de crianza.
Su tecnología de producción en diversos sistemas de cultivo ha permitido su comercialización y aprovechamiento como alimento para consumo humano. Es necesario indicar que la producción de la "tilapia" con alimento artificial constituye el principal factor de producción de mayor costo (50-60%). En este sentido, la tecnología del biofloc se presenta como una alternativa de alimentación suplementaria de menor costo.
Guillermo & Mujica (2019) reportan que el Biofloc se debe utilizar en la producción acuícola de la "tilapia" por ser una opción sostenible y amigable con el medio ambiente. Asimismo, Hernandez et al. (2019) reportan la importancia del biofloc en la acuicultura señalando que mejoran la producción de peces, mantienen la calidad de agua y utilizan un mínimo recambio de agua.
De acuerdo a ello, Monroy-Dosta et al. (2013) reportan que las bacterias y las levaduras asociadas al biofloc mejoran la calidad del agua y es una fuente de alimento natural en los peces. La composición del Biofloc está conformada por ciliados, rotíferos, microalgas, nematodos, bacterias y levaduras. Ibarra et al. (2015) reportan que en la composición del Biofloc maduro también incluyen a Chlorella, Spirogyra, Naviculas, y flóculos.
Todos los componentes del biofloc se convierten en alimento vivo para las "tilapias", Rodríguez et al. (2015) concluyen que el hábito alimentario omnívoro de la "tilapia" y la facilidad de absorber nutrientes por el alimento vivo del Biofloc mejora la producción.
Ibarra et al. (2015) reportan que cuando se utiliza biofloc no se necesita realizar recambios de agua a los sistemas de cultivo y puede mantener densidades de cargas de tipo intensivo. Investigaciones de Collazos & Arias-Castellanos (2015) señalan que la tecnología del Biofloc, también se puede utilizar en cultivo super intensivo de especies nativas para incrementar la producción considerando las características y estadio de las especies.
La tecnología del biofloc también fue utilizada para crustáceos y peces. En este sentido, Ibarra et al. (2019) reportan la aplicación de biofloc en Litopenaeus vannamei con una relación de C/N de 20:1 inoculando Thalassiosira sp. en cultivo con densidades de 40 Ind/m² con un buen rendimiento y con un análisis proximal del 36,53% de proteína cruda.
Bru-Cordero et al. (2017) experimentan con un bicultivo entre "paco" y "tilapia" con densidades de 1:1 y reportan que el mejor alimento del biofloc se generó con alimento de proteína vegetal del 24% con rendimientos de 11,4 kg/m3 y supervivencias de 98%. Zapata et al. (2017) aplicando el sistema de biofloc en O. niloticus reportan que lograron un factor de conversión alimenticia de 1,37 y una supervivencia del 95% cuando se aplicó una relación de C/N de 10:1.
Además, Muñoz (2018) experimenta con biofloc inoculado con probióticos comerciales Eco-aquablend® y Eco-aquaprotect® encontrando que las "tilapias" mejoran su crecimiento porque se genera alimento de buena calidad.
En este contexto, el objetivo de la investigación fue determinar el Alimento vivo producido por el Biofloc en la crianza de Oreochromis aureus.
Material y métodos
La investigación se realizó en el SL04LA04- Laboratorio de Acuicultura del Departamento Académico de Pesquería de la Universidad Nacional de Trujillo en el 2021.
La producción de alimento vivo, se realizó en tanques de 1 m3 en condiciones indoor. Para la aireación de las unidades experimentales se utilizó un Ring Blower modelo GB con flujo máximo de 57 m3/h y se implementaron con un sistema de aireación de dos tipos, uno en forma de L de tubos de PVC perforado en el extremo final, asentados en el fondo del tanque para el suministro de aire, además se colocaron dos líneas de aire con piedras difusoras.
En el sistema Biofloc se inició con un tratamiento control de abril a julio 2021 sin suministro de fuentes carbonadas y de agosto a diciembre se utilizaron dos tratamientos denominados T-5 con Melaza y T-6 con Harina de Plátano en tanques de 1 m3 como fuentes de carbono y como fuente de nitrógeno se utilizó el agua de la crianza de O. aureus. El Biofloc se mantuvo con inóculos quincenales de 0,02:1 en T1 y en T2, luego se complementó con el 10% del volumen del agua utilizada en la crianza de O. aureus y el resto del volumen se completó con agua potable.
La crianza de O. aureus se realizó en dos tanques de 0,5 m3 con una densidad de 100 individuos y se alimentó con tasas de alimentación entre 15 a 2% utilizando alimento artificial de 45 a 35% de proteínas. Esta agua de cultivo fue utilizada en la producción de Biofloc con melaza y harina de "plátano".
La muestras de agua se recolectaron de agosto a diciembre 2021, estas fueron conservadas en frascos de 1 L codificados y fijadas con formol al 4%, el control y monitoreo de la producción de Alimento vivo se realizó semanalmente con un análisis cualitativo y cuantitativo para el fitoplancton y sólo cualitativo para el zooplancton.
La determinación y cuantificación del fitoplancton se realizó mediante el uso de un microscopio invertido Üthermol, para registrar la composición del plancton se usó un microscopio compuesto ACCU-SCOP 3000 Led Series con 10 y 40 X, además de claves taxonómicas para determinar el fitoplancton y zooplancton (Streble & Krauter, 1987; Fernández, 1994; Fernández, 1999; Asociación Española de Normalización y Certificación, 2007; NORDIC, 2019 ).
Se realizaron controles diarios de temperatura del agua con un termómetro digital Taylor, y quincenales de pH con un pen type pH meter y TDS con un digital model YL TDS2-A. Finalmente, se aplicó el análisis de varianza de una sola vía, con un nivel de significancia 0,05 y un nivel de confianza del 95%, para determinar si existe diferencia significativa en los tratamientos T5 y T6.
Resultados
El alimento vivo producido con melaza y harina de "plátano" en el biofloc presentó flóculos de diversos tamaños y de formas irregulares. En el Tratamiento control se observó que necesitaba entre 15 y 20 días en madurar con el desarrollo predominante de Chlorella sp. En los tratamientos T5 y T6, el Biofloc generó la producción de fitoplancton y zooplancton en siete días con diferentes taxas que sirvieron de alimento vivo a O. aureus.
En el análisis cualitativo del fitoplancton se obtuvo diferentes coloraciones del agua en los tanques variando de verde claro, oscuro, amarillo, marrón claro predominando las Chlorophytas. Se encontraron flóculos maduros de Biofloc con Chlorophytas, Bacillariophytas y algas filamentosas. En cuanto al análisis cualitativo del zooplancton fue característico encontrar ciliados, rotíferos, nematodos, oligoquetos y larvas de zancudos.
La composición fitoplanctónica del alimento vivo producido por el biofloc estuvo conformada por dos a cuatro microalgas verdes en el tratamiento T-5 con melaza y se mantuvo constante con tres microalgas en el tratamiento T-6 con harina de plátano (Tabla 1).
Tabla 1 Alimento vivo fitoplanctónico producido semanalmente con los dos tratamientos de Biofloc de agosto a diciembre 2021
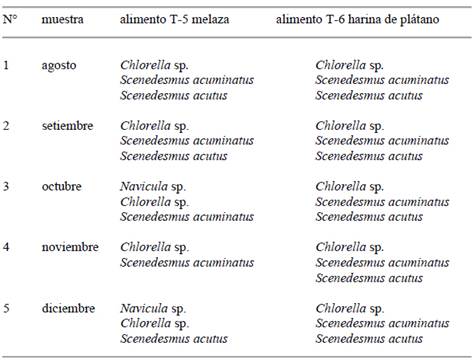
En ambos tratamientos, T-5 y T-6, la predominancia cualitativa y cuantitativa fue de Chlorella sp. con rangos entre 99,06 y 81,80% en T-5 y de 98,64 a 66,25% en T-6.
El biofloc que se elaboró en base a melaza-T5, presentó cambios en la composición del alimento de octubre a diciembre con la presencia de Navicula sp. con rangos entre 18.18 a 6,67%. En el biofloc del tratamiento T-6 con Harina de plátano, la composición estuvo conformada siempre por Chlorella sp., Scenedesmus acuminatus y Scenedesmus acutus pero de octubre a diciembre los rangos de porcentajes para Chlorella sp. fluctuaron entre 85,29 y 60,75%.
En cuanto a la composición del alimento vivo zooplanctónico producido en los tratamientos T-5 y T-6 del Biofloc, estuvieron conformados por los ciliados, rotíferos, nematodos, oligoquetos y larvas de zancudos (Tabla 2).
Tabla 2 Composición cualitativa del Alimento vivo Zooplanctónico del Biofloc producido con los tratamientos T-5 melaza y T-6 harina de plátano de agosto a diciembre 2021
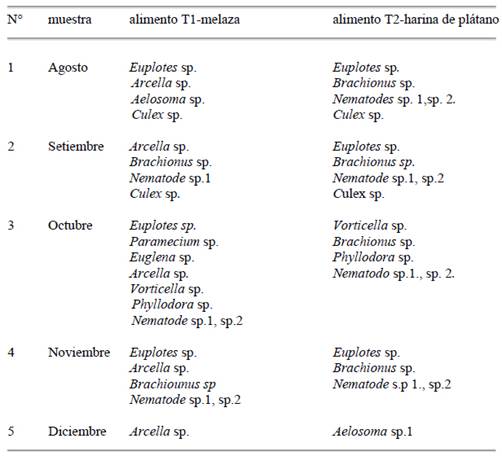
De agosto a diciembre se encontraron composiciones diferentes en el zooplancton y en octubre 2021 se incrementaron los grupos zooplanctónicos coincidiendo con los flóculos más grandes. La temperatura promedio del agua en las unidades experimentales T-5 y T-6 fluctuaron entre 18,5 y 25,5 °C para setiembre y diciembre 2021 respectivamente, en octubre se mantuvo en 20 °C, el pH varió entre 7,2 a 7,6 y el TDS se encontró en rangos de 100 a 500 ppm.
En el análisis de varianza aplicado a Chlorella sp. como microalga predominante, no se encontró diferencia significativa en los tratamientos T5 y T6, a diferencia de S. acuminatus, S. acutus y Navicula sp., que sí presentaron diferencias significativas. Asimismo, cuando se analizó el número de fitoplanctontes y zooplanctontes con el biofloc del T5-melaza y T6-harina de plátano, no se encontraron diferencias significativas.
Discusión
El biofloc puede ser producido de diferente manera, entre ellos, El-Hawarry et al. (2021) consideran que en su preparación deben tener urea, sedimentos de fondo de un estanque y levadura además de los efluentes que producen las "tilapias". En esta investigación el biofloc producido tuvo como componentes la melaza y la harina de "plátano" en los tratamientos, lo que indica que la producción del biofloc puede ser manejada de diferentes maneras con la obtención de alimento vivo importante para las "tilapias".
Otras investigaciones, como las de Joo-Jung et al. (2017) reportan que el sistema de Tecnología del Biofloc Autotrófico es otra opción de manejo en reemplazo al Sistema de Biofloc Heterótrofo Microbial (BFT). En nuestro sistema se tuvo la producción de fitoplanctontes (autótrofos) y de zooplanctontes (heterotróficos) compartiendo dos sistemas de Biofloc secuenciales en 15 días hasta la aplicación del nuevo inóculo.
Se concuerda con El-Hawarry et al. (2021) sobre la disminución de oxígeno en los sistemas de cultivo, debido a que el biofloc regula las concentraciones de amoniaco, nitrito y nitratos, por ello, esta investigación también se aplicó una fuente de aireación en el fondo y en la columna de agua propiciando que la materia orgánica con la acción de la melaza y harina de "plátano" produzca alimento vivo.
Rosas et al. (1998) reportan que el desarrollo de estas microalgas servirán como alimento vivo del Biofloc además de remover el nitrógeno, fosfatos y materia orgánica al 100, 78 y 36% respectivamente, mejorando la calidad de agua.
Los fitoplanctontes producidos en los tratamientos T5 y T6 fueron Chlorella sp. como microalga predominante, además de S. acutus, S. acuminatus y Navicula sp. importantes en la alimentación de larvas y juveniles de peces y crustáceos por su nivel de proteínas y lípidos, ya que aportan entre 26 y 28% de proteínas y entre 4,70 y 2,47% de lípidos respectivamente ( Rosas et al., 1998; Andrade et al., 2009; Jimenez, 2016; Contreras et al., 2019). La formación de éstas microalgas responde al medio nutritivo, cuando se utilizó melaza en T-5, el agua se tornó marrón con tendencia a la acidez mientras que en T-6 predominaba la coloración verde.
En cuanto al Zooplancton, todos los grupos formados sirvieron como alimento vivo, entre ellos, destacaron los rotíferos como Brachionus sp. que los utilizan como alimento de peces y crustáceos en las primeras etapas de alevinaje. Asimismo, los nemátodes y oligoquetos como Aelosoma sp.
En los flóculos maduros del Biofloc, tener oligoquetos y larvas de zancudos nos indicó que el alimento aporta no sólo proteínas y lípidos para su crecimiento y supervivencia, sino que está disponible y accesible en todo momento para las diferentes tallas de los peces. De esta manera, se confirma lo que reportan Monroy-Dosta et al. (2013) e Ibarra et al. (2015), al indicar que la composición de biofloc está conformada por ciliados, rotíferos, microalgas, nematodos, bacterias, levaduras y un biofloc maduro también incluyen a Chlorella, Spirogyra, Naviculas, y flóculos.
Finalmente, el alimento vivo del Biofloc con melaza y harina de "plátano" fueron una nueva alternativa de manejo para producir alimento vivo conformado por fitoplancton y zooplancton con insumos disponibles en la Región, que sirven para la alimentación de las "tilapias" y mejora el performance del crecimiento.
Conclusiones
Se concluye, que la producción de biofloc generó alimento vivo para O. aureus conformado por fitoplancton y zooplancton con ambos tratamientos T5- melaza y T-6 harina de plátano, sin diferencia significativa.
Se recomienda trabajar el biofloc con otras fuentes de carbono para conocer la formación de alimento vivo que en las primeras etapas de vida son fundamentales en el crecimiento de las "tilapias".












 uBio
uBio 


