Introducción
Los Andes Tropicales del territorio peruano tipifican la región andina por las cadenas de altas montañas, los glaciares y sus diversos ecosistemas. En la superficie terrestre, el bioma de la criósfera constituye aproximadamente entre el 10 -11% y está presente en el Ártico, Antártico, las regiones Alpinas, Andinas, los Himalayas, entre otros. La nieve puede cubrir hasta el 32% de la superficie terrestre y el hielo hasta el 11%. En los biomas glaciares con sus diversos hábitats (supraglaciares, subglaciares, crioconites, entre otros), los procesos biogeoquímicas son dominados por comunidades microbiales autótrofas y quimioautótrofos (Anesio & Laybourn-Parry, 2012; Boetius et al., 2015; Allison et al., 2018; Hoham & Remias, 2020).
Las algas criofílicas han sido reportadas en diversas zonas de los glaciares del mundo (Hoham & Duval, 2001; Anesio & Laybourn-Parry, 2012). La mayoría de las especies algales glaciares pertenecen a las Chlorophyta (Chlamydomonadales) y a las Streptophyta (Zygnematales). Los estudios filogenéticos demostraron que el linaje de las estreptofitas subaéreas (Zygnematophyceae) son grupos hermanos de las plantas terrestres o embriofitas en el proceso de evolución (de Vries et al., 2018; Cheng et al., 2019; Williamson et al., 2019; de Vries & Rensing, 2020). Los hábitats supraglaciares representan la interfase clima/hielo con la presencia de floraciones algales de Chlamydomonas, Chloromonas, Raphidonema, entre otras. Así mismo, las floraciones nivales pueden cambiar de aspecto durante el verano con las diferentes tonalidades como la nieve verde (Microglena), roja (Chloromonas reticulata, Chlamydomonas nivalis), pardo dorado (Hydrurus) entre otras. También, las biopelículas fototróficas con talos costrosos que colonizan el sustrato rocoso de los nevados y en valles glaciares están formados por las Zygnematophyceae como Mesotaenium berggrenii, Ancylonema nordenskioldii y Cylindrocystis brebissonii (Edwards & Cameron, 2017; Takeuchi et al., 2019).
Comunidades fototróficas en matas microbianas de las zonas del Ártico (Canadá), Antártica, Alpina y otras evidenciaron la dominancia de cianobacterias y la distribución global de ecotipos cianobacteriales en la criósfera. Poblaciones supraglaciares de cianobacterias como las filamentosas Phormidesmis pristleyi y Oscillatoria sp. asociadas con los criconites dominan la producción de carbono en la superficie glacial mientras que, los eucariontes fotosintéticos como las estreptofitas dominan la superficie de hielo y las Chlamydomonadales están más relacionadas con la dinámica de la nieve (Jungblut et al., 2010; Lutz et al., 2014; Cvetkovska et al., 2016; Anesio et al., 2017; Edwards & Cameron, 2017; Hoham & Remias, 2020).
Al igual que en otros glaciares del mundo, el calentamiento global y el retroceso de los glaciares en las montañas andinas impactan en el clima y en la reducción del bioalbedo. La deglaciación de los Andes del Sur con el deshielo notorio de las montañas de mayor altitud (>5000 m) contribuye a incrementar el flujo hídrico en las laderas montañosas y en los ecosistemas de altitudes más bajas como las aguas dulces aledañas (riachuelos, turberas, pozas glaciales) evidenciando la hidrología dinámica espacial y temporal de la criósfera como ha sido reconocido por Remias et al. (2009) y Williamson et al. (2018). En el Perú, los crioecosistemas de la región Andina se presentan con hábitats cubiertos por nieve o hielo la mayor parte del año. Los glaciares y plataformas de hielo albergan comunidades biológicas como las algas y cianobacterias glaciares que crecen en las zonas de deglaciación y sobre las superficies de hielo causando que el hielo absorba energía solar y la deglaciación sea más rápida con la disminución del bioalbedo. Por consiguiente, los autótrofos criófilos tienen un rol en el balance energético de los glaciares y de las capas de hielo circundantes.
Los ecosistemas terrestres de las Vertientes Orientales Andinas del sur del territorio peruano son tipificados como la ecoregión del bosque montano nublado (Yungas) con hábitats subaéreos frágiles en los acantilados y laderas de las montañas que proporcionan diversos servicios ecosistémicos y albergan una gran diversidad biótica. En el presente trabajo, las estreptofitas glaciares y las mesofílicas (Zygnematophyceae) del género Mesotaenium (Desmidiales, Mesotaeniaceae) denominadas como las desmidias Saccodermae con especies subaéreas. representan un avance en la colonización andina terrestre. El objetivo de la investigación fue reportar la presencia de comunidades subaéreas (epilíticas, casmolíticas) mediante la caracterización morfoecológica de las especies de Mesotaenium. El reconocimiento de sus morfoespecies, su variabilidad morfológica y plasticidad fenotípica le proporcionan ventajas adaptativas en la colonización de hábitats peculiares. Así mismo, se contribuye a reducir los vacios de información en nuestro país relacionado con la diversidad microalgal en las zonas altoandinas y las vertientes orientales del sur e incrementar la base de datos de las microalgas peruanas.
Material y métodos
Área de estudio y estrategias de muestreo
En los Andes tropicales del sur del territorio peruano, el muestreo se realizó en el nevado Allincapac perteneciente a la Cordillera Carabaya, distrito de Macusani, Provincia de Carabaya, departamento de Puno. El material de estudio de la zona altoandina (4500 - 4700 msnm) fue obtenido en la estación de verano (febrero), 2018) considerada época de lluvia, granizada o nevada. En la criósfera andina se inició el ascenso desde la planicie del glacial Allincapac por las estribaciones andinas. Las colecciónes de las comunidades algales y cianobacteriales subaéreas (litofílicas, casmolíticas) sobre la superficie glacial (hielo/nieve) y del sustrato rocoso se realizó en las laderas montañosas de relieve escarpado con pendientes en los alrededores del nevado Allincapac. La obtención del material mediante raspados del sustrato rocoso (espátula de acero inoxidable) entre 1 y 5 mm de profundidad fue mantenido en refrigeración (cooler 5 -10°C) para su preservación temporal.
En las Vertientes Orientales del Sur, en la quebrada de Alccamayo en Aguas Calientes y próxima al rio del mismo nombre, colindante con el hotel Inkaterra, en el departamento del Cusco, se realizaron colecciones entre los 2184 y 3000 m de altitud. Costras, biopelículas o biofilms cianobacteriales y algales fueron obtenidas directamente por el raspado superficial del sustrato rocoso en otoño (agosto, 2017) parte de las cuales fueron posteriormente desecadas. Las muestras colectadas fueron preservadas con solución de formalina al 3%. Las muestras secas y las fijadas fueron depositadas en el Herbario San Marcos del Museo de Historia Natural, UNMSM.
La caracterización de los morfotipos de las especies mediante las observaciones microscópicas y registro de sus parámetros morfométricos en poblaciones naturales fueron realizados con bibliografía especializada. El reconocimiento de las fases vegetativas y reproductivas así como las descripciones de los fenotipos de las especies fue complementado con la toma de microfotografías.
Resultados
Área de estudio, comunidades subaéreas cianobacteriales y microalgales
En los Andes tropicales, la biomasa disminuye conforme se incrementa la altitud en las montañas andinas. El área de estudio en el territorio andino peruano comprendió los flancos altoandinos del este: Allincapac, Puno y el bosque montano nublado: Allcamayo, Cuzco. El nevado de Allincapac aún presenta glaciares no obstante otros glaciares del territorio andino están experimentando cambios por el calentamiento global. En el paisaje nival del Allincapac durante el verano, existe un marcado descongelamiento de la superficie de los glaciares y capas de hielo. En verano (febrero 2018), la temperatura del aire estuvo entre 0 y 10°C entre las 8 am y 14 pm y el pH osciló entre 6.0 y 6.5. Figs.1-2.
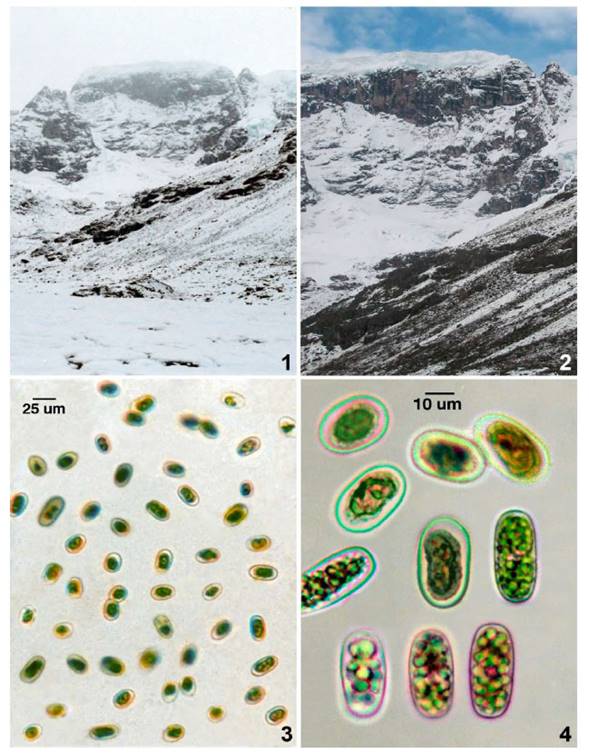
Figs. 1-2 Criosistemas de montaña altoandina del nevado Allincapac en los Andes del sur de Perú. Planicie glacial y ladera montano cubiertos de nieve (mañanas: 6.30 am) a la izquierda, comparada con ladera deshielada con exposición de biopelículas o costras parduscas en sustrato rocoso (medio día:12.30 pm) a la derecha. Fig. 3. Mesotaenium berggrenii con células embebidas en mucílago. Fig. 4. Células de M. berggrenii ovoide elongadas, pigmentadas de tonalidad pardusca y con sustancias de reserva.
Las laderas montañosas y los acantilados rocosos calcáreos exhiben hábitats glaciares que varían en tiempo y espacio en las irregularidades del sustrato, donde se filtra el agua del deshielo superficial (supraglacial) y en la parte inferior de las nevadas y las cavidades del hielo (subglacial o subsuperficial). La acumulación de nieve y carbono orgánico autóctono en los hábitats supraglaciares y en las grietas rocosas calcáreas se reconoció como capas fangosas delgadas por el desarrollo de las comunidades microbianas complejas. Las montañas reciben corrientes del viento que acarrean partículas orgánicas e inorgánicas alóctonas o autóctonas como agregados de exudados microbianos. La exposición de las superficies rocosas, irregulares y porosas así como las partículas y matriz porosa del hielo están rodeados con las productos extracelulares (EPS) que es relevante en la adhesión de las matas algales sobre el sustrato rocoso.
Debido al descongelamiento durante el medio día, la pérdida parcial de la superficie glacial en las estribaciones andinas y el flujo de agua del deshielo causan, en forma ocasional el desprendimiento de células o agregados celulares de las comunidades microalgales que no están bien adheridos al sustrato rocoso. Ellas son transportadas pasivamente por el influjo del agua descongelada y el viento circundante en riachuelos, acequias y pozas glaciares dispersas en la base de las colinas montañosas. En las laderas de montañas se desarrollan biofilms o biopelículas o costras biológicas, visibles con el derretimiento de la nieve. Las algas subaéreas de las laderas del Allincapac se distribuyen en la película de agua líquida intersticial entre la nieve descongelada y los cristales de hielo. Las biopelículas con crecimiento algal cubiertos con nieve parcial o totalmente dominantes en las montañas expuestas a radiación ultravioleta intensa en el verano y adaptadas al frío extremo por el congelamiento (noches) y a la desecación por la escasa disponibilidad de agua líquida. Las laderas con diferentes tonalidades por la colonización microalgal y cianobacterial exhiben acumulación de materia orgánica verde pardusca, gris pardusco o anaranjada grisáceo. Las comunidades casmolíticas en fisuras o microcavidades del sustrato también exhibieron crecimiento algal, cianobacterial y de microorganismos con sus restos orgánicos rodeados con productos exopoliméricos.
Las superficies glaciares albergan diversas comunidades de productores primarios fototrofos supraglaciares como la microalga verde estreptofita Mesotaenium berggrenii. Esta microalga supraglacial pigmentada del nevado del Allincapac está relacionada con el fluctuante descongelamiento que evidencia su tolerancia fisiológica y adaptación a condiciones criófilas. El crecimiento algal fue notorio durante el verano, cuando las temperaturas permanecen por encima de 0°C (medio día). Las comunidades cianobacteriales del Allincapac forman colonias extensivas mucilaginosas de la cianobacteria Nostoc commune (L.) Vaucher asociadas con microalgas criófilas como las estreptofitas Mesotaenium berggrenii y Klebshormidium. Entre otras cianobacterias tenemos a Leptolyngbya, Phormidium, Chroococcus, Scytonema y Stigonema. Las comunidades citadas con roles en los ciclos biogeoquímicos reflejan las condiciones climáticas locales de la región andina.
En el bosque montano nublado de Alccamayo de las Vertientes Orientales de los Andes del sur, las laderas de superficies rocosas y húmedas colonizadas por comunidades subaéreas formando biopelículas, costras o matas tipifican la fisionomía montañosa entre los 2184 y 3000 m altitud. El clima es templado cálido con alto porcentaje de humedad (>70%) y la temperatura promedio oscila entre 16 y 18°C. Las estaciones son definidas por la época de lluvias (noviembre-marzo) siendo la época seca la restante del año. Las comunidades microalgales estables maduras desarrolladas como las subaerofíticas: epilíticas y casmolíticas, de coloración pardo a pardo rojiza o pardo oscura debido a la pigmentación que exhiben la mayoría de las especies. Los biofilms parduscos tienen impurezas inorgánicas aunadas a los restos orgánicos, éstas biopelículas parduscas o verde parduscas de comunidades microalgales como las estreptofitas Mesotaenium macrococcum y M. chlamydosporum, clorofitas como Trentepholia y cianobacterias como Scytonema, Stigonema, Dichothrix y Gloeocapsa. Fig. 5.
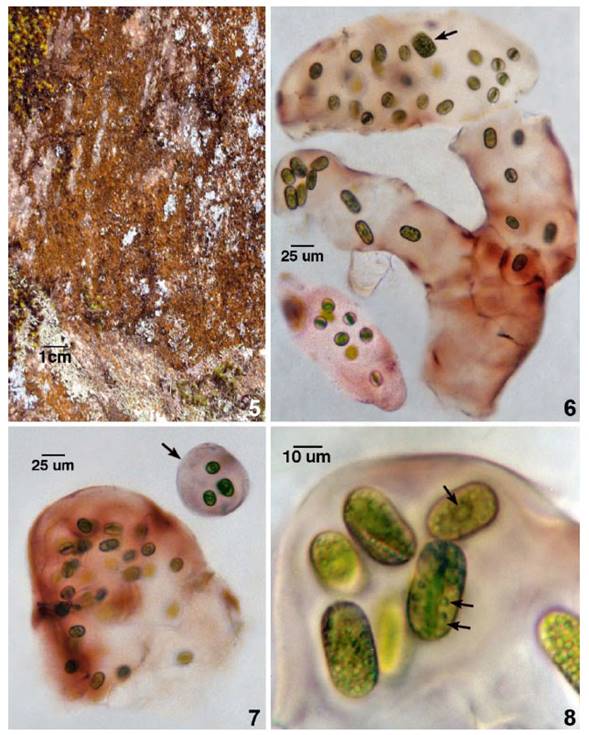
Fig. 5 Ladera rocosa del bosque montano nublado de Allcamayo con biopelículas mesofílicas pardo rojizas, con dominancia de Mesotaenium macrococcum y la cianobacteria Gloeocapsa sp. Fig. 6. Talo colonial cilíndrico ramificado y pigmentado de M. macrococcum, con células vegetativas y zigospora (flecha). Fig. 7. Porción de talo colonial con mucílago denso y colonia joven aislada por fragmentación (flecha). Fig. 8. Borde colonial con células vegetativas embebidas en mucílago. Cloroplastos con pirenoide y gránulos de almidón (flechas).
Morfoespecies de Mesotaenium Naegeli del territorio andino
Las desmidias Saccodermae del género Mesotaenium (Zygnematophyceae) se distribuyen generalmente como biopelículas de masas mucilaginosas sobre las rocas o laderas deglaciadas y húmedas. Las morfoespecies de la estreptofita criofílica Mesotaenium berggrenii (nevado Allincapac) y de las mesofílicas M. macrococcum y M. chlamydosporum (bosque montano nublado) demostraron un rango de variantes morfológicas con un grado de polimorfismo en sus poblaciones. La variabilidad morfométrica en células de poblaciones naturales de M. macrococcum fue notoria y evidenció la diversidad fenotípica de su morfoespecie con características plásticas favorecidas por factores abióticos. M. macrococcum y M. chlamydosporum (bosque montano nublado) constituyen nuevos registros para la microflora en nuestro país. Las especies reportadas así como su variabilidad fenotípica son descritas e ilustradas en diversas microfotografías.
Mesotaenium berggrenii (Wittrock) Lagerheim
Talos coloniales formando agregados o grupos de numerosas células vegetativas cilíndricas, elipsoidales u ovoides, elongadas ó cortas, de extremos apicales o polos redondeados. Células embebidas en mucílago tenue e incoloro. Pared celular lisa u homogénea. Cloroplasto laminar axial, parietal, ovalado y curvado, verde pardusco, o pardo claro, con gránulos de almidón. Las células vegetativas exhibieron plasticidad fenotípica en su morfología y pigmentación. Ellas alcanzaron, de 12.8 a 14.9 (18.2) um de diámetro y de 20.3 a 27.8 (28.9) um de longitud, con proporción celular entre 1 ½ - 2 veces más largas que anchas. Las variaciones en pigmentación celular evidenciaron tonalidades pardo violeta, rojo marrón, purpura oscura a pardusca o pardoverdosa oscura. Ellas estuvieron relacionados con vacuolas y la presencia de glóbulos pigmentados de diferentes tamaños, algunos de los cuales coalescen en el citoplasma rodeando al cloroplasto y núcleo. Reproducción por fisión transversal. No se reconocieron capas densas de estuches o cápsulas mucilaginosos como en las otras especies de Mesotaenium. La cepa peruana de M. berggrenii del territorio altoandino de los Andes tropicales es de mayores dimensiones por lo cual no se le asigna como la variedad criofílica de M. berggrenii var. alaskana. Figs. 3-4.
Habitat: M. berggrenii coloniza hábitats en la superficie glacial con depresiones y fisuras que acumulan partículas biogénicas en el hielo con el desarrollo de comunidades algales asociadas como filamentosas como Spirogyra y Klebshormidium. Las células de M. berggrenii expuestas en las laderas glaciares exhibieron coloración pardusca o pardo anaranjada (asociada con zigotes de Spirogyra). Los agregados celulares de M. berggrenii fueron reconocidos por la coloración pardo grisáceo, verde pardusca, pardo oscura sobre la nieve parcialmente descongelada y entre cristales de hielo en las laderas o acantilados de superficies calcáreas irregulares en las montañas andinas. Las poblaciones de M. berggrenii asociadas con otras algas en laderas del Allincapac exhibieron un potencial de adaptación a periodos de congelamiento y desecación así como de descongelamiento e hidratación.
Mesotaenium macrococcum (Kützing) Roy u Bisset.
Talos coloniales macroscópicos mucilaginosos, tubular cilíndricos, lobulados, elongados e irregulares, de 240 - 700 um de diámetro. Fragmentos coloniales, esféricos, ovoides, ovoides elongados, de 96.3 a 149.8 um de diámetro con estructura mucilaginosa estratificada, de coloración rojo o rosado vinoso, violeta o rosado pálido Figs.6-7. En el interior del talo colonial, las colonias en formación alcanzan de 67.4 a 85.6 (107) um de diámetro, liberándose las nuevas colonias al desintegrarse el mucilago colonial. Las células vegetativas embebidas en denso mucílago y rodeadas de un estuche individual denso y definido o cápsula mucilaginosa estratificada, de forma esférica u ovoide. Figs.8 -10. Células vegetativas, ovoides, elipsoidales, elongadas, superpuestas, levemente atenuadas y muy ligeramente curvadas. La cápsula mucilaginosa estratificada e individual, alcanzó de 8.6 a 33.2 um de espesor Figs.8-10, 12. Células en vista apical esférica, ápices celulares redondeados o ligeramente truncado redondeado. Células vegetativas de tonalidades verdosas, rosadas, violáceas, de (14.9) 15.5 - 18.2 (19.3) um de diámetro por (21.4) 28.9 - 39.6 (41.7) um de longitud y proporción celular entre 1 1/3 y 2 1/3 veces más largas que anchas. Cloroplasto laminar axial, linear, curvado, con borde irregular crenado y dentado, hinchado en el centro por el pirenoide, en la mayoría de casos el cloroplasto llena casi toda la célula. Numerosos gránulos de almidón liberados alrededor del cloroplasto y luego periféricos acumulándose en el citoplasma. Células libres del talo colonial, ovoides, elipsoidales elongadas, con pared celular definida homogénea y doble rodeadas de mucilago individual tenue e incoloro. Las células aisladas de M. macrococcum y las derivadas de las colonias fueron removidas para su mejor caracterización Figs.11-12. Reproducción por fisión transversal previa división del cloroplasto. Zigote cuadrangular de ángulos redondeados dentro del talo colonial colonial Fig.6. Talos coloniales mucilaginosos, con células verdosas y rodeadas de cápsulas estratificadas más bien incoloras, fueron reconocidas en material fresco mantenido en laboratorio a partir de 1.5 mes de colección Fig.14.
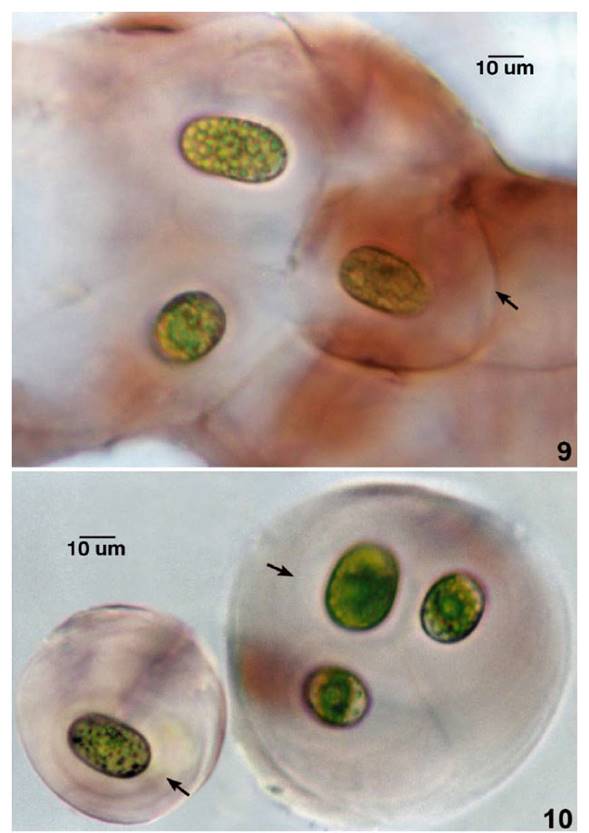
Fig.9. Porción de talo colonial de M. macrococcum y diferenciación celular con cápsula mucílaginosa individual (flecha). Fig. 10. Colonias jóvenes aisladas del talo colonial con cápsula estratificada y pigmentada (flechas).
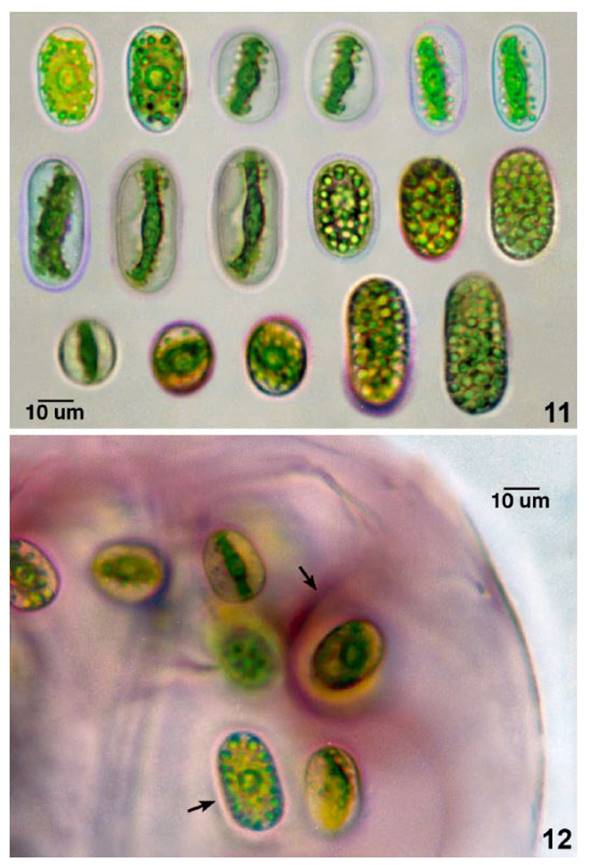
Fig.11. Plasticidad fenotípica célular de M. macrococcum, de izquierda a derecha, en hilera superior: las primeras células (2) en vista frontal con cloroplasto laminar y pirenoide central; células (4) en vista lateral con cloroplasto linear y liberación de granos de almidón. En hilera media: células adultas elongadas (3) en vista lateral con cloroplasto linear y células en vista frontal (3) con sustancias de reserva. En hilera inferior: células (3) en vista apical, ovoides, con cloroplasto y pirenoide; células adultas (2) en vista frontal. Fig. 12. Talo colonial de M. macrococcum con células vegetativas con cápsula mucilaginosa en formación (flechas).
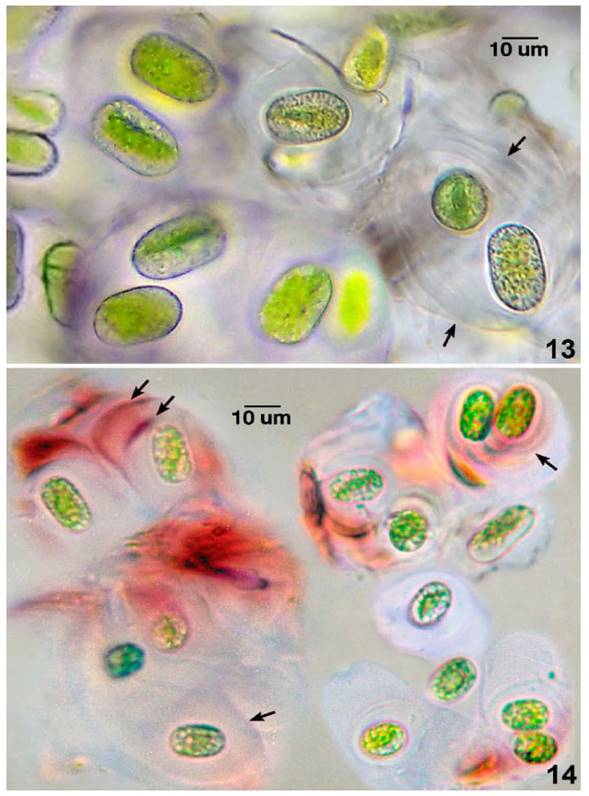
Fig.13. Porción colonial de M. macrococcum con células verdosas rodeadas por cápsula estratificada e incolora bajo condiciones de laboratorio (flechas). Microfotografía tomada después de 1.5 mes de colectada. Fig. 14. Colonias de M. chlamydosporum con células rodeadas de capsulas estratificadas mucilaginosas y pigmentadas (flechas) en laderas del bosque montano nublado .
Habitat: En laderas de montañas de los Andes Orientales correspondiente al Bosque montano nublado, Ceja de Selva o Ceja de Montaña. M. macrococcum forma matas subaéreas en laderas húmedas entre musgos y líquenes asociadas con las cianobacterias Gloeocapsa, Stigonema y Scytonema.
Mesotaenium chlamydosporum De Bary
Talo colonial en matriz gelatinosa o mucilaginosa, ovoide, de 31.1 a 53.5 um, de 160.5 a 192.6 um de diámetro, con numerosas células vegetativas embebidas en el mucilago colonial. Estuche delineado o cápsula colonial con pigmentación rojo vinoso y orientada hacia la radiación luminosa. Mucílago colonial, de 37.5 a 74.9 um de espesor, tenue, estratificado, incoloro o pigmentado. Células rodeadas de estuche definido o cápsula, de forma elipsoidal que confluye con el estuche colonial, de (21.4) 29.1 - 32 de diámetro por 42.8 um longitudinal. Células vegetativas verdosas, ovoides, elipsoidales, cilíndricas y ápices redondeados. Células de (10.7) 11.2 -12.3 (16) um de diámetro y de (14.9) 16 - 20.3 (25.1) um de longitud, con proporción celular entre1 1/3 a 2 1/3 veces más largas que anchas. Cloroplasto laminar axial con pirenoide notorio y numerosos granos de almidón. Células libres o embebidas en mucílago y rodeadas de capsula individual densa, incolora e irregularmente distribuidas. El espesor del mucílago en un extremo celular alcanza de (3.2) 4.3 a 6.4 (7.5) um en un extremo y de 14.9 a16 um de espesor de mucílago en el extremo celular opuesto. Fig.13.
Habitat: formando capas verde violáceas sobre rocas húmedas en sustratos subaéreos y aéreos. Asociado con colonias cocoides y filamentos cianobacteriales de Gloeocapsa Scytonema y Dichothrix.
Discusión y conclusiones
Los ecosistemas de montañas en los Andes tropicales constituyen la topografía dominante en la región Neotropical de Sudamérica. El establecimiento de las montañas está relacionado con procesos climáticos y tectónicos. La distribución y gradiente de riqueza de especies en los Andes está influenciada por la complejidad topográfica (estribaciones escarpadas, laderas, planicies, valles ribereños, entre otros), las gradientes climáticas (temperatura, precipitación, radiación y viento) como fronteras emergentes así como la heterogeneidad espacial y ecológica (hábitats, nichos, refugios, aclimatación y adaptación). Los Andes incluyen regiones complejas con un rango de montañas de alta elevación que tienen un impacto en los patrones de circulación y dinámica atmosférica como el transporte de humedad y precipitación entre la llanura Amazónica y los Andes. La humedad de los vientos amazónicos conforme se orienta al oeste se encuentra con las montañas andinas (barrera) y se descarga al igual que las lluvias en las laderas y valles andinos del este (Yungas: cálida/ húmeda). En el territorio altoandino, los ecosistemas extremófilos glaciares con factores climáticos estresantes como las temperaturas bajas, elevados niveles de radiación, ciclos diurnos y estacionales de congelación, están relacionados con la desecación y descongelación nival (Insel et al., 2009; Pennington & Dick, 2010; Stein et al., 2014; Rahbek et al., 2019; Alonso & Rojas, 2020).
A nivel mundial, el bioma glacial y sus ecosistemas incluyen diversos ambientes como el de agua dulce con comunidades algales especializadas en aspectos biológicos, biofísicos y glaciológicos, de gran impacto sobre el albedo superficial, espesor de la nieve, contenido calorífico y velocidad del derretimiento glacial (Kohshima, 1994; Lutz et al., 2017). Diversos hábitats del bioma glacial como el supraglacial, subglacial, crioconite, entre otros. han sido establecidos por diversos autores (Anesio & Laybourn-Parry, 2012; Williamson et al., 2019). En el nevado Allincapac, los hábitats supraglaciares se reconocieron en las cumbres, laderas y plataformas mientras que los hábitats subglaciares están presentes en los lechos glaciares y plataformas de hielo en las partes bajas del nevado. Las laderas cubiertas por nieve y hielo superficial que experimentan descongelamiento favorecen el crecimiento de los biofilms entre las fisuras del substrato calcáreo y en las pozitas glaciares efímeras de las montañas andinas. En la superficie glacial del Allincapac, la estreptofita M. berggrenni estuvo asociada con el crecimiento de algas estreptofitas como Klebsormidium, Spirogyra, entre otras.
Las algas glaciares andinas evaluadas del género Mesotaenium, son consideradas eucariontes fotosintéticos de trascendencia por su conquista de la superficie terrestre. El grupo de las Zygnematophyceae se separaron de las Chlorophyta durante el periodo geológico Criogeniano, cuando la tierra experimentó el proceso de glaciación. Los científicos asumen que los hábitats supraglaciales pueden haber tenido un rol en la evolución (transición geobiológica) de los eventos biológicos como la resistencia a estresores (frío, alta radiación, desecación) para comprender el proceso de terrestrialización en la especie subaérea de Mesotaenium endlicherianum (Cheng et al., 2019; de Vries et al., 2018; Williamson et al., 2019; de Vries & Rensing, 2020). La dinámica del paisaje glacial andino podría explicar la ruta de migración y capacidad de supervivencia de las algas, como M. berggrenii fácilmente dispersada por el aire, desde regiones criófilicas del hemisferio norte hacia las montañas andinas y establecimiento de sus poblaciones en el nevado del Allincapac. El potencial para la adaptación evolutiva es favorecida por el fenómeno de la transferencia de horizontal genes (HGT) que es mayor entre organismos relacionados o no, en hábitats de temperaturas bajas (Anesio & Bellas, 2011).
La habitabilidad de las regiones glaciares está relacionada con la fracción del hielo descongelado, la disponibilidad del agua líquida y sus condiciones nutritivas (iones solubles). Las especies criófilas tienen las adaptaciones específicas para el frío, como las modificaciones en la estructura lipídica con ácidos grasos poli-insaturados (PUFAs) que le proporcionan flexibilidad o fluidez a las membranas celulares para la absorción de nutrientes y la liberación de productos. Las secuencias de aminoácidos en las proteínas y enzimas proporcionan mayor flexibilidad (estructura terciaria) permitiendo sus funciones en el paisaje glacial. La mantención de la turgencia celular y las funciones enzimáticas mediante solutos compatibles constituyen estrategias celulares para sobrevivir en condiciones extremófilas. Así mismo, compuestos específicos en la membrana celular o su liberación como proteínas ligadas al hielo o anticongelantes bloquean la formación de cristales de hielo evitando el daño de las membranas celulares de las especies criófilas. Ellas metabolizan activamente en los glaciares mediante enzimas activadas en el frío y los productos exopoliméricas les proporcionan protección celular frente a los efectos potencialmente dañinos de las bajas temperaturas. (Hoham & Duval, 2001; Anesio & Laybourn-Parry, 2012; Boetius et al., 2015).
La biodiversidad en regiones glaciares está dominada por la microbiota como algas, bacterias, protistas, hongos y virus con interacciones biológicas específicas. De esta manera, la cadena trófica en los glaciares no constituye el estado inicial en la sucesión ecológica sino el de comunidades estables y maduras (Anesio & Laybourn-Parry, 2012). Las interacciones andinas de la biósfera-litósfera permite comprender los patrones de evolución a través del espacio y tiempo (Antonelli et al., 2018; Badgley et al. (2018). El potencial de erosión en la zona andina con la disturbancia respectiva favorece la heterogeneidad de los suelos y el establecimiento de nichos habitables. Los predictores o variables como la temperatura, estacionalidad, nevadas y precipitaciones, favorecen la disponibilidad hídrica para el desarrollo de Mesotaenium berggrenii y su biota asociada. La biogeografía de la microbiota de la criósfera, extiende su distribución en territorio Sudamericano con la especie criofílica M. berggrenii para el supraglacial altoandino.
La especie tipo M. endlicherianum Naegeli tiene semejanza con la especie subaerofítica y mesofitica M. macrococcum de Alccamayo, Cusco, en la tipificación del cloroplasto sin embargo, la proporción celular en M. endlicherianum es de 3 a 5 veces más largas que anchas superando a la cepa andina M. macrococcum. Además del registro de hábitats subaéreo y aéreo para M. endlicherianum, varios autores la citan para ambientes acuáticos. Prescott et al. (1972) la reportaron para hábitats subaéreos como masas gelatinosas, coloreando la nieve y para ambientes acuáticos y pantanos asociados con el musgo Sphagnum. Coesel & Meesters (2007) la reportaron para hábitats oligotróficos ácidos, bénticos y subaéreos en los Paises Bajos, con 1 o 2 cloroplastos laminares curvados y proporción celular de 3 a 5 veces más largas que anchas. Tomaszewicz (1988) evaluó las zonas transicionales de pantanos en los Países Bajos y reportó la flora desmidiológica de Polonia con especial referencia a las Mesotaeniaceae, citando la especie M. endlicherianum en aguas lénticas, ligeramente ácidas. Así mismo, sus dimensiones celulares son similares con la especie mesofílica M. macrococcum del bosque montano nublado en Cusco.
Asimismo, la distribución altitudinal de las especies mesofílicas subaéreas M. macrococcum y M. chlamydosporum embebidas en cápsulas mucilaginosas estratificadas y gruesa en el bosque montano nublado refleja su heterogeneidad espacial, migración y dispersión e interacciones en las vertientes orientales de los Andes. Las algas mesófilas son conocidas como criófilas no obligadas que alcanzan una temperatura óptima mayor de 15°C (Hoham & Duval 2001). M. chlamydosporum también es citada para ambientes acuáticos de agua dulce según Guiry & Guiry (2021). M. chlamydosporum también coexiste con Sphagnum según Krieger (1937) y Coesel & Meesters (2007) reportaron M. chlamydosporum con 1 ó 2 cloroplastos purpúreos, para sustratos húmedos, rara vez en ambientes oligotróficos. La especie subaérea mesofílica andina de M. chlamydosporum, por la coloración violácea o rosado violácea del mucilago colonial, es próxima a M. chlamydosporum var. violascens por las dimensiones celulares reportadas por Prescott et al. (1972).
Varios autores reportaron la especie M. macrococcum en ambientes subaéreos y acuáticos demostrando su distribución amplia. Así tenemos, células de M. macrococcum asociadas con musgos como Sphagnum y formación de zigotes según Krieger (1937). Prescott et al. (1972) la reportaron para Norte América y citaron la presencia de zigotes de forma cuadrangular y ángulos redondeados (de 33 a 35 um de longitud y 15 um de diámetro) para M. macrococcum var. macrococcum. Tomaszewicz (1988) reportó M. macrococcum para el plancton de turberas y Coesel & Meesters (2007) para humedales oligotróficos ácidos así como para sustratos aéreos húmedos (Paises Bajos).
Las floraciones de las Zygnematophyceae, en la superficie glacial, con notoria pigmentación e impacto en la criósfera, disminuyen el albedo estimulando la descongelación de la nieve y la elevación del nivel del agua (Bamber et al., 2018). Este proceso ha sido evidenciado en Groenlandia donde la plataforma de hielo (masas de hielo de escala continental) constituye el mayor ecosistema supraglacial la biósfera, siendo el mayor contribuidor criosférico para la elevación del nivel de agua del mar. Además, la presencia de floraciones de microalgas en la superficie de la plataforma de Groenlandia, con las estreptofitas M. berggrenii, Ancylonema nordenskioldii y Cylindrocystis impacta en los periodos de ablación en los glaciares por el incremento de la temperatura global (Williamson et al., 2018, 2019, 2020). Las floraciones algales sobre las superficies glaciares causan coloraciones como la nieve roja, verde, marrón, gris y son frecuentes en los últimos tiempos debido al cambio climático global. El ecosistema superficial de hielo incluye especies como las desmidias M. berggrenii, Actinotaenium y Cylindrocystis en los glaciares Athabasca en Canadá (Wharton & Vinyard, 1983). Las comunidades algales de glaciares en los Himalaya (Yala) incluyen a M. berggrenii, A. nordenskioldii, C. brebissonii, Raphidonema, Koliella y Trochiscia (Yoshimura et al., 1997). Algunas algas verdes de las Chlamydomonadaceae sobre los glaciares y hielo forman quistes rojizos causando la nieve roja en los Alpes y en la Antartica (Remias et al., 2005; Komárek & Nedbalová, 2007; Cvetkovska et al., 2016; Hoham & Remias, 2020). Entre las especies criófilas que forman biopelículas o costras altoandinas han sido reportada la cianobacteria colonial Nostoc commune formando capas densas de sustancias extracelulares poliméricas que favorecen la estabilización de sus biopelículas en los glaciares aunada a su función crioprotectora (Montoya et al., 2019). También, entre las comunidades cianobacteriales criofílicas tenemos productores primarios como Phormidium, Phormidesmis priestleyi, entre otras cianobacterias filamentosas (Takeuchi, 2001; Comte et al., 2007; Lutz et al., 2014; Christmas et al., 2016; Lutz et al., 2017).
M. berggrenii, especie cosmopolita y criófila fue registrada para diferentes hábitats extremófilos y extiende su distribución en los Andes Tropicales Peruanos con la cepa pigmentada andina del presente trabajo. En general, las especies criófilas están equipadas con biomoléculas protectoras en respuesta a la alta radiación como carotenoides secundarios (cantaxantina, echinenona y astaxantina). Estos carotenoides no plastidiales en glóbulos citoplasmáticos protegen los fotosistemas plastidiales y el núcleo de la excesiva radiación. Los carotenoides tienen un rol importante en la fotoprotección por la absorción de la energía excesiva actuando como antioxidantes (Remias et al., 2005; Leya et al., 2009; Lutz et al., 2014; Anesio et al., 2017; Williamson et al., 2020). Remias et al. (2012) reportaron la producción del pigmento fenólico, vacuolar marrón denominado purpurogalina ácido carboxílico-6-o-b-D-glucopironoside en M. berggrenii var. alaskana aislada del glaciar Gurgler, Austria que proporciona la tonalidad gris a purpúrea en la superficies glaciares y de hielo. La estreptofita glaciar andina M. berggrenii con formas unicelulares inmóviles, pigmentada con tonalidad parduzca y asociada con material orgánico autóctono (biogénico), causa coloración grisácea como parches discretos en la superficie de hielo de las laderas del Allincapac. Las células de esta especie están rodeadas de un estuche o mucílago fluido que puede atribuirse a las fluctuaciones diurnas de congelación y descongelación de la nieve y hielo.
Las comunidades algales nivales reflejan las diferencias geográficas entre regiones. M. berggrenii ha sido reportado en diversas zonas como las alpinas, glaciares polares, entre otros. Así tenemos, reportes en hábitats de la Antártida, Andes, Alaska, los Himalayas, Rusia y Groenlandia (Ling & Seppelt, 1990; Yoshimura et al., 1997; Takeuchi, 2001; Takeuchi & Kohshima, 2004; Takeuchi et al., 2006; Uetake et al., 2010). Entre las características que facilitan la colonización del criobionte M. berggrenii tenemos la secreción de polisacáridos extracelulares que favorece la agregación de masas celulares como biopelículas, facilitando su adherencia a las partículas de hielo y al sustrato rocoso. La pigmentación rojiza parduzca de M. berggrenii protege las células de los efectos de la radiación uv y la formación de zigotes facilitaron su sobrevivencia en invierno crudos (-25°C) (Ling & Seppelt, 1990; Remias et al., 2012).
La distribución altitudinal de las estreptofitas, es importante para el análisis de las especies criófilas de mayor altitud, como los reportados para Los Himalaya, con estratos glaciares por la nieve acumulada que proporciona información de los cambios climáticos del pasado (Yoshimura et al., 1997). A continuación, la distribución mundial de M. berggrenii, considerando las altitudes de otras localidades son comparadas con la registrada para los Andes Peruanos (Allincapac). Los patrones de distribución de las comunidades algales en la plataforma de Groenlandia, entre los 1011 - 1854 m de elevación, revelaron en un inicio la baja diversidad de especies con M. berggrenii, A. nordenskioldi y C. brebissonii f. cryophila. Sin embargo, con la tecnología moderna se logró adicionar las especies Hydrurus foetidus, Raphidonema sempervirens, Chloromonas polyptera y Chloromonas cf. alpina (Lutz et al., 2018). También, en el glaciar Mittivakkat entre los 128 y 880 m de altitud al sud este de Groenlandia (debajo del circulo Ártico) se reportaron las especies M. berggrenii, A.nordenskioldii y Chlamydomonas nivalis (Lutz et al., 2014). Adicionalmente, Uetake et al. (2010) evaluaron las comunidades algales y cianobacteriales de los glaciares Qaanaaq y Russel del oeste de Groenlandia, con altitudes entre 276 - 938 m y entre las especies reportadas tenemos a M. berggrenii, A. nordenskioldii, C. brebissonii y Chloromonas sp. siendo M. berggrenii dominante en el glaciar Qaanaaq (276 m altitud).
La cepa costera M. berggrenii, de color rojo parduzco de las Islas Windmill en la Antártida, proporcionó una tonalidad grisácea a la nieve subglaciar (Ling & Seppelt (1990) y Remias et al. (2009) reportaron varios autores que señalaron que el pH del agua de hielo en la Antartida fue ligeramente acida (5.7). Takeuchi & Kohshima (2004) reportaron la cepa M. berggrenii para el glaciar Tyndall, Chile, distribuida en la superficie del glaciar entre los 340 - 1100 m de altitud. La estructura de la comunidad algal nival demostró que M. berggrenii de tonalidad pardo rojiza fue dominante en el área de hielo y nieve. Takeuchi (2001, 2013) evaluó las comunidades algales que incluyeron a M. berggrenii asi como, la reflectancia superficial del glacier de Gulkana, Alaska. M. berggrenii también estuvo presente en formaciones supraglaciares como los crioconites del glaciar de Gulkana con una distribución altitudinal entre 1270 - 1770 msnm.
Prescott et al. (1972) reportó M. berggrenii var. alaskana con dimensiones celulares de (4) 5 - 6 (7) um de diámetro por 10 a 21 um de longitud para Norte América. Remias et al. (2009) examinaron muestras de M. berggrenii con dos variedades (dimorfismo en tamaño) y reportaron la variedad alaskana para los glaciares de los Alpes europeos y extendieron el rango de sus dimensiones celulares. La presencia de M. berggrenii en el glaciar Tiefenbach de los Alpes Austriacos fue reportada para una altitud de 3000 m. (Remias et al., 2009). Takeuchi et al. (2006) reportaron la estructura de la comunidad algal en glaciares del hemisferio norte con las estreptofitas M. berggrenii y A. nordenskioldii que dominaron el área de hielo del glaciar Akkem en las montañas Rusas Altai entre los 2460 y 3139 m.s.n.m. No obstante, las diferencias geográficas y altitudinales de la especie andina M. berggrenii del glacial Allincapac 4500 y 4700 m, las dimensiones celulares de la cepa rusa son próximas a la cepa andina aunada con la tipificación del citoplasma marrón oscuro (contenido celular). Las cepas de M. berggrenii de los glaciares de Los Himalaya (Yala y Nepal Este) son los que alcanzaron mayor altitud (4950 - 5380 m) y exhibieron menor diámetro celular (Yoshimura et al., 1997; Takeuchi et al., 1998). La cepa de M. berggrenii del glaciar Yala, con citoplasma violeta oscuro en hábitats inestables de transición (nieve/ hielo) coloniza altitudes entre los 5200 y 5300 m. Las dimensiones celulares de las cepas de M. berggrenii de los glaciares de Los Himalaya son próximas a M. berggrenii var. alaskana.
La plasticidad fenotípica de la cepa M. berggrenii del Allincapac se evidenció en la variabilidad morfológica y en sus dimensiones celulares que pueden estar influenciadas por factores ambientales como los estresantes de la criósfera de las montañas altoandinas. La especie andina es superada en distribución altitudinal por los registros de las cepas de los nevados de Los Himalayas (4950 -5380 m). Sin embargo, la distribución altitudinal de M. berggrenii en los Andes Tropicales Peruanos (4,500- 4700m) supera en altitud a las cepas registradas para los Alpes Austriacos (3000 m), glaciares de montañas rusas ( 2460 - 3139 m), los glaciares de Gulkana, Alaska (1270 a 1770 m), glaciares de Groenlandia entre los (128 - 1854 m) y el glaciar Tyndall, Chile (340 - 1100 m). De esta manera, se ratifica la su distribución cosmopolita con una alta gradiente altitudinal de M. berggrenii.
Las desmidias forman biopelículas en sustratos subaéreos terrestres y en ecosistemas acuáticos como los humedales donde forman parte del bentos y/o perifiton. Las desmidias secretan una matriz macromolecular compleja formada por productos extracelulares poliméricas como capas mucilaginosas externas a la pared celular. Estas sustancias extracelulares tienen roles funciónales dinámicos en las biopelículas como el estructural, la adhesión y estabilización, deslizamiento celular, absorción de nutrientes y protección física contra los estresores bióticos (predación) y abióticos como desecación, radiación uv y bajas temperaturas (Kiemle et al., 2007). La liberación de sustancias complejas exopoliméricas (EPS) también facilitan la colonización de los glaciares por su función anticongelante (proteinas activas en el hielo embebidas en EPS) y actuan como amortiguador frente a concentraciones de sales. Los exudados (EPS), de alto peso molecular como polisacáridos, proteínas y lipopolisacáridos en respuesta a las condiciones ambientales (temperatura, salinidad, disponibilidad de nutrientes) constituyen sustratos para el crecimiento de comunidades de heterótrofos en las biopelículas maduras (Chrismas et al., 2016). Boney 1981 reportó M. chlamydosporum formando masas gelatinosas en sustrato de areniscas y en laderas con un espesor de 4 mm, asociadas con musgos, hepáticas, algas filamentosas (Mougeotia) y cianobacterias creando microcosmos similares a los estadios palmeloides (flagelados). Estas comunidades gelatinosas con M. chlamydosporum se secan en verano formando costras y recuperan su coloración verdosa e hidratación en otoño (Scotland, Reino Unido).
Coesel (1994) indicó, que en las desmidias se puede distinguir cápsulas delineadas asi como una matriz mucilaginosa y difusa no delineada que parece disolverse en el medio. Este último fenotipo fue reconocido en la cepa de M. berggreni del nevado Allincapac. Según Remias et al. (2009) las células vegetativas de M. berggrenii en los glaciares alpinos austriacos, producen altas cantidades de almidón entre otras moléculas (lípidos). Esta característica también fue reconocida en M. berggrenii del Allincapac y fue muy notorio en las especies M. macrococcum y M. chlamydosporum del bosque montano nublado de los Andes Tropicales del Sur, donde las células con la producción de granos de almidón, evidenciaron sus condiciones mesofílicas óptimas. Las comunidades de las desmidias M. macrococcum y M. chlamydosporum formaron costras o biopelículas estratificadas con talos macroscópicos que incluyen en su mayoría colonias mucilaginosos, pardo violáceas, rosadas o verde violáceas. Estos talos coloniales con agregaciones celulares como masas mucilaginosas, facilitan su adherencia colonial a los sustratos rocosos siendo protegidos de la desecación celular en las estribaciones andinas. Las desmidias también forman cápsulas verdaderas como estuches homogéneos que encapsulan las células y están relacionadas a procesos fisiológicos como el metabolismo del carbono. Las cepas del bosque montano nublado mesofílicas andinas M. macrococcum y M. chlamydosporum forman cápsulas coloniales e individuales, estratificadas y pigmentadas de utilidad en la formación de biopelículas subaéreas. Así mismo, las biopelículas disminuyen su probabilidad de ser liberadas por las precipitaciones, quedando parcialmente hidratados y en algunos casos sumergidas (depresiones) especialmente durante el verano (diciembre-marzo).
La desmidia estreptofita Spondylosium panduriforme, rodeada de una cápsula mucilaginosa definida de un polisacárido capsular (CPS) también produce polisacáridos extracelulares (EPS) según Paulsen & Henriques (1994). En la desmidia Staurodesmus convergens, la regeneración de las cápsulas de polisacáridos mucilaginosos (CPS) y del polisacárido extracelular disuelto (EPS) fueron independientes de las condiciones externas de nutrientes (Gouvea et al., 2002). También, la estreptofita Penium margaritaceum formó biopelículas siendo considerada como un modelo de producción y secreción de productos exopoliméricos como polisacáridos complejos polianiónicos (Domozych (2007). En las biofilms maduros, las colonias andinas subaéreas de M. macrococcum y M. chlamydosporum con producción de estuches individuales y cápsulas mucílaginosas que rodean las células en forma extensiva permiten su hidratación (precipitaciones) y presión higroscópica que facilita la homeostasis colonial de las biopelículas subaéreas del Cusco.
La desmidia estreptofita Ancylonema nordenskiöldii ha sido registrada para el bioma glacial del Ártico, Antártida, los Himalaya, Groenlandia, Noruega y otras regiones montañosas no polares, asociada con M. berggrenii (Yoshimura et al., 1997; Edwards & Cameron, 2017; Lutz et al., 2018; Takeuchi et al., 2019). Filamentos violeta oscuros de A. nordenskioldii fueron citados para los glaciares de Nepal en los Himalaya y fue dominante en valles glaciares del Ártico (Yoshimura et al., 1997; Takeuchi et al., 2019). En la zona altoandina de la Cordillera La Viuda, naciente del río Chillón, Canta, en los Andes Centrales (4150 m) del departamento de Lima, la estreptofita filamentosa A. nordenskioldii formó masas mucilaginosas flotantes y sumergidas. Algunas de sus células desprendidas como planctónicas se exportaron de los glaciares (nieve y hielo) hacia la cuenca hidrográfica del río Chillón (donde el agua se congela durante las noches) y hacia la laguna altoandina Chuchón, limitada por las cadenas montañosas de las vertientes occidentales andinas (Montoya & Acosta, 1987). Las poblaciones criófilas de A. nordenskiöldii se desprenden e inoculan en humedales altoandinos próximos (turberas ó bofedales, pozas o riachuelos glaciares) hasta donde llegan los camélidos sudamericanos para hidratarse (alpacas, vicuñas y llamas). Por lo tanto, la cepa andina A. nordenskiöldii de la cordillera de La Viuda y la cepa andina M. berggrenii del Allincapac constituyen algas extremófilas criófilas en los Andes Peruanos.
Los organismos extremófilos, considerados dominantes en la historia evolutiva de la vida en nuestro planeta están relacionadas con condiciones estresantes e investigaciones de los límites de la vida en el espacio y otros planetas (exobiología). Los extremófilos, de importancia en disciplinas múltiples, facilitan la evaluación y comprensión de la vida en la tierra y su diversificación en otros cuerpos planetarios (celestiales) y sus nichos. Es importante considerar el efecto de los parámetros que controlan la disponibilidad del agua y la estabilidad de las macromoléculas relacionadas con las gradientes fisicoquímicas que permiten la disponibilidad de elementos y electrones creando condiciones para el origen, evolución y diversidad de la vida (Merino et al., 2019). Los ecosistemas extremófilos como las superficies glaciares altoandinas de la Cordillera de los Andes Tropicales, zonas alpinas, regiones polares así como sus colonizadores (microorganismos, algas y cianobacterias fotótrofas) están en la categoría de análogos para investigaciones astrobiológicas. La evaluación de la dinámica de las comunidades microbiales de la criósfera es relevante para la exploración de la vida extraterrestre del hielo, porque las superficies de numerosos exoplanetas están cubiertas de hielo y podrían ser habitables como las regiones polares de Marte, Europa (luna de Jupiter) y Enceladus (luna de Saturno) (Boetius et al., 2015; Havig & Hamilton, 2019; Vimercati et al., 2019).












 uBio
uBio 


