Introducción
El Perú es un país mega diverso el cual alberga una gran diversidad de peces del planeta; tiene una rica fauna de peces marinos con aproximadamente 1070 especies entre condríctios y teleósteos, distribuidas en 549 géneros, 194 familias y 39 órdenes. Esta gran diversidad íctica marina es atribuida a la situación latitudinal especial del Perú, en donde al norte de los 6° S, encontramos el Área de Transición, denominada así a la influencia conjunta de las aguas cálidas que provienen del Ecuador y de las aguas costeras frías de la Corriente Peruana que viene desde Chile. Además, esta situación es favorecida por la variedad de ambientes, desde la superficie hasta las grandes profundidades, en el sentido latitudinal y de la orilla a las 200 millas (Chirichigno & Cornejo, 2001).
La FAO (2010), reporta que, en el Perú, el sector pesquero es la más importante fuente generadora de divisas después de la minería, destacándose la pesca marítima y en menor grado la continental. Es así que los volúmenes de desembarque en recursos hidrobiológicos marítimos en 2013 fueron de 5 859 000 toneladas métricas brutas (TMB), mientras que en los continentales fueron de 56 500 TMB. El 19.8% de la extracción de los recursos hidrobiológicos marítimos fue destinado al consumo humano directo (enlatado, congelado, curado o fresco), en tanto que el 80.2% fue destinado al consumo indirecto (harina y aceite de pescado) en 2013 (INEI, 2014; Serrano et al., 2017); sin embargo, indistintamente a su destino, existen requerimientos sanitarios nacionales e internacionales para asegurar la inocuidad de estos productos.
Luque & Poulin (2007), reportaron que el Perú posee una gran riqueza de metazoos parásitos debido a la diversidad de especies de hospederos invertebrados y vertebrados y de las aproximadamente 1070 especies de peces marinos; sin embargo, a pesar de esta gran diversidad íctica apenas el 10,5% de las especies de peces conocidas tienen registros parasitológicos. El estudio de los parásitos y las alteraciones histológicas que generan en diferentes tipos de tejidos, es importante para comprender la relación hospedero-parásito, la bioecología del mismo y el daño producido en función a la intensidad de infección (Gonzales, 2017).
Los parásitos de peces marinos son de gran interés no solo desde el punto de vista científico sino también por su repercusión en la economía y la salud pública. Se conoce que el desarrollo tecnológico ha contribuido al aumento de determinadas parasitosis, por ejemplo, la anisakiasis, cuya frecuencia se ha incrementado con la utilización de instalaciones frigoríficas en los barcos de pesca, esto se observa principalmente en los grandes países pesqueros (Japón, Holanda, Noruega, entre otros). Debido a que ya no se evisceran los pescados a bordo, sino que se congelan inmediatamente, los parásitos en estadio larval que se encuentran en las vísceras, migran hacia el músculo del pescado para protegerse. El riesgo de infestación en humanos aumenta según las costumbres alimenticias de las poblaciones, que prefieren ingerir peces ahumados, salados o insuficientemente cocidos en forma de marinados o cebiche. Otra parasitosis de importancia en salud pública es la ocasionada por la ingestión del Diphyllobothrium pacificum que se presenta también en nuestro país con cierta frecuencia, como lo hace Diphylobothrium latum en países del Caribe (Tantalean et al., 1982).
En el Perú, según el Instituto del Mar del Perú - IMARPE (2009), muchas son las especies de peces marinos que sustentan la pesquería artesanal, dentro de ellos “jurel” y “caballa”, recursos cuyo estudio parasitario ya ha sido reportado por algunos autores entre los cuales mencionan a parásitos como cestodos (Novoa, 2004; Tantalean et al., 1982; Montalvo, 1977); nematodos (Jara, 1995; Oliva, 1994; Tantalean, 1972).
Los parásitos son organismos que dependen de otros para su nutrición y desarrollo, la presencia de los mismos en los peces algunas veces no genera alteraciones fisiológicas importantes; sin embargo, en los últimos años debido al calentamiento global están surgiendo una serie de problemas asociados con los efectos de los parásitos en los tejidos y órganos de los peces, que a su vez al ser ingeridos por el hombre e infectarlo pueden causar ictiozoonosis (Olivero & Baldiris, 2008). Esta infección, se produce mayormente por la ingesta de peces crudos o insuficientemente cocidos, infectados por larvas de ciertos parásitos, siendo los helmintos (nematodos y cestodos principalmente) causantes de la mayoría de zoonosis reportadas para América Latina (Chávez, 2007; Quijada et al., 2005; Acha & Szyfres, 1997; Ferre, 2018). Existe una amplia variedad de parásitos que pueden infectar a los peces, pero solo un número reducido puede causar zoonosis (Ferre, 2018).
Quiroz (2014) cita a varios investigadores, quienes hacen hincapié que, en nuestro país, existe una gran variedad de recursos hidrobiológicos cuyas investigaciones sobre parasitología han estado dirigidas principalmente hacia aspectos como la descripción taxonómica, el conocimiento de índices parasitarios y/o enfocados solo a algunos especímenes, como a nematodos y cestodos principalmente (Bermejo et al., 2000; Pérez et al., 1999; Jara, 1995; Tantaleán et al., 1982).
El estudio de los parásitos y las alteraciones histológicas que generan en diferentes tipos de tejidos, es importante para comprender la relación hospedero-parásito, la bioecología del mismo y el daño producido en función en función a la intensidad de infección. La mayor consecuencia de una enfermedad se observa en los cultivos de peces, crustáceos o moluscos, donde la mortalidad puede alcanzar a la totalidad de los ejemplares, generando fuertes pérdidas económicas (Gonzales, 2017).
Chero (2017), manifiesta que diversos investigadores han publicado inventarios organizados de las especies de metazoos que parasitan peces peruanos. Así tenemos, el trabajo realizado por Luque et al. (1991), donde reportan un total de 131 especies de parásitos entre protozoos, helmintos y artrópodos. Posteriormente, Tantaleán & Huiza (1994) publican una sinopsis de los diversos géneros y especies de metazoos parásitos de peces del Perú, indicando posición taxonómica, hospederos y distribución geográfica.
En esos ambientes hay mayores facilidades para que las enfermedades puedan ser estudiadas, cualitativa y cuantitativamente, porque pueden efectuarse el historial clínico y el estudio bioecológico de la carga parasitaria; sin embargo, es muy importante la prevención, para lo cual debe tomarse en consideración los diferentes factores físicos, químicos y biológicos de la especie cultivada y procurar que estos factores siempre se encuentren en condiciones óptimas como para llevar a cabo el cultivo (Gonzales, 2017).
Por tal motivo, se hace necesario incrementar las investigaciones y trabajos taxonómicos de parásitos de peces marinos comerciales, con énfasis a la investigación de los ciclos biológicos, prevalencia e incidencia parasitaria y efectos patológicos sobre el huésped.
El presente trabajo en general, estuvo orientado a determinar los parásitos de peces marinos de consumo humano directo, así como la prevalencia y la intensidad parasitaria de los mismos.
Material y métodos
La muestra biológica estuvo constituida por 240 especímenes de ocho especies de peces
marinos comerciales de consumo humano directo, expendidos en el Mercado Mayorista de Buenos Aires de Trujillo - La Libertad, Perú. Tomándose como especies frecuentes a:
Sciaena deliciosa Tschudi, 1846. Familia Scianidae. “lorna”.
Mugil cephalus Linnaeus, 1758. Familia Mugilidae. “lisa”.
Scomber japonicus Houttuyn, 1782. Familia Scombridae. “caballa”
Sarda chiliensis chiliensis Cuvier, 1832. Familia Scombridae. “bonito”.
Trachurus murphyi Nichols, 1920. Familia Carangidae. “jurel”.
Mustelus mento Cope, 1877. Familia Triakidae. “tollo blanco”.
Mustelus whitneyi Chirichigno, 1973. Familia Triakidae. “tollo común”.
Myliobatis chilensis Philippi 1892. Familia Myliobatidae. “raya águila”.
Los especímenes fueron comprados al azar, durante los meses de febrero a noviembre del año 2019, luego se trasladaron de manera inmediata en bolsas plásticas al laboratorio A-108 del Pabellón Felipe Ancieta Calderón, del Departamento de Pesquería, Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo, donde se mantuvieron y separaron por especies en bandejas plásticas hasta efectuar el examen parasitológico. Para su identificación taxonómica, se utilizó la clave para identificar los peces marinos del Perú, propuesta por Chirichigno (1998) y el catálogo comentado de los peces marinos del Perú, de Chirichigno & Cornejo (2001).
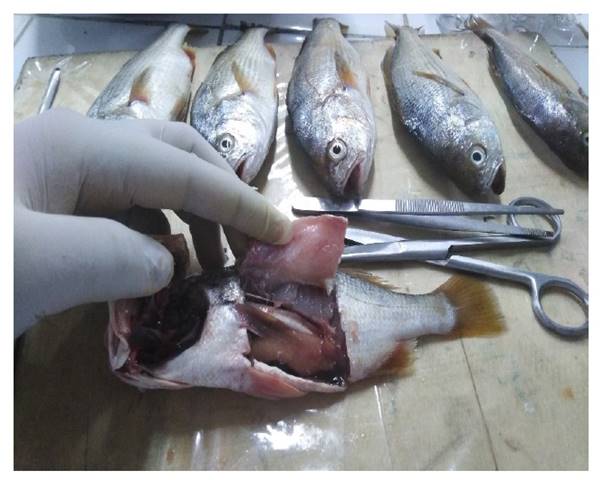
Luego de verificar a los especímenes para el estudio, primero se realizó un examen externo de la muestra de manera visual, para la búsqueda y localización de ectoparásitos; se efectuaron raspados del tegumento con ayuda de una hoja bisturí, especialmente a la altura de las aletas y a lo largo de la línea lateral, siendo el producto depositado en placas Petri y láminas portaobjetos con agua destilada, para ser observado directamente en el microscopio binocular marca Zeiss y estereoscopio marca Carl Zeiss Jena, respectivamente. Las branquias se extirparon y se examinó por separado, desprendiendo los filamentos branquiales de sus respectivos arcos, para ser observados al microscopio entre lámina y laminilla con gotas de agua destilada.
Seguidamente, se realizó el examen interno de la muestra para la búsqueda de endoparásitos, el cual consistió en colocar en una tabla los peces, haciendo un corte ventral a lo largo de la línea media, desde la región anal hasta la zona branquial; de igual manera, se realizaron cortes transversales de la pared del cuerpo con la finalidad de exponer totalmente las vísceras y órganos internos que fueron aislados en placas Petri con solución salina fisiológica al 0.85 %. El tubo digestivo fue abierto longitudinalmente y el contenido examinado con la ayuda de estiletes y bajo la observación con los aumentos múltiples del estereoscopio.
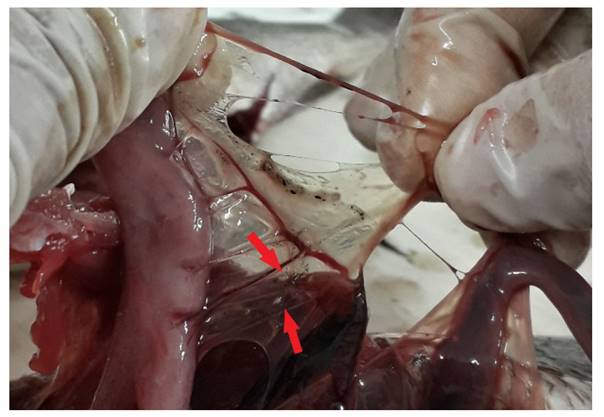
De igual manera, se analizó internamente el tejido muscular, hígado, bazo, riñón, corazón, gónadas y vejiga natatoria (Fig. 1), estos órganos se individualizaron en placas Petri con solución salina al 0.85 % para ser revisados con ayuda del microscopio y estereoscopio; el peritoneo, vejiga natatoria y la superficie visceral fueron observados cuidadosamente y el tejido muscular se cortó y se analizó en pequeñas porciones con ayuda de bisturís de diferente número. Así también se tomaron pequeñas muestras del corazón, hígado, riñón y bazo, para lo cual se realizaron múltiples squash en láminas porta y cubre objetos para examinarlos con un microscopio y estereoscopio.
Los parásitos encontrados fueron separados cuidadosamente del órgano parasitado con ayuda de hojas bisturí, estiletes, jeringas con agujas hipodérmicas, micropipetas y pinzas, teniendo especial cuidado de no lesionarlos y luego colocados en placas Petri o frascos de vidrio de 10 ml con agua destilada, solución salina fisiológica o formol al 10%, según sea el caso para ecto o endoparásito y filo al que pertenece.
Las características morfológicas de los parásitos fueron determinados mediante descripciones de los organismos parásitos frescos y en algunos casos vivos; para lo cual, fueron colocados con ayuda de goteros entre las láminas y laminillas o pequeñas placas Petri para ser observados directamente al microscopio o estereoscopio; donde se determinó el estado de desarrollo, movimientos, longitud y anchura, coloración y órganos internos, los cuales se anotaron cuidadosamente y sirvieron para la identificación taxonómica. De igual manera se procedió a realizar montajes permanentes, para lo cual, la fijación se realizó con formol al 10 % bufferado, la tinción con hematoxilina - eosina, la deshidratación con una serie alcohólica, el aclaramiento con xilol y el montaje en bálsamo de Canadá. Finalmente se procedió a la identificación, utilizando diversas claves taxonómicas y trabajos científicos como el de Gonzalez (2017), Gonzales y Mateo (2002), Tantaleán et al. (1982) y para el registro de microfotografías, se emplearon cámaras digitales de celulares Samsum de 8 MPx.
Para el análisis cuantitativo de la población parasitaria, se determinaron los valores de prevalencia, intensidad media de infección, intensidad de infección y abundancia de acuerdo con Bush et al. (1997) y Margolis et al. (1982).
Prevalencia (P). Se expresa en porcentaje, sirve para determinar el número de hospederos con uno o más individuos parásitos de una especie en particular o grupo taxonómico.
Intensidad media de infección (IMI). Permite calcular el número promedio de una especie particular de parásito entre los miembros infectados de una especie particular de hospedador.
IMI= Número total de parásitos de una especie particular encontrados. / Número de hospedadores infectados con aquel parasito.
Intensidad de infección (II). Se expresa como el número máximo de individuos de una especie de parásito en particular en un solo hospedador infectado y sirve para conocer el hospedero más infectado.
Abundancia o Densidad relativa(A). Número total de individuos de una especie de parásito en una muestra de hospederos dividido por el número total de hospederos en una muestra.
A= Número total de parásitos de una especie / Número de hospedadores examinados
Resultados
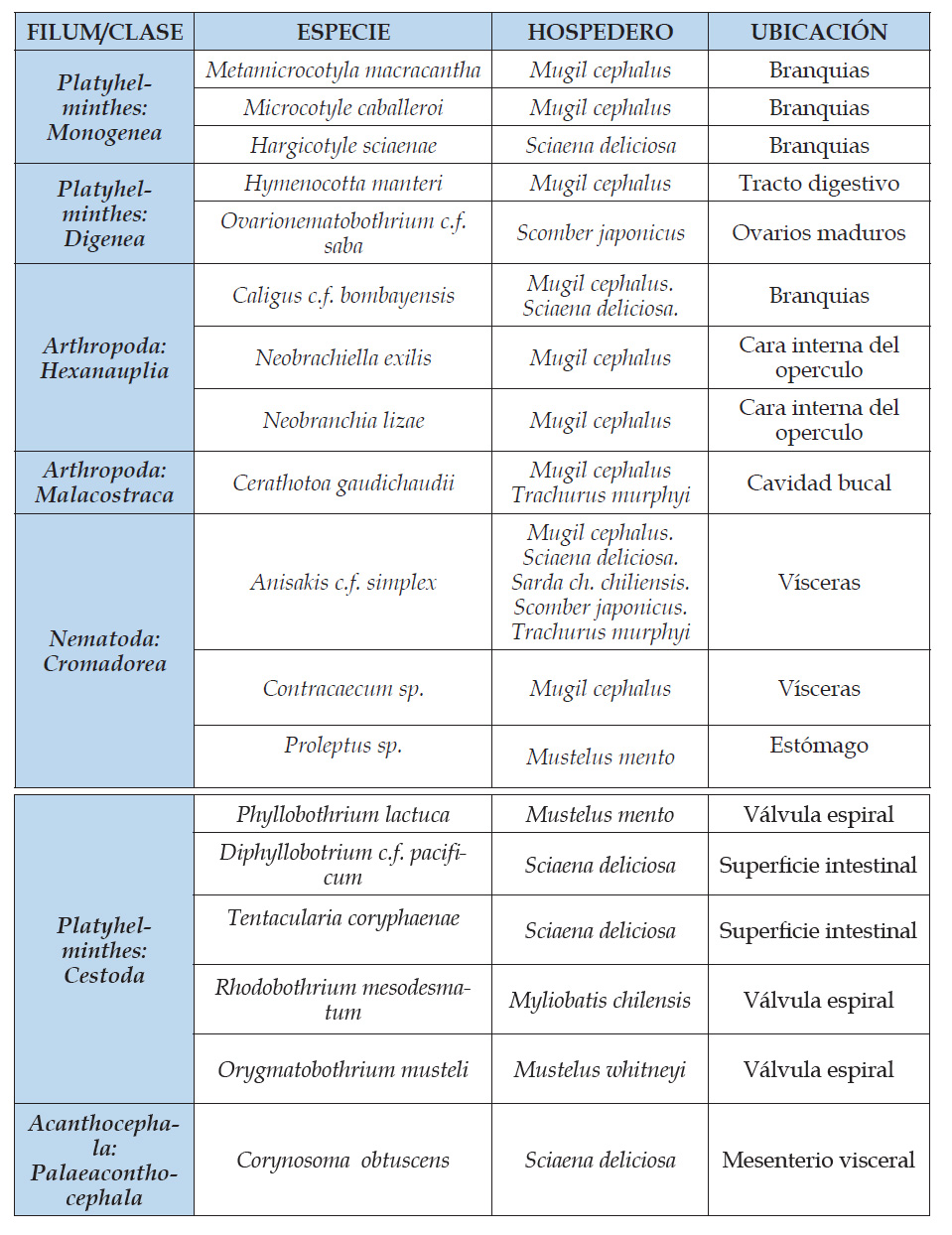
Se encontraron 18 parásitos en peces marinos de consumo humano directo (Cuadro 1).

Fig. 2. Parte anterior: prohaptor de adulto de Metamicrocotyla macracantha Koratha, 1955. Familia Gastrocotylidae.
Características: Prohaptorcon dos ventosas tabicadas, cuyos bordes llevan minúsculos dientes, Opistohaptor acorazonado y con ventosas. Atrio genital armado de tres grupos de espinas. Sin vagina y huevos con filamento (Tantalean et al., 1982).

Fig. 3. Parte posterior: opistohaptor de adulto de Microcotyle caballeroi Bravo, 1960. Familia Gastrocotylidae.
Características: Cuerpoen forma de flecha. Prohaptor con dos ventosas oblicuas. Opistohaptor triangular y con 22 - 28 ventosas en el lado derecho y 22 - 30 en el izquierdo. Atrio armado de 8 a 10 ganchos bien desarrollados. Orificio vaginal situado por debajo de la bifurcación cecal. Huevos operculados y con filamento largo en cada polo (Tantalean et al., 1982).
Características: Prohaptorcondos ventosas. Opistohaptor con ocho ventosas pedunculadas y un apéndice que lleva cuatro ganchos larvarios. Atrio genital con numerosas espinas en forma de hoz. Ovario pretesticular y en forma de “U” invertida. Con receptáculo seminal antero-lateral al ovario. Huevos con filamentos en ambos polos (Tantalean et al., 1982).
Características: Cuerpoalargado, con el extremo posterior más agudo que el anterior, con cutícula gruesa y arrugas marcadas desde el nivel posterior, con pigmentos granulares en todo el cuerpo. Disco oral lobulado con pocas papilas. Acetábulo en el tercio anterior. Con un testículo y ovario redondeado (Tantalean et al., 1982).
Características: Cuerpoaplanado dorsoventralmente y el cefalotórax muy ancho y en forma de herradura. La región anterior del tórax es notoriamente más angosta que la región posterior. Ovisacos cilíndricos, con huevos discoidales en una sola hilera (Gonzales & Mateo, 2002).
Características: Primerpar de maxilípedos modificados, formando un poderoso miembro puntiagudo que se fija firmemente a la branquia o piel del pez, por medio de una estructura denominada bula. Ovisaco alargados, con huevos redondeados en varias hileras (Gonzales & Mateo, 2002).
Características: Primer par de maxilípedos fuertemente modificados, formando un poderoso miembro en forma de acha que se fija fuertemente a la branquia, cara interna del opérculo o piel del pez, por medio de una estructura denominada bula. Masa ovígera muy pegada al cefalotórax, con huevos redondeados en varias hileras (Gonzales & Mateo, 2002).
Características: Isópodo de cuerpo robusto, existe dimorfismo sexual, la hembra es de mayor tamaño que el macho y posee una bolsa de incubación donde las crías se desarrollan, nacen vivas con apéndices natatorios hasta encontrar un hospedero (Gonzales 2017).
Características: Cuerpomuy alargado, vermiforme cilíndrico de dos puntas, con longitud variable entre 20 - 30 mm. Parte anterior con tres labios rudimentarios y una estructura triangular. Con ventrículo, sin divertículo esofágico ni ciego intestinal. Poro excretor en la base de los labios subveatráles (Tantalean et al., 1982).
Características: Cuerpomuy alargado, vermiforme cilíndrico de dos puntas, con longitud variable entre 5 - 29 mm. Robustos con estructura triangular en la región cefálica. Con ciego intestinal y divertículo esofágico (Tantalean et al., 1982).
Características: Condos labios laterales simples, cada uno con un diente truncado. Con collar cefálico circular. Papilas cervicales asimétricas, anterior al anillo nervioso. Esófago dividido en dos partes (Tantalean et al., 1982).
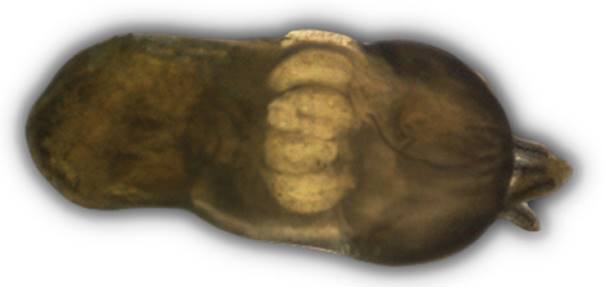
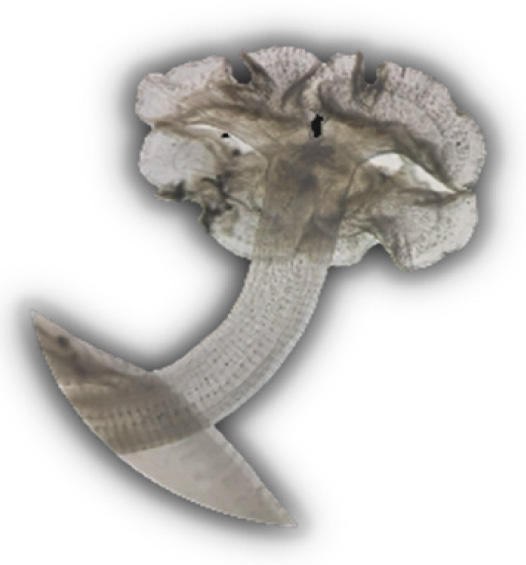
Fig. 13. Parte anterior: escólex de adulto de Phyllobothrium lactuca Beneden, 1850. Familia Phyllobothriidae.
Características: Escólexcon botridios sésiles, cuyos márgenes son fuertemente plegados y con una ventosa accesoria. Poro genital irregularmente alterno, presenta varios testículos e intervitelinos anteriores al ovario y la vagina anterior al saco del cirro. Ovario tetrabulado en sección transversal y vitelario lateral (Tantalean et al., 1982).

Fig. 14. Parte anterior: escólex de larva plerocercoide de Diphyllobotrium c.f. pacificum Nybelin, 1931. Familia Diphyllobothriidae.
Características: Alargadoy con órgano de fijación en el excólex evaginado, acorozonado y con dos botrios bien desarrollados que terminan en una especie de disco succionador. No presenta proglotidos desarrollados (Tantalean et al., 1982).
Características: Cuerporobusto con escólex largo, craspedote subcilíndrico con cuatro botridios separados y sin bordes libres. Tentáculos cortos, con ganchos sólidos dispuesto en espirales; estos ganchos son semejantes con excepción a los de la base. Vaina de la proboscis no espiralada o contorneada (Tantalean et al., 1982).

Fig. 16. Parte anterior: escólex de adulto de Rhodobothrium mesodesmatum (Bahamonde & López, 1962) Campbell & Carvajal, 1979. Familia Phyllobothriidae.
Características: Escólexcon cuatro botridios pedunculados, en forma de trompeta convexa y arrugada, de márgenes crenuladas; estróbilo craspedote, tamaño de 21 - 50 cm de largo. Cirro espinoso con saco. Vagina anterior al saco cirral, con testículos medulares que invaden la zona del ovario. El ovario es en forma de cordones que irradian de un istmo central; tetralobulado en corte transversal. Vitelarias en forma de bandas laterales y con poro uterino (Tantalean et al., 1982).
Características: Escólexsin mizorynchus, cuatro botridios con dos ventosas accesorias, una en el extremo anterior y la otra en el centro. Bordes de los botridios arrugados, sin cuello. Poro genital irregularmente alterno. Bolsa del cirro oblícua. Cirro voluminoso y con espinas. La vagina se abre anterior al saco cirral. Testículos pre-ováricos (Tantalean et al., 1982).
Características: Parteanterior del tronco ensanchado y cubierta de espinas, las que se continúan por la región ventral. Probóscide con 17 hileras de 12 - 13 espinas y con espinas en la región genital (Tantalean et al., 1982).
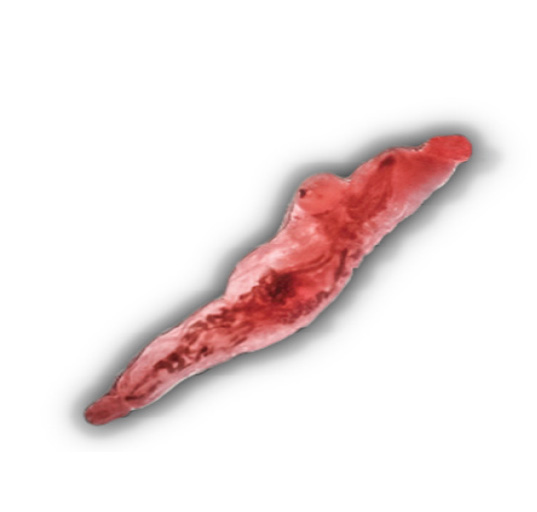
Fig. 19. Gónadas de caballa con un parásito adulto de Ovarionematobothrium c.f. saba Kamegai & Shimazu, 1982. Familia Didymozoidae.
Características: Extremadamentealargado y frágil, con ventosa oral en la parte anterior y debajo de la ventosa se encuentra el poro genital. Esófago corto y tubo digestivo bifurcado. Brazo excretor en posición anterior. Ovario y testículo a la altura de la región central.
De igual manera se calcularon los diversos índices parasitarios en las ocho especies analizadas (Cuadros 2, 3, 4, 5 y 6).
Cuadro 2 Índices parasitarios en 30 ejemplares de Mugil cephalus “lisa” que se expende en el mercado mayorista de Buenos Aires - Trujillo, La Libertad.
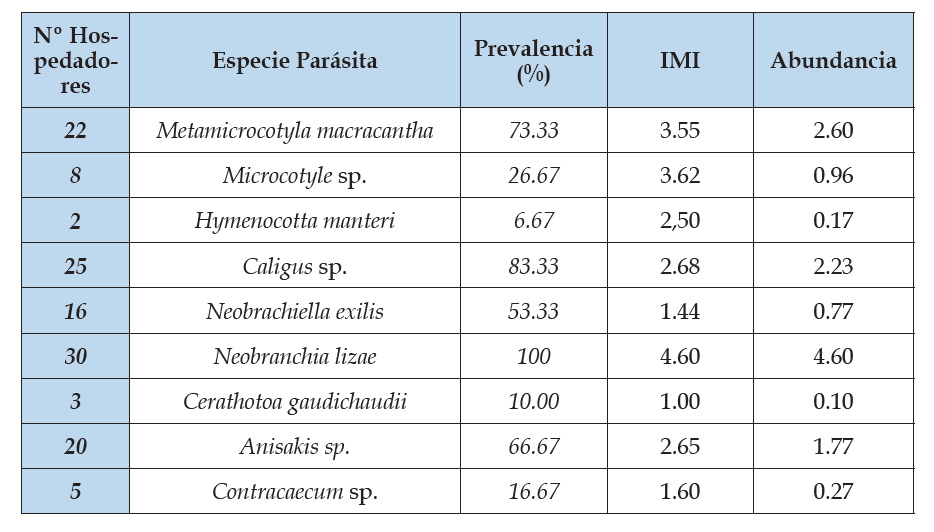
Cuadro 3 Índices parasitarios en 30 ejemplares de Sciaena deliciosa “lorna” que se expende en el mercado mayorista de Buenos Aires - Trujillo, La Libertad.
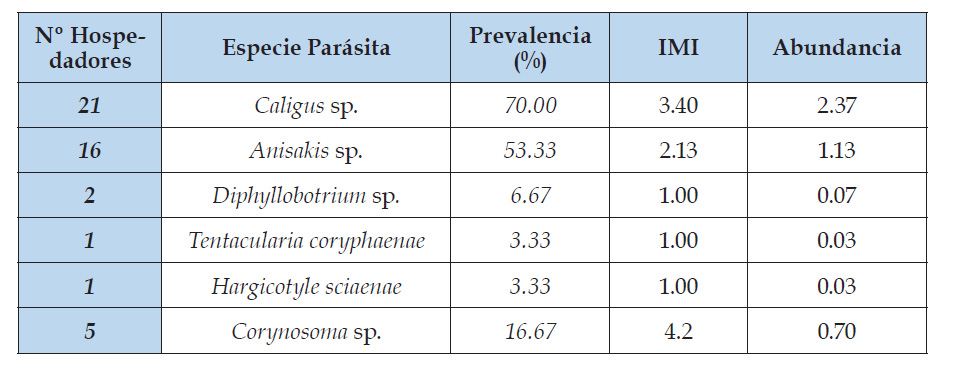
Cuadro 4 Índices parasitarios en 30 ejemplares de Scomber japonicus “caballa” y Sarda chiliensis chiliensis “bonito” que se expenden en el mercado mayorista de Buenos Aires - Trujillo, La Libertad.
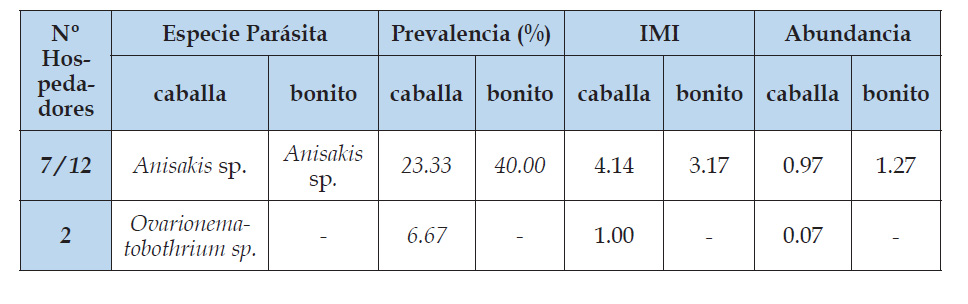
Cuadro 5 Índices parasitarios en 30 ejemplares de Trachurus murphyi “jurel” y Mustelus mento “tollo blanco” que se expenden en el mercado mayorista de Buenos Aires - Trujillo, La Libertad.
Discusión
Se debe tener en cuenta que los peces marinos de importancia comercial, tanto para el comercio industrial de harina, conservas y aceite de pescado y la de consumo humano directo; según sea el caso, están sujetos mayoritariamente a la extracción, procesamiento y conservación del mismo a través de tecnología local e importada; pero éste aprovechamiento no está acompañado de investigaciones o estudios tendientes a patologías o parásitos de los peces, que en algún momento, dadas las condiciones ambientales y la contaminación puedan generar una zoonosis. En ese sentido, la calidad e inocuidad de los alimentos de origen marino es primordial; en el Terminal Pesquero de Buenos Aires de Trujillo, se expende una gran diversidad de peces marinos para consumo humano directo, procedentes del norte y sur del país, cuyo grado de conservación a la vista no es el adecuado.
Sin embargo, de acuerdo al Decreto Supremo Nº 040-2001-PE, la normatividad peruana establece consideraciones sanitarias durante el procesamiento fresco previo al congelamiento o de pescado procesado para curado y luego sometido a la comercialización, y que en alguno de los casos, si el pescado se encuentra parasitado se descartará de la línea de proceso y comercio; ya que, los parásitos aparte de deteriorar el pescado ocasiona pérdidas socioeconómicas, ya sea por la transmisión al humano de patógenos de importancia en salud pública como por ejemplo, los encontrados en el presente trabajo de investigación: Anisakis c.f. simplex y Diphyllobotrhium c.f. pacificum, cuyos casos de zoonosis en el mundo son alarmantes; motivo por el cual, es de interés nacional mantener actualizada la data de la fauna parasitaria presente en las especies hidrobiológicas destinadas al consumo humano directo o indirectamente, con la finalidad de establecer programas sanitarios y recomendaciones para garantizar la inocuidad de estos productos.
Se ha demostrado que la lista de parásitos y su incidencia en peces marinos de consumo humano que se expenden en el mercado mayorista de Buenos Aires de Trujillo - La Libertad, se ve acentuada por la infección de varias especies de parásitos que puede poner en riesgo la salud humana, es así que encontramos diversos helmintos de importancia en salud pública como platelmintos (duelas y tenias), nematodos (gusanos de dos puntas) y acantocéfalos (gusanos espinosos); de igual manera, no menos importantes, se encuentran algunos artrópodos isópoda y siphonostomatoida; en el caso de los helmintos, el registro es coincidente con las investigaciones de Ferre (2018), quien afirma que los problemas médicos son ocasionados por las fases infectantes de estos parásitos, como las metacercarias de digeneos, plerocercoides de cestodos y larvas de tercer estado de nematodos, que se encuentran en el tejido muscular o vísceras de los peces.
Peréz et al. (1999) hacen referencia que la frecuencia de larvas plerocercoides de Diphyllobothriidae están en 4.29% (3/70) en jurel y las larvas de Anisakidae con 8.6% (6/70), 47.1 % (33/70) y 20% (14/70) para jurel, bonito y lisa respectivamente, grupo de parásitos encontrados también, en el presente informe de investigación; se debe mencionar también que lo encontrado por los autores son larvas de Anisakis simplex (Larva Anisakis tipo I), Anisakis physeteris (larva Anisakis tipo II), Hysterothylacium aduncum y Contracaecum sp. Otras especies larvarias encontradas fueron: Corynosoma obtuscens, Tentacularia coryphaenae, Nybelinia sp. y Proleptus sp.
Slifko et al. (2000) hacen hincapié y destacan la importancia de los parásitos de peces marinos, específicamente helmintos como generadores de enfermedades emergentes, similares a nuestra investigación, donde se encuentran parásitos como Hymenocotta manteri, Anisakis c.f. simplex, Contracaecum sp. y Diphylobothrium c.f. pacificum, que son reportados en el mundo como responsables de zoonosis parasitaria como la trematodosis (digeneos) anisakiosis y difilobotriosis, estos parásitos reportados (tabla 1) en la investigación, también se encuentran presentes en los reportes de Cabrera et al. (1999) y Sarmiento et al. (1999) quienes encuentran estadios larvarios de Anisakis sp. en caballa, al igual que Serrano et al. (2017) encuentran Contracaecum sp. en lisa con una prevalencia de 13.3%, de igual manera registran Anisakis simplex en caballa y bonito con una prevalencia de 10 y 13.3% respectivamente, valores relativamente bajos con lo reportado en la presente investigación, tal como se indica en la tabla 2 para lisa, donde la prevalencia para Anisakis c.f. simplex es de 66.6% y para Contracaecum sp. de 16%; y en la tabla 4, para caballa y bonito Anisakis c.f. simplex con una prevalencia de 23.33 y 40.00% respectivamente y finalmente para jurel con 33.33%, tal como se detalla en la tabla 5; resultados que posiblemente estén directamente relacionados con las anomalías térmicas y al no tratamiento de aguas residuales domésticas y de las industrias pesqueras asentadas en nuestro litoral, que es evidente durante todos los años.
Anisakis c.f. simplex, reportado en el presente trabajo como parásito de lisa, lorna, bonito, caballa y jurel, se encuentran durante toda la temporada de trabajo; por lo cual, se infiere que es común en estas especies de peces de importancia en la alimentación humana y que estamos cada vez, más vulnerables a una infección masiva; por su parte, Fernández de Corres et al. (1996) indican que desde mediados de la década de los noventa se han descrito la existencia de casos de anisakiosis humana por consumo de pescado parasitado, pero cuyas larvas estaban presumiblemente muertas por tratamiento térmico; a su vez Muñoz & Olmos (2007), reportan Anisakis sp. en anchoveta procedente de aguas chilenas. Estas patologías ocasionadas por Anisakis sp. de acuerdo a Del Pozo et al. (1996) ocasiona una reacción de hipersensibilidad inmediata, caracterizada por urticaria aguda, angioedema y anafilaxia, mediada por IgE específicas frente a un antígeno termoestable del parásito; sin embargo, López-Serrano et al. (2000) en sus estudios manifiestan que la fuente antigénica causante de la reacción de hipersensibilidad son las larvas vivas de anisákidos.
De igual manera, en estudios realizados sobre detección de parásitos de peces marinos en Lima metropolitana, Serrano et al. (2017) reportan al nematodo Proleptus sp. como parásito de bonito y lisa con prevalencias de 56.7 y 86.7 % respectivamente en 30 ejemplares cada uno; lo que no concuerda con el presente trabajo, donde Proleptus sp. sólo se encuentra parasitando al tollo blanco con 53.33 % de prevalencia; posiblemente debido a la variación climática, la cual influye directamente en la diversidad parasitaria de la fauna ictica de nuestro mar peruano.
La lisa es uno de los peces que sustenta la pesquería artesanal en el departamento de la Libertad y que en el presente se expende también en los grandes supermercados de la ciudad de Trujillo; para el caso, el monogeneo Metamicrocotyla macracanta parasita las branquias con una prevalencia de 73.33% y una IMI de 3.55, Por su parte Vásquez y Jara (2012) trabajaron con 393 ejemplares de lisa procedentes de los puertos de Salaverry y Paita y hallaron 319 monogeneos de M. macracanta con una prevalencia de 81.2% y una IMI de 2.3, similar a las descripciones de Gonzales (1977), quien reporta M. macracanta en branquias de lisa y un endoparásito digeneo: Himenocotta manteri, en el intestino de lisa procedente de Ancón, Chorrillos, Callao y Chimbote; al igual que en el presente trabajo, donde H. manteri está parasitando el tracto digestivo con una prevalencia de 6.67%.
En la tabla 1, se reporta un trematodo digeneo adulto: Ovarionemathobotrium c.f. saba, encontrado en gónadas maduras de Scomber japonicus “caballa”, que es bastante largo y enrollado (Fig. 19), tan igual como lo describe Gonzales (2009) quien menciona que se encuentran enrollados a manera de fideos y en algunos casos atravesando las gónadas. A su vez Cruces et al. (2014), en una investigación, analizaron 31 ejemplares de caballa, procedentes de Puerto Malabrigo, en La Libertad Perú, quienes describen 12 especies de parásitos correspondientes a digeneos, cestodos, acantocéfalos, nematodos, copépodos e isópodos y una de las especies con una prevalencia de 58% es Ovarionemathobotrium saba.
Tantalean et al. (2005) registran 2 especies de acantocéfalos del género Corynosoma: Corynosoma obtuscens y C. australe, para el caso se reporta de igual manera, Corynosoma c.f. obtuscens y por su parte Cabrera et al. (1999), manifiestan que C. obtuscens no es muy exigente con su huésped definitivo; por esta razón, se le ha señalado como un patógeno potencial para el hombre en el Perú; en primer lugar, porque existe la práctica de riesgo de la población peruana de consumir el "cebiche", plato que se prepara a base de músculos de pescado crudo tratados con jugo de limón; la mayoría de los peces que son empleados en su preparación están infectados con estadios juveniles de C. obtuscens y finalmente, porque existe una especie del mismo género, C. strumosum que infecta a humanos y a otros animales que se alimentan de peces en Alaska.
Gonzales (2017) reporta una prevalencia de 1.1% de larvas de céstodes en vísceras de anchoveta, Serrano et al. (2017) encuentran Diphyllobothrium pacificum con una prevalencia de 20.0% en el peritoneo visceral y músculos de bonito y con una prevalencia de 3.3% para perico, en nuestro caso, tal como se muestra en la tabla 3, este céstodo se encuentra en lorna con una prevalencia de 6.67%.
Tentacularia coryphaenae, es un cestodo que se reporta en el presente trabajo en lorna; sin embargo, Tantalean et al. (1982) y Jara (1995) informan que es un parásito que infecta a jurel; a su vez Gonzales (2017) manifiesta que Coryphaena hippurus “perico” o “dorado” es un pez pelágico oceánico que se acerca a nuestras costas en la estación de verano y Gonzales (2012) en un muestreo realizado determina la presencia de T. coryphaenae, con una prevalencia del 100%, a su vez indica que no se ha reportado que la presencia de estos parásitos provoque zoonosis humana.
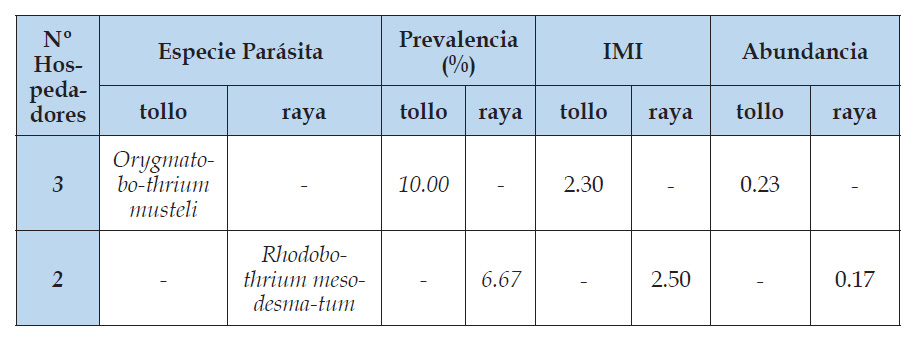
Se demuestra de igual manera que Phyllobothrium lactuca infecta al tollo blanco con una prevalencia del 3.33 %, para el caso Tantaleán et al. (1982), en sus trabajos realizados en la ciudad de Lima, reportan a este cestodo parásito que infecta la válvula espiral de Mustelus mento “tollo blanco”. Aragort (2002), en su estudio parasitológico de 132 elasmobranquios pertenecientes a la familia Rajidae: Raja brachyura, R. Microocellata, R. Undulata y dos especies identificadas como Raja spp. afirma que estas son parasitadas por P. lactuca; por su parte Abdel - Hamid (2005) en sus trabajos realizados en 30 especímenes de Boops boops, un pez de la familia Sparidae, orden Perciformes de los mares de Egypto, manifiesta que; también, Phyllobothrium lactuca infecta el tracto digestivo de este pez.
Tantaleán et al. (1982) manifiesta que el cestodo Orygmatobothrium musteli infecta la válvula espiral de Mustelus whitneyi “tollo común”, lo cual coincide con lo reportado en el presente trabajo; sin embargo, Barkert et al. (1984), en sus trabajos realizados en cestodos del orden Tetraphyllidea, hace hincapié que O. musteli infecta el tracto gastrointestinal de Mustelus mento, lo cual sustenta y reafirma con los reportes de micro anatomía realizados a los parásitos.
Rhodobothrium mesodesmatum se encuentra parasitando la válvula espiral de Myliobatis chilensis “raya águila” con una prevalencia de 6.67 %, lo cual se afirma con los reportes de Tantaleán et al. (1982) es sus trabajos realizados con especies de raya procedentes del Callao y se reafirma con la publicación de Luque et al. (2016), quienes aclaran y aportan que R. mesodesmatum, no sólo infecta M. chilensis; si no también a M. peruvianus y el intestino de Sarda chiliensis “bonito”.
Los copépodos parásitos, en algunos sectores de la sociedad son vistos con cierto desdén o desagrado. Si bien estos organismos son causantes de enfermedades y pérdidas económicas, su función es valiosa, ya que regulan la abundancia de los animales de vida libre y, además, brindan estabilidad a la red alimentaria dentro de los ecosistemas. Estas características han despertado un interés cada vez más creciente por el conocimiento de su diversidad, que tienen como rasgo principal el vivir asociado a otra especie de organismo u hospedero, y se han incentivado estudios científicos que investigan la parasitología con el fin de lograr un mejor entendimiento de los fenómenos biológicos y ambientales en diferentes escalas de tiempo y espacio (Morales & Peréz, 2012).
Al respecto Gonzales (2017), manifiesta que durante los años 2010 y 2012, en su laboratorio de biopatología acuática analizando lisas, observa un aumento de mucosidad en las branquias de estos ejemplares y encuentra en los tres primeros filamentos branquiales, 12 parásitos del copépodo Neobranchia lizae y en la parte externa del opérculo un copépodo ectoparásito: Neobranchiella exilis; que a su vez son parásitos frecuentes de lisa; ya que en el presente reporte N. lizae y N. exilis se encuentran con 100 y 53.33 % de prevalencia.
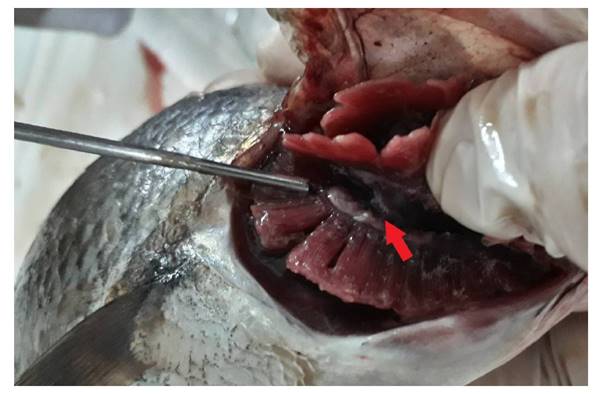
Para el caso de Ceratothoa gaudichaudii, si bien no causa daño alguno al hombre, se ha evidenciado en el presente trabajo que, lesiona la lengua y branquias de peces como lisa y jurel, coincidente con las afirmaciones de Jaramillo (1977), quien indica que es un parásito hematófago que se ubica preferentemente en la cavidad bucal de peces pelágicos de natación rápida y causa erosiones profundas en la cavidad bucal y destrucción de las laminillas branquiales afectando su sistema respiratorio en los hospederos infestados. De acuerdo a Ore (2016) este isópodo parásito, causa alteraciones morfológicas en otolitos de Trachurus murphyi “jurel” y se ha comprobado una relación de 100 % entre la presencia de Ceratothoa gaudichaudii y una anomalía morfológica de los otolitos asteriscus de jurel, no así los sagita, ni los lapilus. Los asteriscus afectados presentan la deformación de la espina central con deposiciones óseas desordenadas; C. gaudichaudii, parasita jureles de todo tamaño sin diferenciar el sexo.
De igual manera, Gonzales (2017), afirma que, en la cavidad bucal de varios ejemplares de caballa y jurel, encuentra el isópodo C. gaudichaudii de 41 mm de longitud total; estos parásitos, por lo general son encontrados emparejados, el macho es más pequeño que la hembra y presenta una bolsa a manera de marsupio en la zona ventral, en cuyo interior se encuentran las crías, son ovovivíparos. También hace hincapié que a la fecha no se ha encontrado ninguno de estos parásitos en el músculo y que pueda ser peligroso para el consumidor.
En general Mugil cephalus “lisa” presenta una prevalencia de 100% con una carga parasitaria de 409 parásitos de nueve especies, concordando con los reportes de Serrano et al. (2017), para Lima metropolitana, donde lisa presenta la mayor prevalencia y carga parasitaria de cinco especies de peces estudiadas; por su parte Lamothe (1994) aclara y hace hincapié que se requiere aún mejorar la manipulación de los productos pesqueros durante su comercialización; ya que, la presencia de parásitos en los peces acelera el proceso de descomposición del producto por las lesiones asociadas a la entrada de otros gérmenes como bacterias y hongos; por consiguiente, siendo escaso los reportes de infección o patologías en humanos causados por estos parásitos en nuestro medio, se deben tomar todas medidas sanitarias para prevenir daños irreversibles a la salud.
Se hace referencia que cada vez es más frecuente en el mundo las infecciones por parásitos de peces marinos de consumo humano directo y el Perú no es la excepción; al respecto, Oliva & Luque (2010) sustentan que alrededor de 18 - 20% de las capturas mundiales de peces marinos provienen del sistema de afloramiento de la corriente de Humboldt, estas capturas se refieren específicamente a pelágicos como anchoveta, sardina, caballa, bonito y jurel; también indican que existen parásitos de hospederos de ambientes acuáticos que están íntimamente ligados a las redes tróficas e inclusive tienen la capacidad de regular las poblaciones de los hospederos y podrían influir en varios procesos ecológicos que actúan a este nivel y que tienen que ver con fenómenos tales como el calentamiento global.
Conclusiones
-Se encontraron 18 especies de parásitos en ocho especies de peces marinos de consumo humano directo que se expenden en el mercado mayorista de Buenos Aires de Trujillo - La Libertad, Perú: Mugil cephalus “lisa”, Sciaena deliciosa “lorna”, Scomber japonicus “caballa”, Sarda chiliensis chiliensis “bonito”, Trachurus murphyi “jurel” Mustelus mento “tollo blanco”, Mustelus whitneyi “tollo común” y Myliobatis chilensis “raya águila”, parásitos pertenecientes a cuatro Phylum y siete Clases: Platyhelminthes: Monogenea, Digenea, Cestoda; Nematoda: Cromadorea; Arthropoda: Hexanauplia, Malacostraca; Acanthocephala: Palaeaconthocephala.
-Todas las especies de peces presentaron al menos un parásito, observándose la mayor prevalencia en lisa con el 100% y una carga parasitaria de 409, seguida de lorna con 70.00%, tollo blanco 53.33%, bonito 40.00%, jurel 33.33%, caballa con 23.33%, tollo común 10.00% y raya águila con 6.67%.
- Los parásitos de importancia en salud pública, relacionados con zoonosis humana son: Anisakis c.f. simplex, Contracaecum sp. y Diphyllobothrium c.f. pacificum.












 uBio
uBio