Introducción
La morfometría geométrica (MG) permite abstraer la forma de los organismos mediante el uso de puntos de referencia, cuantifica y analiza la variación morfológica, y se complementa con la cuantificación de la covarianza entre la morfología y otras variables de origen genético, climático, geográfico y otras. Con el desarrollo de la informática, ahora es posible automatizar el proceso de toma de mediciones, la manipulación de grandes matrices de datos y los análisis multivariados con un despliegue de gráficas muy elaboradas. Por tanto, la morfometría contribuye a dar respuesta a problemas de taxonomía y biología evolutiva, de tal manera que puede precisar cuantitativamente la variación morfológica presente en las poblaciones, investigar el origen y la naturaleza de la biodiversidad, así como los factores que afectan la morfología, apoyar la taxonomía, en particular en poblaciones de estatus taxonómico dudoso, detectar patrones evolutivos y afirmar los estudios filogenéticos (Garzón et al., 2016; Jaramillo-Ocampo, 2011; Toro et al., 2010).
Las alas de los insectos son idóneas para la investigación taxonómica mediante MG, según demuestran varios trabajos que permitieron aclarar diversos aspectos relacionados con la variabilidad morfológica en relación a los hábitats. Romero-Zuñiga et al. (2018), procesaron ortópteros Tettigoniidae de Brasil y Colombia; asimismo, Paredes (2015), en el estado de Bahía, Brasil, trabajó con poblaciones de Gynaikothrips uzeli y Gynaikothrips ficorum; Aldana et al. (2011), encontraron adaptación domiciliaria de Panstrongylus geniculatus en Caracas, Venezuela; en Chile, Espinoza-Donoso et al. (2020), diferenciaron sexualmente a Cicindelidia trifasciata. En Colombia, Moreno-Fonseca & Amat-García (2016), caracterizaron grupos de escarabajos pasálidos; Martínez (2018), Calle et al. ( 2008) y Cárdenas (2018) demostraron la utilidad de la MG en culicidos; también Garzón et al. ( 2016) en Buenos Aires, Argentina. De igual manera Macedo (2017a), Macedo (2017b) y Da Siveira (2011) determinaron con una alta tasa de fiabilidad, especies de Calliphoridae y Sarcophagidae en Brasil.
Según Lopes (2009), la determinación de especies y sub especies de A. mellifera L. y la introgresión genética en las abejas africanizadas, se puede realizar con análisis de isoenzimas, polimorfismo del ADN mitocondrial, hidrocarburos cuticulares y ADN nuclear; pero, estas técnicas requieren de gran inversión en laboratorios con equipos sofisticados, reactivos especializados y personal altamente capacitado; por consiguiente comparó la morfometría tradicional, MG, el sistema ABIS y procesó datos obtenidos de alas de abejas y encontró que la MG acertó en un 99,5% en la determinación de sub especies de A. mellifera; por tanto, recomienda el uso de este método como la mejor alternativa para las investigaciones de insectos sociales, por ser fácil y de rápida aplicación; así como por el acceso libre de los softwares. Francois (2007) y Francois & Imperatriz (2010), consideran que el uso MG, además de su fácil aplicación, también permiten dilucidar con mayor eficiencia las situaciones problemáticas en la taxonomía de las abejas.
Benitez et al. (2014), colectaron muestras de abejas de cuatro colmenares y de una colonia silvestre en la provincia de Granma en Cuba, y las procesaron mediante MG, para lo cual ubicaron 19 puntos anatómicos en las uniones de las venas del ala mesotorácica derecha, realizaron los análisis correspondientes y encontraron diferencias significativas en la venación de las abejas comerciales respecto a las silvestres. Asimismo, Santos et al. (2019), emplearon el mismo método para verificar posibles diferencias entre poblaciones de abejas africanizadas de la región costera y del interior de Piauí en Brasil y lograron diferenciar la sub especie evaluada y verificaron el posicionamiento racial de las abejas africanizadas de Piauí. En la península Ibérica se pudo establecer el padrón de diversidad genética de las abejas A. mellifera (Henriques et al. 2020) y su estructura poblacional (Chávez-Galarza et al., 2016).
En la actualidad, en la costa norte de Perú y en especial en el ámbito del Proyecto de Irrigación CHAVIMOCHIC se ha incrementado la actividad apícola, con el uso de miles de colmenas, para la polinización de frutales de agro exportación tales palto, arándano, cítricos y mango; por consiguiente, el uso de abejas está directamente relacionado con la productividad de estos cultivos. Por lo tanto, hay necesidad de promover investigaciones, para comprender la diversidad de este recurso biológico, de ahí la importancia de este trabajo que tiene por objetivo, determinar la estructura poblacional de abejas silvestres Apis mellifera de Trujillo, Laredo, Casa Grande y Virú, mediante el análisis de componentes principales.
Materiales y Métodos
Colección de especímenes de Apis mellifera
Se ubicaron 10 colonias silvestres de Apis mellifera en cada una de las localidades de Trujillo (2 en la Urbanización Natasha Alta, 4 en la ciudad universitaria UNT, 3 en Urbanización San Andrés, 1 en la Urbanización San Isidro), Laredo (3 en San Borja, 1 en Galindo, 3 en Conache, 3 en Pampas de San Juan), Casa Grande (3 en Santa Clara, 3 en Mocan, 4 en Licapa) y Virú (4 en el Fundo Talsa, 3 en el Fundo Avo Perú, 3 en Calunga), en la costa del departamento de La Libertad, la colecta se realizó entre noviembre del 2019 a marzo del 2020. Según Yániz et al. (2016), de cada colonia se capturaron 10 obreras nodrizas al azar (Sokal & Rohlf, 2015), las que fueron conservadas en frascos de plástico de 100 ml con alcohol al 70% (Triplehorn & Johnson, 2005) y etiquetados según lugar y fecha (Anexo 1), luego las muestras fueron trasladadas al Laboratorio de Entomología, del Pabellón Antonio Samanamud Romero, Sección de Zoología, Facultad de Ciencias Biológicas, ciudad universitaria de la Universidad Nacional de Trujillo, para el montaje y toma de imágenes de las alas.
Montaje y toma de imágenes de alas anteriores derechas de obreras
Según Chávez-Galarza et al. (2016) y Francois et al. (2008), de cada 10 obreras nodrizas se escogieron 5 especímenes al azar, de cada muestra colectada según colonia y localidad; se separó el ala anterior derecha, se procedió al montaje en fresco de cada una de las alas en una gota de agua destilada sobre una lámina porta objetos, luego se colocó otra lámina que fueron selladas con esmalte incoloro marca Vogue Fantastic (Anexo 2), después los montajes se dispusieron en una bandeja de plástico según la localidad.
La toma de imágenes de cada una de las alas, se hizo en el formato JPG con la cámara de celular Samsung J6PLUS calibrada con el estereoscopio Euromex (Anexo 3).
Ubicación y digitalización de los puntos anatómicos de referencia en las alas
Las imágenes de las alas de las abejas, se pasaron del archivo del celular a una laptop HP Intel Core i5 y se creó un archivo tps mediante el software tpsUtil64 versión 1,81 (Rohlf, 2008), y se guardaron como imágenes 2D (Anexo 4). En cada una de las alas, contenidas en el archivo tps, y mediante el software tpsDig2 versión 2,32 (Rohlf , 2006), se colocaron 19 puntos anatómicos de referencia (PAR), que según Francois (2007) corresponden a las intersecciones de las venas (Anexo 5). Estos puntos se transformaron en un plano cartesiano bidimensional y fueron almacenadas en el mismo archivo.
Análisis de los datos
Análisis de Componentes Principales (ACP)
Se creó un registro de datos a partir del archivo tps que fue elaborado en tpsDig 2 versión 2,32 con los 19 PARS digitalizados y se identificaron a los individuos según apiario.
Posteriormente con el programa MorphoJ (Klingenberg, 2011), se ingresó el registro de datos y se clasificaron a todos los especímenes según apiario de procedencia. Se realizó el análisis de procrustes (Anexo 6), se creó una matriz de covarianza y se hizo el análisis de componentes principales, para describir las variaciones morfológicas entre los especímenes.
Resultados
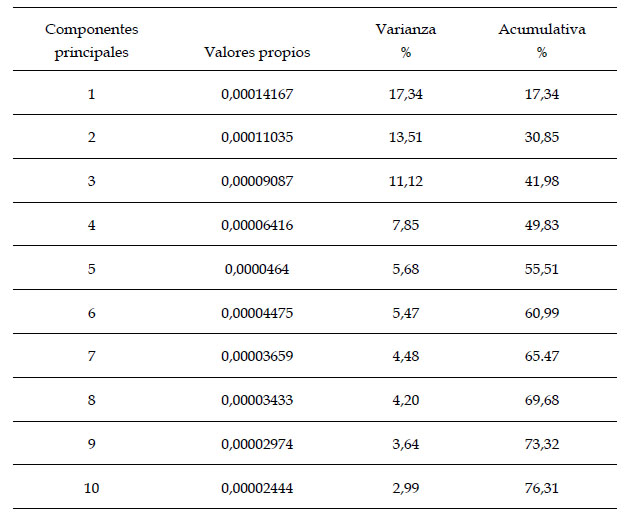
Con el análisis se obtuvieron 34 componentes principales, los dos primeros explicaron el 30,85% de la varianza total, el primero con 17,34% y el segundo con 13,51% (Tabla 1). A partir de 19 Puntos Anatómicos de Referencia (PARS) en el ala derecha anterior de A. mellifera casta obrera, se demostró una superposición importante entre los individuos colectados de distintas colmenas de Trujillo, Laredo, Casa Grande y Virú (Fig.1). Asimismo, en los esquemas de contorno deformado de los CP se observa una diferencia no significativa entre el extremo negativo del CP1 (Fig. 2) y el extremo positivo del CP1 (Fig. 3).
Tabla 1. Los primeros diez valores propios y varianza del análisis de componentes principales del ala anterior derecha de abejas obreras Apis mellifera L. de Trujillo, Laredo, Casa Grande y Virú. La libertad, Perú.
El solapamiento entre los puntos conformantes brinda la certeza de que no hay diferencias en la conformación morfométrica de los individuos analizados, esto explicaría que los especímenes analizados de las distintas colmenas de Trujillo, Laredo, Casa Grande y Virú comparten las mismas características morfológicas.
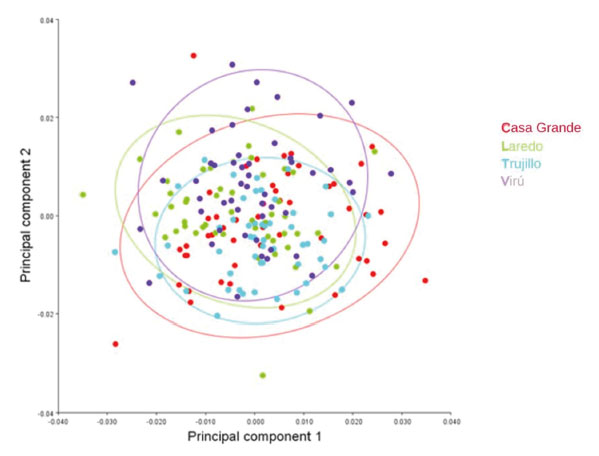
Fig. 1 Diagrama de dispersión del análisis de componentes principales de las coordenadas cartesianas de 19 Puntos Anatómicos de Referencia de las alas derechas anteriores de obreras de Apis mellifera L. de Trujillo, Laredo, Casa Grande y Virú. La Libertad, Perú.
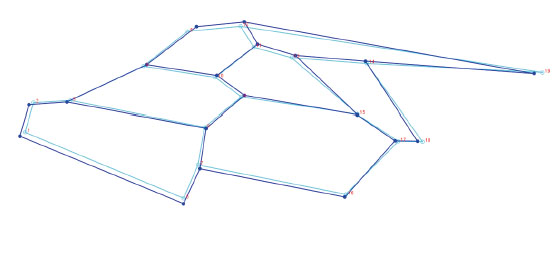
Fig. 2 Esquema de contorno deformado de las alas anteriores derechas de las alas anteriores derechas de Apis mellifera L. de Trujillo, Laredo Casa Grande y Virú, La Libertad, Perú, en el extremo más negativo del CP1 (-0,035)
Discusión
De acuerdo con el análisis de componentes principales (Tabla 1), se observa que los dos primeros componentes explican el 30,85% de la varianza acumulativa de deformaciones de las alas mesotorácicas derechas de las obreras A. mellifera de los cuatro lugares donde se colectaron las muestras, el primero con 17,34% y el segundo con 13,51% de varianza respectivamente, estos componentes demuestran la posibilidad en la baja variación de la forma entre todos los especímenes; al respecto, Salatnaya et al. (2019), con el ACP para el caso de las abejas con aguijón del género Tetragonula, encontraron que solo dos componentes principales alcanzan el 85.8%, por tanto, esto indica diversidad expresada en tres especies diferentes, Tetragonula clypearis, T. sapiens, T. biroi; cada una de ellas asociadas a las características geográficas del lugar que habitan.
En la fig. 1, se demuestra que a partir de contrastar los 19 PARS, ubicados en el ala anterior derecha de las abejas obreras, hay una evidente superposición de las elipses de confianza que representan a las abejas obreras de cada una de las cuatro localidades, lo que indicaría que las colonias contienen las mismas características morfológicas. Los datos analizados, teniendo en consideración las localidades de donde provienen, mediante el ACP, indican un solapamiento significante. Según Whinemiller (1991), una semejanza en la morfología, podría estar relacionado con el nicho ecológico, por lo que las abejas investigadas al compartir el mismo macro hábitat, de la costa del departamento de La Libertad, en consecuencia, en la zona de estudio predominan abejas que comparten las mismas características fenotípicas (Marín-Leyva et al. 2019).
Asimismo, en la fig. 1, las elipses que representan a las abejas de Trujillo, Laredo, Casa Grande y Virú se solapan, sobre esto, De Souza et al.(2015), lograron diferenciar grupos de abejas reinas criadas in vitro, abejas reinas naturales y obreras naturales; en estos casos el análisis de componentes principales fue determinante para identificar los taxones o castas según su crianza. Con una técnica similar y complementadas con caracterización genética, Özdil et al.( 2022), encontraron varias sub especies de abejas obreras que se diferenciaron notablemente en distintas localidades de Tracia en Turquía, por lo que atribuyeron a los accidentes geográficos de la zona. En el presente trabajo las colonias de abejas se distribuyeron en hábitats muy similares de la costa de La Libertad, Perú.
En las figs. 2 y 3 se observa la poca diferencia en la variación de formas de estas abejas, de un extremo positivo a un extremo negativo (-0, 035 y 0, 035) del componente principal 1; es decir, que a pesar de ser extremos relativamente lejanos los esquemas de contorno de las alas no se deforman demasiado con respecto al otro extremo, este resultado también apoyaría la evidencia que las abejas investigadas serían poblaciones de características morfológicas similares. Por esta misma técnica Abed et al. ( 2021), hallaron una gran diferencia significativa en la forma del ala anterior derecha entre las sub especies endémicas Apis mellifera intermissa y A. m. sahariensis; de igual manera Aglagane et al. (2022), encontraron diferencias significativas en cuanto a la forma de las alas, de cuatro poblaciones respecto a las subespecies A. m. sahariensis, A. m. intermissa, debido posiblemente a un proceso de hibridación natural en el Sahara, Marruecos.
Los datos procesados a partir de PARS, en las alas mesotorácicas derechas de las abejas obreras, mediante morfometría geométrica en este trabajo, son significativos para determinar la variabilidad morfológica de las poblaciones de abejas en la costa de La Libertad; de manera similar Barour & Baylac (2016), trabajaron con la finalidad de discriminar a tres sub especies, A. m. intermissa y A. m. sahariensis de Argelia y, A. m. capensis de Sudáfrica y hallaron tasas de clasificación de validación cruzada muy altas. Asimismo, Dolatti et al. (2013), basados en las variables de forma de las alas delanteras, encontraron diferencias significativas en poblaciones de abejas europeas en nueve localidades de Irán; del mismo modo, Masaquiza et al. ( 2023) en Cuba, reportaron que el 96% de abejas procesadas y con un patrón bien definido de la forma de las alas, las clasificaron como híbridos de este país con una gran similitud con A. m. mellifera, sin presencia de abejas africanizadas. Además, Francoy et al. ( 2008), con el procesamiento de las alas por morfometría geométrica, corroboraron la eficiencia para determinar las características de las abejas africanizadas en Brasil; se debe de tener en cuenta que estos ápidos también están presentes en la costa norte de Perú.












 uBio
uBio