Introducción
El hígado es el principal órgano relacionado con la desintoxicación de xenobióticos. Por lo cual, la alta cantidad de xenobióticos ocasiona daños estructurales y funcionales, estando relacionado con hepatotoxicidad (Fu et al., 2018). Entre los agentes que ocasionan hepatotoxicidad se encuentra el paracetamol, responsable de la mitad de casos de fallo hepático en los Estados Unidos (Rotundo & Pyrsopopulos, 2020). El metabolismo del paracetamol a nivel hepático se realiza a nivel microsomal por el citocromo P450 2E1 (CYP2E1), produciendo especies reactivas de oxígeno y disfunción mitocondrial por producción de N-acetil-p-benzoquinona imina (NAPQI) (Jaeschke et al., 2012). El NAPQI se conjuga con glutatión produciendo metabolitos menos tóxicos. Mientras que la actividad de glutatión peroxidasa se reduce hasta el 60% en presencia de paracetamol. Ante niveles crecientes de paracetamol, el NAPQI produce reducción del glutatión e incremento peroxinitritos y de especies reactivas de oxígeno (EROs) (Ramachandran & Jaeschke, 2018).
Los EROs pueden ser reducidos por la actividad de diferentes compuestos incluyendo los flavonoides, compuestos que presentan un núcleo flavano compuesto por dos anillos bencénicos unidos a un anillo pirano heterocíclico con alta capacidad antioxidante por presencia de grupos reductore (Speisky et al., 2016). Se han descrito más de 8000 antioxidantes presentes en el reino vegetal (Pietta et al., 2000). Entre estas plantas se encuentra A. muricata, que según Arroyo et al. (2005) y Quispe et al. (2006), puede eliminar selectivamente a las células que presentan daño oxidativo por la presencia de sustancias alcaloideas y polifenoles teniendo actividad anticancerígena para el estómago y el pulmón (Arroyo et al., 2009), hipoglicemiante, antiespasmódica, sedativa, antimalárica y vasodilatadora (Quispe et al., 2007). A pesar de haber pruebas de la actividad benéfica de esta planta, se requieren más estudios, por lo cual el objetivo de este trabajo fue determinar el efecto del extracto de Annona muricata “guanábana” en Rattus norvegicus albinus “ratas” tratadas con paracetamol.
Material y métodos
Material biológico
Se trabajó con 9 individuos machos adultos de R. norvegicus albinus con un peso promedio de 340 + 100 g de peso corporal, las cuales fueron mantenidas en cuarentena por 15 días para adaptarlas a las condiciones de laboratorio, siendo alimentadas ese tiempo con purina y agua a libre disposición. Luego fueron distribuidas de una manera aleatoria en tres grupos de tres cada uno y se les aplicó los tratamientos por vía oral, diariamente durante 5 días.
Material botánico
Las hojas fueron extraídas del árbol de A. muricata (Annonaceae) “guanábana” del Jardín Botánico de la Universidad Nacional de Trujillo, de donde se colectaron muestras sanas y sin rastro de haber recibido daño mecánico. Las hojas fueron lavadas con abundante agua de caño para eliminar las impurezas y luego enjuagadas con agua destilada, posteriormente fueron cortadas en trozos pequeños para facilitar la extracción de flavonoides.
Obtención del extracto
Se emplearon 261.5 gramos de hojas de A. muricata en etanol al 96%, las hojas se dejaron en maceración durante 7 días. Cumplido el tiempo, el macerado se trató con reflujo continuo durante 2 horas para una extracción más eficiente, tras lo cual se filtró, obteniéndose el extracto etanólico, que fue expuesto a concentración por pervaporación durante 2 días para obtener el concentrado, tras la pervaporación, se obtuvieron 15,68 gr. de concentrado, el que finalmente se disolvió en agua al 15%, tras lo cual se administró a las ratas con su bebida. El flujo de trabajo para la obtención del material botánico y preparación del extracto se muestra en la Fig. 1.
Aplicación de tratamientos
Las ratas fueron dispuestas en un Diseño Completamente Aleatorizado. Los tratamientos fueron administrados vía oral durante 5 día a cada grupo. Se tuvieron 3 tratamientos, detallados a continuación (Cuadro 1):
- T1 (Control): Constituido por 03 ratas tratadas con alimentación normal y con agua destilada.
- T2 (Paracetamol): Constituido por 03 ratas tratadas con alimentación normal y con paracetamol en una dosis de 200 mg/día.
- T3 (A. muricata+Paracetamol): Constituido por 03 ratas tratadas con 4,5 g de extracto hidroalcohólico de guanábana/kg de peso corporal y con paracetamol en una dosis de 200 mg/día.
Cuadro 1: Distribución de los tratamientos y repeticiones para el estudio.
| T1: Nada (control negativo) | T2: Paracetamol (control positivo) | T3: A. muricata + Paracetamol | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| r1 | r2 | r3 | r1 | r2 | r3 | r1 | r2 | r3 | ||
El detalle de la aplicación de tratamientos y obtención del tejido hepático se muestra en la Fig. 2.
Resultados
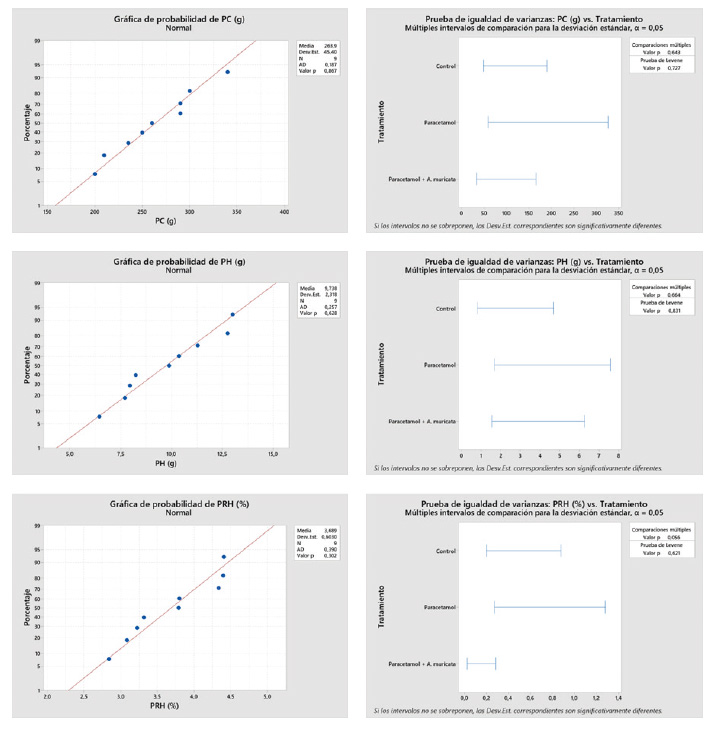
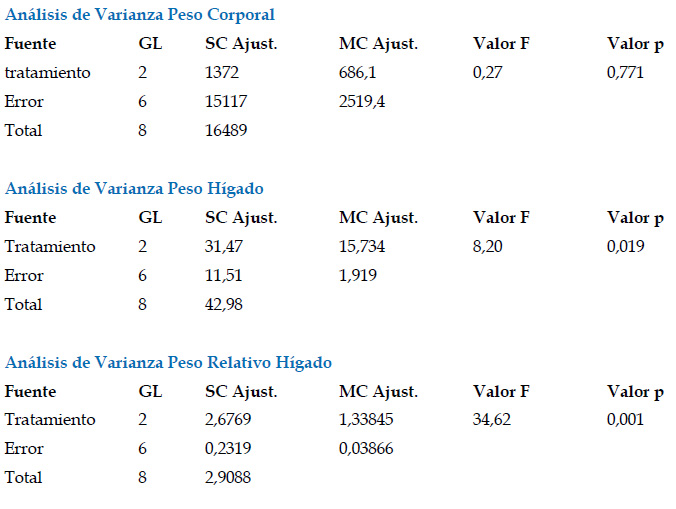
Todos los hígados evaluados mostraron 7 lóbulos, con ausencia de esteatosis a nivel tisular. Con respecto a los resultados de las pruebas de normalidad y la homocedasticidad se muestran en el Anexo 1, mientras que los resultados del ANVA se muestran en el Anexo 2.
Los resultados y la prueba de comparación de medias múltiple de Tukey son mostrados en la Fig. 3. Las ratas del grupo control mostraron un valor de peso corporal (PC) promedio de 246, 7g, siendo estadísticamente similar a los grupos tratados con paracetamol y paracetamol+A. muricata (270 y 275 g, respectivamente).
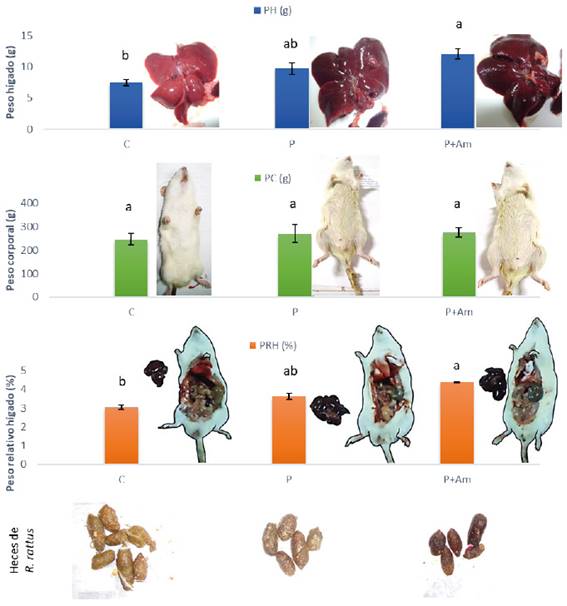
Fig. 3 Resultados del efecto del extracto de A. muricata sobre diferentes parámetros hepático. Las barras de color representan los promedios. Letras diferentes indican diferencias significativas según Tukey HSD (p<0,05). Las líneas verticales en cada barra representan el error estándar.
En relación al peso del hígado (PH), se observó que el grupo control mostró un peso promedio de 7,5g, siendo estadísticamente similar al grupo tratado con P, cuyo hígado mostró un promedio de 9,7g. Pero mostrando diferencias con el grupo P+Am (12, 0g).
De manera similar, cuando se midió el peso relativo del hígado (PRH), se encontró que el PRH tuvo un valor de 3,0, que fue estadísticamente similar al grupo tratado con paracetamol (3,6). En contraste, en las ratas tratados con P+Am, el valor de PRH fue 4,4.
Por otra parte, las heces mostraron coloración diferente, siendo las del grupo control de color marrón claro. En tanto, las heces de las ratas tratadas con paracetamol fueron de color marrón. Por último, las heces de las ratas del grupo P+Am tuvieron un color marrón oscuro.
Discusión
Los resultados arrojados, mostraron un aumento en relación con la aplicación de paracetamol y del extracto de guanábana en los animales tratados. El incremento en el peso del hígado es denominado hepatomegalia, una condición que está relacionada con daño hepático, y que está asociada con toxicidad causada por dosis elevadas de xenobióticos (Brushan & Apte, 2019). Teniendo en cuenta que la hepatomegalia es una manifestación clínica propia de la intoxicación por paracetamol (Torres, 2002), los resultados encontrados en el presente estudio concuerdan parcialmente con Selema & Martínez (1999) y Rodríguez et al. (2001), quienes hallaron en su ensayo variaciones en los pesos relativos del hígado de ratas tratadas con tetracloruro de carbono y con el flavonoide astibilina. En este estudio, el grupo al que se le aplicó solo el compuesto hepatotóxico, mostró mayor incremento en peso relativo del hígado. Estos resultados difieren de los observados en el presente estudio, en el que el mayor peso relativo del hígado fue hallado en el grupo al que se le aplicó el extracto con efecto hepatoprotector. Las diferencias encontradas pueden deberse a la naturaleza química del extracto de A. muricata. En efecto, a pesar de que este extracto presenta altas cantidades de flavonoides, no fue capaz de disminuir el incremento de peso relativo del hígado en las ratas tratadas, por el contrario, lo incrementó.
Estos resultados contrastan a su vez con los encontrados por Troncoso & Guija (2007), quienes utilizaron paracetamol como sustancia hepatotóxica y perejil como hepatoprotector, encontrando mayor peso relativo del hígado en el grupo control, al que no se le aplicó ninguna de las sustancias del estudio. Además, se observó una disminución de los pesos relativos tanto en el grupo al que se aplicó paracetamol, como en aquel al que le fue aplicado el extracto de perejil, mientras que en el tercer grupo, se observó una disminución más acentuada, en el peso relativo del hígado de los animales. Sin embargo, ninguna de las variaciones encontradas en los pesos totales del individuo y de los órganos en estudio, fue significativa. De esta manera Troncoso & Guija (2007) demostraron que el extracto de perejil puede disminuir los efectos hepatotóxicos del paracetamol. Sin embargo, no se explica la razón de haber hallado mayor peso de hígado y mayor peso relativo de hígado en el grupo tratado con el extracto de A. muricata, lo cual señala un nivel de hepatotoxicidad, probablemente inducida por la dosis del extracto empleada.
Con respecto al color de las heces, también se observaron diferencias según los tratamientos. Este parámetro está relacionado con el metabolismo hepático, puesto que este color se relaciona con la cantidad de bilirrubina, pigmento producido por la degradación de la hemoglobina, principalmente en el hígado, y cuya eliminación del organismo como estercobilina, promueve la coloración típica marrón de las heces (Cerrillo et al., 2005). El aumento de bilirrubina según Cerrillo et al. (2005) está relacionado con las hepatopatías durante la gestación, por lo que este aumento, produciría una coloración más oscura en las heces de los grupos tratados. Es así que el resultado encontrado en el presente estudio, coincide con esta descripción, al observarse mayor intensidad de coloración en el grupo tratado con paracetamol. Sin embargo, esta vez también se observó una mayor intensidad, incluso mayor que la producida por el paracetamol, en las heces de las ratas que fueron tratadas además con el extracto hidroalcohólico de A. muricata.
Con respecto al número de lóbulos hepáticos, no se observó variación alguna, presentando todos los animales sus 7 lóbulos. La forma del hígado, fue en todos los casos, compacta y no se observó presencia de cuerpos grasos en los hígados de cada grupo. Resultado esperado, teniendo en cuenta que la literatura revisada no revela resultados resaltantes sobre estas características.
De esta manera, se tiene que a pesar de contar con una gran cantidad de flavonoides efectivos como antioxidantes y con actividad anticancerígena (Arroyo et al., 2005; Quispe et al., 2007) y antidiabética (Arroyo et al., 2009), y que fueron además determinados en la marcha fitoquímica realizada; estos flavonoides, no constituirían un rol preponderante como hepatoprotector frente al daño hepático producido por el fármaco paracetamol. Quedan pendientes, sin embargo, los análisis cuantitativos enzimáticos de transaminasas, compuestos como el malondialdehído, y el examen histológico, que son determinantes para determinar el daño hepático en animales sometidos a estudios de efectos hepatoprotectores de extractos de plantas (Troncoso & Guija, 2007).
Conclusiones
El extracto hidroalcohólico de Annona muricata ocasionó variaciones hepáticas en individuos machos adultos de Rattus norvegicus albinus tratados con paracetamol, incluyendo mayor peso de hígado, mayor peso relativo de hígado y coloración más oscura de heces.
La aplicación de paracetamol, indujo incremento en el peso relativo del hígado y coloración de heces más oscura, característicos de la hepatotoxicidad.
El mayor peso relativo del hígado y la coloración más oscura de las heces de las ratas, podrían significar un efecto hepatotóxico del extracto hidroalcohólico de Annona muricata sobre “ratas albinas”.












 uBio
uBio