Introducción
La producción primaria en el mar es de extrema importancia debido a que es la etapa inicial en la cadena alimenticia marina, la cual termina con peces y mamíferos marinos, como ballenas (Riley & Chester, 1989).
Métodos Normalizados (1992) indica que el fitoplancton, se ha utilizado como indicador de la calidad del agua. Algunas especies crecen en aguas muy eutróficas, mientras otras son muy sensibles a los residuos orgánicos y/o químicos. Algunas especies producen olores y sabores molestos, o condiciones anóxicas o tóxicas que dan lugar a la muerte de animales o enfermedades en el hombre.
El incremento de las proliferaciones algales nocivas a escala mundial como consecuencia de las actividades humanos en la zona litoral es cada vez más evidente. El grupo de microalgas que causa más problemas son los dinoflagelados, que dan lugar a proliferaciones recurrentes, persistentes, con fuertes repercusiones sociales, económicas y sanitarias que, además, parecen hallarse en proceso de expansión (Illoul et al., 2004).
Las intoxicaciones diarreicas (DSP) se producen por ingestión de alimentos de origen marino contaminado con toxinas DSP y se caracterizan por síntomas como nauseas, diarrea, vómitos y dolor abdominal que se inician desde unos 30 minutos hasta algunas pocas horas después de la ingestión de la toxina y persisten en la mayor parte de los casos entre 1 y 3 días (Lawrence et al., 2011).
En ese grupo se incluyen las microalgas que, sin necesidad de alcanzar concentraciones que discoloren el agua, confieren niveles de toxinas de tipo paralizante (PSP), diarreogénico (DSP) y amnésico (ASP) a los bivalvos y los convierten en no aptos para el consumo humano, ocasionando prolongados cierres en las explotaciones de cultivos y bancos naturales de moluscos. Si bien los episodios PSP, asociados a la presencia de Alexandrium spp y Gymnodinium catenatum constituyen el riesgo más grave para la salud humana, son los episodios de DSP causados por Dinophysis spp. y los de ASP causados por Pseudo-nitzschia spp. los que por su carácter crónico, amplia distribución espacial y larga duración constituyen globalmente el principal quebradero de cabeza para los maricultores europeos. A estos síndromes tradicionales hay que añadir el más reciente, la intoxicación de bivalvos por azaspirácidos (AZP), asociado con dinoflageladas del género Protoperidinium, que afecta a los bivalvos de Irlanda, Escocia y Noruega (Reguera, 2003).
Las toxinas diarreicas solían dividirse en tres grupos: ácido okadaico (AO) y derivados, dinophysistoxinas (DTX), pectenotoxinas (PTX) y yessotoxinas (YTX). Existían varias razones por las que incluir los YTX y PTX en el grupo DSP, ya que coexisten en muestras de moluscos bivalvos, son coestraídos de las glándulas digestivas de estos debido a su naturaleza lipofílica y provocan un efecto tóxico tras inyección intraperitoneal en ratones (Camean & Repetto, 2012).
El género de dinoflagelados tecadosDinophysisEhrenberg presenta varias especies toxígenas. Yasumotoet al. (1980) determinaron queD. fortiiPavillard es productora de una toxina a la que denominaron dinofisistoxina, que fue detectada en mitílidos y en fitoplancton, y señalada como productora de un síndrome diarreico al que designaron Intoxicación Diarreica por Moluscos (Diarrhoetic Shellfish Poisoning, DSP), (Sar et al., 2010).
La primera evidencia de la presencia de este tipo de enfermedad gastrointestinal asociada con el consumo de mejillones contaminados tras la ingestión de dinoflagelados tuvo lugar en Holanda en la década de 1960 (Kat, 1979). Dichos síntomas se asociaron entonces con el consumo de vieiras contaminadas con ácido akadaico (AO) y compuestos relacionados (Yasumoto et al., 1978) (Camean & Repetto, 2012).
Los problemas más graves de origen ficotóxico acaecidos en el Cono Sur, desde el punto de vista de las autoridades sanitarias y pesqueras, pertenecen a los definidos como «episodios de microalgas tóxicas», es decir, eventos en los que, sin alcanzarse necesariamente concentraciones que colorearan el agua, han causado graves intoxicaciones humanas y prolongadas prohibiciones a la extracción y comercialización de los moluscos. Inicialmente las intoxicaciones con VDM se asociaron a varios grupos de toxinas liposolubles (Yasumoto et al., 1989), que incluyen poliéteres, como el ácido okadaico (AO), Dinofisistoxina 1 (DTX1) (Murata et al., 1982), y las Dinofisistoxina 2 (DTX2) y Dinofisistoxina 3 (DTX3) descritas en bivalvos filtradores de Irlanda, España, Portugal y Japón (Hu et al., 1992; Yasumoto et al., 1985; Fernández et al., 1996; Vale & Sampayo, 1999). Los otros dos grupos de toxinas asociadas al VDM son las lactonas polietéreas macrocíclicas conocidas como Pectenotoxinas (Yasumoto et al., 1985; Murata et al., 1986) y los poliéteres fusionados conocidos como Yessotoxinas (Murata et al., 1987). Existe hoy día una gran controversia sobre el mantenimiento de estos tres grupos de toxinas bajo las mismas siglas, ya que tan sólo el AO y sus relacionados producen un efecto estrictamente diarreico, siendo este síntoma el que caracteriza el síndrome (Sar et al., 2002).
Dentro del programa de seguimiento o monitoreo que se viene realizando en nuestros país, a través del ya conocido “Programa Nacional de Moluscos Bivalvos”, el cual se encarga de regular aquellos indicadores relacionados a la inocuidad de la mayoría de productos hidrobiológicos cultivados en áreas industriales; y que incluye los ensayos de microalgas potencialmente toxicas como las especies del genero Dinophysis que es uno de los principales productores del grupo de Biotoxinas Lipofílicas; es que, esta investigación se proyecta y ejecuta evaluar la toxicidad del genero Dinophysis en la maricultura de la bahía Guaynuná.
Material y métodos
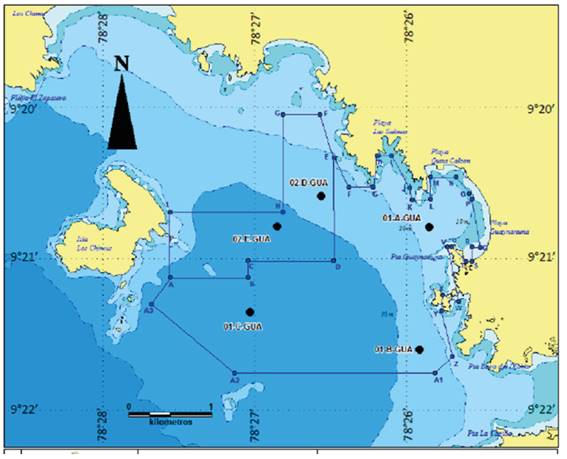
Zona de estudio: La Fig. 1 muestra la zona de estudio y las 5 estaciones de muestreo donde se tomaron las muestras: 01-A-GUA, 01-B-GUA, 01-C-GUA, 02-D-GUA y 02-E-GUA.
Toma de muestras: Las muestras de agua de mar recogidas en las 5 estaciones de la bahía Guaynuná, fueron recolectadas con una red de fitoplancton de 10 µm de abertura de poro de malla para los ensayos cualitativos, y el muestreador de manguera para los ensayos cuantitativos por estrato, muestra superficial de 0-5 m, de media agua de 5-10 m y de fondo de 10-15 m en una columna de agua total de 15 m de profundidad. En total se recolectaron 960 muestras de 80 ml, en frascos de vidrio color ambar de boca ancha tapa rosca y con lugol como conservante. De estas, 240 corresponden a la malla filtradora para análisis cualitativos y 720 al muestreador de manguera para análisis cuantitativos. La frecuencia de muestreo fue semanal, durante doce meses. Una vez en el laboratorio, las muestras para ensayos cualitativos fueron analizadas según el Manual de Procedimientos para el muestreo y ensayo semicuantitativo y cuantitativo de fitoplancton potencialmente toxico-IMARPE (2010).
Recuento y análisis: Una vez sedimentadas las muestras en cámara de Utermöhl de 25 ml se observaron al microscopio invertido (Nikon) para su identificación taxonómica. El objeto del recuento era determinar la diversidad y densidad de especies del genero Dinophysis.
Método de detección de toxinas lipofílicas (Reglamento CE Nº2074/2005)
Bioensayo en Ratón:
- Porción de ensayo: hepatopáncreas o cuerpo entero - Solventes de extracción: acetona o metanol - Solventes de separación: éter dietílico, acetato de etilo y diclorometano - Resuspención con 4mL de Tween 60 al 1% - Inoculación intraperitonealmenemte del extracto a 3 ratones de 19-20g.
Principio:
La gran mayoría son substancias polietereas liposolubles y extraíbles con acetona. El efecto tóxico agudo de la muestra analítica evaporado, resuspendido en Tween 60 e inoculado a ratones de 20g (Community Reference Laboratory for Marine Biotoxins, 2013).
Criterios de Toxicidad:
La muerte de 2 de 3 ratones se considera como positivo a toxinas lipofílicas AO, DTXs, PTXs y YTXs.
Resultados
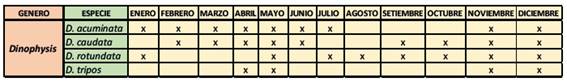
En el muestreo realizado durante el año 2015, los análisis cualitativos determinaron una población formada sólo por cuatro especies del género Dinophyisis: D. acuminata, D. caudata, D. rotundata y D. tripos. (Tabla 1).
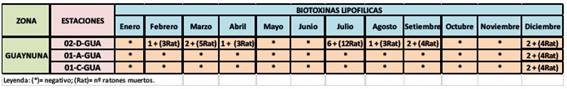
Los resultados del análisis de toxicidad por el método de HPLC del extracto del concentrado de los organismos en cultivo (moluscos), reveló la presencia de bitoxinas lipofílicas (Tabla 2), 6 muestras positivas durante el mes de julio, 1 muestra positiva durante los meses de febrero, abril y agosto, y 2 muestras positivas durante los meses de marzo, setiembre y diciembre en la estación 02-D-GUA; de igual manera se observa 2 muestras positivas durante el mes de diciembre para las tres estaciones evaluadas.
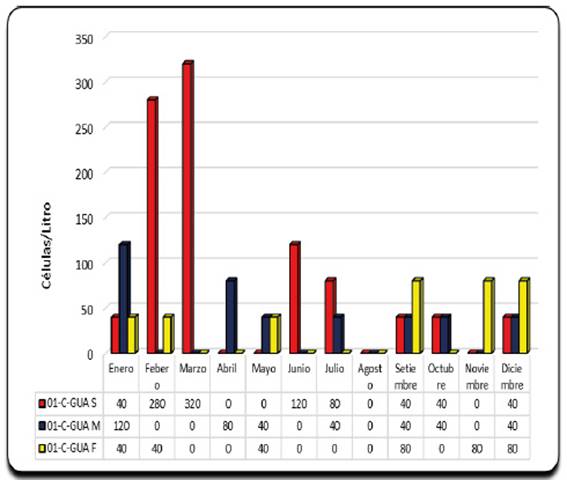
Durante el 2015, la distribución espacial del género Dinophysis en la estación 01-A-GUA predomino en el estrato superficial con concentraciones celulares que fluctuaron de 40 cel/l hasta 400 cel/l (Figura 2), respecto a su distribución temporal esta predomino durante los meses de verano y parte de otoño.
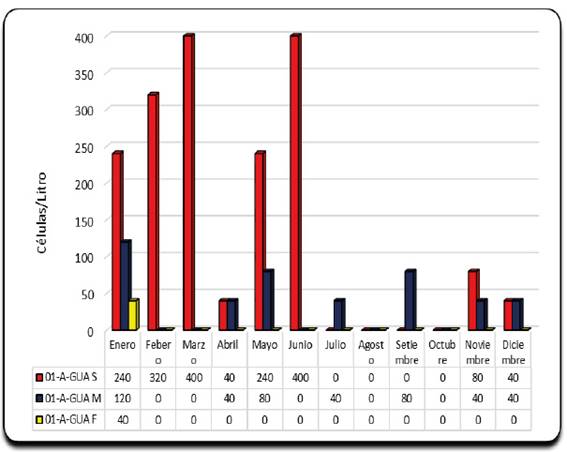
Fig. 2 Concentración del genero Dinophysis en la columna de agua de la estación 01-A-GUA de la Bahía Guaynuná.
La distribución espacial del género Dinophysis en la estación 01-B-GUA, se presentó en el estrato superficial alcanzando una concentración mayor de 840 cel/l y en el estrato fondo con 160 cel/l (Figura 3), con respecto a su distribución temporal esta fue mayor durante el mes de febrero, seguido de marzo, mayo, junio, y finalmente durante noviembre y diciembre.
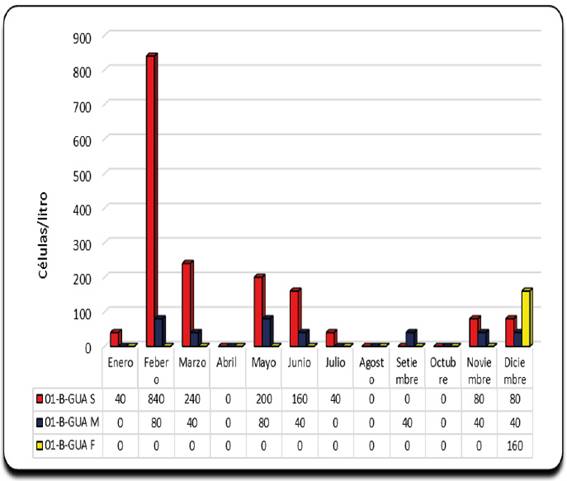
Fig. 3 Concentración del genero Dinophysis en la columna de agua de la estación 01-B-GUA de la Bahía Guaynuná.
En la estación 01-C-GUA, se observa que el género Dinophysis presento una distribución espacial predominante por el estrato superficial, con concentraciones de 320 cel/l (Figura 4), en cuanto a su distribución temporal, esta predomino durante los meses febrero, marzo, seguido de junio y julio, y en menor densidad durante setiembre, octubre y diciembre.
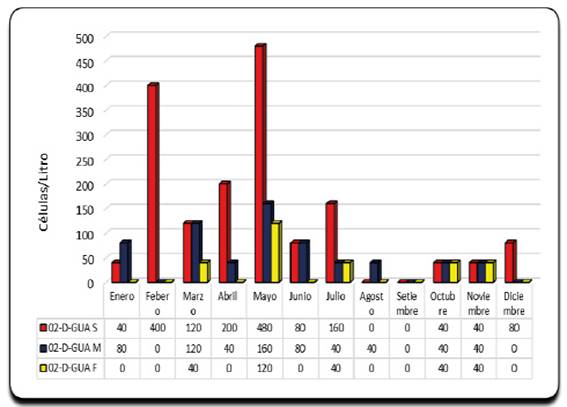
La estación 02-D-GUA, presento una distribución espacial del género Dinophysis en el estrato superficial alcanzando una concentración de 480 cel/ (Figura 5), respecto a su distribución temporal esta se presentó mayormente durante los meses de febrero y mayo, seguido de abril y julio, y en menor densidad durante los meses de octubre y noviembre.
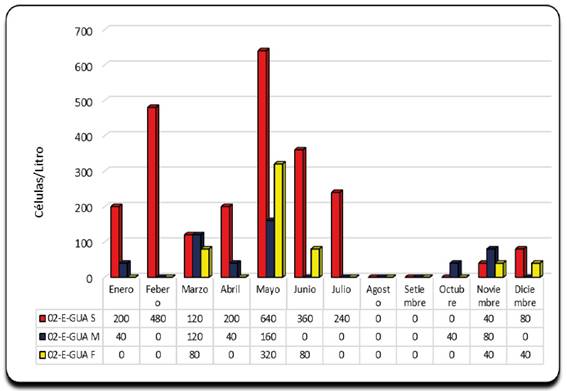
Finalmente, en la estación 02-E-GUA la distribución espacial del género Dinophysis predomino en el estrato superficial alcanzando una concentración mayor de 640 cel/ (Figura 6), respecto a su distribución temporal esta se presentó durante los meses de enero hasta julio y luego durante noviembre y diciembre.
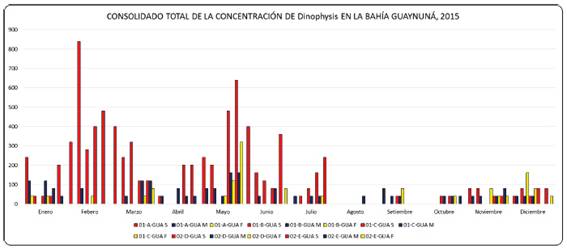
El consolidado total del análisis del género Dinophysis en las cinco estaciones de la bahía Guaynuná (Figura 7) revela que la presencia de las mayores concentraciones celulares se registró durante los meses de febrero, marzo y mayo.
La temperatura registrada en la columna de agua de las estaciones de muestreo de la zona en estudio presenta una tendencia máxima (unimodal) durante los meses de mayo y junio (Figura 8), alcanzando valores máximos en mayo, 21.17 °C en el estrato superficial, 20.89 °C en el estrato medio y 20.51 °C en el estrato fondo.
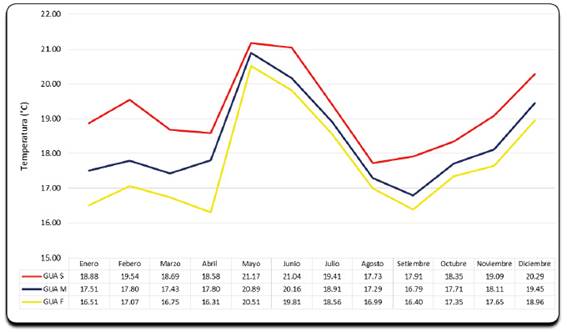
Fig. 8 Variación térmica estacional promedio de la columna de agua en las cinco estaciones de muestreo de la Bahía Guaynuná durante el año 2015.
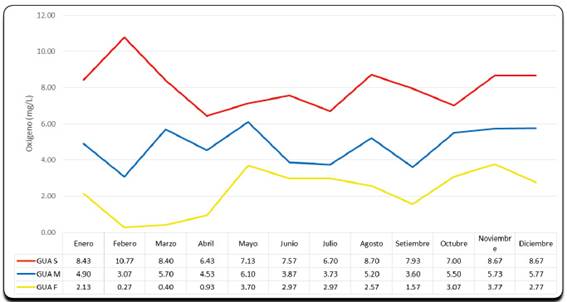
En cuanto al oxígeno disuelto, la figura 9, muestra concentraciones máximas en diferentes espacios, 10.77 mg/L en superficie durante el mes de febrero, 6.10 mg/L en media agua durante el mes de mayo y 3.77 mg/L en el fondo para el mes de noviembre.
Discusión
La bahía de Guaynuná es considerada una de las bahías más limpias del litoral peruano, ya que presenta un atractivo ecosistema, rica por la producción industrial del cultivo de moluscos bivalvos, esto gracias, a las óptimas condiciones ambientales y a su gran riqueza natural, como lo es, la productividad primaria, lo cual permite despertar el interés de muchos investigadores para conocer más aún sobre su comportamiento ambiental.
Por ello, en esta oportunidad este trabajo, permitirá evaluar la toxicidad del género Dinophysis en la maricultura que viene desarrollándose en la bahía de Guaynuná, mediante el monitoreo del fitoplancton cualitativo y cuantitativo, en especial de las especies productoras de toxinas diarreicas (DSP), presentes comúnmente dentro de una gran gama de dinoflagelados, la determinación de toxinas lipofílicas en carne de los moluscos en cultivo y la determinación de parámetros oceanográficos como temperatura y oxígeno disuelto.
El análisis cualitativo de fitoplancton, permitió determinar la presencia de cuatro especies productoras de toxina diarreica, Dinophysis acuminata, D. caudata, D. rotundata y D. tripos (Tabla 1); mientras que Rumay (2010) reporte siete especies para el mismo lugar, las 3 indicas más D. fortii, D. rudgei y D. subcircularis, así mismo, Reguera (2003) determino a D. acuminata y D. acuta como agentes de episodios de presencia de toxinas diarreicas en aguas gallegas.
De las 240 muestras trabajadas para análisis de toxinas lipofílicas (Tabla 2), se determinó mayor cantidad de positivos (6+) durante el mes de julio en la estación 02-D-GUA, una cantidad media de positivos (2+) durante el mes de diciembre en las tres estaciones evaluadas y también durante los meses de marzo y setiembre, por último, un solo positivo (1+) durante los meses de febrero, abril y agosto. Las investigaciones de Reguera (2003), indica que en Dinophysis acuminata: Detectó ácido akadaico (AO) en todas las muestras. En las muestras de Junio del 98, sometidas a dos tipos de extracción, las muestras en las que evidenciaron transformaciones enzimáticas dieron un contenido de AO por célula (7.9 pg.cel-1) inferior en un 20% al de las células extraídas por el método Lee et al. (1987) que presentaron 9.9 pg AO.cel-1. Se observó un minúsculo pico con un tiempo de retención similar al de DTX2. Las muestras de setiembre del 98 presentaron un contenido de toxina por célula 2-3 veces superior (21.7 pg.cel-1) a las de junio. Dinophysis acuta: en las tres muestras analizadas se detectó AO y DTX2. En las dos primeras muestras la proporción AO:DTX2 fue aproximadamente 3:2. Se observaron importantes diferencias cuantitativas entre las muestras resultantes de aislamientos el mismo día del arrastre (10.7 pg.cel-1) y las de arrastre mantenidas en el laboratorio 5 y 9 días (55.1 y 24.1 pg.cel-1 respectivamente). Dinophysis caudata: aparece en el cromatograma un pico muy pequeño con el mismo tiempo de retención que el AO que podría interpretarse como trazas de AO (˜0.7 pg.cel-1). Esto corrobora que existe relación entre presencia de toxinas lipofílicas y aparición elevadas concentraciones de especies del género Dinophyisis (Figura 7), aun cuando la relación de toxicidad sea de tipo cualitativa en nuestro caso. Pero, es necesario evaluar también otras poblaciones algales que en el momento predominan, ya que podría existir interferencias en los resultados de toxicidad obtenidos posiblemente a la relación indirecta de toxicidad comparada (algas-moluscos), es decir, que los datos de toxicidad son de los moluscos en cultivo y no de las biomasas de Dinophysis, por lo tanto, los moluscos evaluados tienen una alimentación mixta y filtran una gran infinidad de microalgas presentes en el medio marino y que como indica Reguera (2003), una vez asimiladas por los bivalvos, las toxinas pueden sufrir transformaciones enzimáticas que dan lugar a la formación de 7-O acil derivados del AO, DTX1 DTX2, genéricamente denominados DTX3. La conversión de DTX1 (procedente de D. fortii) a DTX3 en la viera japonesa (Patinopecten yessoensis) ha sido demostrado por Suzuki et al. (1999).
El análisis cuantitativo de fitoplancton, permite cuantificar la densidad algal de cada especie en estudio. Las concentraciones celulares de especies de Dinophysis, en la estación 01-A-GUA alcanzó concentraciones de 400 cel/L en el estrato superficial durante la época de verano y otoño (Figura 2); Rumay (2010) determino una concentración de 360 cel/L de Dinophysis acuminata en la estación N° 3 durante el verano para la misma bahía, por el contrario, Sar et al., (2010) indica que, Dinophysis acuminataapareció en una única oportunidad con una densidad de 103cel l-1en noviembre del 2009 en las localidades de Villa Gesell y Mar Azul, Provincia de Buenos Aires, Argentina, notándose en esta zona una mayor proliferación microalgal toxica. En la estación 01-B-GUA se observa una concentraciones máxima de 840 cel/L en el estrato superficial durante la época de verano (Figura 3); Rumay (2010) indica una concentración 100 cel/L de Dinophysis caudata en la capa superficial de la estación E-2 para la misma bahía durante el verano; por el contrario, Sar et al., (2010) indica registros de Dinophysis caudata de 103cel l-1 a finales de enero. Para la estación 01-C-GUA se alcanzó dos concentraciones superficiales importantes de Dinophysis, la primera en febrero con 280 cel/L y la segunda en marzo con 320 cel/L durante la época de verano (Figura 4); en el año 2010 también se determinó una concentración de 100 cel/L de D. fortii en la superficie de la E-1 durante la época de primavera, según Rumay, (2010). En la estación 02-D-GUA se observa dos concentraciones principales de Dinophysis, una en febrero con una densidad de 400 cel/L y la otra con 480 cel/L en mayo en el estrato superficial (figura 5); durante el 2010, Rumay determinó una concentración de 40 cel/L de Dinophysis rotundata en las tres estaciones evaluadas durante la época de primavera. Finalmente, en la estación 02-E-GUA, se determinó dos concentraciones importantes una correspondiente al mes de febrero con 480 cel/L y la otra durante el mes de mayo con 640 cel/L en el estrato superficial (Figura 6); así mismo, Rumay (2010) determino un valor de 140 cel/L de la especie Dinophysis rudgei en la una estación E-2, 40 cel/L de D. subcircularis en dos estaciones, E-1 y E-2, y D. tripos superficial en las estación E-3 y de fondo en la estación E-1 en concentración de 20 cel/L; Sar et al., (2010) detecto presencia de Dinophysis tripostecada durante julio del 2009 en todas las estaciones de muestreo, alcanzando una densidad de 3·102cel l-1en Villa Gesell y Mar Azul. En general, la distribución espacial del genero Dinophysis en la bahía de Guaynuná para el año 2015 se manifestó en dos tiempos, la primera durante los meses febrero-marzo y la segunda durante los meses mayo-junio (Figura 7).
En cuanto al comportamiento térmico de la columna de agua en la bahía Guaynuná durante el año 2015, la temperatura alcanzo máximos de 21.17 °C en superficie, 20.89 °C a media agua y de 20.51 °C en el fondo, durante el mes de mayo (Figura 8), alcanzando las especies del género Dinophysis dos concentraciones celulares importantes, la primera en la estación 02-D-GUA con 480 cel/L en superficie, 160 cel/L a media agua y 120 cel/L (Figura 5), y la segunda en la estación 02-E-GUA con 640 cel/L en superficie, 160 cel/L a media agua y 320 cel/L (Figura 6) en la columna de agua, observándose una relación directamente proporcional entre la temperatura y la densidad algal en estudio durante todo el año. Reguera (2003) manifiesta que, las proliferaciones de D. acuminata aparecieron bajo rangos más amplios de temperatura (12.5°C - 22°C) mientras que D. acuta tiene preferencia por rangos más estrechos de temperatura (15°C - 17.5°C).
El comportamiento del oxígeno disuelto, en la bahía Guaynuná durante el año 2015, tuvo una distribución más homogénea para las cinco estaciones evaluadas, excepto ligeras disminuciones durante los meses de febrero-mayo, marzo-abril donde se originaron las mayores densidades de Dinophysis (Figura 9).
Conclusiones
1. Se determinaron cuatro especies de Dinophysis: D. acuminata, D. caudata, D. rotundata y D. tripos.
2. Se determinó un 7.92% de muestras positivas de toxinas lipofílicas en las estaciones evaluadas de la bahía Guaynuná durante el año 2015.
3. Las concentraciones obtenidas de especies del género Dinophyisis durante el año 2015, indican que a pesar del tiempo trascurrido desde el año 2010 en que se evaluó por primera vez este indicador, la bahía Guaynuná mantiene niveles bajos, debido al manejo ambiental adecuado en el desarrollo de la maricultura.
Recomendaciones
Para efectos de este tipo de investigación, es necesario ver la factibilidad de aplicar pruebas de laboratorio directas entre las variables en evaluación; para el caso, los resultados de toxicidad en Dinophysis hubieran sido más precisos y reales si se hubiera realizado en las densidades de la microalga. Por ello, es necesario continuar investigando, en temas como el aislamiento y cultivo de especies nocivas o toxicas propias de nuestro país, ello permitirá resolver las nuevas incógnitas formadas en cada investigador.












 uBio
uBio