Introducción
Caesalpinia spinosa “tara” es un vegetal perteneciente a la familia Fabaceae, proviene del Perú, cuya vaina contiene la mayor concentración de taninos utilizados en la industria (Chambi et al., 2013), principalmente en la fabricación de plásticos y adhesivos, galvanizados, vinos, clarificación, sustituto de la malta en la producción de cerveza, en la industria farmacéutica por su amplio uso terapéutico, en curtiduría por su capacidad de cambiar la estructura dérmica del cuero (Ballesteros et al., 2021; Lasso et al., 2020; Terán et al., 2018). Otro elemento que se obtiene de los taninos de C. spinosa, es el ácido gálico (3,4,5-trihidroxibenzoico) un polifenol que pertenece a los taninos hidrolizables, los cuales tienen propiedades antimicrobianas y anticancerígenas debido a su gran capacidad antioxidante que permiten atrapar fácilmente radicales libres (Wang et al., 2018).
El ácido gálico se produce por hidrólisis ácida a partir del ácido tánico, pero los problemas de costos relacionados con su bajo rendimiento y pureza deben llevar a nuevas opciones, como la utilización de tanasas de un microorganismo (Terán et al., 2018). Las hidrolasas del ácido tánico, comúnmente conocidas como tanasas, son una de las enzimas hidrolíticas microbianas más importantes, que fue descubierta accidentalmente por Van Teighem (1987) quien llegó a demostrar la formación de ácido gálico durante la fermentación de taninos por Aspergillus niger (Prigione et al., 2018; Dhiman & Mukherjee, 2020).
De hecho, se desarrollaron muchos sistemas de fermentación para la producción de enzimas por parte de hongos; entre ellas se pueden mencionar: fermentación líquida superficial, fermentación sumergida y fermentación en estado sólido. La fermentación en estado sólido (FES) consiste en hacer crecer un microorganismo sobre el sustrato, utilizando una fuente de nitrógeno y nutrientes minerales bajo ciertas condiciones como humedad, pH, aireación y temperatura. FES no presenta agua libre en su estructura, pero llega requerimiento de humedad (Gmoser et al., 2019; Wang et al., 2019).
En los últimos años, los procesos de fermentación sobre sustrato sólido han recibido gran atención por parte del mundo científico; como resultado, se realizaron muchas investigaciones para su aplicación en la obtención de enzimas, ácidos orgánicos colorantes y otras sustancias de interés en las industrias alimentarias (Wang et al., 2019). Este proceso tiene la capacidad de mostrar un alto rendimiento en la transformación de sustrato en producto con menor inversión, comparando su costo de producción con la tradicional fermentación sumergida. Además, esta es una alternativa para el aprovechamiento de materiales de desecho provenientes de la agroindustria (Sandhu & Punia, 2017; Lasso et al., 2020; Li et al., 2020; Melnichuk et al., 2020).
Los FES utilizan sustratos naturales que sirven como fuente de nutrientes y soporte físico para los microorganismos; el bajo contenido de humedad no permite que se desarrolle un grupo de microorganismos, especialmente levaduras y hongos. La FES implica que específicamente se pueden cultivar hongos filamentosos, porque tienen ciertas características que los hacen más adecuados para su crecimiento, especialmente A. niger (Arora et al., 2018; Khanahmadi et al., 2018). A. niger se caracteriza por su rápido desarrollo y por excretar una gran cantidad de enzimas en un ambiente de fermentación sólido, además crece en forma de micelio permitiendo la separación y extracción del producto. En la mayoría de los casos, los productos son ácidos orgánicos que se utilizan como aditivos alimentarios con función de conservación (Li et al., 2020).
Muchas investigaciones, muestran que la producción de ácidos orgánicos por biosíntesis depende de la forma microbiana y, también, de las condiciones de operación del proceso. Parecía, que el nivel de oxígeno en la fermentación es un parámetro clave de producción para la FES. Se realizaron investigaciones sobre la influencia de la aireación forzada en este sistema y, se concluyó que la producción de ácido orgánico a partir de A. niger, se ve favorecida por la limitada producción de biomasa que ocurre cuando se aplican bajas velocidades de aireación y, como consecuencia, baja disponibilidad de oxígeno (Lopes et al., 2019).
Los procesos de FES pueden ser realizados por muchos tipos de biorreactores que presentan determinadas características para determinados objetivos y cuyo diseño depende del tipo de proceso. El diseño de un biorreactor para la FES presenta ciertos problemas, como la resistencia a transferir la cantidad de movimiento, la apariencia del gradiente térmico y la concentración de gas en la capa media. De lo contrario, en este proceso es difícil comparar parámetros de pH, temperatura, biomasa, humedad, para ir más allá de las dificultades se han utilizado sistemas de aireación (Arora et al., 2018; Khanahmadi et al., 2018).
Se han reportado algunos trabajos de investigación relacionados, como el trabajo de Lopes et al. (2019) quienes hicieron los estudios en FES como alternativa biotecnológica para la producción de alimentos no convencionales. Sandhu & Punia (2017) realizaron estudios sobre fermentación en estado sólido utilizando los subproductos de la agroindustria utilizando A. niger sobre el sustrato sólido. Marzo et al. (2019) analizaron el metabolismo de A. niger en un sustrato sólido utilizando diferentes fuentes de carbono. Teles et al. (2019) aislaron y optimizaron la producción de tanasas de A. niger. Wu et al. (2018) trabajaron en la producción de xilanasas a partir de tocón de A. niger en medio sólido, utilizando como sustrato “avena” y salvado de “trigo”. Carboué et al. (2018) propusieron un método para la producción de ácido gálico utilizando ácido tánico para A. fischeri. Lopes et al. (2019) trabajaron en la producción de tanasas para A. niger HA37. Lasso et al. (2020) obtuvieron ácido gálico de A. niger en un medio sumergido.
La cuantificación de taninos en productos naturales se realiza mediante análisis volumétrico, colorimétrico, HPLC (Cromatografía Líquida de Alta Resolución) y por el método de luz ultravioleta visible. El último método nos permite cuantificar los taninos, y sustenta la confiabilidad de los resultados (Gallego et al., 2017).
Teniendo en cuenta la importancia comercial del ácido gálico, el uso de C. spinosa como tanino de recurso, la capacidad de A. niger en la producción de tanasas y el reconocimiento del biorreactor para la FES, esta investigación tiene como objetivo obtener ácido gálico por A. niger a partir de C. spinosa (Fabaceae) “tara” utilizando un biorreactor en estado sólido; y evaluar la producción de ácido gálico con el tiempo de exposición en el biorreactor para fermentación en estado sólido y establecer la reacción entre el tiempo de fermentación y la absorbancia.
Material y métodos
Objeto de estudio
Caesalpinia spinosa (Fabaceae) “tara”, fue recolectada del Jardín Botánico de la Universidad Nacional de Trujillo; El cultivo puro de Aspergillus niger estuvo fue proporcionado por el Laboratorio de Micología de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo.
Obtención del sustrato a partir de Caesalpinia spinosa “tara”
Se obtuvieron 6 Kg de vainas secas de “tara” sin contaminantes. Luego se quitaron las semillas. Las vainas de cáscara se colocaron en un horno a 40°C de temperatura durante 36 horas con el fin de eliminar de manera eficiente la humedad (Cholán et al., 2019).
La muestra seca se molió utilizando un mortero hasta obtener un polvo homogenizado, el cual fue tamizado y esterilizado; se tomaron 500 g por cada uno de los biorreactores (Ballesteros et al., 2021).
Reactivación de la cepa de Aspergillus niger
La reactivación de la cepa de A. niger, se llevó a cabo haciéndola crecer hasta la esporulación, en un tubo de ensayo con medio de cultivo sólido agar Sabouraud, luego se colocó a temperatura ambiente durante cinco días hasta su crecimiento. Se conservó a 4 °C de temperatura, obteniéndose la cepa viable (Arshad et al., 2019). Las esporas de A. niger, fueron separadas de la superficie de las colonias contenidas en dos placas de Petri utilizando 30 ml de agua destilada estéril, y luego se trasladó a un vaso aforando hasta 600 ml con el mismo solvente, finalmente se agregó una solución de Tween 0,1% (v/v), hasta obtener la suspensión (Chávez et al., 2018).
Construcción de biorreactores de Fermentación en Estado Sólido (FES)
Para la construcción de los biorreactores se utilizaron 9 botellas de plástico transparente de 3 litros y en ellas se colocaron 500 g de sustrato producto de la molienda de las vainas secas de “tara”, más 200 ml de inóculo de esporas de A. niger y 200 ml de agua destilada estéril mezclando hasta obtener una mezcla homogénea. Los biorreactores fueron acondicionados con un sistema de aireación húmeda utilizando bombas a 0.5 vvm. Los biorreactores se colocaron a temperatura ambiente y se cerraron herméticamente dejando un orificio para la salida de CO2 (Chávez et al., 2018; Arshad et al., 2019). Los datos de temperatura y pH se tomaron durante todo el proceso.
Producción de ácido gálico
Luego de 2, 4 y 6 días, el fermento en estado sólido se retiró del biorreactor, para obtener ácido gálico. Se agregaron
500 ml de agua destilada estéril para disolver los grumos formados durante el proceso, la misma que se realizó por trituración en una fuente plástica y luego por comprensión manual, utilizando tela de tocuyo previamente humedecida. En un vaso de precipitado se recibió el extracto y luego se puso en frascos de vidrio para su posterior centrifugación a 3000 rpm durante 15 minutos. El extracto se mantuvo en refrigeración a 4 °C hasta su cuantificación, la cual se realizó en el Laboratorio Multifuncional de Farmacia y Facultad de Bioquímica, utilizando el espectrofotómetro UV-Vis con lector de microplacas, marca Fisher Scientific (Saeed et al., 2020, 2021).
Cuantificación del ácido gálico
Para la cuantificación de la producción de ácido gálico (mg/ml), se aplicó el método de Folin-Ciocalteu mediante espectrofotómetro UV-Vis por triplicado, utilizando 1 ml de la muestra de cada biorreactor según el tiempo establecido (Gallego et al., 2017).
Diseño experimental
Este estudio se ajusta a un diseño experimental completamente al azar (DECA), donde los tratamientos son los diferentes tiempos de fermentación (2, 4, y 6 días) para la producción de ácido gálico. Cada tratamiento tuvo tres repeticiones y cada repetición estuvo constituida por tres biorreactores de FES. Asimismo, se representaron las unidades experimentales para los valores promedio de la producción de Ácido Gálico en cada repetición por tratamiento (Arshad et al., 2019).
Análisis estadístico
Los datos obtenidos en la producción de ácido gálico por A. niger, se organizaron en tablas y se aplicaron métodos estadísticos de Análisis de Varianza y la Prueba de Comparación de Promedios Múltiples descrito por Duncan, con probabilidad de error de 0,05 (5%), según Saeed (2021). Los métodos estadísticos fueron procesados en el Programa Stratigraphic Plus, Versión 5.1.
Resultados y discusión
La validación de un método, es un proceso que se obtiene mediante estudios de laboratorio cuya capacidad se expresa en términos de parámetro de análisis, donde se debe tener en cuenta la linealidad, precisión, exactitud, reproducibilidad, especificación y sensibilidad, según el objetivo que se persigue. Actualmente, la validación de métodos permite una mayor confiabilidad de los resultados experimentales, especialmente cuando se trabaja con productos naturales (Gallego et al., 2017).
La espectrofotometría se ha convertido en una ayuda muy importante para determinar la concentración de algunas sustancias cuyo análisis se puede aplicar de acuerdo con la Ley de Lamberg-Beer. Esta ley establece una proporcionalidad directa entre la absorbancia y la concentración de un metabolito secundario, cuya lectura debe estar dentro de un rango. de 0,02 y 0,08 (Arshad et al., 2019). Valores que coinciden con los resultados hallados, cuyas absorbancias se encontraron entre 0,275 y 0,779 (Tabla 1).
Tabla 1 Absorbancias promedio (700 nm) del extracto fermentativo de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a diferentes tiempos de exposición.
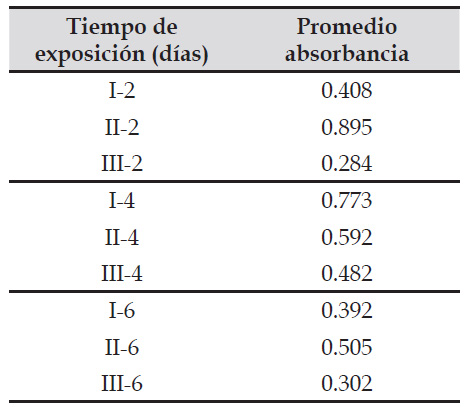
I, II, III: Número de repeticiones
Tabla 2 Concentración promedio del ácido gálico (mg/ml) y coeficiente de variación del extracto fermentativo de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a diferentes tiempos de exposición.
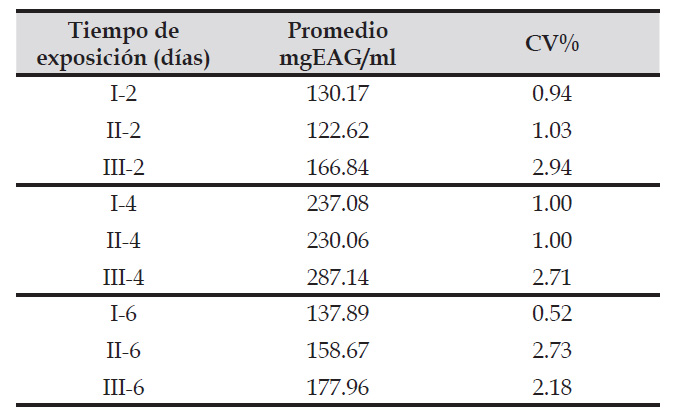
I, II, III: Número de repeticiones
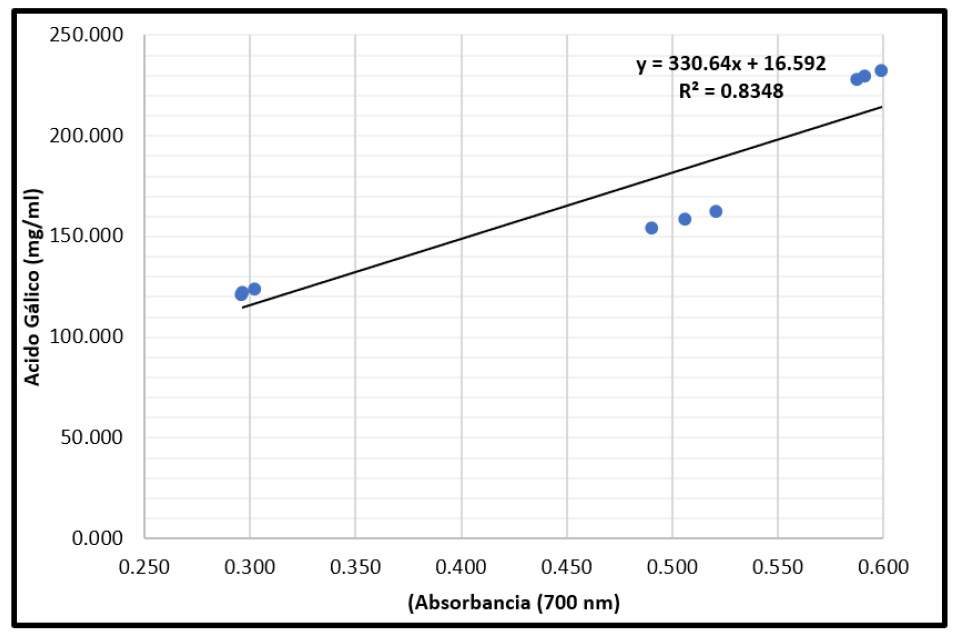
Figura 1 Curva de producción del ácido gálico (mg/ml) según las absorbancias (700 nm) obtenida del extracto fermentativo de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a los dos, cuatro y seis días de exposición (Primera repetición).
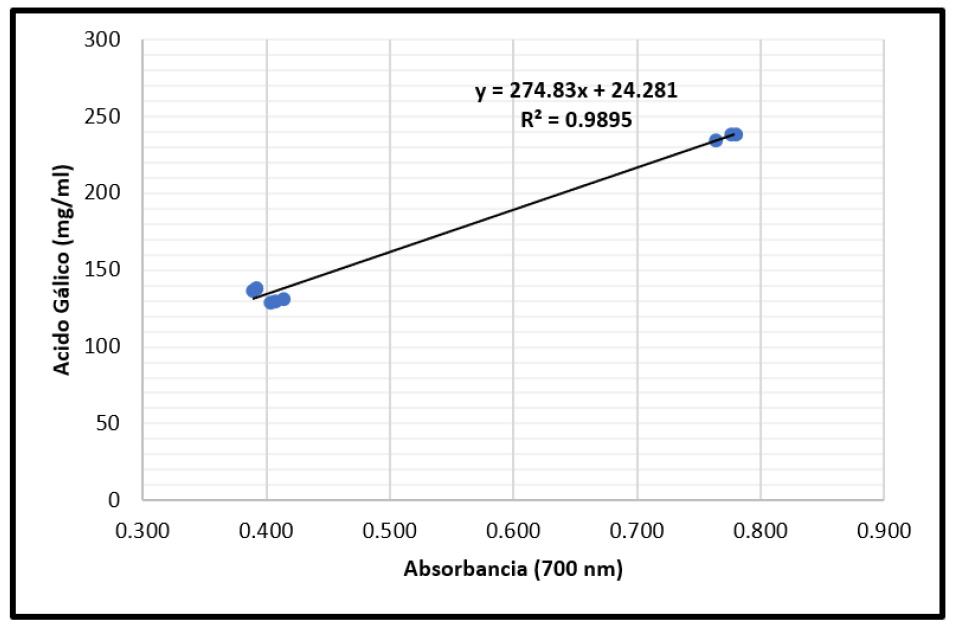
Figura 2 Curva de producción del ácido gálico (mg/ml.) según las absorbancias (700 nm) obtenida del extracto fermentativo de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a los dos, cuatro y seis días de exposición (Segunda repetición).
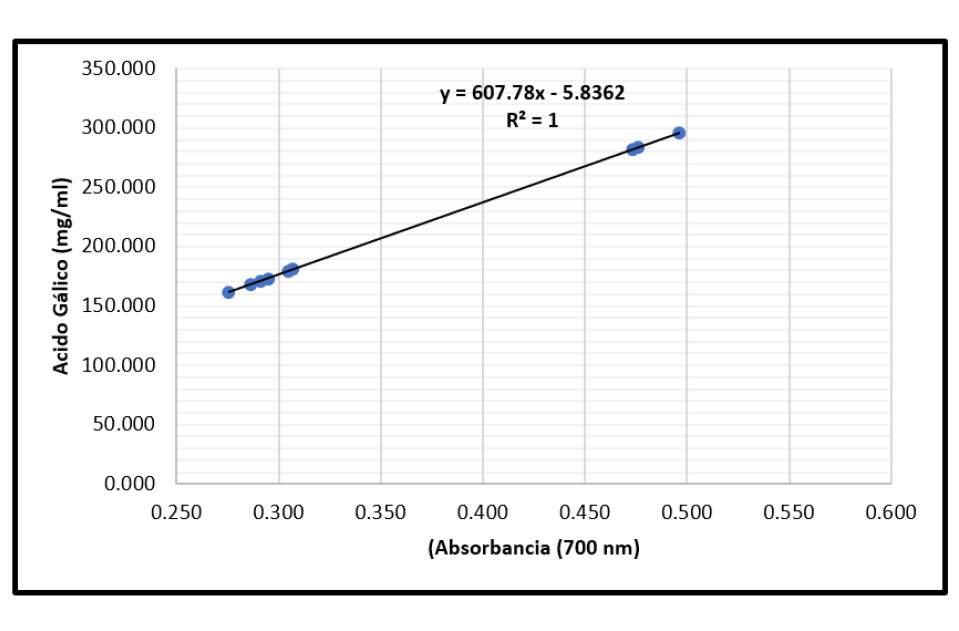
Figura 3 Curva de producción del ácido gálico (mg/ml.) según las absorbancias (700 nm) obtenida del extracto fermentativo de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a los dos, cuatro y seis días de exposición (Tercera repetición).
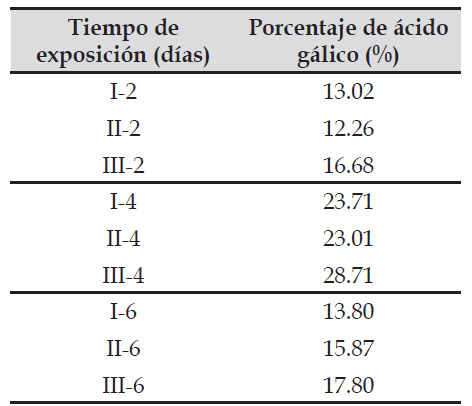
Para establecer el porcentaje de ácido gálico, producto de la fermentación de C. spinosa por A. niger utilizando un biorreactor en estado sólido a dos, cuatro y seis días de exposición, se utilizó la ecuación de la línea recta en la curva de calibración, alcanzando su valor más alto de 28,75% (tabla 3) de ácido gálico, por debajo de lo señalado por Pérez & Pisconti (2010), quienes lograron obtener un 49,88% de ácido gálico. Es necesario resaltar que los máximos se encontraron a los 4 días de proceso fermentativo, llegando a los mínimos a los 6 días; esto se explica por el comportamiento nutricional de A. niger.
Tabla 3 Porcentaje del ácido gálico producido a partir de la fermentación de Caesalpinia spinosa (Fabaceae) obtenida por Aspergillus niger utilizando un biorreactor en estado sólido a diferentes tiempos de exposición.
Aspergillus niger tiene las enzimas para producir ácido gálico a partir del tánico contenido en la “tara”; este proceso se debe a la alimentación propia; es decir, primero se produce ácido gálico y luego lo utiliza. Lo produce en la etapa trofásica, donde las enzimas de producción están en su nivel máximo. Sin embargo, en la etapa idiofásica las enzimas de producción disminuyeron su expresión, predominando las enzimas digestivas hidrolíticas (Gallego et al., 2017; Arshad et al., 2019; Saeed et al., 2020).
Los diferentes resultados en la producción de ácido gálico indicados por sus promedios porcentuales, fueron confirmados mediante análisis de varianza que es un método estadístico riguroso, incluso sobre T-Student; sin embargo, también es genérico. Por lo tanto, fue necesario aplicar una prueba más específica como la Prueba de Comparación de Promedios de Duncan, para determinar entre que tratamientos existen esas diferencias (Saeed, 2021). Por lo tanto, es necesario señalar que al utilizar el ANOVA de Fisher y el T-Student, esta investigación cumple con el parámetro de precisión que incluye repetibilidad y reproducibilidad (Gallego et al., 2017).
Actualmente no se han reportado investigaciones similares, por lo que no es posible contrastar los resultados de esta investigación con otros autores. En este sentido se ha creído conveniente fundamentar los procesos para indicar la valoración de los mismos.
Se sugiere incrementar el uso de biorreactores de fermentación en estado sólido para su aplicación en la obtención de metabolitos secundarios importantes para la industria y complemento alimenticio, debido a que este proceso tiene la capacidad de proporcionar alto rendimiento de conversión de sustrato a producto con menor costo de inversión. Por otro lado, la fermentación en estado sólido se ha convertido en una alternativa para aprovechar materiales de desecho y subproductos de la agroindustria; además es necesario desarrollar la producción de ácido gálico ya que es una sustancia con propiedades antimicrobianas y capacidad antioxidante que le permite capturar radicales libres evitando enfermedades como el cáncer.
La utilización de C. spinosa como fuente de taninos, la capacidad de A. niger para producir tanasas y el conocimiento de biorreactores de fermentación en estado sólido para la producción de ácido gálico, se enmarcan en el marco del desarrollo sustentable; para eso es importante comenzar a desarrollar algunas estrategias que nos permitan implementar reglas y políticas para su uso.
Conclusiones
Se logró obtener ácido gálico por Aspergillus niger a partir de Caesalpinia spinosa (Fabaceae) “tara” mediante un biorreactor de estado sólido. La producción máxima de ácido gálico se produjo a los 4 días del proceso fermentativo con una pureza del 28,71%. Existe una relación directa entre el tiempo de fermentación y su absorbancia.












 uBio
uBio 



