Introducción
La resistencia a los antimicrobianos se considera como uno de los problemas de salud pública más grandes en el mundo y se desarrolla cuando las bacterias pierden su sensibilidad al antibiótico al que eran primariamente susceptibles. Existen diversos factores que contribuyen al surgimiento y difusión de esta resistencia como por ejemplo el uso inadecuado e indebido de antibióticos, medicamentos de mala calidad, prescripciones incorrectas, falencias en la prevención y control inadecuado de las infecciones. Cuando hay un aumento de la resistencia a los antimicrobianos, los pacientes corren un mayor riesgo de complicaciones o fallecimiento por infección (Briceño et al., 2010).
La infección del tracto urinario (ITU) en el contexto mundial representa un problema de salud pública siendo más prevalente en entornos hospitalarios que en comunitarios, y se puede presentar en todas las personas sin importar la edad, como por ejemplo; en la infancia es más frecuente en varones que en mujeres, hecho atribuido a la fimosis en los niños; mientras que en adultos su frecuencia es más elevada en las mujeres jóvenes y se estima que un gran porcentaje de mujeres presentan ITU en alguna etapa de su vida desarrollando al menos una infección de manera anual, muy distinto en el caso de hombres con edades inferiores a los 50 años donde las ITU son escasas (Orrego et al., 2014).
Las ITU sin complicaciones generalmente se manifiesta con síntomas miccionales (disuria, nicturia, polaquiuria, orinas turbias) en pacientes sin problemas funcionales o anatómicas del aparato urinario, además que no presentan comorbilidades como diabetes o inmunosupresión, ni procedimientos invasivos recientes de la vía urinaria (catéteres) o infección urinaria en las semanas previas (Walsh, 2017). La ITU es clasificada, según su localización, como cistitis aguda (o ITU baja) o pielonefritis aguda (o ITU alta) y suele originarse por las vías hematógena y linfática, así como por la cercanía de enteropatógenos ubicados en la zona perineal donde es necesario un gran inóculo para que se produzca la infección en pacientes sin problemas fisiológicos o anatómicos, debido a que en condiciones normales la orina presenta un pH ácido y alta concentración de urea impidiendo la colonización de los patógenos, además de la acción de los mecanismos inmunológicos de defensa presentes en las vías urinarias (Miyahira, 1994).
La infección se inicia cuando el microorganismo coloniza la uretra hasta llegar a la vejiga, y si no es controlada adecuadamente, entonces puede afectar los riñones hasta producir septicemia (Johnson & Russo, 2018). Una característica importante de los microorganismos, que les permite la colonización, sobrevivencia y diseminación dentro de su huésped, es la formación de biofilm que en el caso de la ITU se produce en la vejiga (Luterbach et al., 2018). Los microorganismos uropatógenos aprovechan la formación del biofilm para producir toxinas y proteasas, lo cual produce lesiones en el tejido y favorece la multiplicación de bacterias y su potencial ascenso a los riñones (Flores et al., 2015).
Las ITU forma parte del grupo de infecciones más frecuentes a nivel mundial, sin discriminar sexo ni edad; sin embargo, las mujeres y las poblaciones que conforman los extremos de la vida presentan mayor riesgo de infección, incluso a repetición (Instituto de Evaluación de Tecnologías en Salud e Investigación del Seguro Social del Perú, 2019). Los agentes etiológicos más comunes en ITU sin complicaciones suelen ser bacterias, siendo las enterobacterales los microrganismos con más incidencia, Escherichia coli es la más frecuente a nivel mundial, al representar entre el 70% y el 95% de estas infecciones (Hooton, 2012).
E. coli presenta rápido crecimiento, amplia distribución, posee 11 serogrupos de acuerdo a las características antigénicas del lipopolisacárido, y 19 serotipos por la mezcla de los antígenos H (flagelar) y O (somático); es no esporulado, anaerobio facultativo, móvil con flagelo perítrico, fermenta la arabinosa, lactosa, glucosa, entre otros carbohidratos generando gas y ácido; reduce nitrato a nitrito, decarboxila la lisina, oxidasa negativo y catalasa positivo; indol y rojo de metilo positivo, reacción negativa en Vogues-Proskauer y fenilalanina deaminasa; y no produce H2S; no degrada el citrato ni la urea (Brito et al., 2010).
La principal acción de resistencia de E. coli a los antibacterianos, es la producción de enzimas, en especial las β- lactamasas. Las betalactamasas son enzimas bacterianas que sirven para inactivar a los antibióticos β-lactámicos por hidrólisis, los microorganismos productores de betalactamasas de espectro extendido (BLEE) son capaces de hidrolizar y provocar resistencia a diversas clases de antibióticos β- lactámicos, incluyendo las cefalosporinas de espectro amplio (ceftazidima, ceftriaxona, cefotaxima) y monobactámicos (aztreonam); sin embargo, no presentan resistencia a las cefamicinas (cefoxitina, cefotetan), ni carbapenémicos (meropenem, ertapenem e imipenem). Las BLEE se clasifican genotípicamente en TEM, SHV y CTX-M, y los microorganismos productores de enzimas BLEE CTX- M son los que están involucrados en más eventos de BLEE en los últimos años, especialmente en países de América del Sur y Europa donde se han propagado entre las personas adultas mayores y los pacientes en contacto hospitalario permanente (Aguilar, 2015; Bastidas et al., 2022; Marcos et al., 2021; Galván, 2016).
De los métodos utilizados para la identificación de bacterias Gram negativas generadoras de BLEE, el más utilizado dada las ventajas no técnicas, como costos, facilidad y factibilidad de su aplicación, es el método de Jarlier basado en la sinergia entre los antibióticos betalactámicos y su inhibidor (Lezameta et al., 2010).
Las primeras investigaciones sobre las enzimas beta-lactamasas se iniciaron en el año 1940, en Inglaterra (Bastidas et al., 2022) y los primeros reportes realizados sobre las enzimas β-lactamasas de espectro extendido (BLEE) se presentaron en el año 1985 en Alemania; es así como en los años siguientes se elaboraron gran número de investigaciones a nivel mundial respecto a BLEE, y se cree que las BLEE tipo CTX-M fueron comunes en América del Sur desde 1989 (Villegas et al., 2008).
Bastidas et al. (2022) realizaron una revisión sistemática, desde 1990 hasta abril de 2021 en América del Sur, sobre betalactamasas de espectro extendido producidos por E. coli, bajo una perspectiva de “One Health”, y reportaron que el 50% (n=65/130) de investigaciones fueron hechas en Brasil, 11,5 % (n=15/130) se realizaron en Ecuador y Argentina (cada uno) y el 10,7% (14/130) se realizaron en Perú. Respecto a la clasificación de las investigaciones se procedió a categorizar según el origen de la muestra; es decir, categoría de estudios en humanos (casos clínicos y portadores sanos), estudios en animales, alimentarios, ambientales e interdisciplinarios; donde en todos los países, excepto Guayana Francesa, el mayor porcentaje de investigaciones se realizaron en casos clínicos como por ejemplo, el 100% (12/12) de las investigaciones realizadas en Venezuela, 80% (12/15) en Argentina, 57,1% (8/14) en Perú, 46,6% (7/15) en Ecuador, 46,2% (n=30/65) en Brasil, etcétera (Bastidas et al., 2022).
En el Perú se han realizado investigaciones respecto a E. coli productora de BLEE uropatógenas, tanto en pacientes intrahospitalarios como en pacientes ambulatorios. Los estudios realizados están relacionados con la determinación de patrones de resistencia antibiótica (Loyola et al., 2021; Ormeño et al., 2022; Sosa & Chapoñan, 2022; Tamayo et al., 2021) y la caracterización microbiológica y molecular de la resistencia (Marcos et al., 2021); determinación de la prevalencia (Cuba et al., 2020; Díaz et al., 2015) y factores asociados a la infección de E. coli BLEE uropatógenas (Carcausto & Rodríguez, 2022; Morales, 2021; Yábar et al., 2017); caracterización fenotípica y molecular de los factores de virulencia de E. coli BLEE uropatógenas (Galván et al., 2016; Gonzales et al., 2022); determinación de la clonalidad de E. coli BLEE provenientes de pacientes con ITU de la comunidad y portadores asintomáticos (Santamaría et al., 2019); y determinación de Enterobacteriales BLEE portadores del gen mcr-1 provenientes de diferentes tipos de muestras clínicas (Yauri et al., 2020).
Con respecto al Hospital de Cascas ubicado en la provincia de Gran Chimú - La Libertad (Perú), no se evidencian reportes o investigaciones acerca de resistencia de E. coli aislado en pacientes con ITU , debido a que se está presentando elevada morbilidad por el uso indebido de antibióticos y el creciente número de reportes de bacterias resistentes a esos a nivel regional, nacional y mundial es que se considera necesario realizar vigilancia adecuada de las bacterias generadoras de β-lactamasas de espectro extendido BLEE, a fin de proporcionar a los médicos y a la salud pública conocimiento sobre la producción de β-lactamasas por E. coli como agente etiológico de ITU en las personas con riesgo, de esta manera aportar información valiosa para el adecuado tratamiento antibiótico prescrito por los médicos en beneficio de cada paciente. Por lo tanto, el objetivo del presente estudio fue determinar la prevalencia de E. coli productoras de betalactamasas de espectro extendido, aisladas de urocultivos de pacientes del Hospital Provincial de Cascas- La Libertad, Perú-2021 según la producción de BLEE, género y grupo etario de los pacientes.
Material y métodos
Objeto de estudio
El estudio comprendió 200 muestras de urocultivos de pacientes atendidos en el Hospital de Cascas, La Libertad, Perú, de enero a julio del año 2021, de los cuales se aislaron 100 cultivos positivos para E. coli.
Recolección de la muestra
Para la toma de muestra de orina se procedió según las recomendaciones dadas por el Instituto Nacional de Salud en el Manual de Procedimientos de laboratorio (Zurita, 2013). Las muestras de orina fueron recolectadas y procesadas dentro de las 2 horas posteriores a la adquisición de la muestra o se mantuvieron en refrigeración a 4 °C hasta el procesamiento no máximo de 24 horas (Ventura & Sacsaquispe, 2002).
Aislamiento primario
Las muestras de orina se sembraron en agar sangre (AS) y agar Mac Conkey (AMC) por el método del asa calibrada (1 ul). Para ello se inoculó la muestra en el centro de la placa con AS y se extendió hacia adelante y hacia atrás, luego, sin quemar el asa, el inóculo se diseminó uniformemente con trazos perpendiculares a la siembra inicial en toda la placa, y se procedió de la misma forma para el AMC. Las placas fueron incubadas a 37° C durante 24 a 48 horas y se tomaron en consideración los cultivos con características macroscópicas para E. coli, con un recuento mayor de 105 UFC/ml de orina (Zboromyrska et al., 2019)
Identificación bioquímica diferencial de E. coli
Se consideró el criterio de Bergey (Bergey, 2005), de acuerdo con las características de cultivo observadas. Se efectuaron los siguientes ensayos bioquímicos: prueba de uso de citrato, prueba de ureasa; fermentación de glucosa, lactosa y/o sacarosa en medio TSI “Hierro Triple Azúcar”; descarboxilación de lisina en medio LIA “Agar Lisina Hierro”, producción de indol - ácido sulfhídrico - movilidad en tubos con medio SIM (Sulfuro de Hidrógeno, Motilidad e Indol) y prueba de VP-RM (Voges-Proskauer y Rojo de Metilo) (MacFaddin, 2003). Una vez identificada la especie E. coli, las colonias aisladas se sembraron en Agar Soja Tripticasa (TSA) y se incubaron a 37°C durante 24 horas para obtener cultivos puros
Detección de Betalactamasas de espectro extendido (BLEE)
Se utilizó el método de difusión en disco, según los lineamientos de “Clinical and Laboratory Standards Institute” (CLSI, 2020), para detectar E. coli productoras de BLEE y el método de Jarlier, según los lineamientos del Comité de Antibiograma la Sociedad Francesa de Microbiología (Jarlier et al., 1988; Lezameta et al., 2010; Sacsaquispe, 2002) para determinar la presencia de BLEE. Se preparó el inóculo a partir de un cultivo puro de E. coli y se obtuvo una suspensión en solución salina fisiológica estéril ajustado a la turbidez del tubo Nº 0,5 de la escala de MacFarland (1,5 x 108 UFC/ml). Luego se sumergió un hisopo de algodón estéril en la suspensión rotando el hisopo varias veces e inoculó la placa con Agar Müeller Hinton (AMH), estriando en tres direcciones con el hisopo a fin de garantizar una distribución estándar del inóculo, se dejó secar por 3 minutos para luego proceder a colocar los discos y determinar la presencia de BLEE; los cuales se colocaron según el método de Jarlier, donde el disco que contenía amoxicilina/ ácido clavulánico (AMC) con 20/10 μg de carga estándar se colocó en el centro de la placa, y a una distancia de al menos 25 mm a su alrededor se colocaron los discos con cefotaxima (30 μg), ceftriaxona (30 μg), ceftazidima (30 μg ) y aztreonam (30 μg). Finalmente, los cultivos se incubaron a 37°C durante 24 h. Se consideró la prueba como positivo si se observó una imagen de sinergia entre el disco amoxicilina/ácido clavulánico y los discos de ceftazidima, y/o aztreonam, y/o cefotaxima, y/o ceftriaxona.
Procesamiento y análisis de la información
Con cada resultado obtenido, se determinó mediante estadística descriptiva la prevalencia de cultivos de E. coli productoras de BLEE y de acuerdo con el antibacteriano evaluado, según el género y edad cronológica del paciente. También, se realizó la prueba Chi Cuadrado (X2) de Pearson, para validar de modo estadístico si existe una relación significativa (Polit & Hungler, 2003)
Resultados
Se determinaron 100 urocultivos positivos a E. coli, de los cuales, 16 (16%) fueron productores de betalactamasas de espectro extendido (Tabla 1). De los E. coli BLEE 5 (31,25) procedieron de pacientes varones y 11 (68,75) a pacientes mujeres (Tabla 2). Así también, se evidenció que la mayoría de E. coli BLEE pertenecieron al grupo etario comprendido entre 61 a 80 años (Tabla 3). Se encontró sinergia de E. coli BLEE con el disco de sensibilidad de ceftriaxona en 6 cultivos, con el disco de sensibilidad de ceftazidima en 6 cultivos, con el disco de sensibilidad de aztreonan en 8 cultivos y con el disco de sensibilidad de cefotaxima en 8 cultivos (Tabla 4).
Tabla 1 Prevalencia de E. coli BLEE en urocultivos de pacientes atendidos en el Hospital de Cascas-La Libertad, Perú en el período de enero a julio 2021.
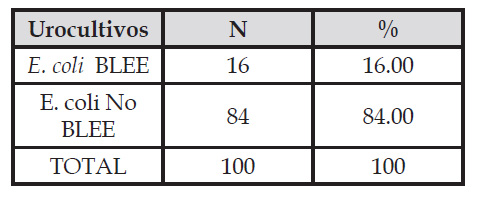
Tabla 2 Prevalencia de E. coli BLEE en urocultivos, según el género de pacientes atendidos en el Hospital de Cascas- La Libertad, Perú en el período de enero a julio 2021.
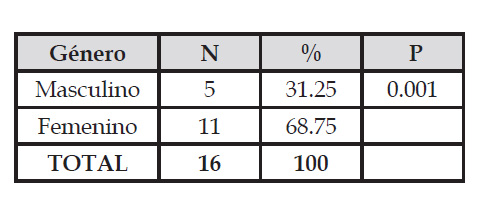
Nota: P < 0.05
Tabla 3 Prevalencia de E. coli BLEE en urocultivos, según grupo etario de pacientes atendidos en el Hospital de Cascas-La Libertad, Perú en el período de enero a julio 2021.
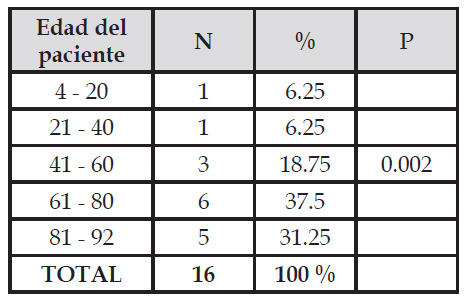
Nota: P < 0.05
Tabla 4 Prevalencia de E. coli BLEE de pacientes atendidos en el Hospital de Cascas-La Libertad, Perú en el período de enero a julio 2021, según antibacterianos que presentaron sinergia con el disco de amoxicilina/ácido clavulámico (AMC).
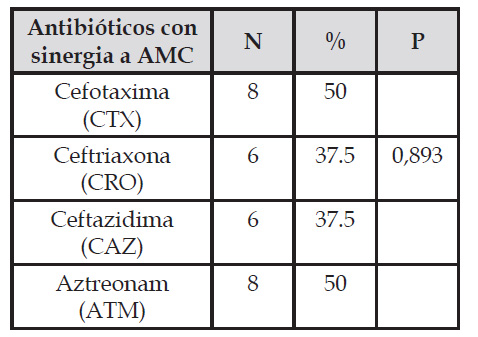
Nota: P > 0.05
Se observó que 6 cultivos de E. coli BLEE presentaron sinergia a un solo antibacteriano, 8 cultivos de E. coli BLEE presentaron sinergia para dos antibacterianos y 2 cultivos de E. coli BLEE presentaron sinergia para tres antibacterianos.
Discusión
El incremento de la resistencia a los antibióticos en las bacterias que causan ITU constituye un problema de salud pública y de no enfrentarse a tiempo podría afectar la salud de las futuras generaciones; razón por lo que, en el año 2011 el Perú participó en un Programa de vigilancia de la resistencia para monitorear los patrones de susceptibilidad a los antimicrobianos en América Latina y, se reportó que en el Perú el 54% de E. coli aisladas eran productoras de BLEE (Jones et al., 2013).
En la presente investigación se evidenció que de 100 cultivos positivos para E. coli aislados de muestras de orina pertenecientes a pacientes atendidos en el Hospital de Cascas durante el periodo de enero a julio del 2021, 16 cultivos (16%) fueron E. coli productoras de BLEE y 84 cultivos (84%) fueron E. coli no productoras de BLEE (Tabla 1), similar a lo reportado por Galván et al. (2016) quienes realizaron un estudio en un laboratorio privado de la ciudad de Lima, reportaron que de los 325 aislamientos de E. coli, el 16,3% (53/325) fueron productores de BLEE. Y con Cuba et al. (2020), quienes reportaron el 15,4% (18/117) E. coli BLEE en el Hospital Distrital Jerusalén - La Esperanza.
Con respecto a la prevalencia de E. coli BLEE en urocultivos en relación con el género de los pacientes (Tabla 2), los resultados obtenidos en este estudio precisan que los aislamientos de E. coli BLEE fueron más frecuentes en mujeres con el 68,75% (11/16), en comparación con los varones con un 31,25% (5/16). Estos resultados son similares a estudios realizados en el año 2016 por Santamaría et al. (2019) en el Hospital Regional Lambayeque donde determinaron la relación clonal de cepas de E. coli BLEE aisladas de pacientes con ITU de la comunidad y portadores asintomáticos, y se reportó que del 100% (41) de aislamientos de E. coli BLEE positivos, el 61% (25/41) procedieron de pacientes del sexo femenino y el 39% (16/41) de pacientes masculinos (Santamaría et al., 2019). Otro estudio donde se reportó altos porcentajes de E. coli BLEE en pacientes mujeres fue el realizado en el 2017 por Juárez y Garay en un nosocomio de nivel III-1 en la ciudad de Cusco, el 75% (56/70) de cultivos de E. coli BLEE fueron aislados de pacientes hospitalizados femeninos, en tanto que el 25% (14/70) de cultivos fueron aislados de pacientes masculinos (Juarez & Garay, 2020). Así mismo, en el 2020, la investigación realizada por Sosa y Chapoñan en el Hospital III - 1 ESSALUD Lambayeque reportó que el 71,6% (63/88) correspondieron al sexo femenino, y el 28,4% (25/88) al sexo masculino (Sosa & Chapoñan, 2022).
Por otro lado, Ormeño et al. (2022) también realizaron estudios para determinar la recurrencia de ITU causada por E. coli y resistencia antimicrobiana asociada, reportaron altas tasas de resistencia a los antibióticos comunes y determinaron que el sexo femenino es uno de los factores de riesgo para el desarrollo de ITU resistente. Estos resultados sugieren que las ITU tienen mayor prevalencia en pacientes mujeres porque están influenciadas por la ubicación anatómica de la uretra, que se encuentra cerca del recto y la vagina, lo que permite el paso de bacterias a través de la vejiga hacia los riñones. Las mujeres son más vulnerables a sufrir ITUs que los varones, principalmente en dos momentos, en el comienzo de la vida sexual activa durante las edades comprendidas entre 20 a 35 años, y en las variaciones hormonales y anatómicas del climaterio que se producen entre las edades de 65 a 85 años (Pereira et al., 2016).
En cuanto a la prevalencia de E. coli BLEE en urocultivos en relación con el grupo etario de los pacientes (Tabla 3), en esta investigación se obtuvo mayor prevalencia en aquellos que oscilan entre 61 a 80 años con un 37,5 % existiendo una diferencia significativa (p<0.05) en contraste con los otros grupos etarios, lo que concuerda con el estudio realizado por Amado et al. (2014) en un establecimiento de salud colombiano, donde un 33.1 % de personas que estaban infectados por E. coli BLEE tenían entre 60-79 años. Este porcentaje es menor que el encontrado en Perú por Galván et al. (2016), que reportaron que el 54,7% (29/53) correspondieron a las pacientes mayores de 65 años, que fue el grupo etario más afectado, y por Sosa & Chapoñán (2022) quienes reportaron el 76,1% (67/88) correspondió a pacientes mayores de 60 años. Concordando con Valdez (2017) quien afirma que los factores de mayor riesgo, para padecer de infecciones ocasionadas por E. coli productora de BLEE, son la edad y la condición de hospitalización previa donde se presenta mayor riesgo de infección y colonización y con Loyola et al. (2021), quien indica que la prevalencia de infección por E. coli BLEE en pacientes mayores de 60 años se relaciona con la condición de presentar atrofia genitourinaria y el prolapso vaginal; además de poseer un sistema inmunitario deprimido, a diferencia de personas con menos de 60 años.
En relación a la prevalencia de E. coli BLEE en urocultivos, en relación con los antibacterianos que presentaron sinergia con el disco de amoxicilina/ácido clavulánico (Tabla 4), resultó que 6 (37,5 %) cultivos presentaron sinergia entre el disco de amoxicilina/ácido clavulánico con ceftriaxona, de la misma manera 6 (37,5 %) cultivos presentaron sinergia con ceftazidima, 8 (50 %) cultivos presentaron sinergia con aztreonan, al igual que 8 (50 %) cultivos presentaron sinergia con cefotaxima, lo que contribuyó a la identificación de los 16 cultivos de E. coli BLEE dejando en evidencia una diferencia no significativa (p ≥ 0.05) entre los antimicrobianos utilizados para la identificación; sin embargo, se encontró un número mayor de resistencia (8 cultivos resistentes ante aztreonan y cefotaxima, respectivamente), resultados semejantes a lo reportado por Rioja & Martin (2017), quienes identificaron E. coli BLEE resistentes en mayor proporción con aztreonan y cefotaxima.
Según Serra (2017), el incremento constante de bacterias resistentes es debido a indicaciones y ventas sin control de antibióticos, uso de antimicrobianos durante infecciones bacterianas, utilización excesiva de los antibióticos en animales y, también al abandono del tratamiento, abuso de profilaxis antibiótica, así como el uso inadecuado e irracional de los antibióticos, aquí se evidencia la importancia del laboratorio, en el aislamiento e identificación de bacterias en el menor tiempo posible, para así determinar su susceptibilidad, y el clínico pueda brindar un tratamiento adecuado y oportuno.
Conclusiones
La prevalencia de E. coli productoras de betalactamasas de espectro extendido (BLEE), aisladas en urocultivos de pacientes del Hospital de Cascas - La Libertad, Perú en el período de enero a julio del 2021, fue de 16,0 %, alcanzando una mayor prevalencia el género femenino (68,75%), el grupo etario comprendido entre 61 a 80 años (37,5%) y para los antimicrobianos aztreonan y cefotaxima (50%).
Recomendaciones
Realizar estudios dirigidos a la detección de bacterias productoras de betalactamasas de espectro extendido relacionadas a portadores asintomáticos.
Se recomienda la vigilancia activa de pacientes extrahospitalarios con colonización por E. coli BLEE que son potenciales reservorios de estas cepas a fin de apoyar a determinar las acciones de control.












 uBio
uBio 


