INTRODUCCIÓN
En Ecuador, el aguacate se cultiva en los valles interandinos (Viera, Ponce, Morillo & Vásquez, 2016a), experimentando un notable incremento de área cultivada (Viera et al., 2016b). Las principales variedades cultivadas son “Fuerte” y “Hass” injertadas en patrones denominados “Criollos” (raza mexicana). Las plantas de aguacate requieren un período de crecimiento en vivero previo al trasplante a campo abierto, siendo la fase de vivero determinante en la calidad de plantas. En el caso del aguacate, es indispensable partir con un patrón de buena calidad, es decir: diámetro de tallo superior a 0,5 cm, altura de planta superior a 30 cm, sistema radicular abundante, follaje de color verde oscuro y estar libre de enfermedades; dichas características se cumplen aproximadamente a los 150 días después de la siembra para posteriormente ser injertados con la variedad comercial (Sotomayor et al., 2019a).
La necesidad de obtener plántulas de buena calidad y reducir el uso de productos agroquímicos ha promovido el uso de microorganismos benéficos (Kumar et al., 2021) debido a su función en la nutrición y crecimiento (Orozco-Mosqueda et al., 2021; Santoyo et al., 2021). Estudios previos han determinado que la aplicación de microorganismos mejora la absorción de nutrientes (Sotomayor et al. 2019b) y protege contra organismos antagónicos a las plantas (Wang et al., 2022a), especialmente hongos del suelo como Fusarium oxysporum que ha sido reportado en viveros de aguacte (Marzaini & Mohd-Aris, 2021; Uribe et al., 2021). Además, los microorganismos benéficos influyen en el rendimiento del cultivo (Viera et al., 2019; Viera et al., 2020a).
Entre los principales microorganismos utilizados en agricultura destacan las micorrizas, Trichoderma spp. y las bacterias benéficas. El ciclo vital de las micorrizas solo se puede cumplir si se asocian simbióticamente a las raíces de una planta hospedera (Wang, Yang, Ma, Wang y You, 2022b). Las micorrizas incrementan el volumen del sistema radicular, derivando en un aumento en la absorción y transporte de agua y nutrientes (Viera et al., 2017a; Kheyri et al., 2022), principalmente fósforo (Zhang et al., 2021).
Algunas especies de Trichoderma influyen favorablemente en la solubilización y absorción de minerales desde el suelo, así como en la tolerancia al estrés biótico y abiótico (Marra et al., 2022). Adicionalmente, Trichoderma spp. es un agente de control biológico, debido a su capacidad de generar antagonismo y control de agentes patogénicos, mediante mecanismos de competencia por espacio y nutrientes, antibiosis, micoparasitismo directo y la activación de defensas a través de la producción de los ácidos salicílico y jasmónico en raíces (Viera et al., 2020b; Colquehuanca & Blanco, 2021).
Las bacterias promotoras de crecimiento vegetal o rizobacterias, incluyen varios géneros no patogénicos como Pseudomonas spp., Bacillus spp., Azotobacter spp., Serratia spp. y Azospirillum spp., Rhizobium spp. (Woo & Pepe 2018; Thomloudi et al., 2019). Estos microorganismos inducen el crecimiento vegetal directa e indirectamente (Hamid et al., 2021). Los mecanismos directos están relacionados a procesos de nutrición y desarrollo vegetal como incremento de materia orgánica en el suelo y su posterior biodegradación, mejoramiento de la capacidad de intercambio catiónico, incremento en la retención de agua y capacidad tampón del suelo; mientras que los mecanismos indirectos están relacionados a la sanidad de la planta mediante la generación de antibióticos o inducción de resistencia (Dhir, 2017; Cabrera et al., 2018).
Varias investigaciones han reportado los efectos de la inoculación de consorcios microbianos en especies de frutales andinos y otros. En mora de Castilla (Rubus glaucus Benth.) su inoculación resultó en mayor productividad (Viera et al., 2019; Viera et al., 2020a); incrementó las concentra-ciones de fosforo en tejido foliar en portainjertos (Solanum hispidium y Nicotiana glauca) de tomate de árbol (Solanum betaceum Cav.) (Viera et al., 2017a), mientras que en plántulas de chirimoyo se reportó mayor biomasa y contenido de fosforo (Viera et al., 2017b); en arándano (Vaccinium corymbosum) incrementó el peso seco de raíces y brotes (Schoebitz et al., 2016); en cerezos (Prunus sp.) aumentó el diámetro, volumen y peso seco de raíces (Gluszcek et al., 2020). Resultados similares se observaron con aplicaciones de consorcios bacterianos y fúngicos en plantas de frutilla (Todeschini et al., 2018). Específicamente en aguacate, la inoculación de microorganismos ha sido evaluada en vivero debido a la importancia de esta fase. Sotomayor et al. (2019b) registraron incrementos significativos en la absorción de nitrógeno, magnesio, calcio, manganeso, hierro y cobre en raíces, hojas y tallo con inoculaciones de T. harzianum y G. iranicum. Adicionalmente, Alvarado (2017), Barra et al. (2017) y Viera et al. (2017c), reportaron mayor altura, incremento de contenido de clorofila y peso seco en plántulas inoculadas.
En Ecuador, la demanda de plantas de aguacate se ha incrementado debido a la amplia aceptación de esta fruta en los mercados nacional e internacional, incentivando el establecimiento de viveros que basan su plan nutricional en el aporte de fertilizantes utilizados en etapas tempranas de crecimiento vegetal (Viera et al., 2021). Actual-mente existe la necesidad de investigar sobre material de siembra y manejo sustentable de aguacate (Arias et al., 2021) y aunque en Ecuador se está incorporando el uso de microorganismos en la producción agrícola (Viera & Jackson, 2020), todavía existe un déficit de investigación en esta estrategia.
El presente estudio tuvo el objetivo de evaluar el efecto de la aplicación de consorcios microbianos en el crecimiento y estado nutricional de plántulas de aguacate cultivar ‘Criollo’, principal portainjerto de las variedades comerciales “Fuerte” y “Hass”.
MATERIAL Y MÉTODOS
Los ensayos se llevaron a cabo en el invernadero de la Granja Experimental Tumbaco del Instituto Nacional de Investigaciones Agropecuarias (INIAP), cantón Quito, provincia de Pichincha, con altitud de 2348 m, ubicación geográfica 00°12’00’’ S y 78°24’00’’ W, temperatura promedio de 17 °C y humedad relativa de 75% (Instituto Nacional de Meteorología e Hidrología, 2019).
La siembra se hizo en bolsas de vivero con una capacidad de 2,2 kg de sustrato (tierra negra y pomina; 3:1 respectivamente), se utilizaron 220 semillas de aguacate, cultivar “Criollo” (raza mexicana). Luego de su germinación, las plántulas estuvieron bajo invernadero, con cobertura plástica de la superficie para el control de malezas y evitar el contacto directo con suelo. El principal insecto plaga del aguacate en la fase de vivero fue la mosca blanca (Trialeurodes vaporariorum) (Sotomayor et al., 2019a), por lo que se ejecutó un manejo integrado de plagas. El control químico consistió en aplicaciones semanales de insecticidas con rotación de principios activos (Imidacloprid 1 mLL-1, Lambda-cyalotrina 2 mL L-1, Hidrogeno Oxalato de thiocyclam 1 g L-1, Azadirhactina 3 mL L-1); mientras que, el control cultural consistió en el uso de trampas cromáticas amarillas engomadas. Se usó un sistema de fertirriego por goteo tipo espagueti para aportar una solución nutritiva de Hoagland y Arnon (N: 210 mg L-1; P: 31 mg L-1, K: 234 mg L-1; Mg: 34 mg L-1; Ca: 160 mg L-1; S: 64 mg L-1¸Fe: 2,5 mg L-1; Mn: 0,5 mg L-1; B: 0,5 mg L-1; Cu: 0,02 mg L-1; Zn: 0,05 mg L-1; Mo: 0,01 mg L-1). La frecuencia del fertirriego fue de 3 días por semana, 8 minutos por cada ciclo de riego, con un caudal de 1 L h-1; además, la solución nutritiva fue controlada dentro de los parámetros: 1,69 mS cm-1 y pH de 6,5. Adicionalmente, se aplicó fertilizante foliar Bayfolan® (N 7%; P2O5 45%; K2O 5%; B 0,10%; activadores metabólicos 3%; y extracto de algas 10%), con dosis de 3 mL L-1 cada 15 días.
Los tratamientos evaluados consistieron en “consorcios microbianos” formulados como productos comerciales, en dosis y frecuencias de aplicación que constan en la Tabla 1. Los tratamientos se aplicaron directamente en el sustrato de cada plántula. En el caso del consorcio microbiano 1, las micorrizas (Fungifert®) se depositaron 20 g divididos en 4 orificios opuestos entre sí con una profundidad aproximada de 15 cm, la inoculación de Trichoderma spp. (Trichoeb 5WP®) se la hizo diluyendo 0,18 g del producto comercial en 100 mL de agua más un coadyuvante (Arpón®, 0,15 mL L-1), aplicándose 100 mL de la solución en cada planta. Los consorcios microbianos 2 (ReviB®) y 3 (ReFuerza®) fueron aplicados diluyendo 0,4 g en 100 mL de agua y aplicándose 100 mL de la solución a cada plántula. Las plantas control tuvieron el mismo manejo que el resto de plantas, excepto en que no fueron inoculadas con microrganismos.
Durante el ensayo se evaluaron variables de crecimiento y asimilación de nutrientes de las plantas. La altura de la planta se registró desde los 80 hasta los 170 DDS con intervalos de 30 días, esta medición (cinta métrica) se hizo desde el cuello de la planta hasta el ápice de la primera hoja nueva, el resultado se reportó en centímetros (cm). El diámetro de tallo se registró desde los 80 hasta los 170 DDS con intervalos de 30 días, a una altura de 5 cm desde la superficie de sustrato. El resultado se reportó en milímetros (mm).
Tabla 1 Tratamientos en estudio
| Tratamientos | Producto comercial | Microorganismos | Concentración | Dosis | Frecuencia aplicaciones (DDS*) |
| Consorcio 1 | Trichoeb 5WP® | Trichoderma spp. | 1x109 UFC g-1 | 0,18 g planta-1 | 100, 120, 150 |
| Fungifert® | Endomicorrizas vesículo arbusculares: Glomus spp., Acaulospora spp. y Entrophospora spp. | 120 propágulos g-1 | 20 g planta-1 | 70, 110 | |
| Consorcio 2 | ReviB® | Bacillus thuringiensis, B. subtilis, B. megaterium, B.licheniformis, Trichoderma harzianum, T. viridae, Pseudomonas fluorescens, Penicillium sp., Aspergillus orizae, Beauveria bassiana, Saccharomyces cerevisiae y Paecilomyces lilacinus | 109 UFC g-1 | 0,4 g planta-1 | 90, 120, 150 |
| Consorcio 3 | ReFuerza® | Paecilomyces lilacinus | 1x1011 UFC g-1 | 0,4 g planta-1 | 90, 120, 150 |
| Beauveria bassiana | 1x109 UFC g-1 | ||||
| Bacillus licheniformis | 1x109 UFC g-1 | ||||
| Streptomyces spp. | 1x108 UFC g-1 | ||||
| Saccharomyces cerevisiae | 1x107 UFC g-1 | ||||
| Pochonia chlamydospora | 1x108 UFC g-1 | ||||
| Control | Sin inoculación de microrganismos |
*DDS: días después de la siembra.
El contenido de clorofila (Minolta SPAD-502) se registró desde los 80 hasta los 170 DDS, con intervalos de 30 días, de tres hojas maduras por cada planta (en el ápice del eje y primeras hojas con el limbo totalmente extendido), las cuales fueron reemplazadas cada dos meses por nuevas hojas debido al envejecimiento de las primeras y el resultado se reportó en unidades SPAD. El peso seco se registró a los 170 DDS, las muestras fueron secadas en una estufa a 105 ⁰C por 72 horas, la evaluación fue independiente en hojas y tallos (parte aérea) y las raíces, el resultado se expresó en gramos (g).
Las concentraciones de nutrientes en tejidos se registraron a los 170 DDS, los macronutrientes analizados fueron nitrógeno (N), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg), azufre (S); mientras que los micronutrientes fueron boro (B), zinc (Zn), cobre (Cu), hierro (Fe), manganeso (Mn). Para la determinación del N se utilizó el método Semimicro - Kjeldahl, la extracción del resto de elementos (P, K, Ca, Mg, S, B, Cu, Zn, Fe, Mn) se hizo con el método de digestión húmeda con ácido perclórico en relación 5:1, el peso de muestra seca fue de 10 g.
Se utilizó un diseño de bloques completos al azar (DBCA) con cinco repeticiones por tratamiento, cada repetición estuvo constituida por 11 plántulas de aguacate, con un total de 220 plántulas en el ensayo. Los tratamientos estuvieron constituidos por los consorcios de microorganismos (productos comerciales) que se describen en la Tabla 1 y el respectivo control del estudio. Se realizó un análisis de varianza (ANOVA) para determinar diferencias estadísticas entre tratamientos y se utilizó la Prueba LSD Fisher (p≤ 0,05) para establecer rangos de significación. Los datos fueron analizados mediante el programa estadístico INFOSTAT .
RESULTADOS Y DISCUSIÓN
La variable altura de planta no registró diferencias significativas a los 80 y 110 DDS para ningún tratamiento (Figura 1), siendo las alturas promedio de 20,50 cm y 29,46 cm respectivamente para cada período. Alemán et al. (1998) reportaron diferencias significativas entre tratamientos con la aplicación de Glomus spp. y otras bacterias promotoras del crecimiento (R1B: 3 mL 1x109 UFC mL-1) a los 150 DDS al evaluar la altura de planta, en aguacateros de raza mexicana.
En el presente estudio, los consorcios uno y dos mostraron mayores valores en esta variable a los 140 y 170 DDS (Figura 1 y Tabla 2), con promedios de 41,07 cm y 47,58 cm para el consorcio uno, y 41,31cm y 47,51 cm para el consorcio dos, respectivamente. A los 170 DDS, los consorcios uno y dos superaron en 12% a la altura de las plantas control.
Tabla 2 Efecto de la inoculación de consorcios microbianos en el crecimiento y el contenido de clorofila de plántulas de aguacate cultivar “Criollo”
| Tratamiento | Altura (cm) | Diámetro (mm) | Contenido clorofila (SPAD) |
| Consorcio 1 | 47,58 a | 7,50 a | 53,42 a |
| Consorcio 2 | 47,51 a | 7,51 a | 53,76 a |
| Consorcio 3 | 43,57 b | 7,26 ab | 52,27 ab |
| Control | 42,52 b | 7,19 b | 51,80 b |
Los análisis se realizaron 170 DDS. Letras distintas en la misma columna señalan diferencias significativas (LSD Fisher, α= 0,05).
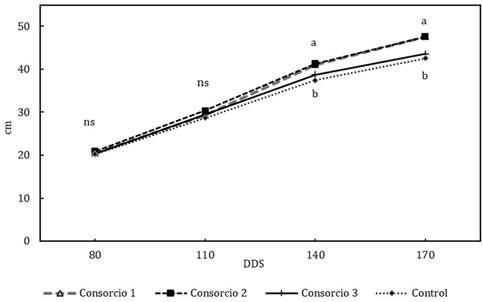
Figura 1 Efecto de los consorcios sobre la altura de plántulas de aguacate. Letras distintas en el mismo periodo (DDS) señalan diferencias significativas (LSD Fisher. α= 0.05), ns: diferencias estadísticas no significativas.
Estos resultados son acordes a los obtenidos en estudios similares, por ejemplo, Arellano (2017) quien evaluó complejos de Glomus spp., registró un incremento de 9% (150 DDS) en alturas de portainjertos de raza mexicana al contrastarlos con el control. Además, Mege et al. (1980) registraron alturas con incrementos del 98% (270 DDS) versus el control, con la inoculación de Glomus sp. y un programa de fertilización completo. Montañez (2009) reportó un incremento de 28% (210 DDS) en altura al inocular Glomus spp. y Acaulospora spp. Por otro lado, Alvarado (2017) con inoculaciones de Trichoderma spp. generó plántulas 33% (158 DDS) más altas que el control, sin embargo, Glomus sp. no tuvo diferencias significativas versus el control. Inoculaciones de conjuntos bacterianos (Enterobacter sp., Serratia sp., Microbacterium sp., Pseudomonas sp., Achromobacter sp.) realizadas por Barra et al. (2016), resultaron en incrementos entre el 20% y 26% en alturas de plántulas. Estos resultados confirman que la inoculación de bacterias benéficas aporta positivamente al crecimiento de las plántulas; efecto observado con la aplicación del consorcio dos.
No existieron diferencias significativas entre los diámetros de tallos de los tratamientos evaluados a los 80 y 110 DDS, en dichos períodos los valores promedios fueron de 4,01 cm y 5,46 cm respectivamente (Figura 2). A los 170 DDS se observaron diferencias significativas entre tratamientos, las plantas con mayor incremento pertenecieron a los consorcios uno (7,50 cm) y dos (7,51 cm); en relación al control (7,19 cm) (Tabla 2). Se observó un incremento del diámetro de aproximadamente 5% en los tratamientos versus el control. Carreón et al. (2014) y Arellano (2017) al inocular micorrizas nativas (S. pellucida) y un conjunto de Glomus spp. obtuvieron incremento en el diámetro de tallos de 6% en ambos casos, porcentajes similares al obtenido en este estudio. Barra et al. (2016) reportaron un engrosamiento de tallos en 15% con inoculaciones de conjuntos microbianos (Enterobacter sp., Serratia sp., Microbacterium sp., Pseudomonas sp., Achromobacter sp.).
El contenido de clorofila mostró valores SPAD similares estadísticamente en todos los tratamientos en los períodos de 80, 110 y 140 DDS, los promedios registrados fueron de 29,70; 46,65 y 53,57 respectivamente (Figura 3). A los 170 DDS se observaron diferencias significativas entre los tratamientos (Tabla 2 y Figura 3).
Los mayores contenidos de clorofila fueron registrados en los consorcios uno y dos (53,42 y 53,76 respectivamente), que representaron un incremento del 4% al compararlos con el control. Otros estudios han reportado el incremento de valores SPAD en plántulas de aguacate con inoculaciones de complejos bacterianos (entre 19% y 25% de incremento) (Barra et al., 2016) y Glomus spp. (9% de incremento) (Arellano, 2017).
A los 170 DDS, la porción aérea de las plantas (hojas y tallo) registró el peso seco más alto con la aplicación del consorcio dos (19,93 g), representando un incremento del 12% con respecto al control; sin embargo, estadísticamente todos los consorcios microbianos generaron resultados similares (Figura 4).
Resultados similares fueron reportados por Viera et al. (2017c) quienes al inocular plántulas de aguacates ecotipo mexicano (cultivar “Criollo”) con cepas de micorrizas nativas (Glomus spp.) registraron incremento de materia seca de 10% en relación al control.
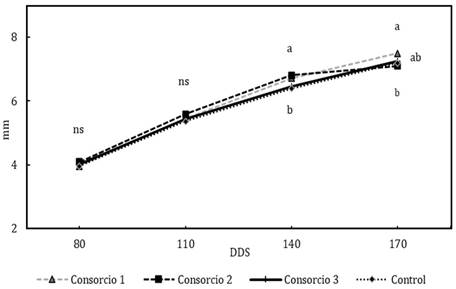
Figura 2 Efecto de los consorcios sobre el diámetro del tallo de plántulas de aguacate. Letras distintas en el mismo periodo (DDS) señalan diferencias significativas (LSD Fisher. α= 0.05), ns: diferencias estadísticas no significativas.
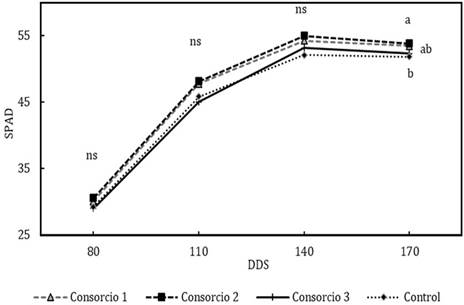
Figura 3 Efecto de los consorcios sobre el contenido de clorofila. Letras distintas en el mismo periodo (DDS) señalan diferencias significativas (LSD Fisher. α= 0.05), ns: diferencias estadísticas no significativas.
Alvarado (2017) reportó un incremento del 50% de peso seco de tallo y hojas en plantas inoculadas con Trichoderma sp.; mientras que, Montañez (2009) registró incrementos entre 20% y 30%. Todos los resultados mencionados coinciden en el incremento de biomasa seca que se reporta en este trabajo. Adicionalmente, en condiciones de suelos salinos y suministro limitado de agua, plántulas de aguacate tratadas con consorcios bacterianos (Enterobacter sp., Serratia sp., Achromobacter sp.) incrementaron en 43% la materia fresca de tallos y hojas (Barra et al., 2016).
El peso seco de raíces no registró diferencias significativas entre tratamientos, los consorcios dos y tres presentaron mayores valores absolutos con 5,44 g y 5,49 g respectivamente (Figura 4). Alvarado (2017) reportó resultados similares en esta variable al evaluar la inoculación de Trichoderma sp. y micorrizas arbusculares en plántulas de aguacate. Con resultados opuestos, Gluszcek et al. (2020) reportaron el incremento de pesos fresco y seco de raíces en plantas de cerezo (Vanda/GiSelA5) inoculadas con complejos micorrícicos (Rhizophagus intrara¬dices, Funneliformis mosseae, Claroideoglomus etu-nicatum, Rhizophagus clarus).
El incremento de biomasa en tallos y hojas reportado en el presente trabajo, concuerda con otras investigaciones que han evaluado el efecto sobre el desarrollo de plántulas frutales con inoculaciones de Trichoderma spp., Glomus spp.,
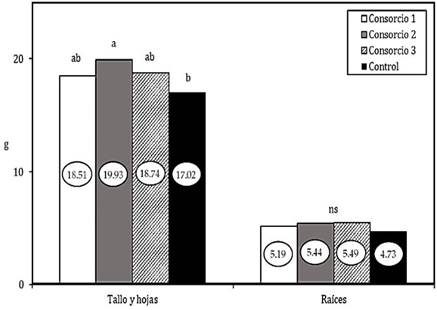
Figura 4 Análisis de peso seco en plántulas tratadas con los diferentes consorcios. Letras distintas en el mismo periodo (DDS) señalan diferencias significativas (LSD Fisher. α= 0.05), ns: diferencias estadísticas no significativas.
Bacillus spp. y otras bacterias promotoras de crecimiento. Se ha reportado que en plántulas de chirimoyo inoculadas con micorrizas nativas se registró un incremento de 42% de materia seca (120 DDS) en comparación al control (Viera et al., 2017b). En arándano, Schoebitz et al. (2016) reportó un incremento del 32% de materia seca de brotes, en plantas inoculadas con consorcios microbianos (Bacillus spp., Pseudomonas spp., Nocardiac sp., Saccharomyces cerevisiae y Trichoderma viride); mientras que en frutilla (Fragaria × ananassa Duch var. Elyana) se registraron incrementos en variables relacionadas a rendimiento (número y peso de frutos), desarrollo vegetal y calidad de frutos con inoculaciones de distintos compuestos bacterianos y fúngicos (Rhizophagus sp., Septoglomus sp., Funneliformis sp., Pseudomonas sp.) (Todeschini et al., 2018). En otras especies de interés comercial (soya, tomate, pimiento, lechuga, etc.), también se ha reportado que la inoculación conjunta o individualizada de T. atriviride, G. intraradices y Bacillus spp. y otros microorganismos, resultaron en plántulas con mayor altura, peso seco, diámetro de tallo, índice de verdor e incremento en cantidad y calidad de cosechas, entre otras características (Mastouri et al., 2010; Nzanza et al., 2012; Colla et al., 2015; Bradáčová et al., 2019).
Las concentraciones de nutrientes en tallos y raíces tuvieron diferencias significativas únicamente para el Cu (Tabla 3). En la parte aérea (hojas y tallo), el consorcio uno fue diferente estadísticamente al resto de tratamientos con la concentración más alta (4,74 ppm), registrándose un incremento del 46% de este catión en relación a los consorcios restantes y el testigo. En la raíz, el mayor contenido de Cobre lo tuvo el consorcio uno con 7,08 ppm y además fue distinto estadísticamente al resto de tratamientos. Más del 98% del Cu presente en las plantas es parte de moléculas complejas (proteínas), la importancia de este catión radica en su papel como elemento de transición en reacciones redox y como activador enzimático en procesos como fotosíntesis, respiración, síntesis de lignina, metabolismo del nitrógeno y carbono entre otros (Broadley et al. 2012). El incremento de la concentración foliar de Cu en plántulas de aguacate como resultado de la interacción planta-microrganismos, ha sido reportado por Sotomayor et al. (2019b), quienes detectaron el incremento de aproximadamente 12% de cobre en follaje en plántulas inoculadas con Thichoderma sp. Además, Menge et al. (1980) registraron incrementos de hasta 35% de concentración de este catión.
Para el resto de nutrientes, los valores obtenidos no mostraron diferencias estadísticas (Tabla 3). Con resultados similares, Alvarado (2017) no registró diferencias en el contenido de nutrientes en tejido en plántulas de aguacate inoculadas con Trichoderma sp. Glomus sp. y otros micro-organismos versus el control; por otro lado, los resultados exhibidos por Sotomayor et al. (2019b) no demostraron diferencias en las concentraciones de K, S, P, Mn Zn y B en raíces y K, S, Fe, Zn y B en tallos y raíces. Sin embargo, cabe mencionar que las concentraciones obtenidas en los tejidos vegetales del presente trabajo concuerdan con estándares adecuados reportados por varios autores para aguacate (Martínez et al., 2014; Viera et al., 2017c; Lazare et al., 2019; Selladurai & Awachare, 2019).
Los resultados generados en este trabajo corroboraron la influencia sobre el crecimiento vegetal de los microrganismos benéficos mediante varios posibles mecanismos de acción (solubiliza-ción y fijación de nutrientes, producción de hormonas. incremento en la absorción de agua y nutrientes, control de patógenos, etc.) (Dhir, 2017; Kashyap et al., 2017; Martínez‐Medina et al., 2017; Ruano-Rosa et al., 2017; Woo & Pepe, 2018; Thomloudi et al., 2019).
Tabla 3 Efecto de la inoculación de consorcios microbianos en las concentraciones de nutrientes en tejido (tallo, hojas y raíces) de plántulas de aguacate cultivar “Criollo”
| Órganos | Tratamientos | Macronutrientes (%) | Micronutrientes (ppm) | |||||||||||
| N | P | K | Ca | Mg | S | B | Zn | Cu | Fe | Mn | ||||
| Tallos y hojas | Consorcio 1 | 2,34 | 0,12 | 1,66 | 1,08 | 0,36 | 0,17 | 62,06 | 12,68 | 4,74 | a | 157,28 | 227,96 | |
| Consorcio 2 | 2,27 | 0,11 | 1,51 | 1,16 | 0,37 | 0,16 | 60,54 | 7,9 | 3,46 | b | 148,34 | 174,28 | ||
| Consorcio 3 | 2,64 | 0,11 | 1,59 | 1,2 | 0,4 | 0,17 | 57,06 | 10,6 | 2,9 | b | 136,68 | 205,1 | ||
| Control | 2,48 | 0,11 | 1,74 | 1,28 | 0,42 | 0,19 | 65,4 | 10,36 | 3,36 | b | 151,6 | 243,9 | ||
| Raíces | Consorcio 1 | 1,92 | 0,11 | 1,62 | 0,39 | 0,17 | 0,25 | 83,46 | 16,28 | 7,08 | a | 549,26 | 197,2 | |
| Consorcio 2 | 2,04 | 0,1 | 1,55 | 0,36 | 0,17 | 0,22 | 98,88 | 12,38 | 5,48 | b | 673,08 | 249,44 | ||
| Consorcio 3 | 1,97 | 0,09 | 1,39 | 0,33 | 0,15 | 0,21 | 81,98 | 10,36 | 5,14 | b | 605,98 | 234,52 | ||
| Control | 2,41 | 0,1 | 1,54 | 0,36 | 0,16 | 0,23 | 93,82 | 12,42 | 5,36 | b | 651,32 | 232,9 | ||
CONCLUSIONES
Las inoculaciones de microorganismos benéficos, en plántulas de aguacate en etapas tempranas de crecimiento promovieron su desarrollo vegetativo, como resultado se dieron incrementos en las variables altura de planta, diámetro de tallo, biomasa y actividad fotosintética en comparación con el testigo. Además, las concentraciones de nutrientes en tejidos se mantuvieron en niveles adecuados para esta especie, dándose un incremento en el contenido de Cu en tallos, hojas y raíces. Se pudo evidenciar que el consorcio 2 que en su mayoría estuvo conformado por géneros de bacterias benéficas produjo los mejores resultados en este estudio; sin embargo, también se observó que la aplicación de Trichoderma sp. y micorrizas produce resultados positivos para promover el crecimiento vegetal. Estos resultados contribuyen al fomento de una agricultura sustentable mediante el uso de microorganismos que constituye una práctica amigable con el medio ambiente y agronómicamente viable para ser implementada en viveros de producción comercial.












 uBio
uBio 


