INTRODUCCIÓN
El género Polylepis cuenta con 28 especies y forma parte de la vegetación natural de los ecosistemas altoandinos entre los 3500 y 5000 msnm. Están distribuidos de manera reducida en laderas y quebradas (Trinidad & Cano, 2016; Segovia-Salcedo et al., 2018), encontrándose la mayor cantidad de especies en los Andes del sur de Perú (Mendoza, 2005). Cumplen un papel fundamental en la ecología de las zonas altoandinas, estableciéndose como ecosistemas de gran importancia (Castro & Flores, 2015; Trinidad & Cano, 2016) y forman parte del hábitat de la flora y fauna (Hurtado et al., 2018), por lo que existe una pluralidad de aves especialistas y variedad de especies asociadas, que dependen de estos bosques (Huaira et al., 2019). Así mismo brindan servicios ecosistémicos directos como combustible, medicina natural y material para construcción (Hurtado et al., 2018); del mismo modo, almacenan carbono comportándose como sumideros para hacer frente al cambio climático (Eyzaguirre, 2015).
En la actualidad constituyen los ecosistemas más vulnerables, por la constante actividad antropogénica, la deforestación y el pastoreo (Zutta et al., 2012; Castro & Flores, 2015; Caiza et al., 2018; Rossi et al., 2018; Guzmán et al., 2021). A pesar de la importancia que poseen como recursos necesarios para la conservación de la biodiversidad y la regulación hídrica, existe poca información sobre su fenología y no se han implementado estrategias de conservación y restauración (Zutta et al., 2012; Franco et al., 2021; Guzmán et al., 2021). Por otro lado, las semillas de este género presentan un bajo porcentaje de germinación, como lo demostraron Canales & Huarasa (2020), quienes obtuvieron un 9% de germinación en semillas de Polylepis incana, mientras que Vega et al. (2018) obtuvieron entre 2% y 19 % de germinación en tres especies de Polylepis. Por su parte Salazar et al. (2020) logró entre el 2,83 ± 1,27 % y 3,24 ± 0,73 % al germinar semillas de Polylepis tomentella, estos resultados explican la dificultad de su propagación masiva mediante el uso de semillas.
En estudios realizados sobre la propagación asexual de queñoa, como los de Salazar et al. (2020), realizaron la reproducción asexual por estacas ex situ e in situ de Polylepis tomentella, sin obtener resultados, pese al cuidado otorgado. Sin embargo, Chipani et al. (2021), emplearon enraizadores naturales y tres tipos de sustratos para el enraizamiento de esquejes de Polylepis incana con lo que obtuvieron un 94,67% de prendimiento. Respecto al enraizamiento in vitro se encontró el estudio realizado por Vega-Krstulovic et al. (2007) quienes desarrollaron esta fase en la especie Polylepis tomentella obteniendo formación y desarrollo radicular. Cabe señalar que de toda la información revisada no se encontró trabajos de enraizamiento de estacas ni enraizamiento in vitro de yemas de Polylepis rugulosa Bitter, además como antecedente previo a este estudio se realizó ensayos de enraizamiento de estacas de Polylepis rugolosa Bitter empleando diferentes concentraciones de la auxina AIB, pero no se pudo lograr el enraizamiento. Ello debido a la dificultad que presentan al emplear estacas de esta especie, algo similar al resultado obtenido por Salazar et al. (2020). Así mismo se realizaron ensayos previos de enraizamiento in vitro empleando la auxina ANA, notándose que al usar concentraciones bajas las yemas no enraizaban y al incrementarse la concentración las yemas empezaban a formar callos muy pronunciados y posteriormente raíces; en ese sentido, se descartó esta auxina para el enraizamiento in vitro ya que el objetivo del presente trabajo era generar nuevas plantas mediante organogénesis directa. Por todo lo mencionado surge la necesidad de generar información relacionada con su propagación para poder ser empleada en programas posteriores de restauración y conservación.
A través de la técnica de propagación in vitro, es posible desarrollar un protocolo de enraizamiento que permita la producción masiva de plantas empleando el menor tiempo posible y su producción durante cualquier época del año.
El objetivo del presente estudio fue desarrollar las fases de enraizamiento in vitro y aclimatación de Polylepis rugulosa Bitter, a partir de yemas, empleando diferentes concentraciones de reguladores de crecimiento; en la fase de enraizamiento con la finalidad de obtener el mayor porcentaje de yemas enraizadas con la concentración adecuada de auxina (AIB) y citoquinina (BAP) y en la fase de aclimatación con el fin de generar el mayor número de plántulas sobrevivientes mediante el uso de cuatro tipos de sustratos bajo las condiciones de invernadero.
MATERIAL Y MÉTODOS
El presente trabajo se desarrolló en el laboratorio de biotecnología vegetal de Sociedad Minera Cerro Verde, distrito de Uchumayo, departamento de Arequipa, Perú, con coordenadas geográficas: 16°26'46'' Latitud sur, 71°77'15'' Longitud Oeste y altitud de 2104 m.s.n.m.; llevándose a cabo en dos etapas:
Etapa 1 Fase de enraizamiento
Se emplearon yemas provenientes de la fase de multiplicación con un tamaño promedio de 10 mm, se cultivaron 10 yemas por frasco, se colocó 25 ml de medio Murashige & Skoog por frasco, suplementado con 3% de sacarosa, 0,6% de agar y diferentes concentraciones de AIB (0, 0,3, 0,5 y 0,7 µM) y BAP (0, 0,05 y 0,1 µM), se empleó el Diseño de Bloques Completamente al Azar con arreglo factorial 4 x 3, distribuidos en 12 tratamientos, 5 repeticiones y 60 unidades experimentales, con análisis de varianza ANOVA y la prueba de especificidad de LSD Fisher para la comparación de medias entre los tratamientos. Durante esta etapa, los explantes fueron expuestos a una temperatura de 25° C se consideró un fotoperiodo de 16 horas de luz y 8 horas de oscuridad. Los explantes fueron evaluados una vez por semana y la evaluación final se realizó a los 45 días. Las variables evaluadas fueron: porcentaje de enraizamiento, número de raíces/plántula, longitud de raíces/plántula, altura de plántula y número de hojas /plántula.
Etapa 2 Fase de Aclimatación
Se seleccionaron plántulas provenientes de la fase de enraizamiento con un tamaño promedio de 30 mm, 5 hojas promedio, longitud promedio de raíces de 10 mm y con 1 a 2 raíces por plántula; se trasplantó 1 plántula en cada bolsa de polietileno negro con sustrato y los tratamientos empleados fueron los siguientes: T1: tierra (40%) + turba (40%) + estiércol vacuno (20%), T2: tierra (50%) + turba (50%), T3: tierra (80%) + estiércol vacuno (20%) y T4: Tierra (100%). Asimismo se empleó el Diseño de Bloques Completamente al Azar, distribuido en 4 tratamientos, 3 repeticiones y 24 unidades experimentales, con análisis de varianza (ANOVA) y la prueba de especificidad de LSD Fisher para la comparación de medias entre los tratamientos. Se realizó 1 evaluación por semana y a los 75 días después del trasplante se realizó la evaluación final, considerándose las siguientes variables: porcentaje de sobrevivencia, altura de plantas, longitud de raíces y número de raíces.
RESULTADOS Y DISCUSIÓN
Fase de enraizamiento
Porcentaje de enraizamiento
Respecto a esta variable (Figura 1), se obtuvo diferencias significativas entre los tratamientos, ya que el tratamiento 0,5 µM AIB + 0,05 µM BAP presentó los mejores resultados con un 98% de enraizamiento, en comparación a los tratamientos 0 µM AIB + 0,05 µM BAP y 0 µM AIB + 0,1 µM BAP, que presentaron 0% de enraizamiento en ambos casos.
Eras-Guamán et al. (2019), en el enraizamiento in vitro de Cinchona officinalis, obtuvieron el mayor porcentaje de enraizamiento (46,11%) del medio suplementado con 2,0 mg L-1 AIB + 0,0 mg L-1 BAP, y mencionan que el resultado podría estar relacionado con el efecto de la auxina AIB; a su vez, se pudo evidenciar que en aquellos tratamientos en el cual emplearon la combinación de la auxina AIB con la citoquinina BAP (1 mg L-1 de AIB + 0,5 BAP mg L-1 y 2 mg L-1 de AIB + 0,5 BAP mg L-1), contando con el BAP en bajas concentraciones en relación al AIB les permitió obtener porcentajes de raíces del 43,33% y 41,67%, respectivamente. En el presente estudio se encontraron similares resultados que Eras-Guamán et al. (2019), ya que se pudieron lograr porcentajes de enraizamiento tanto en tratamientos en donde sólo estuvo presente la auxina AIB como también en los tratamientos en combinación con la citoquinina BAP, con la diferencia de que el mejor resultado respecto al porcentaje de enraizamiento (98%) se logró en aquel tratamiento en donde estuvo presente tanto la auxina AIB y la citoquinina BAP; así mismo, también se pudo obtener el enraizamiento cuando no estuvo en combinación con la citoquinina BAP pero el porcentaje disminuyó (94%). Estos resultados demuestran que se puede obtener el enraizamiento in vitro cuando se combina la auxina con la citoquinina, siempre que la concentración de citoquinina sea más baja en relación a la auxina. Esto se corrobora con Indacochea et al. (2018), donde evaluaron tres medios de cultivo para tres especies nativas forestales denominadas Myroxylon balsamum (bálsamo), Tabebuia crhysantha (guayacán) y Tabebuia billbergii (madero negro). Se pudo ver que ninguno de los tratamientos empleados les permitió lograr formación de raíces, ya que emplearon concentraciones altas o iguales de citoquinina en relación a la auxina; mientras que en el trabajo realizado de Concha et al. (2008), quienes probaron el efecto de diferentes concentraciones de BAP y AIA en la propagación de Musa AAB Simmonds, en aquellos tratamientos en donde había una mayor proporción de auxina en relación al BAP, los explantes presentaron dominancia apical, enraizamiento y desarrollo foliar. Por su parte, Garay-Arroyo et al. (2014) afirman que las diversas respuestas que se obtengan del uso de auxinas van a estar sujetas a la concentración, percepción, estado de la planta, entre otros, así mismo se puede dar el caso de interacción con otras hormonas que contribuyen con la regulación de respuesta por parte de las auxinas.
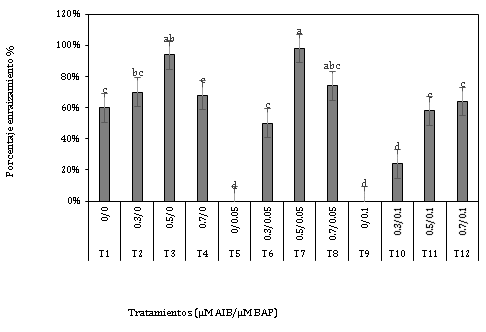
Figura 1. Porcentaje de enraizamiento de explantes de Polylepis rugulosa (queñoa) a los 45 días en diferentes concentraciones de auxina y citoquinina.
Número de raíces
El resultado del número de raíces obtenidos de los doce tratamientos (Figura 2) en la fase de enraizamiento (Figura 6a), indica que existe diferencia significativa entre los tratamientos, en donde los tratamientos 0,5µM AIB + 0µM BAP, 0,7µM AIB + 0µM BAP, 0,3 µM AIB + 0µM BAP y 0,5 µM AIB + 0,05 µM BAP muestran los mejores resultados con 2,24, 2,08, 1,92 y 1,86 raíces respectivamente en comparación al resto de tratamientos.
Se pudo obtener explantes con raíces del tratamiento en el cual no estuvo presente la auxina y la citoquinina pero en menor cantidad (Figura 2) en contraste con aquellos tratamientos que contenían reguladores de crecimiento, este resultado es parecido al realizado por Silva et al. (2020), en el enraizamiento de brotes de Salix babylonica L. ya que lograron obtener formación de raíces del tratamiento sin reguladores de crecimiento, aludiendo que el resultado que obtuvieron estaría relacionado con la presencia de auxinas endógenas sin embargo el número de raíces fue menor en comparación al tratamiento en el cual estuvo presente la auxina AIB. Así mismo Curi et al. (2020), en la fase de enraizamiento in vitro de Prosopis pallida observaron diferencias significativas entre los tratamientos adicionados con auxina en tanto que el tratamiento sin auxina no presentó respuesta durante el periodo de evaluación; sin embargo, posterior a esta actividad empezaron a presentar desarrollo de raíz, con lo que confirmaron que es necesaria la adición de auxinas para adelantar el proceso de enraizamiento. Por otro lado, Cortes et al. (2019), mencionan que las plantas durante su desarrollo necesitan la presencia de reguladores de crecimiento, los cuales se encargaran de controlar la actividad metabólica para mantener un equilibrio a nivel intra y extracelular.
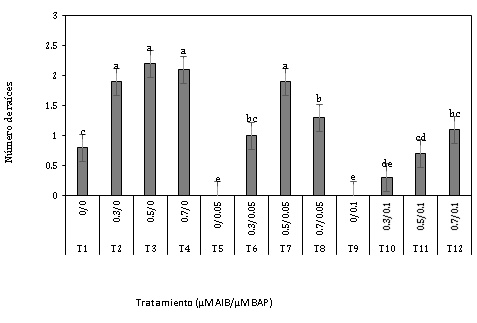
Figura 2. Número de raíces a los 45 días en la fase de enraizamiento in vitro de explantes de Polylepis rugulosa (queñoa) en diferentes concentraciones de auxina y citoquinina.
Longitud de raíces
Respecto a esta variable se obtuvo diferencias significativas entre los tratamientos, en donde el tratamiento 0,3 µM AIB + 0µM BAP presentó el mejor resultado con 11,74 mm.
Se puede observar (Figura 3) que la longitud de raíces va disminuyendo a medida que aumenta la concentración de auxina en los tratamientos T3 y T4, dicho resultado se puede respaldar con lo que afirma Jiménez-Mariña et al. (2019), en el sentido que el desarrollo de las raíces se ven afectadas porque la alta concentración de auxina, en combinación con las auxinas endógenas, hace que los valores en el desarrollo de raíces sean menores; siendo determinante para ello la concentración empleada de auxina. Del mismo modo Curi et al. (2020) comprobaron que mientras sea mayor la concentración de auxinas, se disminuye la respuesta al enraizamiento de los explantes.
En el presente estudio el tratamiento que permitió el mejor porcentaje de enraizamiento y un alto número de raíces, no mostró la mayor longitud de raíces a diferencia de Jiménez-Mariña et al. (2019) cuando estudiaron el efecto de diferentes concentraciones de AIA en Dahlia sp., en donde el tratamiento con 0,5 mg L-1 les permitió obtener el mejor porcentaje de enraizamiento, número de raíces y longitud de raíces: 87,5%, 3,9 y 3,6 cm respectivamente; y también Curi et al. (2020), en la fase de enraizamiento in vitro de Prosopis pallida, obtuvieron la mejor respuesta con el tratamiento 0,5 mg L-1 AIB respecto a las variables porcentaje de enraizamiento, longitud y número de raíces siendo los resultados de 53,3%, 1,5 cm y 1,5 respectivamente.
Chamorro et al. (2007) evaluaron diferentes concentraciones de reguladores de crecimiento y obtuvieron que las concentraciones empleadas de AIB fueron directamente proporcionales al número de raíces; sin embargo, fueron inversa-mente proporcionales respecto a la longitud de raíces. Comparando las figuras 2 y 3 se puede observar similar resultado.
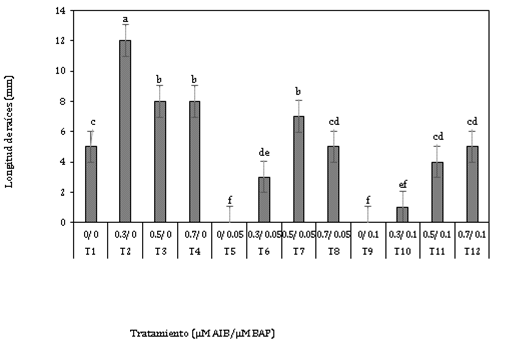
Figura 3. Longitud de raíces a los 45 días en la fase de enraizamiento in vitro de explantes de Polylepis rugulosa (queñoa) en diferentes concentraciones de auxina y citoquinina.
Altura de plántulas
Los resultados (Figura 4) indican que existe diferencias significativas entre los tratamientos, en donde el tratamiento 0,5 µM AIB + 0,05 µM BAP (Figura 6c), presentó el mejor resultado con 38,20 mm de altura, seguido del tratamiento 0,5 µM AIB + 0 µM BAP (Figura 6b) con 35,60 mm de altura.
Se puede apreciar (Figura 4), que los tratamientos que presentan las mayores alturas 0,5 µM AIB + 0,05 µM BAP y 0,5 µM AIB + 0 µM BAP también mostraron los mayores porcentajes de enraiza-miento (Figura 1), mientras que en el resto de los tratamientos: la respuesta fue diferente, similar al resultado que obtuvieron Zurita-Valencia et al. (2014) en el enraizamiento in vitro de Tilia mexicana Schlecht. Este resultado muestra que el desarrollo de raíces permite la absorción de agua y nutrientes del medio, permitiéndoles de esta manera aumentar su tamaño.
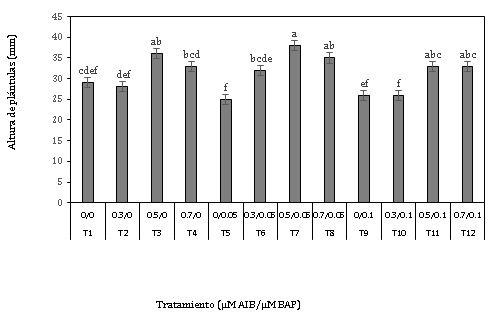
Figura 4. Altura de plántulas a los 45 días en la fase de enraizamiento in vitro de explantes de Polylepis rugulosa (queñoa) en diferentes concentraciones de auxina y citoquinina.
Número de hojas
Los resultados muestran (Figura 5) que el tratamiento 0,5 µM AIB + 0,1 µM BAP presentó el más alto valor con 6 hojas en promedio por brote en comparación al resto de tratamientos, sin embargo, este tratamiento no fue el mejor respecto a las variables antes mencionadas, con lo que se comprueba una vez más que en Polylepis rugulosa no necesariamente un solo tratamiento se va a mantener como el mejor en todas las variables que se consideren evaluar, lo que sí podría suceder con otras especies.
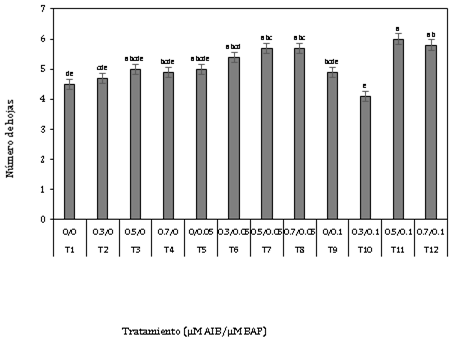
Figura 5. Número de hojas a los 45 días en la fase de enraizamiento in vitro de explantes de Polylepis rugulosa (queñoa) en diferentes concentraciones de auxina y citoquinina.
Fase de aclimatación
Se logró un porcentaje de plantas sobrevivientes superior al 78% (Figura 6e) en los cuatro tipos de sustratos empleados, así, las plántulas de queñoa pudieron superar el cambio de las condiciones in vitro a las condiciones ambientales naturales de invernadero. Este resultado estaría relacionado a varios factores que se consideraron, entre ellos podemos mencionar el uso de plántulas prove-nientes del mejor tratamiento de enraizamiento. Zurita-Valencia et al. (2014) mencionan que gene-rar plantas enraizadas en óptimas condiciones durante la fase de enraizamiento y como la parte final del proceso de micropropagación permite que las plántulas tengan un óptimo desarrollo y supervivencia al instalarlas bajo condiciones de invernadero.

Figura 6. Micropropagación en Polylepis rugulosa Bitter. (a) Tratamiento de enraizamiento, (b y c) Evaluación de enraizamiento, (d) Trasplante de vitroplantas, (e) Plantas aclimatadas, (f) Evaluación de raíces en plantas aclimatadas.
Por otro lado, Mariña (2020) logró obtener una aclimatación mayor del 80% aludiendo a que este resultado se debe al empleo de un sustrato estéril mediante el uso de autoclave o solarización, lo que evitó que se desarrollen enfermedades fungosas; debemos precisar que en el presente estudio no se empleó un sustrato esterilizado, ya que para evitar el desarrollo o la presencia de hongos se aplicó una solución de fungicida a base de fosetil aluminio 0,5 g L-1, adicionalmente también se consideró los monitoreos que permitían evaluar y prevenir la presencia de hongos.
La aclimatación de plántulas in vitro de queñoa (Figura 6d) se alcanzó en un período de tiempo de 10 semanas (75 días), el mismo tiempo que emplearon Indacochea et al. (2018) en la aclimatación de tres especies forestales endémicas. Durante las primeras cuatro semanas se mantuvieron bajo sombra y cubiertas con un envase transparente por cada plántula, lo que permitía mantener una alta humedad similar a la metodología empleada por Espinosa et al. (2019); luego se retiró la sombra, pero permanecieron con los envases transparentes. Estos envases se fueron perforando gradualmente hasta quedar cada plántula expuesta a las condiciones de invernadero.
Respecto a la variable altura de planta (Tabla 1), se puede observar que los tratamientos T1 y T2 presentaron los valores más altos en comparación al resto de tratamientos. Cabe mencionar que estos tratamientos estaban formulados a base de estiércol vacuno, lo cual podría haber influenciado en el desarrollo de la parte foliar, aumentando la composición nutricional, lo que permitió un mayor incremento de la altura. Espinosa et al. (2019) mencionan que el sustrato que usaron propició el crecimiento y desarrollo de plantas in vitro, indicando que los mejores resultados para las variables que evaluaron lo pudieron obtener de aquellos tratamientos donde estaba presente el estiércol vacuno, con lo cual indican que la adición de este elemento es beneficioso, ya que estaría asociada con el mejoramiento de las propiedades físicas, contenido de nutrientes y materia orgánica. Así mismo, comparando con los resultados alcanzados por Machado & Pérez (2020), en la aclimatación de Morus alba, emplearon cuatro mezclas de sustratos obteniendo la mayor altura de plantas con el sustrato que contenía humus de lombriz; sin embargo, debemos precisar que a este resultado le seguía el sustrato que contenía estiércol vacuno.
Referente a las variables relativas al número de hojas, longitud de raíces y número de raíces (Tabla 1), no se observaron diferencias significativas entre los tratamientos evaluados. Sin embargo, se pudo observar un incremento en el número de hojas entre 3,53 y 4 puesto que el número de hojas iniciales fue en promedio 5, mientras que la longitud de raíces mostró un incremento elevado entre 85,9 y 93,5 mm ya que las raíces iniciales medían 10 mm de longitud promedio.
Se lograron resultados satisfactorios respecto a la longitud de raíces en todos los tratamientos empleados, lo cual es muy importante, como lo menciona Sánchez et al. (2020), considerar el desarrollo de raíces asegura que la vitroplanta pueda absorber agua y nutrientes y de esta manera convertirse en una planta totalmente autotrófica. En la Tabla 1 se puede apreciar un ligero mayor tamaño de longitud de raíces en los tratamientos T1 y T3 respecto a los tratamientos T2 y T4, por lo que dichos resultados estarían relacionados a la presencia del estiércol vacuno; por su parte, Espinosa et al. (2019) aluden que uno de los factores que influyen en la aclimatación de plántulas in vitro es el tipo de sustrato y su composición. Según indicó, de estos elementos depende que la planta pueda proveerse de agua y nutrientes y al mismo tiempo influye en su desarrollo radicular, por eso es importante seleccionar el tipo de sustrato. De igual manera indica Sánchez et al. (2020) con relación a los sustratos que propiciaron el enraizamiento durante la aclimatación de Agave vivipara L. que los resultados que obtuvieron se habrían alcanzado por el contenido de fosfatos y materia orgánica de los sustratos, lo que produce a su vez mayor eficiencia en el riego. Por su parte Yescas et al. (2016) concluyeron que considerar la adición de materia orgánica en el sustrato ayuda durante el transcurso de aclimatación de plantas de Agave americana var. oaxacensis L.
Respecto al número de raíces durante la evaluación final, se pudo observar que el número de raíces iniciales se mantuvieron en la mayoría de los tratamientos, solo que estas habían elongado y a la vez ramificado (Figura 6f). Como se puede observar en la Tabla 1, no existen diferencias significativas entre los tratamientos aplicados, similar resultado obtuvieron Haygert-Lencina et al. (2017), durante la aclimatación de Apuleia leiocarpa al usar dos tipos de sustrato y también Torrejón & Gómez (2006), quienes realizaron la aclimatación de Uncaria tomentosa en cuatro tipos de sustrato, con lo que concluyeron que las vitroplantas en respecto a la altura y el número de hojas no mostraron diferencias significativas. Sin embargo, difieren con los resultados alcanzados por Gil et al. (2017), quienes realizaron la aclimatación de plántulas in vitro de violetas africanas empleando cuatro tipos de sustratos.
Tabla 1 Resultados de las variables evaluadas a los 75 días en la aclimatación de plántulas in vitro de Polylepis rugulosa Bitter provenientes del mejor tratamiento de la fase de enraizamiento bajo condiciones de invernadero
| Tratamientos | % de sobrevivencia | Altura de plántula (mm) | Número de hojas | Longitud de raíces (mm) | Número de raíces |
| T1 | 83,33% a | 76,87 a | 9,00 a | 103,5 a | 2,40 a |
| T2 | 87,50% a | 58,60 b | 8,53 a | 95,9 a | 2,40 a |
| T3 | 79,16% a | 68,53 a | 9,27 a | 99,0 a | 2,73 a |
| T4 | 83,3.3% a | 54,73 b | 8,60 a | 98,4 a | 2,00 a |
Esto es algo parecido a lo empleado en el presente estudio con la divergencia que obtuvieron diferencias estadísticas significativas, siendo el tratamiento T1 el que presentó los mejores resultados en todas las variables que evaluaron en relación al resto de sus tratamientos.
CONCLUSIONES
El medio Murashige & Skoog suplementado con auxina de 0,5 µM de AIB en combinación con la citoquinina 0,05 µM de BAP generó el mayor porcentaje de enraizamiento 98%, el cual presentó 1,9 raíces con 7 mm de longitud promedio, la mayor altura de plántula 38 mm y 5,7 hojas.
Se logró un porcentaje de sobrevivencia superior al 78%; sin diferencias significativas entre los tratamientos respecto a las variables número de hojas, longitud y número de raíces por lo que se considera que estos resultados fueron homogéneos durante la aclimatación, mientras que para la variable altura de plántula sí hubo diferencias significativas, obteniéndose los mejores resultados de 76,87 y 68,53 mm correspondiente a los tratamientos T1 y T3 respectivamente, cabe resaltar que estos tratamientos contenían 20% de estiércol vacuno.
Se recomienda evaluar el porcentaje de explantes enraizados a medida que aumenta el número de subcultivos para determinar el número máximo de subcultivos que permita buen desarrollo de raíces.












 uBio
uBio 


