INTRODUCCIÓN
La zanahoria (Daucus carota L.) es una especie originaria del centro de Asia y del Mediterráneo y es una de las especies más importantes de la familia Apiaceae (Que et al., 2019) y ha sido cultivada desde hace alrededor de 1500 años (Welbaun, 2015). Es una planta bianual, con una raíz napiforme (Mitich, 1996), la cual es muy apreciada por su alto contenido en caroteno o provitamina A (Fikselová et al., 2008) e importantes compuestos bioactivos que pueden beneficiar a la salud (Surbhi et al., 2018). Entre los tipos de zanahoria: Alrededor del mundo es posible encontrar cultivadas variedades de distintos tipos de zanahoria. Dentro de estas se encuentran los tipos Ámsterdam, Nantes, Chanan y Chantenay (Leteinturieret al., 1978).
La germinación de las semillas es un paso crucial para el posterior desarrollo de las plántulas de zanahoria (Molitor et al., 2014; Reid & English, 2000) y la consecución de óptimos rendimientos (Pereira et al., 2019; Iqbal et al., 2012); sin embargo, es también la principal dificultad debido a la extrema variabilidad que existe en la etapa de emergencia (Villeneuve & Leteinturier, 1992).
En este sentido, a través del tiempo se han desarrollado investigaciones que abordan la posibilidad de promover el desarrollo de las plantas mediante el uso de microorganismos (Cano, 2011; Di Barbaro et al., 2012) constituyéndose como una alternativa que permite producir a bajo costo y de manera sostenible ya que este material contiene varios minerales que son importantes para la semilla durante el proceso de emergencia.
Al respecto, BID (2009), plantea que, en semilleros, la aplicación al sustrato de microorganismos eficientes produce un efecto hormonal, similar al del ácido giberélico, aumentando el vigor y crecimiento del tallo y raíces de las plantas (Forti et al., 2020; Hurtado et al., 2020). Todo esto debido a la interacción huésped-microbio establecida a través de la evolución natural que posiciona a los EM como probióticos ambientales que ayudan en el crecimiento y el bienestar de los cultivos al fijar N, solubilizar K y P, desbloquear los oligoelementos del suelo, secretar exopolisacáridos, transformar la materia orgánica en nutrientes utilizables, mejorar la capacidad de retención de agua del suelo y mejorar la salud general del suelo. También liberan compuestos bioactivos como vitaminas, hormonas y enzimas para estimular el crecimiento de las plantas (Zhao et al., 2021), secretar agentes de control biológico y mejorar la tolerancia a la sequía (Naik et al., 2019).
Los ME se aplican para el crecimiento de cultivos en forma de consorcios que generalmente incluyen fotótrofos, bacterias del ácido láctico, actinomicetos, hongos fermentativos, levaduras, entre otros. Sin embargo, dado que el perfil del suelo y su ecología microbiana intrínseca a lo largo de las regiones geográficas varían, no se puede concebir una formulación microbiana eficaz universal.
Por lo expuesto, el presente estudio tiene como objetivo evaluar los efectos de imbibición de semillas de D. carota en una solución de microorganismos eficientes (EM) sobre las primeras etapas fenológicas de la planta.
MATERIAL Y MÉTODOS
El presente proyecto se llevó a cabo en el invernadero de la Facultad de Ingeniería Agronómica de la Universidad Técnica de Manabí, parroquia Lodana, cantón Santa Ana, provincia Manabí, Ecuador, localizada geográficamente a 01º 09ˊ de latitud sur y 80º 21ˊ de longitud oeste con una altitud de 47 msnm. durante los meses de octubre 2017 y febrero 2018. Se utilizaron semillas de la variedad Chantenay Royal y como sustrato, suelo de textura franco arcilloso.
El experimento incluyó tres tratamientos y un testigo (Tabla 1) en diseño completamente al azar (DCA) teniendo como factor en estudio el tiempo de imbibición de las semillas en la solución EM tomando en cuenta las recomendaciones de BID (2009) y Ramírez (2006), quienes sugieren utilizar una concentración al 2%.
Tabla 1 Descripción de los tratamientos en estudio para establecer los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes
| Tratamiento | Tiempo de imbibición (minutos) | Número de semillas por tratamiento |
|---|---|---|
| T1 | 00 | 25 |
| T2 | 15 | 25 |
| T3 | 30 | 25 |
| T4 | 45 | 25 |
Obtención de los microorganismos eficientes
La captura de microorganismos se realizó en el Campus Experimental “La Teodomira” de la Facultad de Ingeniería Agronómica de la Universidad Técnica de Manabí ubicada en la parroquia Lodana del Cantón Santa Ana. Se utilizó la metodología propuesta por Suquilanda (2006), que consiste en utilizar arroz entero precocido en vasos desechables cubiertos con tela asegurada con ligas para evitar el ingreso de rastrojo y hierbas. Estos vasos con el sustrato se distribuyeron de manera estratégica en el bosque donde no exista la intervención del hombre o animales domésticos (puesto que en estos lugares la descomposición de materia orgánica y la actividad microbiana es mayor), fueron enterrados a 10 cm de profundidad y cubiertos con la misma tierra, durante 15 días. Transcurrido este periodo de tiempo, se realizó la cosecha de los sustratos.
Preparación de la solución EM
En un bidón plástico de cinco litros se mezcló tres litros de agua y un litro de melaza, para luego incorporar los microorganismos capturados. Se cerró el bidón y se dejó fermentar 39 días acondicionando un agujero en la tapa para facilitar el escape de gas de la fermentación.
Preparación del semillero y aplicación de EM
Se utilizaron bandejas plásticas de germinación llenas con un sustrato compuesto por tierra agrícola de textura franco-arcillosa donde se sembraron las semillas a una profundidad de entre 3 y 5 mm, una en cada alveolo de la bandeja. El riego se realizó cada día a partir de la siembra, utilizando 1,5 litros de agua.
Análisis Bacteriológico de EM
El análisis bacteriológico, se llevó a cabo en el laboratorio de microbiología y control de calidad Fabril S.A., en el cual se analizó el producto preparado de los EM por métodos cualitativos y cuantitativos para determinar la existencia de Microorganismos Eficientes y el tipo de microorganismos presentes en el EM, esto mediante técnicas de aislamiento, tinción y observación.
Variables en estudio
Se consideró la escala extendida BBCH (Feller et al., 1995), evaluando el crecimiento de las plántulas desde el estadio 00 (germinación) hasta el estadio principal 14 (desarrollo de 4 hojas verdaderas del tallo principal), se registró datos correspondientes a las variables mencionadas en la Tabla 2. Se utilizó como dato para análisis el incremento desde el primer registro hasta el último, en cada una de las variables.
Tabla 2 Descripción de las variables en estudio para establecer los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes
| Abreviatura | Descripción | Unidad de medida |
|---|---|---|
| APC | Altura de planta en estadio fenológico 10 (cotiledones desplegados) | cm |
| AP1HV | Altura de planta en estadio fenológico 11 (1 hoja verdadera) | cm |
| AP2HV | Altura de planta en estadio fenológico 12 (2 hojas verdaderas) | cm |
| AP3HV | Altura de planta en estadio fenológico 13 (3 hojas verdaderas) | cm |
| AP4HV | Altura de planta en estadio fenológico 14 (4 hojas verdaderas) | cm |
| LC1 | Longitud cotiledón1 en estadio fenológico 10 (cotiledones desplegados) | cm |
| LC2 | Longitud cotiledón2 en estadio fenológico 10 (cotiledones desplegados) | cm |
| L1HV | Longitud de la 1 hoja verdadera en el estadio fenológico 11 | cm |
| L2HV | Longitud de la 2 hoja verdadera en el estadio fenológico 12 | cm |
| L3HV | Longitud de la 3 hoja verdadera en el estadio fenológico 13 | cm |
| L4HV | Longitud de la 4 hoja verdadera en el estadio fenológico 13 | cm |
La estadística utilizada en esta investigación comprende un análisis de varianza no paramétrica (Kruskal-Wallis) con un alfa de 0,05. Adicionalmente, se realizó un análisis de componentes principales (ACP) para establecer relaciones entre variables y tiempo de imbibición de las semillas en EM.
RESULTADOS Y DISCUSIÓN
Los resultados del análisis microbiológico de la solución EM establecen la presencia de microorganismos aerobios mesófilos, mohos, levaduras y bacterias de ácido lácticas (BAL), estas últimas comúnmente relacionadas con la liberación de compuestos bioactivos que estimulan el crecimiento de las plantas (Naik et al., 2019)
Se observó emergencia desde los ocho días después de la siembra (DDS), estos datos fueron registrados hasta los 10 DDS para obtener de esta manera el porcentaje de emergencia (Figura 1). En este sentido, es posible establecer que no existe diferencias estadísticas (p > 0.05) en cuanto al tiempo de emergencia, en tanto que el número de plántulas emergidas en T3 (24%) fue mayor que en los demás tratamientos. Este hecho podría responder a que los microorganismos estimulan la germinación de semillas y podría incrementar el suministro los nutrientes y a la mejora de la estructura del suelo por su contribución a la formación de agregados estables (Cabrera et al., 2012).
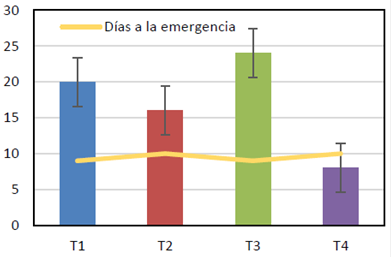
Figura 1 Efectos del tiempo de imbibición de semillas de D. carota. en una solución con microorganismos eficientes sobre el porcentaje (%) y tiempo de emergencia (DDS).
No obstante, la poca germinación de semillas se debe a que este proceso en este cultivo puede ser extremadamente variable (Reid & Englis, 2000) o posiblemente debido al no uso de materia orgánica en el semillero implementado en este ensayo. Al respecto, Gaviola (2013), señala que la emergencia y el establecimiento de cultivos de zanahoria sobre suelos minerales, con bajo contenido de materia orgánica, normalmente no resulta uniforme y en muchos casos es escasa. A partir de los 10 DDS se registraron los datos de las variables en estudio con un intervalo de dos días hasta los 32 DDS cuando las plantas desarrollaron cuatro hojas verdaderas del tallo principal. La Figura 2 muestra las variaciones en el tiempo para cada una de las variables en estudio.
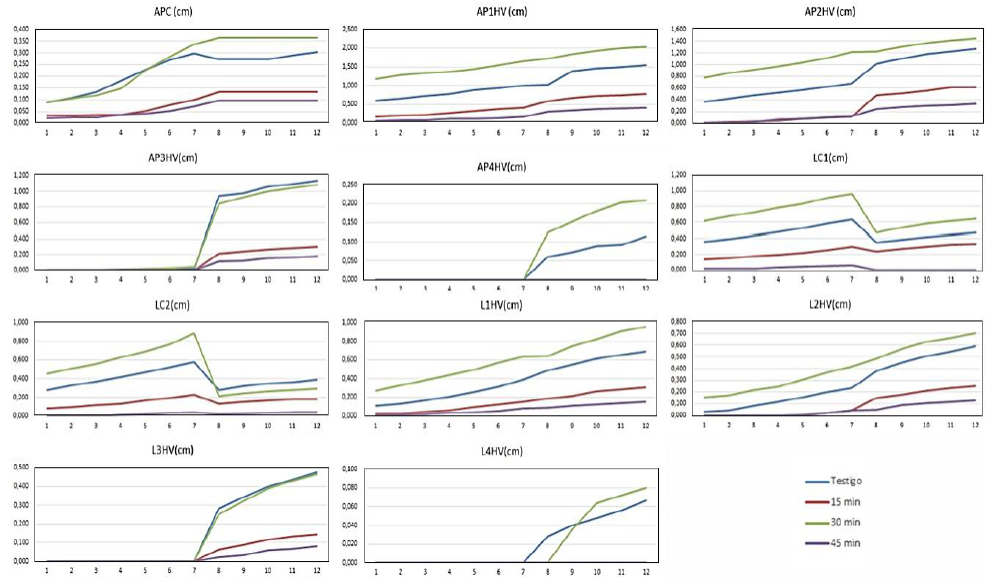
Figura 2 Efectos del tiempo de imbibición de semillas de D. carota. en microorganismos eficientes sobre algunas variables durante los primeros estadios de la plántula.
Todas las variables en estudio muestran un comporta-miento ascendente en el tiempo, con excepción de los registros correspondientes al cotiledón (LC1 y LC2), los cuales apoyan el crecimiento de las plántulas hasta que se expanden las hojas primarias (Harris et al., 19866) y luego reducen su tamaño y actividad (Mantilla, 2008; Tsukaya et al., 1994). En todas las variables se observan valores mayores progresivos para T3, situación que llevaría a pensar que existe mayor crecimiento y desarrollo de estructuras foliares cuando las semillas son embebidas en EM durante 30 minutos. Por otra parte, el análisis de varianza demostró que no existen diferencias significativas (p > 0,05) cuando se utilizaron los valores de incremento en el tiempo (valor registrado en la última fecha menos el valor registrado en la primera fecha de toma de datos) para cada variable como insumo para el análisis.
Con base en los resultados obtenidos mediante análisis de varianza, se pudo establecer que cinco de las 11 variables en estudio tuvieron significación estadística (Tablas 3, 4 y 5). Es así como APC obtuvo valores iguales en T1 y T3 (1,52 cm) seguido por T4 y T2 con 1,2 y 0,83 cm, respectivamente.
Tabla 3 Análisis de varianza para las variables en estudio sobre los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes

Tabla 4 Análisis de varianza para las variables en estudio sobre los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes.
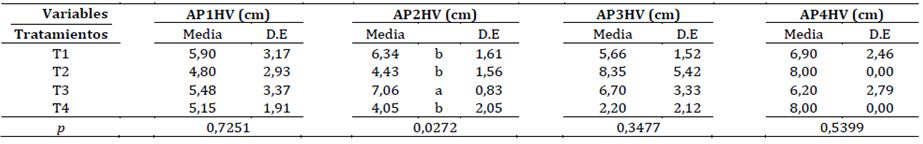
Tabla 5 Análisis de varianza para las variables en estudio sobre los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes
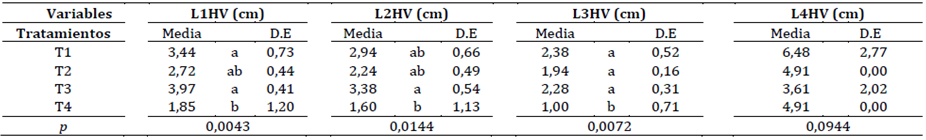
La variable AP2HV obtuvo los mejores resultados promedio en T3 (7,06 cm) mientras T1, T2 y T4 obtuvieron 6,34; 4,43 y 4,05 respectivamente. Con respecto a la longitud de hojas, se puede observar que en L1HV los mayores valores los obtienen T1, T2 y T3; para L2HV y L3HV se repite esta tendencia, no obstante T3 registra los mayores valores numéricos, sin que exista diferencia entre estos tres tratamientos. Este hecho lo justifica Tanya-Morocho y Leiva-Mora (2019) cuando indica que las levaduras (un componente de la solución utilizada en este ensayo) han sido reportada como estimuladoras del crecimiento en especies tales como clavel, crisantemo, petunia, pepino, cebolla, berenjena, pimienta, rábano, tabaco, tomate, lechuga, zanahoria, papa, algodón, fríjol, pastos y ornamentales. Adicionalmente sintetizan sustancias requeridas por la planta para su optimo crecimiento (Feijoo, 2016).
Los resultados del ACP (Figura 3) señalan que con las dos primeras componentes es posible explicar el 88,1% de la variabilidad total de las observaciones. En este sentido, la primera componente (CP1) con una inercia de 65,7%, separa, por un lado, los tratamientos T2 y T4, los cuales se encuentran relacionados con la variable AP4HV y, por otro lado, se encuentran los tratamientos T1 y T3 que guardan una estrecha asociación con la mayoría de las variables respuesta, existiendo mayores valores cuando se utilizó el tratamiento correspondiente a 30 min (T3).
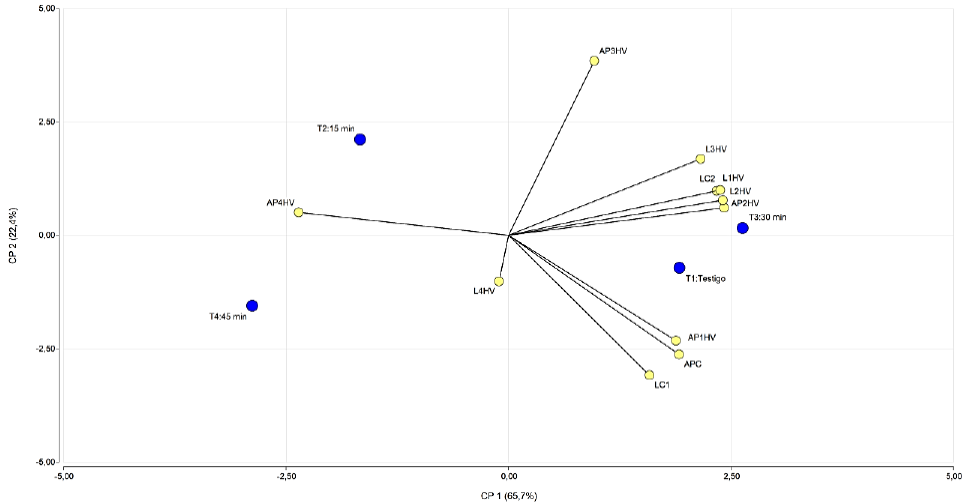
Figura 3 Análisis de componentes principales (ACP) para los efectos del tiempo de imbibición de semillas de D. carota en una solución con microorganismos eficientes.
Adicionalmente, es posible observar que las variables correspondientes a altura de planta guardan una estrecha correlación con las variables de longitud de hoja, por ejemplo: AP1HV con L4HV; AP2HV con L2HV; AP3HV con L3HV y AP4HV con L4HV, siendo esta última menor, con respecto a las demás correlaciones. Al respecto, Ramírez (2009), plantea que debe haber un equilibrio entre altura, diámetro del tallo y su área foliar, para lograr que las posturas se adapten bien al cambio que implica llevarlas al campo. Cuando se logra tal equilibrio la postura puede soportar el estrés post siembra y adaptarse a las condiciones agrícolas, mejor que otra con mayor área foliar que altura y viceversa.
Algunas correlaciones negativas, como por ejemplo la existente entre AP4HV con LC1 y AP4HV con LC2; este hecho confirma que en la medida en que las plantas se van desarrollando, los cotiledones disminuyen tu tamaño.
Es importante tener en cuenta que el uso de EM en la agricultura podría tener muchos beneficios (directos e indirectos). Al respecto, Bennett & Whipps, (2008a) demostraron que la supervivencia y establecimiento de microorganismos en las raíces desencadena una promoción continua del crecimiento en las plantas y potencialmente proporcionar control de enfermedades (Jensen et al., 2001,2004) durante las etapas iniciales cruciales de crecimiento de un cultivo a medida que los microorganismos se establezcan en la rizosfera (Harman, 1991), pudiendo ser considerados como una alternativa al uso de plaguicidas pre emergentes (Bennett & Whipps, (2008b).
CONCLUSIONES
Es posible concluir que la imbibición de semillas en una solución con microorganismos eficientes podría mejorar significativamente el desarrollo de las plántulas de D. carota, desde el estadio principal 00 hasta el estadio principal 14. El tiempo de imbibición podría ser un factor importante en el tratamiento pregerminativos de gemillas.
Se recomienda realizar estudios en otras especies probando diferentes tiempos de imbibición que bordeen los 30 minutos.












 uBio
uBio 


