INTRODUCCIÓN
La fresa Fragaria x ananassa Duch., es un cultivo que se establece a partir de plantines que provienen de yemas de estolones, cuyo rendimiento disminuye con facilidad; una alternativa es el cultivo in vitro (Pillco-Tancara & Quezada-Portugal, 2017), es rápida, eficiente y libre de enfermedades (Bonilla et al., 2015); asimismo, Fragaria x ananassa Duch. considerada híbrida interespecífica con características entre F. chiloensis y F. virginiana, con “rizomas muy ramificados y sin estolones o con éstos muy cortos” (Muñoz & Navarro, 1998); sus semillas no son viables; sin embargo, tiene “un sistema de crecimiento y formación de coronas y estolones que permite una propagación vegetativa rápida y segura” (Kessel, 2012); de rizoma cilíndrico muy corto, denominado corona, contiene las yemas, base del crecimiento de la planta (MINAGRI, 2008); se dispone de variedades que se consumen como fruta fresca o procesada, tiene alto contenido de vitamina C que va de 36,42 a 45,87 mg 100 g-1 de fruta en cv. Selva (Mena et al., 2017); y en la variedad Camino Real el contenido de antocianinas es de 5,9 mg l-1 (Cárdenas-Navarro et al., 2019), en Camarosa entre 45,64 a 92,83 y en Osogrande de 30,43 a 48,95 en mg equivalentes de Cianidin-3-glucósido 100 g-1 (Carvajal de Pabón et al., 2012).
Para la desinfección de explantes, la combinación de etanol al 70% e hipoclorito de sodio, permite niveles de contaminación inferiores; y al incrementar la concentración de hipoclorito de sodio y el tiempo de exposición, el número de explantes contaminados disminuye; pero, incrementa la cantidad de explantes no viables (Bedoya-Perez et al., 2016); que produce grandes pérdidas en el cultivo in vitro, hasta un 90% (Aguirre et al., 2016). En la micropropagación, la elección de las plantas madres donadoras de explantes es muy importante, éstas no deben mostrar síntomas de enfermedades y presentar características fenotípicas de las variedades correspondientes (Mamani-Sánchez & Murillo-García, 2020), se recomienda que provengan de un ambiente controlado para disminuir agentes contaminantes en el establecimiento in vitro, no obstante también depende del tipo de explante.
El establecimiento in vitro de fresa cv. Aroma, a partir de brotes apicales con una combinación de 0,25 mg l-1 de bencil aminopurina (BAP) más 0,30 mg l-1 de ácido giberélico (GA) y 0,60 mg l-1 de ácido indolbutírico (IBA) fue posible un 70% de tejido vegetativo con viabilidad, previamente tratada con una solución antioxidante 150 mg l-1 de ácido ascórbico e inmersión en etanol al 70% por 30 segundos y en solución de hipoclorito de sodio comercial y agua destilada (1:6) por 10 minutos (Ruíz et al., 2018). Se ha logrado un buen establecimiento in vitro de las variedades de fresa Portola, Albión y Camino Real en el medio Murashige y Skoog (MS) + 0,5 mg l-1 por una rápida brotación y contaminación baja (Félix-Hernández et al., 2017).
En estolones de las variedades, San Andrés, Camino Real y Festival, se desinfectó en hipoclorito de sodio comercial (30%), luego en alcohol etílico (30%), ambos durante 5 minutos, donde se presentó el mayor porcentaje de sobrevivencia en San Andrés y Festival; asimismo, el medio MS con 1,25 mg l-1 de BAP y 1 mg l-1 de ácido indolacético (AIA) permitió mejores resultados en establecimiento de las tres variedades y la mejor respuesta de sobrevivencia fue en la variedad Camino Real en medio MS modificado + 1 mg l-1 de kinetina (Jiménez & Alvarado, 2014).
La contaminación (por hongos y bacterias) y la fenolización, es común en la introducción in vitro de muchas especies vegetales; por tanto, es importante evitarlo mediante el tratamiento de los explantes con desinfectantes y antioxidantes, respectivamente, la eficiencia de éstas va a depender de la concentración y tiempo de exposición (Sanchez-Cuevas & Salaverría, 2004); además, el establecimiento in vitro puede variar dependiendo del origen del material biológico, estado de desarrollo, edad ontogénica, y tamaño del explante (Mroginski & Roca, 1991).
En la introducción in vitro de segmentos foliares de dos grados de maduración diferentes de las variedades de fresa, Oso Grande y Sweet Charlie, en medios de cultivo suplementados con tidiazuron y ácido indolbutírico, se determinó en aquellas que procedían de tejido juvenil y en la combinación de 0,002 mg l-1 y 0,2 mg l-1 de tidiazuron e IBA, respectivamente (Pillco-Tancara & Quezada-Portugal, 2017). En la inducción de respuestas morfogénicas de Acourtia cordata a partir de plántulas germinadas in vitro, en MS, sacarosa y agar de 30 y 4 g l-1 + auxinas y citocininas a 5 y 0,5 mg l-1, se detectó 0,2% de contaminación y sin explantes en estado de oxidación (Gómez-Serrano et al., 2010).
Durante la propagación in vitro, uno de los problemas a enfrentar es el establecimiento, debido al proceso de oxidación de los explantes, que causa un oscurecimiento del tejido, en especial en las especies leñosas (Azofeifa-Delgado, 2009), que se produce en todos los tejidos frente a un estrés abiótico, como un sistema de defensa del explante (Hernández & González, 2010); otro es, la contaminación por hongos, que depende del tipo de desinfectante que se utilice; así, al utilizar hipoclorito de sodio, éste no controló comparado al bicloruro de mercurio donde su porcentaje fue menor y depende de la concentración y el tiempo de exposición (García et al., 2015), una forma de reducir la contaminación por hongos, es la aplicación de fungicidas a las plantas donadoras (Bogado et al., 2016); asimismo, se tiene que ver la composición del medio, la especie, condiciones ambientales y los reguladores de crecimiento (Twaij et al., 2020).
Uno de los grandes problemas que se enfrenta el cultivo de fresa, es que las plantas obtenidas mediante el sistema convencional son muy propensas a enfermedades (Dutta & Sen, 2019), de modo que para un alto rendimiento, se requiere contar con semilla que garantice la producción; la que se puede lograr mediante el cultivo in vitro (Mir et al., 2019), que permite tener la variedad o cultivar libre de patógenos en especial virus, al mismo tiempo, una menor aplicación de pesticidas; por el otro lado, obtener individuos con cierta homogeneidad, consecuencia de una propagación asexual. En este contexto, el laboratorio de Biotecnología Vegetal de la Universidad Nacional Daniel Alcides Carrión (Undac), Filial Oxapampa, requiere contar con protocolos desarrollados para cada fase que implica el cultivo in vitro de fresa.
El objetivo de la presente investigación fue determinar un protocolo de desinfección y establecimiento in vitro de yemas de corona de fresa Fragaria x ananassa Var. Aroma, procedentes del Centro Poblado Menor (CPM) Mallampampa, distrito de Huancabamba y del sector la Florida, Chontabamba, provincia de Oxapampa, región Pasco, Perú.
MATERIAL Y MÉTODOS
El trabajo se desarrolló en el laboratorio de Biotecnología Vegetal de la Universidad Nacional Daniel Alcides Carrión, filial Oxapampa, Carretera Central s/n, km 3.5, Barrio Miraflores, distrito y provincia de Oxapampa, región Pasco, Perú.
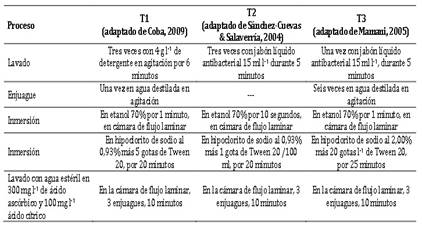
El material para establecer el método de desinfección fueron yemas extraídas de las coronas de plantas de fresa (Fragaria x ananassa Duch. Var. Aroma) de un cultivo de 4 meses de edad, procedentes del CPM Mallampampa, distrito de Huancabamba, provincia de Oxapampa, región Pasco. UTM 10.517245 LS y 75.447462 LO a una altitud de 2014 msnm, (GPS Garmin Monterra) las cuales fueron trasladadas debidamente codifi-cadas, a las instalaciones de la Undac, filial Oxapampa, donde se retiró el sustrato y se introdujeron en una bolsa de polipropileno y llevadas al Laboratorio de Biotecnología Vegetal. En el laboratorio, las plantas fueron lavadas con agua corriente de caño, a fin de retirar los restos de sustrato, defoliadas y lavado de coronas, Anexo, Figuras 1, 2 y 3; luego, las coronas fueron colocadas en un vaso de precipitado de 1000 ml para ser lavadas nuevamente en agua corriente. La desinfección se realizó utilizando tres métodos: T1, adaptado de Coba 2009 (Coba, 2009); T2, adaptado de Sánchez-Cuevas & Salaverría, 2004 (Sanchez-Cuevas & Salaverría, 2004); T3, adaptado de Mamani, 2005 (Mamani-Sáchez, 2005), Tabla 1, luego las yemas de corona fueron sembradas en 10 ml de medio de cultivo sólido MS (de sales y vitaminas), con 0,5 mg l-1 de BAP + 0,5 mg l-1 de ANA + 30 g l-1 de sucrosa y 9 g l-1 de agar, y el pH ajustado a 5,6; esterilizado en autoclave a 121 °C y 0,1 MPa durante 20 minutos.
El material biológico para el establecimiento in vitro, fueron yemas de corona de fresa Fragaria ananassa Duch. Var. Aroma, extraídas de plantas de 7 meses de edad, del sector La Florida, distrito de Chontabamba, provincia de Oxapampa, región Pasco y trasladadas al laboratorio de Biotecnología Vegetal, donde se retiró los residuos de sustrato mediante lavado con agua corriente de caño, posteriormente fueron defoliadas y colocadas en un vaso de precipitados de 1000 ml para un segundo lavado, posteriormente fueron desinfectadas con el mejor método establecido, T3 (Tabla 1); seguido, con la ayuda de un estéreos-copio ACCU-SCOPE, pinzas y hojas de bisturí N° 11, se extrajeron las yemas de corona y se sembraron en cinco medios (tratamientos): t1 (MS + BAP, 0,5 mg l-1 + ANA, 0,5 mg l-1), t2 (MS + BAP, 0,5 mg l-1 + ANA, 0,3 mg l-1 + AG3, 0,2 mg l-1), t3 (MS + BAP, 0,5 mg l-1 + AIA, 0,6 mg l-1), t4 (MS + BAP, 0,5 mg l-1 + AIA, 0,5 mg l-1 + AG3, 0,3 mg l-1) y t5 (MS sin reguladores) en 10 ml de cada uno. A todos los medios se agregaron 30 g l-1 de sucrosa, 9 g l-1 de agar, el pH se ajustó a 5,6 y fueron esterilizados en autoclave a 121 °C y 0,1 MPa por 20 min. Después de la siembra de las yemas de corona en los medios de cultivo respectivo en la etapa de desinfección como de establecimiento fueron incubadas a 20 °C, 77,98 μmol m-2 s-2 de luminosidad, 60% de humedad relativa y fotoperiodo de 16 horas luz.
Para la desinfección y establecimiento, se utilizó el DBCA, (Steel & Torrie, 1985), 3 métodos de desin-fección (tratamientos), y 4 repeticiones; mientras que, en el establecimiento in vitro, los tratamientos fueron 5 medios de cultivo y 3 repeticiones, la unidad experimental estuvo constituida de 5 yemas de corona, una en cada frasco de 20 ml, con 10 ml de medio.
Las lecturas de las variables en el proceso de desinfección fueron realizadas a los 6, 11, 14, 27 y 36 días después de la inoculación (ddi), se consideró el número de explantes con presencia de micelios de hongos y colonias de bacterias; la fenolización, fue número de explantes con más del 50% de tejido que cambió de verde a marrón oscuro y la sobrevivencia, los que mantuvieron el tejido de color verde natural; mientras que, en la fase de establecimiento, además de las mencionadas fueron brotación, número de brotes y número de hojas por microplanta. Las lecturas fueron realizadas a los 11, 17, 24 y 32 ddi.
Los datos fueron procesados con el software estadístico R v4.0.4, mediante el análisis de variancia (Anova) para encontrar significancia entre los tratamientos y prueba de comparación múltiple de Duncan (α = 0,05) que sirvió para determinar el mejor método de desinfección, y el mejor medio para el establecimiento de yemas de corona. Los datos fueron transformados mediante raíz cuadrada de X+1.
RESULTADOS Y DISCUSIÓN
Desinfección
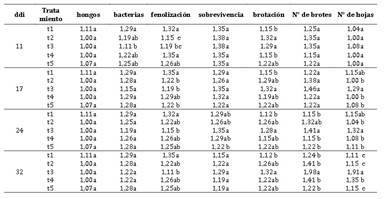
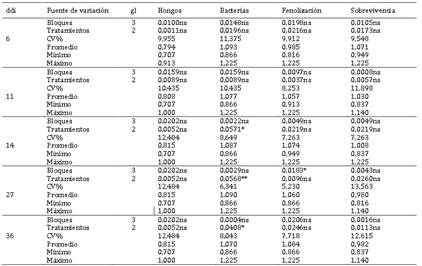
El Anova, muestra diferencias significativas para tratamientos (métodos de desinfección) en yemas de corona a los 14 y 36 ddi y altamente significativas a los 27 ddi para bacterias; mientras que, en las variables hongos, fenolización y sobrevivencia no hubo diferencias significativas, Tabla 2. La prueba de comparación múltiple de Duncan, α = 0,05, Tabla 3, muestra que, la sobrevivencia a los 14 ddi, T1 fue estadísticamente superior e igual a T3, y en fenolización T2 fue superior e igual a T3; mientras que, en contaminación con bacterias T2 y T3 fueron superiores a T1, sin diferencias entre éstos, y en hongos no se presentó diferencias. A los 27 ddi en bacterias T3 fue superior a T1 y T2; sin embargo, en hongos, fenolización y sobrevivencia no se encontró diferencias significativas; por otro lado, a los 36 ddi, T3 fue superior a T1 e igual a T2 en bacterias y fenolización, y no hubo diferencia en hongos y sobrevivencia. Al respecto se reporta que, en estolones de fresa de cv. Chandler, el uso de HgCl2 a 0,1%, por dos minutos se obtuvo una supervivencia de 70,78% con una contaminación del 35,41%, previa-mente sumergido en etanol al 70% por dos minutos (Kumar et al., 2020); esto demostraría que la contaminación y la supervivencia de los explantes está en función del tipo, tiempo de exposición y la concentración de los desinfectantes utilizados, considerando que se utilizó yemas de corona de fresa var. Aroma.
En cuanto a la sobrevivencia de los explantes a los 14 ddi, donde T1 fue superior a T2 e igual a T3; pero en el resto de las evaluaciones no hubo diferencias entre estos tratamientos, esto se debería que hubo explantes que se recuperaron de la fenolización. Referente a esto, la esterilización de explantes de fresa, “Osogrande” y “Toro”, con NaClO 0,5% por 15 minutos, se obtuvo una supervivencia de 75%, similar a cv Chandler en NaClO al 1% por 10 minutos y en “Islamabad” al 2,5% NaClO por 5 minutos con una fenolización del 75% de los meristemos a esta última concentración y disminuyó cuando se bajó la concentración a 0,5% en “Osogrande”, “Toro” y “Chandler”, por 10 minutos (Munir et al., 2015).
Tabla 2 Cuadrados medios, coeficiente de variación (CV) y valores descriptivos de tres métodos de desinfección.
gl. grados de libertad; **. Significativo al 1%; *. Significativo al 5%; ns. No significativo.
Tabla 3 Comparación múltiple de Duncan, α = 0,05, de tres métodos de desinfección
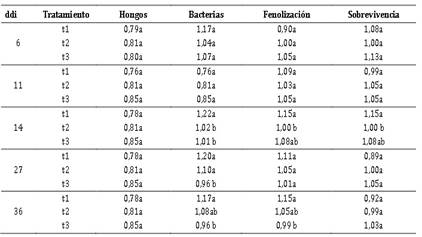
Los promedios en columna, que no comparten la misma letra son significativamente diferentes.
Se debe tener en cuenta que, al aumentar la concentración de cloro y el tiempo de exposición el proceso de supervivencia se afecta de manera significativa (Sanchez-Cuevas & Salaverría, 2004), en estudios de interacción se obtuvo que la asepsia es máxima (78,33%) cuando las yemas apicales se tratan con NaClO al 1,5% más etanol a 70% por medio minuto (Jan et al., 2013) y en “Islamabad” al 2,5% NaClO por 5 minutos con una fenolización del 20% de los meristemos a esta concentración y resultó similar cuando se bajó la concentración a 0,5% en “Osogrande” y “Chandler”, por 10 minutos (Munir et al., 2015). Por otro lado, cuando las yemas apicales se tratan con NaClO al 1,5% por 20 minutos, más etanol a 70% por medio minuto, pero se presentó mayor necrosis (58,32%) (Jan et al., 2013). Por ello, los resultados de fenolización a los 14 ddi, t2 fue superior a t1 e igual a t3, esto se debería a la interacción entre el menor tiempo de exposición al etanol al 70% y la concentración de NaClO; pero, a los 36 ddi, la mejor respuesta de t3 a la fenolización, indicaría que la combinación de sustancias durante la desinfección puede provocar menor fenolización; debido a una mejor eficiencia de la enzima superóxido dismutasa para convertir el O2- a peróxido de hidrógeno que es el sustrato de la catalasa y tener como producto final agua (Thanh-Tam et al., 2020).
El Anova (Tabla 4) muestra diferencias significati-vas para tratamientos (medios de cultivo in vitro) de yemas de corona de fresa var. Aroma en la variable brotación y altamente significativas en fenolización a los 11 ddi; sin embargo, a los 17 ddi fue altamente significativa en número de hojas y no
significativa para el resto de variables; a los 24 ddi hubo diferencias significativas en número de brotes y hojas; pero, altamente significativa a los 32 ddi para estas mismas variables. La prueba de comparación múltiple de Duncan, α=0,05, Tabla 5, muestra que a los 11 ddi, el t3 fue el menos contaminado por bacterias, y en fenolización el t2 fue superior comparado al resto de tratamientos; sin embargo, en brotación los mejores tratamientos fueron t2 y t3 frente a los demás. A los 17 ddi, los mejores medios de cultivo en fenolización fueron t2, t3 y t5, y en las variables brotación y número de
hojas fue t3, comparado al resto de tratamientos; mientras que, a los 24 ddi, t3 fue superior al resto de tratamientos en las variables evaluadas, excepto en contaminación por hongos y bacterias que no mostraron diferencias entre los tratamientos; sin embargo, a los 32 ddi, t3 tuvo igual comporta-miento que a los 24 ddi, excepto en sobrevivencia que no hubo diferencias significativas entre los tratamientos.
Estos resultados de las combinaciones de los reguladores de crecimiento en el establecimiento in vitro de yemas de corona de fresa Var. Aroma en que destacó el tratamiento t3, concuerda con un trabajo realizado donde se probaron diferentes combinaciones de BAP, ANA y AG3 y resultó la mejor combinación de BAP, 0,2 mg l-1 + ANA, 0,2 mg l-1 + 1 mg l-1 de sulfato de adenina (Jhajhra et al., 2018), esto confirma la sinergia entre citoquinina y auxina, con la diferencia en la auxina que se ha utilizado AIA en vez de ANA y una mayor concentración de BAP; asimismo, en el establecimiento in vitro de los cultivares “Dulce Charly “ y “Amanecer de Invierno” con el medio MS + BAP 5 mg l-1 + kinetina 0,1 mg l-1 + 0,7 g l-1 ácido ascórbico + 10 mg l-1 sulfato de adenina, azúcar de mesa al 4%, se logró un número de brotes de 4 a 5
por explante en el tiempo de un mes (Dhukate et al., 2021); esto indica que establecer un medio de cultivo in vitro para fresa, Var. Aroma, es hacer variar los reguladores y las concentraciones de éstos, en tal punto que se mantenga un equilibrio que favorezca el establecimiento del explante, considerada como la fase crítica en el cultivo de tejidos.
En cuanto a la fenolización, resultó ser mejor el t3 e igual a t2, t4 y t5. Esto evidenciaría que esta variable es sensible a la concentración de sales del MS y las combinaciones de los reguladores de crecimiento.
Tabla 4 Cuadrados medios, coeficiente de variación (CV) y valores descriptivos de cinco medios de cultivo en establecimiento de microesquejes de Fragaria x ananassa Var. Aroma.
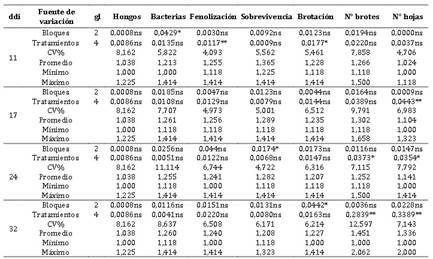
gl. grados de libertad; **. Significativo al 1%; *. Significativo al 5%; ns. No significativo.
Al respecto, en cv Chandler, para controlar la exudación fenólica se utilizó 300 g l-1 de ácido cítrico, donde disminuyó a cero, pero no favoreció la supervivencia de los explantes y por ende la proliferación de brotes; pero, la proliferación de brotes fue favorecida, cuando el medio MS fue suplementado con 200 a 300 g l-1 de carbón activado (Mir et al., 2019); sin embargo, en el presente trabajo se utilizó 300 mg l-1 de Ácido Ascórbico y 100 mg l-1 Ácido Cítrico, por un tiempo de inmersión de 10 minutos, en el proceso de la desinfección.
CONCLUSIONES
De los tres protocolos de desinfección de yemas de corona de fresa, Fragaria ananassa var. Aroma, fue el tratamiento T3 (adaptado de Mamani, 2005), que tuvo como procedimiento lavado con solución de jabón líquido antibacterial 15 ml l-1 durante 5 minutos, seguido con agua estéril seis veces e inmersión en etanol al 70% por un minuto e hipoclorito de sodio al 2% más Tween 20 gotas l-1, durante 25 minutos, tres enjuagues con agua estéril y la mezcla de 300 mg l-1 de ácido ascórbico y 100 mg l-1 ácido cítrico por 10 min, en base a una menor contaminación por bacterias, menor fenolización y mayor número de explantes que sobreviven.
La mejor combinación de reguladores de crecimiento en el medio de establecimiento de yemas de corona de fresa Var. Aroma, fue el t3 (MS + BAP, 0,5 mg l-1 + AIA, 0,6 mg l-1), de los cinco medios de cultivo in vitro utilizados, por una menor respuesta de los explantes a la fenolización, mayor grado de sobrevivencia, brotación, número de brotes y hojas por explante. Este medio se requiere ser probado con otras variedades o cultivares de fresa con el fin de estandarizar un establecimiento in vitro de fresa.












 uBio
uBio