INTRODUCCIÓN
En Piura encontramos diversos ecosistemas importantes para la conservación de la biodiversidad, entre ellos los humedales (manglares, estuarios y lagunas) (Calle, 2013). Los estuarios son ecosistemas caracterizados por la presencia de una gran diversidad de organismos en diferentes etapas de vida, tales como hembras ovadas, juveniles, larvas, entre otros (Barletta et al., 2002).
Las larvas de invertebrados hacen que un ambiente estuarino sea diverso y productivo, además de ser un eslabón clave en la trama trófica (Virnstein, 1977). Existen algunas investigaciones en otros estuarios de la región Piura (Barrionuevo & Marcial, 2006; Charcape, 2007; Ríos, 2014; Piscoya & Yupamqui, 2017), pero escasamente se ha documentado a nivel específico en el estuario del río Chira, especialmente cuando hablamos de este grupo de organismos que son sensibles a los cambios ambientales.
La mayoría de los invertebrados tienen un ciclo de vida indirecto, lo que origina estados larvales pelágicos que se mantienen en la columna de agua desde unas horas hasta varios meses antes de asentarse, según la especie, las condiciones ambientales y el alimento disponible (Scheltema, 1986; Vilicicb et al., 1994; Buckland et al., 2002; Molinet et al., 2005).
Determinar y clasificar las larvas en el plancton suele ser un trabajo complicado, en particular cuando no se conoce la diversidad de la zona de estudio. Esta carencia de información sobre los estadios larvales, tanto morfológica como ecológica, está presente en muchos grupos de invertebrados cuyos adultos son bentónicos y las larvas planctónicas (Albornoz, 1996).
Eventos anómalos como el “Fenómeno El Niño” en nuestra región, afecta diferentes recursos produciendo alteraciones en sus procesos biológicos, comportamiento y una paulatina disminución de sus niveles poblacionales (Estudio Nacional del Fenómeno El Niño [ENFEN], 2017).
Pero no solo el estuario del río Chira se ve afectado por eventos meteorológicos, sino también por las actividades ejercidas por los pobladores de la zona, tales como pesca artesanal y/o vertimiento de desechos orgánicos e inorgánicos dentro y fuera del estuario (Céspedes, 2005).
El estudio de las larvas de invertebrados es de mucha importancia tanto para contribuir a una mejor comprensión del ciclo de vida de una especie, como por la información que surge para el interés biológico pesquero (Boltovskoy, 1981).
El objetivo fue determinar las especies de larvas de invertebrados presentes en el estuario del río Chira.
MATERIAL Y MÉTODOS
El estuario del río Chira se encuentra ubicado en el distrito de Vichayal, provincia de Paita, departamento de Piura. Se seleccionaron 3 estaciones de muestreo, la Estación 1 (bocana), Estación 2 (margen izquierda) y Estación 3 (margen derecha). La ubicación de las estaciones de muestreo en la Figura 1.

Figura 1 Ubicación geográfica de las estaciones de muestreo en el estuario del río Chira, distrito de Vichayal, Paita -Piura. Fuente Google Earth.
Las muestras se colectaron mensualmente de septiembre 2017 a julio 2018, con el método de larveo artesanal de langostinos propuesto por el Instituto del Mar del Perú [IMARPE] (2007).
Las muestras se obtuvieron mediante capturas por 20 minutos, utilizando artes convencionales para el larveo de langostinos (Fig. A1-a del Anexo ); “Avión”: es un arte empleado mayormente en las playas, compuesta de una armazón en forma de “H” con un cono de 2 a 2,5 m de longitud, elaborado con un tul rojo de 1 mm de abertura; “Chayo” (Fig. A1-b del Anexo), es un instrumento más pequeño, confeccionado con una tela de tul de las mismas características del “avión”, pero cuya armazón está compuesta por dos varillas de madera de 1 m de longitud, que se manipulan a manera de tijera (IMARPE, 2007).
Se colocaron con cuidado las larvas obtenidas en un recipiente de porcelana con capacidad de 1 L (Fig. A1-c del Anexo), se separó las larvas de invertebrados de la fauna acompañante (larvas de vertebrados) y de los restos de vegetación transportada por el rio, luego de obtenida la muestra se colocó en un recipiente de plástico con capacidad de 1 L y se agregó formol al 4% para su conservación y posteriormente ser trasladada a laboratorio de Ecología de la Universidad Nacional de Piura.
Los parámetros fisicoquímicos fueron medidos in-situ con un termómetro de mercurio con sensibilidad 0,1 °C, y un refractómetro óptico KOMPASS (sensibilidad 1‰), se registró la temperatura superficial del agua del estuario, temperatura del ambiente y salinidad.
Las larvas se observaron en microscopio y estereoscopio (LABOMED), se determinó su grupo taxonómico, además de su estadío larval, para su determinación se utilizó guías y claves taxonómicas como:
“Catálogos de Zooplancton en el mar peruano” (Santander et al., 1981), “Catálogo de Crustáceos decápodos y Estomatópodos del Perú” (Moscoso, 2012), “Atlas de zooplancton del Atlántico Sudoccidental” (Boltovskoy, 1981) parte “III a” y “III b2”.
“Illustrated keys for the identi¢cation of the Pleocyemata (Crustacea: Decapoda)” (Santos y Gonzalez, 2004), “Chave ilustrada para identificação das zoés de Brachyurado estuário da Lagoa dos Patos (RS) e região costeira adjacente” (Ramos & Kloetz, 2010), “Morphology of the zoeae larvae of Brachyura (Crustacea,Decapoda) in Veracruz, southwestern Gulf of Mexico” (Chazaro et al., 2013).
“Clave de identificación para los estadios de postlarva y primeros juveniles de camarón del género Penaeus (Crustacea: Decapoda) Del Golfo De California, México” (Pérez et al., 1989), “Keys to the larvae of common decapod crustaceans” (Weiss, 2017), “Marine Zooplankton Practical Guide” (Yamani et al., 2011), y trabajos individuales como: Medellín et al. (2009); Cuesta & Gordillo (2020); Haug et al. (2016); Cházaro et al. (2017); Ferrández (2017); Ocaña & Pérez (2004); Mujica et al. (2015); Dworschak et al. (2012) y Harvey et al. (2014).
RESULTADOS Y DISCUSIÓN
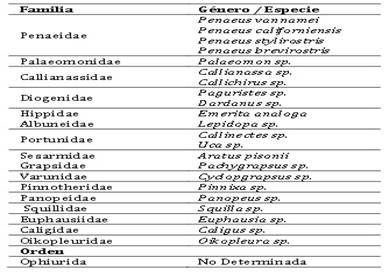
Se determinaron 22 especies repartidos en 16 familias (Tabla 1). Además, se observó la presencia de una larva Ophioploteus no determinada perteneciente a la orden Ophiurida.
Tabla 1 Clasificación de larvas de invertebrados encontradas en las tres estaciones de muestreo en el estuario del río Chira
Se encontró más de un estadio larval en algunas especies de invertebrados en el estuario del río Chira, el reconocer las fases de desarrollo además de necesario fue útil, porque facilitó su clasificación y posterior determinación, coincidiendo con lo mencionado por (Costlow & Bookhout, 1968; Mcconnaughey, 1974; Ruppert & Barnes, 1996).
El estuario del río Chira presentó 20 especies de larvas de crustáceos, repartidas en 14 familias. Este tipo de ecosistemas en la región Piura muestran una semejanza en la cantidad de crustáceos encontrados; así Barrionuevo & Marcial (2006) registraron 14 especies de crustáceos distribuidas en 9 géneros y 8 familias en los Manglares de San Pedro-Piura, también hallaron 7 estadios larvarios entre crustáceos e insectos; Charcape (2007) reporta en el manglar “San Pedro” de Vice 23 especies de crustáceos.
En el estuario del río Chira el 78,25% de las larvas de invertebrados registradas corresponde a los decápodos, agrupados en 12 familias. Siendo este taxón el más abundante con un total 18 especies, seguido de 5 órdenes que representan el 4,35% cada uno (Figura 2).
Ríos (2014), en el estuario de Virrila - Sechura determinó larvas de 2 bryozoos, un poliqueto, 7 crustáceos, de los cuales 6 fueron copépodos en estado adulto y nauplios. Piscoya y Yupanqui (2017), determinaron 7 larvas del zooplancton en el manglar de San Pedro - Piura: cirrípedo, bivalvo, crustáceo, nauplio de copépodo, larva de poliqueto, larva trocófora y una de Chironomidae. En las muestras del estuario del rio Chira se encontró larvas de decápodos, copépodos, apendicularia y Ophiura.
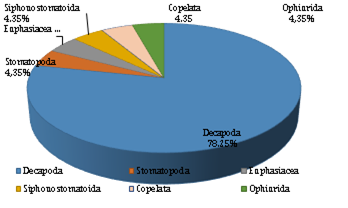
Figura 2 Distribución porcentual por órdenes de las larvas en las tres estaciones de muestreo en el estuario del río Chira.
Cabe destacar que el orden Decápoda con 5 infraordenes (Penaeoidea, Caridea, Axiidea, Anomura y Brachyura) fue el más representativo en el estuario del río Chira. Comparado con lo encontrado en otras regiones nuestra data se asemeja a lo reportado por Cervellini (2001) al determinar 30 especies de larvas de crustáceos en el estuario de Bahía Blanca, Argentina, clasificados en 15 familias y 4 infraordenes (Caridea, Thalassinidea, Anomura y Brachyura).
En el infraorden Brachyura se registró 6 familias: Portunidae, Sesarmidae, Grapsidae, Varunidae, Pinnotheridae y Panopeidae, esto muestra una cantidad mayor de familias a diferencia de lo encontrado por IMARPE (2007) en la bahía de Sechura frente a la bocana de San Pedro (estuario de San Pedro), donde encontró familias como Majidae, Grapsidae, Porcellanidae.
Los resultados correspondientes a la temperatura superficial del estuario (°C) se muestran en la Figura 3, el valor máximo se presentó en la estación 1 con 26,1 °C en marzo del 2018 y el valor mínimo correspondió a 18,0 °C en la estación 2 en octubre 2017.
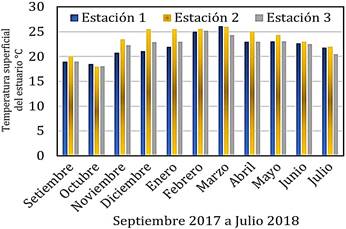
Figura 3 Variación de la temperatura superficial del estuario (°C) de las tres estaciones, setiembre 2017 a julio 2018.
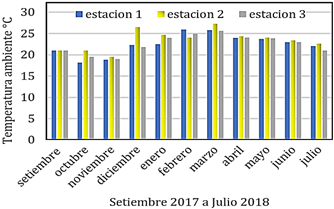
La temperatura ambiente (°C) se muestra en el Figura 4, el valor máximo registrado fue 27,3°C en marzo 2018 en la estación 2 y el menor valor fue de 18,2 °C en octubre 2017 en la estación 1.
Benfield (2013), menciona que la temperatura puede influenciar en desarrollo, comportamiento y metabolismo de las larvas estuarinas.
La salinidad en la estación 1 oscilo entre 16- 20 (UPS), los cambios observados en los niveles de salinidad están asociado con la presencia de larvas en esta estación, dado que existen muchas especies que son tolerantes a ciertos rangos de salinidad (Benfield, 2013). En la estación 2 los valores de salinidad estuvieron entre 13 - 20 (UPS). Los mayores cambios de salinidad se observaron en la estación 3, llegando la salinidad a bajar hasta los 5 (UPS) en marzo y con un punto más alto de 16 (UPS) en octubre (Figura 5).
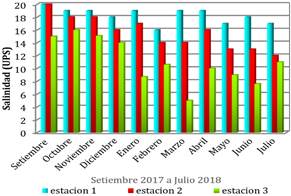
Figura 5 Variación de la salinidad según estación en el estuario del río Chira, setiembre- diciembre 2017 a enero- julio 2018.
Se observó que entre diciembre 2017 a marzo 2018 en la estación 1, la salinidad fluctuó entre 16 - 19 (UPS), la temperatura superficial del estuario fue >21 °C y < 26,1 °C y la temperatura ambiente fue >22 °C y < 26 °C, condiciones donde se hallaron las cuatro especies de peneidos (P. stilylirostris, P. vannamei, P. californiensis y P. brevirostris) lo cual tiene relación con lo mencionado por Piccolo & Perillo (1997) al indicar que las larvas y postlarvas de los camarones Caridea y Penaeoidea se registraron en la desembocadura donde los factores abióticos, fundamentalmente la salinidad son más constantes. Por otra parte, García (1976) menciona que la etapa reproductiva en peneidos (L. stylirostris) en el medio natural está asociada estrictamente con la temperatura.
Sin embargo, para Ramírez & Aragón (2006) tras estudiar el hábitat de las postlarvas de los camarones peneidos que ingresan al estuario del río Colorado, muestran que las postlarvas de camarón azul P. stylirostris y camarón café P. californiensis son más abundantes en mayo, junio y septiembre (estación de verano); coincidiendo con nuestro registro, las postlarvas de los peneidos se presentaron desde octubre 2017 a marzo 2018, con mayor presencia en los meses de verano.
Entre los portunidos registrados, Callinectes sp. se encontró en la Estación 1 entre marzo a mayo con salinidad 17 - 19 (UPS) y el género Uca en la Estación 2 con salinidad de 13-16 (UPS). La información obtenida se ve apoyada por lo registrado por Estrada (1999) y Ramírez et al. (2003) al mencionar que los portunidos se desarrollan en salinidades de al menos 20 partes por mil, y que en algunas especies de Callinectes son tolerantes a bajas salinidades.
También se registró un copépodo del género Caligus en la estación 1, se observó en diferentes etapas de desarrollo, en su fase larval (Chalimus), con temperatura superficial del estuario >20 °C y ≤26,1 °C y salinidad entre 16 - 19 UPS. González y Carvajal (1999) comprobaron que la salinidad afecta el desarrollo de las larvas, observaron que los nauplius no mudan a copepodito a salinidades iguales o inferiores a 15 ppm; después en 2003, describen que este copépodo en su ciclo de vida depende directamente de la temperatura del agua.
En efecto, en la desembocadura (estación 1) del estuario del rio Chira y/o lugares más próximos a éste, es donde se presentó el mayor número de géneros, coincidiendo con lo mencionado por Mujica & Medina (2000) al referirse que el número de especies aumento en zonas próximas al mar.
En un contexto general, se observó que al aumentar la temperatura ambiental y del estuario en los meses de verano, hubo un incremento importante del número de especies registradas, por lo que este parámetro resulta determinante para el desarrollo de los ciclos reproductivos y por ende de las fases larvales de diversas especies.
En relación al gradiente de salinidad las zonas que presentaron menores variaciones posibilitaron el desarrollo de más especies de larvas, por ello presentaron los valores más altos. Esto favoreció la presencia de las larvas de invertebrados en el estuario del rio Chira, donde se determinaron 22 larvas a nivel de especie y una a nivel de orden.
CONCLUSIONES
Se determinaron 22 especies de larvas de invertebrados, distribuidas en 16 familias, además de 1 especie del orden Ophiurida en el estuario del río Chira, distrito de Vichayal, Paita -Piura.
El 78,25 % de larvas de invertebrados del estuario del río Chira fueron crustáceos decápodos, pertenecientes a 5 infraórdenes y 12 familias, siendo el infraorden Brachyura el más numeroso con 7 géneros.
La mayor presencia de larvas de invertebrados se registró en febrero en la estación 1 (bocana), con temperatura superficial del estuario de 25 °C, temperatura ambiente 26 °C y salinidad 16 UPS.
Los gradientes de temperatura superficial y salinidad del estuario fueron determinantes en la presencia de las larvas de invertebrados.
Los registros obtenidos servirán como base para realizar nuevas investigaciones que permitan conocer el estado de sus poblaciones, además de que se pueda considerar en evaluar más factores fisicoquímicos y/o si las diferentes actividades humanas estarían afectando o fragmentando la composición de la flora y fauna acuática del estuario, cuya información ayudaría a una mejor comprensión, conservación y aprovechamiento de este ecosistema.












 uBio
uBio