INTRODUCCIÓN
Las garrapatas en el mundo afectan al 80% del ganado, son consideradas, después de los mosquitos, los ectoparásitos de mayor importancia económica en granjas (Valencia et al., 2017), pero también en salud pública ya que se estima que son responsables de más de 100 000 casos de enfermedad en humanos y animales, tanto silvestres como domésticos (Bona et al., 2022; Kaba, 2022, Domínguez-García et al., 2010), cuyo ciclo de vida depende del huésped vertebrado. En los países africanos, las garrapatas se encuentran entre los vectores más importantes de importancia médica y veterinaria representando así un obstáculo para el desarrollo y mejora de la producción ganadera (Compaore et al., 2022).
La importancia de las garrapatas como ectoparásitos radica en su hábito de alimentarse de la sangre de animales domésticos, silvestres y humanos para completar su ciclo de vida. En el proceso de alimentación, el huésped afectado puede volverse anémico si la carga de parásitos es alta (Kaur et al., 2017) o puede estar expuesto a patógenos secundarios de los que las garrapatas son vectores. Por ejemplo, el género de garrapatas Rhipicephalus (Boophilus), en particular R. microplus es vector de múltiples patógenos infectando animales y humanos (Lu et al., 2022), es uno de los ectoparásitos más importantes que afecta la salud del ganado y es considerado un riesgo epidemiológico debido a que provoca importantes pérdidas económicas, principalmente, por las restricciones en la exportación de animales infestados a varios países. Su distribución espacial ha estado ligada a factores ambientales, principalmente temperaturas cálidas y alta humedad relativa (Alcalá-Canto et al., 2018). Además de alimentarse de sangre, las garrapatas perforan la piel de los animales con sus piezas bucales especializadas ocasionando heridas y, cicatrices en la piel de los animales, en consecuencia, el impacto económico en términos de degradación de la calidad de las pieles y cueros en las curtiembres es significativo (Sertse & Wossene, 2017).
Según Guglielmone et al. (2010), en todo el mundo se han registrado 896 especies de garrapatas y su importancia radica en la capacidad que poseen algunos géneros, además de ser microparásitos obligados, son vectores de agentes patógenos, que incluyen protozoarios, bacterias y virus (Lu et al., 2022; Ernieenor, Ernna & Mariana, 2017) que causan un amplio espectro de enfermedades en animales, humanos y zoonóticas (Defaye et al., 2022).
Por ejemplo, Haemaphysalis longicornis, la garrapata asiática de cuernos largos se ha caracterizado por su frecuente parasitismo del ganado, la capacidad de reproducirse a través de la partenogénesis y su capacidad de transmitir una variedad de patógenos transmitidos por vectores al ganado, la vida silvestre y los huéspedes humanos en su área de distribución geográfica nativa (Cumbie et al., 2022). Algunas de las enfermedades transmitidas por garrapatas son consideradas como graves plagas de animales domésticos, provocando grandes pérdidas económicas y muchas de ellas de carácter zoonótico (Estrada-Peña, 2015).
El impacto económico causado por las garrapatas a la ganadería mundial es enorme, especialmente en los países tropicales y subtropicales. En América Latina, el principal perjuicio es la merma en la producción, debida, al efecto nocivo de los ectoparásitos sobre el bienestar animal y a la anemia producto de la parasitosis de agentes como babesiosis, anaplasmosis o ehrlichiosis, incrementando los costos por manejo sanitario (medicamentos, pérdida de la producción y horas hombre) (Sonenshine et al., 2002; Álvarez, 2010). Así mismo, Gregory et al.(2022) manifiestan que la incidencia de enfermedades transmitidas por garrapatas se ha incrementado drásticamente en las últimas décadas, y que las áreas urbanas se reconocen cada vez más como entornos de alto riesgo de exposición a garrapatas infectadas y destacan que los espacios verdes pueden desempeñar un papel clave para facilitar la invasión de garrapatas, huéspedes y patógenos en áreas residenciales, particularmente donde se conectan los patios residenciales con áreas naturales más grandes (por ejemplo, parques) y que sin embargo, los factores que median la distribución de las garrapatas en paisajes urbanos heterogéneos siguen estando pobremente caracterizados.
El área de bosques secos de la Reserva de Biosfera del Noroeste (RBNO) es considerada como una zona de importancia biológica por ser un ecosistema singular, altamente amenazado y poco conocido, con presencia de especies endémicas y un importante grado de diversidad local y regional en una superficie relativamente reducida. Por estas características, ha sido incluida recientemente en la lista de puntos calientes o hotspots del mundo, junto con los bosques del Chocó colombiano y ecuatoriano y los bosques secos ecuatorianos, conformando el Tumbes-Chocó-Magdalena Hotspot (Mittermeier et al., 2005).
Es conocido que en el interior y exterior de la RBNO la presencia de garrapatas es frecuente por el tipo de manejo que se hace en la RBNO, donde se incluye la crianza de animales domésticos (bovinos, caprinos y ovinos) y la constante presencia de vertebrados silvestres (ungulados silvestres entre otros). Todos ellos pueden jugar un papel importante en el ciclo de vida de algunos de estos artrópodos, que disponen así de una mayor diversidad de hospederos, lo que hace esta dinámica muy compleja.
La posible presencia de garrapatas en la RBNO podría afectar directamente la actividad ganadera, la sobrevivencia de animales silvestres y sobre todo afectar a la salud humana de los ganaderos y pobladores locales y especialmente de los visitantes que realizan actividades de ecoturismo en estas ANP.
La introducción de nuevas especies de garrapatas al ecosistema natural, al igual que la adquisición de nuevas especies de garrapatas por parte del ganado que es traído de otras zonas o regiones del país, puede tener un impacto negativo tanto para la producción local de ganado, así como constituir un riesgo para la vida silvestre impactando en algún grado, en la conservación de algunas especies en estas ANP de la RBNO. Pese a la importancia de estas, hasta la fecha no se tiene un inventario de las especies de garrapatas presentes en las ANP de la RBNO. Esta propuesta plantea como objetivo la identificación, descripción, georreferenciación y distribución de las especies de garrapatas presentes en tres de las cuatro áreas naturales que forman parte de la RBNO del Perú, el Parque Nacional Cerros de Amotape, la Reserva Nacional de Tumbes y el Coto de Caza el Angolo.
METODOLOGÍA
Áreas de estudio. La fase de campo se realizó en 3 de los 4 sectores seleccionados, dentro de la RBNO en Tumbes y Piura (Tablas 1 y 2, Figura 1) siendo clasificadas como áreas naturales protegidas.
Tabla 1 Ubicación geográfica de las áreas de estudio
| Sector | ANP | Ubicación política | Ubicación geográfica | |||
| Departamento | Provincia | Distrito | Latitud (S) | Longitud(W) | ||
| Estación biológica El Caucho | PNCA (zona 1) | Tumbes | Tumbes | Pampas de Hospital | 3°49'25,3195" | 80°15'36,8725" |
| Puesto de control Zapallal | RN Tumbes (zona 2) | Tumbes | Tumbes | Pampas de Hospital | 3°59'39,5853" | 80°20'56,4847" |
| Puesto del control Quebrada Fernández | CCEA (zona 3) | Tumbes y Piura | Contralmirante Villar y Sullana | Casitas y Marcavelica | 4°11'53,3348" | 80°52'44,4948" |
ANP= Área Natural Protegida, RNT=Reserva Nacional de Tumbes, PNCA=Parque Nacional Cerros de Amotape, CCEA=Coto de Caza el Angolo, ZA=Zona de amortiguamiento.
Tabla 2. Sectores muestreados en la Reserva de Biosfera del Noroeste
| Sector | ANP | Lugar de muestreo | Coordenadas Geográficas | |
| Latitud (S) | Longitud(W) | |||
| Estación biológica El Caucho | RNTumbes y PNCA | Quebrada Faical | 3°49'7,217" | 80°15'53,836" |
| Quebrada Caucho | 3°48'55,28" | 80°16'5,453" | ||
| Quebrada Las Pavas | 3°49'31,483" | 80°15'32,385" | ||
| Sendero Campo Verde | 3°49'32,065" | 80°15'26,905" | ||
| Bocana Murciélago | 3°59'14,361" | 80°20'16,817" | ||
| Puesto de control Quebrada Fernández | CCEA y ZA | Rastrojos | 4°11'25,882" | 80°50'46,244" |
| Cerecitos | 4°13'32,785" | 80°50'57,054" | ||
| Macanche | 4°15'16,639" | 80°51'10,399" | ||
| Guabal | 4°14'13,113" | 80°18'6,615" | ||
| Quebrada Caña Dulce | 4°14'46,962" | 80°52'22,942" | ||
| Puesto del control Zapallal | RNTumbes | Quebrada Jardines | 3°56'3,547" | 80°16'39,683" |
| Jurupe | 3°57'37,228" | 80°16'31,593" | ||
| El Huabo | 3°59'20,729" | 80°16'11,981" | ||
| Los Pindos | 3°57'30,117" | 80°16'15,256" | ||
| Ponderosa | 3°56'44,566" | 80°16'41,528" | ||
| Cebollas | 3°58'26,587" | 80°17'56,315" | ||
ANP= Área Natural Protegida, RNT=Reserva Nacional de Tumbes, PNCA=Parque Nacional Cerros de Amotape, CCEA=Coto de Caza el Angolo, ZA=Zona de amortiguamiento.
Figura1 Ubicación geográfica de las áreas en estudio. (1) Parque Nacional Cerros de Amotape, Tumbes y Piura, (2) Zona Reservada de Tumbes, Tumbes (3) Coto de Caza el Angolo, Piura.
Recolecta de garrapatas
Las muestras se recolectaron de quebradas y caminos por donde transita el ganado vacuno realizando transeptos y cubriendo la mayor área posible. Se utilizó muestreo a conveniencia de hospederos silvestres y domésticos (conviven en las ANPs) y en el caso de vegetales se utilizó un muestreo aleatorio.
Tiempo de muestreo
El estudio de soportabilidad se desarrolló en un área de 12023 ha de pastos naturales, correspon-dientes a cinco caseríos. Durante la visita en las tres ANPs, se realizaron muestreos en 16 diferentes transeptos. Se evaluaron tres hectáreas por cada caserío, haciendo un total de quince hectáreas dentro de la zona en estudio. 540 h de muestreo duró la fase de campo; 6 h diarias (4 h por la mañana y 2 h por la tarde). El muestreo se iniciaba a las 8 am y por las horas de sol culminaba a las 12 m. En el caso de transeptos de 20-40 m se realizaron en promedio 2 muestreos por día. Ubicado el ejemplar en el hospedero vertebrado, así como en la vegetación, fue extraído con pinzas y depositado en una solución que contenía alcohol al 75%, glicerina líquida y ácido acético (AGA). Adicionalmente, se realizó la recolecta de ejemplares en pastos o hierbas frecuentados por el ganado, como el pasto “chilena” (Panicum maximun) y otras malezas conocidas como “pata blanca” (Alternanthera halimifolia), “barillero” (Cordia polyantha), “escoba” (Scoparia sp.) “alcahuasa” (Mimosa albida) y “mosquero” (Croto elegans). Al tomar las muestras de los ejemplares, se anotaron las coordenadas geo-referenciadas usando un GPS. Navegador satelital marca Garmin con 12 satélites de ubicación (margen de error satelital de 5-20,0 m en 10 mil metros).
Trabajo de laboratorio
Para la identificación, los ejemplares de garrapatas se extrajeron del medio AGA y depositado en pequeñas placas Petri para su lavado con agua destilada. Posteriormente se les depositó en un portaobjeto para ser observados en el estéreos-copio (Stemi DRC marca Olympus Modelo SZ61), con oculares micrométricos de 16 aumentos con objetivos de 1,6 aumentos con un factor de conversión de 0,50. Con el mismo ocular y un objetivo de 4 aumentos con un factor de conversión de 0,213 se utilizó para medir estructuras o partes muy pequeñas de los ácaros en estudio. Previamente se colocaron dos gotas de solución AGA, luego los ejemplares se hicieron descender al centro del portaobjeto de 3 cavidades, colocando dos en posición dorsal y uno en posición ventral.
Identificación taxonómica de las garrapatas
La fase de identificación de los ejemplares se llevó a cabo en el laboratorio de Entomología de la Escuela de Agronomía, Facultad de Ciencias Agrarias de la Universidad Nacional de Tumbes. Para la identificación taxonómica de las garrapatas a nivel de género, se utilizaron las claves taxonómicas de Dale (1989) y para la identificación preliminar de especies se utilizaron las descripciones taxonómicas de Álvarez (2003). Adicionalmente, algunos ejemplares fueron remitidos al Programa de Investigación en Garrapatas del Servicio Nacional de Salud Animal (SENASA-Costa Rica), para validación y confirmación de los géneros y especies previamente identificadas. Los datos de colecta fueron sometidos a una estadística de tipo descriptiva donde se enfatizó en la distribución de las especies y los porcentajes por localidades muestreadas.
RESULTADOS Y DISCUSIÓN
La Figura 2 muestra los estados de desarrollo recolectados de las 4 principales especies. La Tabla 3 muestra el número de ejemplares y el porcentaje de las especies de garrapatas identificadas para cada una de las ANPs que son parte de la RBNO. Los estados de desarrollo mayormente colectados han sido los de la larva de la especie A. maculatum en la Zona 2 y en la Zona 1, les sigue el estado de ninfa.
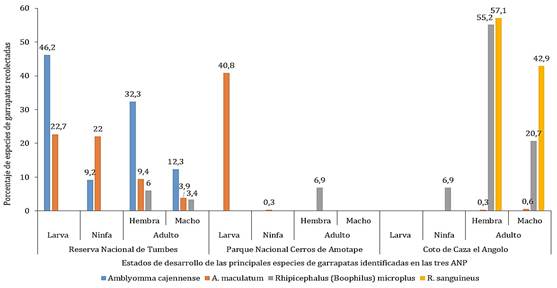
Figura 2. Estados de desarrollo recolectados de las principales especies de garrapatas identificadas en las tres ANP de la RBNO.
Tabla 3. Número de ejemplares y porcentajes por estados de desarrollo recolectados de las especies de garrapatas identificadas en las tres ANPS de la RBNO
| Especie de garrapata | Áreas Naturales Protegidas de la Reserva de Biosfera del Noroeste del Perú | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Zona 2 (RNT) | Zona 1 (PNCA) | Zona 3 (CCEA) | |||||||||||
| Larva | Ninfa | Adulto | Larva | Ninfa | Adulto | Larva | Ninfa | Adulto | Total | ||||
| Hembra | Macho | Hembra | Macho | Hembra | Macho | ||||||||
| Amblyomma cajennense | 30 (46,2%) | 6 (9,2%) | 21 (32,3%) | 8 (12,3%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 65 |
| A. dissimile | 0 | 0 | 7 (63,6%) | 4 (36,4%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 11 |
| A. maculatum | 70 (22,7%) | 68 (22,0%) | 29 (9,4%) | 12 (3,9%) | 126 (40,8%) | 1 (0,3%) | 0 | 0 | 0 | 0 | 1 (0,3%) | 2 (0,6%) | 309 |
| A. testudinis | 0 | 0 | 5 (38,5%) | 8 (61,5%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 13 |
| Haemaphysalis sp. | 0 | 0 | 0 | 0 | 0 | 1 (33,3%) | 1 (33,3%) | 1 (33,3%) | 0 | 0 | 0 | 0 | 3 |
| Rhipicephalus (Boophilus) microplus | 0 | 0 | 2 (6,0%) | 1 (3,4%) | 0 | 0 | 2 (6,9%) | 0 | 0 | 2 (6,9%) | 16 (55,2%) | 6 (20,7%) | 29 |
| R. sanguineus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 16 (57,1%) | 12 (42,9%) | 28 |
Se recolectaron larvas, ninfas y adultos mayor-mente en arbustos y malezas (Tabla 4), siendo las especies dominantes: A. maculatum y A. cajennense; A. maculatum tienen como hospederos alternantes a los vacunos y equinos, mientras que A. cajennense, solamente a vacunos, A. testudinis y A. dissimile a Iguana , Haemaphysalis sp. a humanos, R. microplus a caprinos, vacunos, equinos, caninos y humanos y R. sanguineus a caprinos, vacunos y caninos.
Especies de garrapatas registradas en la RBNO
Amblyomma cajennense (Fabricius) (Figura 3 A, B y C). En la RNT fueron recolectados ejemplares en las plantas A. halimifolia, C. elegans C. polyantha, M. albida, P. maximun, Sida rhombifolia y en vacunos. Beati et al. (2013) reportan esta especie en Bella-vista (Jaén, Cajamarca) en especies no identificadas de Cervidae. Los estudios filogenéticos y taxonó-micas demuestran que A. cajennense se subdivide en seis grupos genéticamente distintos (Ogrze-walska & Pinter (2016), además, que los adultos son encontrados en una gran variedad de huéspedes vertebrados animales, y reportan que en capibaras (Hydrochoerus hydrochaeris Linnaeus, 1766), tapires (Tapirus terrestres Linnaeus), pecaríes (Tayassu sp.) y caballos (Equus caballus Linnaeus) solo sirven como hospederos primarios en su ciclo, igualmente manifiestan que esta especie es capaz de parasitar aves y es probable que la especie sea A. sculptum y no A. cajennense.
Para El Salvador, Navarrete et al. (2014) encontraron A. cajennense en bovinos y equinos. Álvarez & Hernández (2011) para Costa Rica, indican que se han descrito más de 20 especies del género Amblyomma, siendo A. cajennense la más importante por su frecuencia, distribución e implicación en la salud pública, al ser responsable de la transmisión de los agentes causales de las enfermedades del Grupo de las Manchadas o Rickettsiales (Fiebre Manchada de las Montañas Rocosas). Las garrapatas del género Amblyomma se caracterizan por necesitar de tres hospederos para completar su ciclo de vida. Desde huevo hasta adulto, necesitan de tres animales, los cuales pueden ser de diferente especie (conejo, equino y bovino) o de una sola especie, lo que hace muy difícil su control, dándose una mayor incidencia en las áreas de estacionalidad de lluvias (verano e invierno). Acevedo-Gutierrez et al. (2021) destacan que el complejo de garrapatas de A. cajennense es el principal vector de Rickettsia rickettsii en América Central y del Sur.
Amblyomma dissimile Koch (Figura 3 D y E)
De esta especie se recolectaron en la RNT 11 individuos adultos, de ellos tres hembras se encontraron en la planta C. elegans, cuatro hembras y cuatro machos en el reptil Iguana iguana. Esta especie es reportada por Guglielmone & Nava (2005) como ectoparáristo en reptiles (Squamata) y anfibios. Por otro lado, Carrascal et al. (2009) y Krebber et al. (2017) para Colombia han registrado a esta especie sobre Boa constrictor, Bufo marinus, Boa imperatus, Iguana tuberculata, Epicrates cenchria, Callopsis areolata, C. pulcherrima y C. rubida, Ameiva ameiva, Chironius carinatus, Crotalus durissus, Dryadophis sp., I. iguana y Pseudoboa neuwiedii. Navarrete et al. (2013) para El Salvador en garrobo (Ctenosaura similis), iguana (I. iguana), sapo (Rhinella marina), tortuga (Rhinoclemmys pulcherrima), boa (B. constrictor), víbora Castellana (Agkistrodon bilineatus) y víbora cascabel (Crotalus durissus). Scott & Durden (2015) y Scofield et al. (2011) en el Estado de Pará en Brazil sobre Primolius maracana Vieillot (Psittaciformes: Psittacidae).
Tabla 4 Ejemplares por especies de garrapatas identificadas recolectados en arbusto y malezas y hospederos vertebrados en la RBNO
| Especie de garrapata | Arbustos y malezas | Hospederos | Total | |||||
|---|---|---|---|---|---|---|---|---|
| Iguana | Caprinos | Vacunos | Equinos | Caninos | Humanos | |||
| Amblyomma cajennense | 53 | 0 | 0 | 12 | 0 | 0 | 0 | 65 |
| A. dissimile | 3 | 8 | 0 | 0 | 0 | 0 | 0 | 11 |
| A. maculatum | 304 | 0 | 0 | 3 | 2 | 0 | 0 | 309 |
| A. testudinis | 0 | 13 | 0 | 0 | 0 | 0 | 0 | 13 |
| Haemaphysalis sp. | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 3 |
| Rhipicephalus (Boophilus) microplus | 0 | 0 | 3 | 9 | 13 | 2 | 2 | 29 |
| R. sanguineus | 0 | 0 | 2 | 15 | 0 | 11 | 0 | 28 |

Figura 3 A. cajennense: (A) macho, (B) hembra en vista ventral y (C) hembra ovipositando; A. dissimile: (D) hembra y (E) macho; A. maculatum: (F) hembra y (G) macho; A. testudinis: (H) hembra e (I) macho; Haemaphysalis sp. Hembra (J) vista dorsal y (K) vista ventral; R. microplus: (L) hembra y (M) macho; y R. sanguineus: (N) hembra y (Ñ) macho.
Amblyomma maculatum Koch (Figura 3 F y G)
En la RNT se recolectaron larvas, ninfas y adultos hembras y machos en P. maximun y larvas en una maleza no identificada y conocida como frijolillo de campo. En la zona 1 se recolectaron mayormente larvas y una ninfa en P. máximum, también fueron recolectadas dos ninfas en asnos. En la zona 3 en ganado vacuno, se recolectaron una hembra adulta y dos machos. Javier et al. (2011), reportan a esta especie para la ciudad de Bogotá (Colombia) parasitando a caninos en infestaciones del orden del 4,25% una alta tasa por tratarse de animales de compañía, domiciliados, vinculados a planes de atención sanitaria, en una ciudad del trópico americano con altura de 2 640 msnm, donde no se habían descrito antes. Crispell et al. (2016) indican que esta especie cubre un rango geográfico que abarca áreas de la costa del Atlántico este y el Golfo de México dentro de los Estados Unidos y que es un vector del patógeno rickettsial del grupo de la fiebre maculosa, Rickettsia parkeri, que causa la fiebre del boutonneuse americano, una forma similar pero más leve que la fiebre manchada de las Montañas. También es vector de Hepatozoon americanum. Esta especie de garrapata se ha convertido en un modelo para estudiar las interacciones garrapata/Rickettsia (Ribeiro et al., 2023).
Amblyomma testudinis (Conil) (Figura 3 H e I)
En la zona 2 se colectaron la cantidad de 13 adultos de I. iguana, de ellas, cinco fueron hembras y ocho machos. Con relación a esta garrapata, Keirans citado por Guglielmone et al. (2001) sinonimiza esta especie con A. argentinae. Lehman et al. (1971) estudiaron la fototaxis, termotaxis, geotaxis y quimiotaxis de A. argentinae. Posteriormente Guglielmone et al. (2009), consideran el nombre de esta especie como invalido. Los mismos autores citados destacan haber encontrado esta especie en áreas de las provincias del Chaco y del Monte en Argentina y como hospederos a Chelonoides chilensis, B. constrictor occidentalis, Eunectes notaus, Crotalus terrificus, especies de los géneros Bothrops y Phrynops y también sobre especies de anfibios del género Bufo.
Haemaphysalis sp. (Figura 3 J y K)
De este género de especie aún no identificada, se recolectaron de personas en la zona 1, una ninfa, un adulto hembra y un macho. Al respecto, Bermúdez (2016) reporta para Panamá en tierras bajas a Haemaphysalis juxtakocchi parasitando tapires, Jing-Jing et al. (2016), en Malasia realizaron estudios de este género, de la comunidad bacteriana de garrapatas en perros, gatos y pollos en dos aldeas locales indígenas, habiéndoseles implicado como vectores potenciales de enfermedades para los seres humanos y animales en todo el mundo. Según Kang et al., (2016) y Khoo et al., (2016) varias bacterias patógenas han sido previamente detectadas en garrapatas Haemaphysalis, incluidas los agentes de la enfermedad para la fiebre moteada rickettsial, tifus de garrapatas, anaplasmosis y ehrlichiosis. Ilia - Rochlin et al. (2023) reportan que, desde su descubrimiento en los Estados Unidos en 2017, la garrapata Haemaphysalis longicornis se ha detectado en la mayoría de los estados del este entre Rhode Island y Georgia.
Rhipicephalus (Boophilus) microplus (Canestri-ni) (Figura 3 L y M)
En la zona 3 se colectaron dos ninfas y 11 adultos (ocho hembras y tres machos) en caballos, seis adultos en vacunos (cuatro hembras y 2 machos), 3 adultos en caprinos (dos hembras y 1 macho) y dos hembras adultas en caninos. En la zona 1, en personas se encontraron dos hembras. En la zona 2 en vacunos, se colectaron dos hembras y un macho.
Navarrete et al. (2014) para El Salvador, la han encontrado parasitando a bovinos (Bos taurus), canino (Canis familiaris), equino (E. caballus), venado (Odocoileus virginianus), caprino (Capra hircus) y humano. En Argentina, se indica que es una garrapata introducida y específica de los bovinos, a los cuales infesta severamente y transmite enfermedades como la babesiosis, causando importantes pérdidas a la producción ganadera y daños indirectos ocasionados por la transmisión de tres agentes etiológicos: B. bovis, B. bigemina y Anaplasma marginale (Domínguez-García et al., 2010).
Para Panamá, Bermúdez (2016) manifiesta que esta especie es investigada por provocar serios daños a la industria ganadera. En Cuba, Rodríguez & Suarez (2013) destacan que el bovino es el hospedero principal, y que es un parásito que ocasiona considerables pérdidas en la explotación ganadera, de forma directa, por la succión de sangre, el deterioro de los cueros, y de forma indirecta, como transmisor de agentes causantes de hemoparásitosis (como babesisiosis, anaplas-mosis y theileriosis), que provocan enfermedad e incluso pueden causar la muerte a los animales.
Guerrero et al. (2014) indican que es una plaga parásita del ganado obligada que ha establecido poblaciones en todas las regiones tropicales y subtropicales del mundo es responsable de importantes pérdidas económicas para los productores de ganado. Valencia et al. (2017), en estudios realizados en la meseta de Popayan en Colombia, destacan que la prevalencia de garrapatas fue de 79,5%; de ellas, 99,6% eran R. microplus y solamente el 0,4% correspondía a la especie Dermancentor nitens. Así mismo, encontraron que la mayoría de los bovinos (58%) presentaron una infestación media y alta.
Nava et al. (2022) hacen referencia que R. microplus está restringido por las bajas temperaturas en otoño e invierno que inhiben el desarrollo de sus huevos, pero la introducción de ganado infestado con esta garrapata desde principios de primavera hasta finales de verano en áreas de zonas templadas podría producir hembras grávidas que pondrían huevos y que originarían larvas viables desde fines de la primavera hasta el invierno.
Rhipicephalus sanguineus (Latreille) (Figura 3 N y Ñ).
Se recolectaron en la zona 3, la cantidad de 32 adultos (18 hembras y 14 machos) y se extrajeron de canes (ocho hembras y tres machos), de vacunos (8 hembras y 11 machos) y de caprinos (dos hembras). Esta especie, es conocida como garrapata marrón del perro, representa una amenaza para la salud pública en todas las etapas de desarrollo como vector de Ehrlichia canis (erliquiosis), Babesia canis (babesiosis) y Hapatozoon canis (hepatozoonosis), que causan enfermedades que afectan a un gran número de perros en todo el mundo (Dantas-Torres, 2010; Dantas-Torres & Otranto, 2015).
Además, este parásito transmite varias bacterias, como Rickettsia spp. (Ferreira-Borges et al., 2007). En Brasil, R. sanguineus s.l. se informó que estaba infectado con R. parkeri, otro agente etiológico de la fiebre maculosa brasileña (BSF), la enfermedad de la fiebre manchada (Coutinho et al., 2005; Dantas-Torres et al., 2006; Cunha et al., 2009; Abrego et al. 2010; Álvarez, 2012; Bermúdez, 2016; Moerbeck et al., 2016; Barbosa-Silva et al., 2017).
Del mismo modo Bohrer et al. (2016) hacen notar que los adultos también pueden alimentarse de humanos y muchos otros mamíferos, como cabras, ovejas, ganado, caballos, carnívoros salvajes, gatos, liebres y erizos; garrapatas pre-adultas se han encontrado en musarañas y muchos roedores
CONCLUSIONS
De acuerdo con los resultados obtenidos en el presente estudio, se han registrado las especies Amblyomma cajennense, A. maculatum, A. dissimile y A. testundinis, Haemaphysalis sp., Rhipicephalus boophilus microplus y R. sanguineus, destacando que cinco de ellas se encuentran en la RNT y en las otras áreas naturales protegidas. Algunas de estas especies son de importancia económica, por las pérdidas asociadas a costos directos en la producción y su naturaleza vectorial, transmitiendo enfermedades tanto a animales de producción y mascotas o/y afectando la salud pública.
El tipo de explotación ganadera dentro de las áreas naturales implica un riesgo sanitario para la explotación misma, al igual que un impacto económico negativo por el mayor costo en el manejo parasitario profiláctico en estas producciones. A lo anterior se suma el riesgo de introducción, dentro de la población nativa de vertebrados, de nuevas especies de artrópodos, que podrían tener consecuencias graves en relación con la conservación y bienestar animal.
Con la finalidad de tener una mayor exactitud respecto a la identificación de las especies presentes en la RBNO, se recomienda hacer uso del ADN “barcoding” mediante el análisis del gen citocromo oxidasa I (COI) e igualmente realizar estudios sobre la biología y métodos de control de las especies más importantes que conlleven a plantear estrategias adecuadas para el control de estas bajo un esquema de manejo integrado.












 uBio
uBio 


