INTRODUCCIÓN
En Nigeria, Costa de Marfil, Guinea, Camerún, Italia, Brasil, Perú, entre otros países, se ha detectado la presencia del 93% de Ocratoxina A [OTA] en granos de cacao demostrando que, los organismos generadores de esta toxina están presentes desde la cosecha, siendo la etapa de fermentación donde proliferan en mayor cantidad hongos filamentosos, debido a la sobrefermentación (144 h) (Copetti et al., 2010; Manda et al., 2009; Ramos et al., 2016; Teixeira de Magalhães et al., 2011; Almeida et al., 2020). En Ecuador, se encontró presencia del 14% de OTA en muestras de cacao en concentraciones hasta 5,53 µg/kg (Toaza, 2012). Los granos de cacao contaminados por hongos filamentosos (es decir, Aspergillus, Penicillium y Fusarium) (Serra et al., 2019) inciden en la presencia de OTA causando efectos nefrotóxicos, inmunosupresores, carcino-génicos y teratogénicos afectando la salud del ser humano (Malir et al., 2013; Ravelo et al., 2011) e importantes pérdidas económicas (Wang et al., 2022). Los hongos productores de OTA en granos de cacao son los géneros A. niger y A. carbonarius de quienes se ha reportado la incidencia de OTA en un 96,6% en chocolates artesanales expendidos en Cuenca-Ecuador debido al deficiente manejo postcosecha (Bonilla, 2013; IARC & WHO, 1993; Wang et al., 2023). La presencia de micotoxinas en chocolates es un problema de seguridad alimentaria, que en mercados europeos es de estricto control, y afecta la exportación del cacao ecuatoriano.
Se ha demostrado que, la aplicación de microorganismos antagonistas es una opción más económica y se prevé como una alternativa sostenible (Putri et al., 2023) para el control biológico de OTA. En particular, las especies de Bacillus más prevalentes, incluidas B. subtilis y B. licheniformis, están clasificadas por la FDA de los EE. UU. y se consideran seguras (Ghazaei, 2023). Además, han sido ampliamente estudiadas como agente de control biológico (Chowdhury et al., 2015; Fan et al., 2017), por mantener su viabilidad cuando se almacenan durante largos períodos. B. subtilis es capaz de reducir el 90% del contenido de OTA en granos de cacao fermentados y secos (Kadjo et al., 2023). También, ha demostrado inhibir los niveles de hongo Trichoderma sp en plantas de cacao (Putri et al., 2023) y reducir micotoxinas acumuladas en las semillas de maíz por Fusarium moniliforme (Bhushan et al., 2013; Figueiredo et al., 2010; He et al., 2019; Muzaifa et al., 2019), asimismo, se demostró que B. licheniformis inhibe el crecimiento de Aspergillus y degrada la aflatoxina B1 (AFB1) y OTA de manera eficiente (Derya et al., 2019; Sukkasem et al., 2018). Las cepas de Bacillus spp producen una amplia variedad de antibióticos (bacitracinas, bacilinas, bacilomicinas B y tirocidinas), sustancias y enzimas (celulasas, glucanasas, proteasas y quitinasas), que inhiben el crecimiento de fitopatógenos afectando la germinación de las esporas y degradando su pared celular (Caulier et al., 2019; Y. He et al., 2019; Li et al., 2023).
Dado el éxito antagonista de cepas bacterianas contra el crecimiento de Aspergillus spp, hipotéticamente planteamos que cepas de Bacillus spp serán efectivas contra el crecimiento de hongos productores de OTA quienes afectan al cacao. Para confirmar la hipótesis planteada, el objetivo del presente trabajo fue controlar el crecimiento de hongos productores de OTA aislados de la fermentación del cacao mediante la aplicación de Bacillus spp en condiciones in vitro.
MATERIAL Y MÉTODOS
Aislamiento de microorganismos
Se aislaron seis cepas bacterianas del género Bacillus del suelo y materia orgánica en descomposición; las cepas fueron identificadas y conservadas en 20% glicerol y -20 °C (Florido et al., 2017). Las cepas bacterianas reconocidas fueron B. subtilis 50BP, 20BP, E-54, 31BMC y 21BMC y B. licheniformis E-44. Se utilizó Caldo Nutriente (CN) para la verificación de la pureza y refrescamiento de las cepas de Bacillus spp. Los medios se prepararon de acuerdo con las indicaciones del fabricante (Titan Biotech, India), añadiendo agua destilada a la cantidad recomendada del medio deshidratado, y autoclavado a 15 psi durante 15 min.
Se obtuvieron aislados fúngicos de los géneros Aspergillus spp y Penicillium sp, provenientes de cuatro centros de acopio de cacao de la ciudad de Calceta (Manabí, Ecuador). El aislamiento de los aislados fúngicos se realizó de forma directa, mediante la técnica de cámara húmeda (Cajiao, 2017). Se acondicionaron recipientes plásticos con papel absorbente esterilizado humedecido con agua destilada estéril. Para seguidamente, colocar granos de cacao con un peso promedio de 1,2 g. La cantidad de granos de cacao colocados fueron de 20 a 25 granos por cada cámara húmeda. La incubación en estas cámaras fue a 37 °C durante ocho días.
Luego, de los granos que presentaban un notable crecimiento fúngico, se tomó una pequeña porción de este tejido y se colocó en medio de cultivo Papa Dextrosa Agar (PDA). Este procedimiento se repitió para las muestras de cuatro centros de acopio de cacao ubicados en la ciudad de Calceta.
Identificación morfológica
La identificación macroscópica de las cepas de hongos se efectuó mediante las características de las colonias de los hongos en las cajas Petri. Las características observadas fueron: forma de la colonia, crecimiento, color y textura. La identificación microscópica se realizó preparando láminas semipermanentes, colocando una gota de azul de lactofenol (Fisher, USA) en el centro de un portaobjeto previamente esterilizado según la metodología descrita por (NTP, 1988). Luego, empleando un asa de platino se colectó un pequeño fragmento de los tejidos miceliares de los hongos y se transfirió al portaobjeto con la gota de azul de lactofenol. Después, se colocó un cubreobjeto sobre la muestra para su observación en microscopio de luz (Olympus, Japón).
Para la identificación del género fúngico, se utilizaron claves de identificación y literatura pertinente, para cada espécimen estudiado (Seifert et al., 2011).
Ensayo de antagonismo
Los aislados fúngicos se sembraron previamente en medio PDA y se incubaron durante ocho días a 37 °C. Por otro lado, las cepas bacterianas se sembraron en Caldo Nutriente durante 24 horas, en condiciones de agitación en incubadora a 150 rpm y temperatura de 30 °C. Posteriormente, se agregaron 100 y 200 µL del cultivo bacteriano en placas de 90 x 16 mm mediante diseminación con espátula Drigalsky y se dejó secar durante 15 min.
Seguidamente, se depositó un disco de 5 mm cortado con un sorbete plástico previamente esterilizado, de cada cepa fúngica crecida, en el centro de la placa con medio de cultivo PDA. Las placas se incubaron a 30 °C y como testigo se empleó el hongo sembrado sin la cepa bacteriana. Las evaluaciones se realizaron transcurridos tres días. El experimento se realizó empleando un diseño completamente al azar [DCA] con arreglo factorial a*b, con 12 tratamientos y 5 repeticiones. En la Tabla 1, se detallan los niveles de cada factor.
Tabla 1 Niveles de los factores
| Factor a | Factor b |
| a1: B. subtilis 21BMC | |
| a2: B. subtilis 20BP | b1: 100 µL |
| a3: B. subtilis E-54 | b2: 200 µL |
| a4: B. subtilis BP-50 | |
| a5: B. subtilis 31BMC | |
| a6: B. licheniformis E-44 |
El diámetro del crecimiento del hongo se midió con un calibrador Vernier donde se tomaron dos medidas de distancia de crecimiento micelial. Esta medición, se realizó de forma horizontal y vertical, tomando en cuenta que la caja Petri es redonda. Se marcaron dos puntos: uno que representó el lado horizontal y el otro el lado vertical; estos dos datos se promediaron y se obtuvo el resultado en longitud (mm) para luego representarlo en porcentaje de inhibición aplicando la ecuación aplicada por (Bharose & Gajera, 2018; Ramos et al., 2016).
% inhibición= 100 - (DMCT * 100) /DMST (1)
Donde,
• DMCT= Distancia de crecimiento micelial con tratamiento antagonista.
• DMST= Distancia de crecimiento micelial sin tratamiento antagonista.
Se realizó la prueba no paramétrica Kruskal Wallis al 0,05 de significancia de las mediciones del porcentaje de inhibición. El procesamiento de datos se realizó utilizando el software estadístico Infostat versión 2018.
RESULTADOS Y DISCUSIÓN
Crecimiento fúngico en cacao
De la etapa de fermentación del cacao, se aislaron 20 aislados fúngicos que correspondieron a los géneros Aspergillus y Penicillium. Sus caracterís-ticas morfológicas macroscópicas y microscópicas más notables son resumidas en la Tabla 2, en concordancia con lo estudiado por (Samson et al., 2014; Seifert et al., 2011).
Antagonismo in vitro
La Figura 1 describe la eficiencia de las cepas de Bacillus spp con respecto al porcentaje de inhibi-ción de los aislados fúngicos. La cepa de B. subtilis 31BMC controló significamente (α = 0,0265) a la cepa fúngica CF1.1(1) de Aspergillus spp, inhibiendo su crecimiento en un 74,43%. La bacteria B. licheniformis E-44 controló significati-vamente (α = 0,0074) a la cepa fúngica CH1.2(2) de Penicillium sp en un porcentaje de inhibición de 76,96%. Las dosis de 100 y 200 µL de Bacillus spp no mostraron diferencias significativas (α > 0,05) sobre los aislados fúngicos de Aspergillus spp y Penicillium sp.
Tabla 2 Características morfológicas macroscópicas y microscópicas de muestras de hongos
| Código de muestra identificada | Características macroscópicas | Características microscópicas |
| CF1.1(1) CE1.1(1) | Colonias irregulares algodonosas de crecimiento rápido, de color verde con bordes blanco y textura algodonosa elevada. | Conidióforos lisos, vesículas globosas, sobre la vesícula se observaron la formación de métulas, formación de fiálides y abundantes conidios formados sobre los fiálides y presencia de conidios alrededor. |
| CE1.2(1) | Colonia de rápido crecimiento, color negro, con textura algodonosa. | Conidióforo liso, conidio globoso ligeramente rugoso de color negro y presencia de conidios a su alrededor. |
| CH1.2(2) | Colonia circular de crecimiento rápido, de color gris verde olivo con bordes blancos y textura densa cremosa. | Conidióforo liso con ramificaciones, métulas formadas sobre las ramificaciones de los conidióforos, fiálides formadas sobres las métulas y microconidios simples formados en las métulas y presencia de conidios alrededor. |
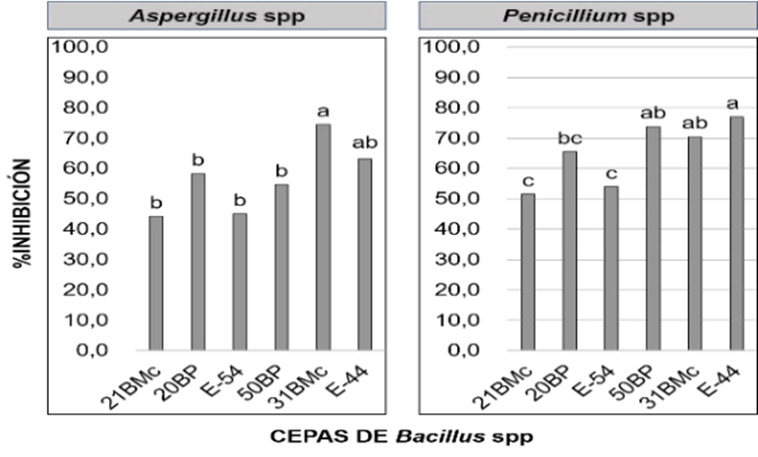
Figura 1 Porcentaje de inhibición de los aislados fúngicos CF1.1(1) y CE1.1(1) de Aspergillus spp y CH1.2(2) de Penicillium sp expuestas por las seis cepas de Bacillus spp en medio PDA ajustado a pH 7. Las letras diferentes (a y b) entre columnas indican diferencias significativas para Kruskall Wallis (α ≤ 0,05).
La Figura 2 describe la interacción entre las cepas de Bacillus spp y las dosis de aplicación (100 y 200 µL) sobre el porcentaje de inhibición de los aislados fúngicos de Aspergillus spp y Penicillium sp. La cepa de B. subtilis 31BMC con dosis de 100 y 200 µL controló significativamente (α=0,0093) a la cepa fúngica de CF1.1(1) de Aspergillus spp, inhibiendo su crecimiento en un 74,43% y la cepa de B. licheniformis E-44 con dosis de 200 µL controló significativamente (α=0,0239) a la cepa fúngica de CH1.2(2) de Penicillium sp, en un porcentaje de inhibición de 81,52%.
La interacción entre las cepas de Bacillus spp y dosis de 100 y 200 µL no tuvieron diferencias significativas (α > 0,05) sobre el control de los aislados fúngicos de Aspergillus spp CE1.1(1) y CE1.2(1). Los aislados fúngicos no inhibidos poseen una estructura celular rígida compuesta por polisacáridos y proteínas; entre los polisacáridos destacan la quitina (10-20%) y glucano (65-90%). Las proteínas están asociadas a polisacáridos formando glicoproteínas (20-30%) (Astorga et al., 2014; Pontón, 2008).
Se ha demostrado que las cepas de Bacillus spp reducen entre un 22-73% el crecimiento de Aspergillus flavus después de siete días de incubación (Palumbo et al., 2006). Además, B. licheniformis disminuyó el 98% de maíz contami-nado con ZEA (zearalenona), inhibió el crecimiento de Aspergillus, degradó la aflatoxina B1 (AFB1) y la OTA de manera eficiente (He et al., 2018b; Yi et al., 2011).
Los experimentos in vitro dieron como resultado una inhibición significativa del crecimiento fúngico (Figura 3). Estos resultados se deben a que las cepas de B. subtilis tienen la capacidad de producir enzimas hidrolíticas que ocasionan actividades de degradación en la pared de la quitina de los hongos (Sadfi et al., 2002), las enzimas que ocasionan este fenómeno son las quitinasas, β-1,3-glucanasa y las proteasas (Li et al., 2016). Las cepas de B. licheniformis exhiben actividad antifúngica y presentan la producción de forlantibiótico y 2,3-butanediol (Sukkasem et al., 2018).
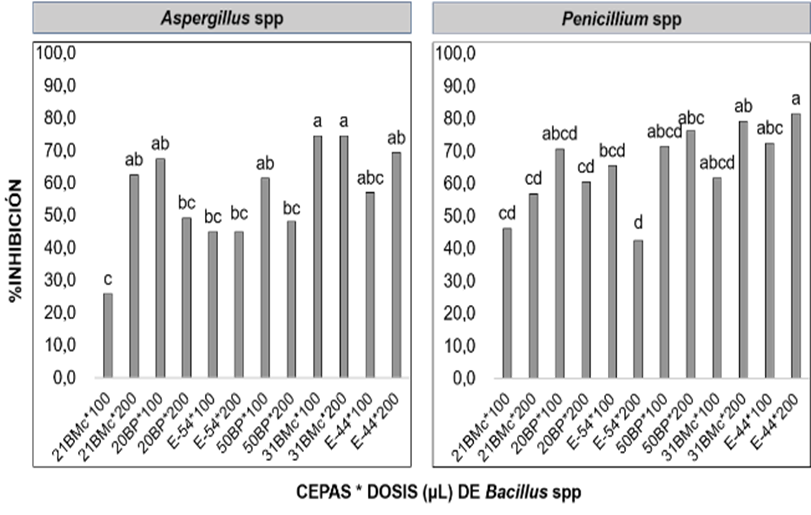
Figura 2 Porcentaje de inhibición de los aislados fúngicos CF1.1(1) y CE1.1(1) de Aspergillus spp y la cepa CH1.2(2) de Penicillium sp. expuestas por las seis cepas*dosis (µL) de Bacillus spp en medio PDA ajustado a pH 7. Las letras diferentes (a y b) entre columnas del %inhibición indican diferencias significativas para Kruskall Wallis (α ≤ 0,05).
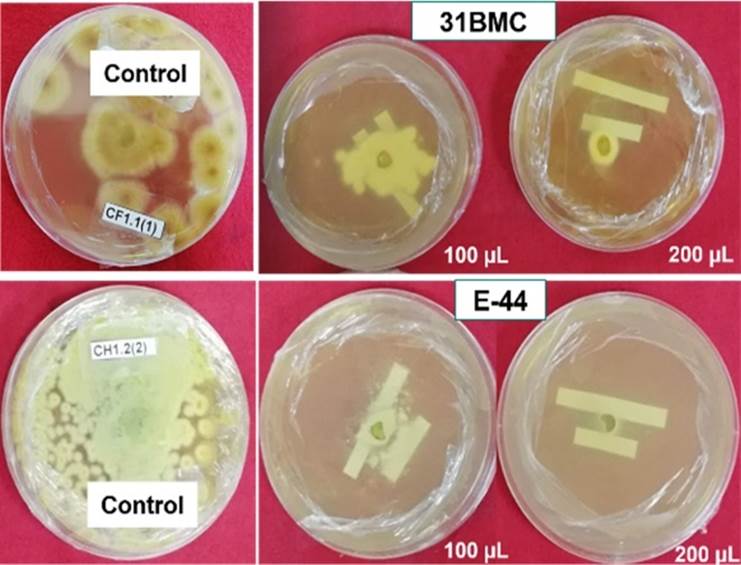
Figura 3 Actividades antifúngicas de B. subtilis 31BMC y B. licheniformis E-44 contra hongos productores de OTA CF1.1(1) y CH1.2(2). Los aislados fúngicos del lado izquierdo no estuvieron expuestas a cultivos bacterianos, mientras que, del lado derecho, mostraron una inhibición significativa del crecimiento. Los hongos estuvieron expuestos a cultivo bacteriano de Bacillus spp con dosis de 100 y 200 µL. Estas imágenes fueron tomadas el día 3 del experimento (después de sellar las placas).
En efecto, el compuesto antifúngico que exhibe las cepas de Bacillus spp pertenecen al grupo iturina de los antibióticos, que interactúan con los esteroles de la membrana citoplásmica de los hongos (Chitarra et al., 2003) y con los compuestos lipopéptidos cíclicos de las familias surfactina y fenginina (Cawoy et al., 2015).
Tabla 3 Inhibición de cepas de Bacillus spp. sobre hongos filamentosos
| Bacillus spp. sobre hongos filamentosos asociados al proceso de fermentación del cacao | Bacillus spp. sobre hongos filamentosos en estudios previos |
|---|---|
| B. subtilis controló el crecimiento de Aspergillus spp. en un 74,43% B. licheniformis inhibió en un 81,52% de Penicillium spp. | Cepas de B. subtilis AF1 suprimió el 90% de A. niger (Podile y Prakash, 1996). B. subtilis causaron inhibición del 30% al 70% en el crecimiento fúngico de P. digitacum (Leelasuphakul, Hemmanee y Chuenchitt, 2008). Bacillus sp. redujo en un rango entre 76-95% el crecimiento micelial de A. westerdijkiae (Einloft et al., 2017). B. subtilis y B. amyloliquefaciens pudieron suprimir el crecimiento de A. parasiticus (hasta un 92%) y la producción de aflatoxinas (hasta un 100%) (Siahmoshteh et al., 2018). B. licheniformis bajo condiciones in vitro controló el crecimiento de P. verrucosum MC12 en un 53% (UI, 2019). Bacillus subtilis CW14 y sus componentes sobrenadantes de fermentación (Mw < 3 kDa, 3-10 kDa y > 10 kDa) tuvieron la capacidad de inhibir el crecimiento de A. ochraceus y la tasa antifúngica de CW14 alcanzó el 85,7 % (Zhao et al., 2022). B. subtilis Ctpx S2-1 tuvo mayor efecto de inhibición en el crecimiento de P. crustosum¸ en un 38,13% (Palacios, 2021). |
CONCLUSIONES
Las características morfológicas de los aislados fúngicos obtenidos de los granos de cacao indican que pertenecen a Aspergillus spp y Penicillium sp. Las cepas bacterianas más efectivas en el control in vitro de los hongos productores de OTA fueron, B. subtilis 31BMC y B. licheniformis E-44, las cuales tienen efecto de inhibición del 74,43 y 81,52% en su orden, sobre los aislados CF1.1(1) y CH1.2(2) de Aspergillus y Penicillium sp. respectivamente. Bacillus spp demostró ser efectivo en la inhibición de hongos productores de OTA. Es por ello que, es necesario que se realicen más investigaciones sobre el uso de estas cepas bacterianas como agentes de control biológico.












 uBio
uBio 


