INTRODUCCIÓN
Oreochromis niloticus es una de las especies de peces de agua dulce más populares en la acuicultura mundial y una fuente de alimento animal. Está ampliamente distribuida en varios países del mundo, así mismo, posee varias características que lo hacen adecuada para la acuicultura, que incluye tasas de crecimiento rápido, tolerancia a las condiciones ambientales y resistencia al estrés inducido por la manipulación; hábitos alimentarios omnívoros; resistencia a enfermedades, conversión alimenticia eficiente y buena aceptación por parte de los consumidores. Sin embargo, se sabe que la tilapia se reproduce excesivamente en los sistemas de cultivo, lo que provoca un retraso en el crecimiento y tamaños pequeños en el momento de la cosecha, que se vuelven no comercializables. Para superar este problema se han empleado varios métodos para producir poblaciones de tilapia mono sexo macho para cultivo (Migiro y Nyakwama, 2021).
Los machos crecen aproximadamente dos veces más rápido que las hembras. Por tanto, es necesario invertir el sexo de las hembras. Esto es posible porque la tilapia se diferencia sexualmente durante varios días después de la absorción del saco vitelino. El desarrollo de técnicas hormonales de reversión del sexo en la década de 1970 fue un gran avance que permitió elevar las poblaciones masculinas monosexuales hasta alcanzar tamaños uniformes y comercializables. Entre las hormonas más utilizadas para la reversión sexual tenemos a 17 α metiltestosterona (MT), ya que es una hormona que es comúnmente utilizada en el cultivo de tilapia, que es una especie gonocorística, para la obtención de una población monosexual de machos para evitar la reproducción durante el engorde haciendo que el cultivo sea comercialmente más lucrativo. Las larvas se recolectan y reciben experimentalmente MT en el alimento. Los eventos fisiológicos de la diferenciación sexual y el momento en que ocurrió la reversión sexual promovida por la MT se documentan mediante el uso de métodos histológicos y morfométricos (Campos et al, 2023).
Uno de los temas aún persistentes al lograr que la proporción sexual sea 100% machos, es que algunos autores indican que la supervivencia puede verse afectada por la MT (Chakraborty et al. en Migiro & Nyakwama (2021), la reducción de la tasa de crecimiento al inicio de madurez sexual y reproducción precoz, que conduce a tamaños indeseables de producción de peces pequeños, lleva a producir semillas masculinas monosexuales que es la mejor solución a este problema. La energía metabólica en los machos se usa para el crecimiento somático, mientras que, en las hembras, grandes porciones de energía metabólica se usan con fines reproductivos (Sarker et al., 2022).
El presente trabajo tiene como objetivos determinar la proporción sexual, así como obtener los parámetros de producción en ejemplares de Oreochromis niloticus, cultivados en un sistema de cultivo intensivo.
MATERIAL Y MÉTODOS
El estudio fue realizado en las instalaciones del Módulo Piscícola La Balsa, ubicado en el caserío Puerto Internacional La Balsa, distrito de Namballe, Provincia de San Ignacio, Departamento de Cajamarca (Figura 1), geográficamente está ubicado a 4°58’53’’N y 79°6’5’’W
Selección y características de los organismos para la reversión sexual
Para la obtención de las larvas, primero se seleccionaron a los mejores especímenes adultos de Oreochromis niloticus para la reproducción, 20 días después, se realizó el drenaje del estanque, los progenitores fueron extraídos y separados por sexo sometiéndolos a un periodo de descanso en diferentes estanques, al mismo tiempo se extrajeron las larvas con un carcal (colector de mano) de 0,28 mm de tamaño de malla, éstas, fueron colocadas en recipientes de plástico, donde se las mantuvo, mientras se colocó una regla de 50 mm en la base del recipiente, para separar a las larvas que presentaron un rango de longitud de 5 a 11 mm.
Finalmente, se realizó el conteo de larvas a través de la técnica del conteo individual, esta técnica consistió en extraer con un pequeño colador de plástico una muestra de larvas, la que fue vaciada en un recipiente con agua y se procedió a contar el número de especímenes presentes, las larvas restantes fueron extraídas considerando el mismo volumen del colador empleado inicialmente para estimar el número de larvas producidas.
Las larvas fueron trasladadas a una hapa (jaula) de 4,42 m2 a razón de 203 larvas/m2, allí permane-cieron con un flujo continuo de agua proveniente de la quebrada “El Mango” durante un periodo de 28 días, diariamente se contó el número de peces muertos, para obtener el porcentaje de mortalidad (%M):
%M=(PM/N) x 100 (1)
Donde PM: Número de Peces muertos; N: Total de Peces sembrados inicialmente.
La tasa de supervivencia (%S) se calculó de la siguiente forma:
%S= 100 - %M (2)
Así mismo, se realizaron muestreos biométricos a los 10, 20 y 28 días de tratamiento, para obtener un promedio en longitud total (cm) utilizando un ictiómetro, graduado en mm (Medida Max. 500 mm) y el peso total (g) utilizando una balanza digital modelo SFE-2000 (Capacidad Max. 2000 g x 0,1 g).
Selección del esteroide, dosis y tiempo de aplicación
En la alimentación se les suministró alimento con 45% de proteína, el que fue mezclado con la hormona 17-α-metil-testosterona (MT), la cual fue la responsable de estimular las gónadas del pez. Primero, se preparó la solución madre, la cual constó de 6 gr. de la hormona disuelta en 1000 ml de alcohol etílico al 95%, de esta manera, la solución madre tuvo una concentración de 4 mg de MT/ml de solución. Luego, con una pipeta, se extrajo 20 ml de la solución madre y fue mezclado con 500 ml alcohol etílico al 95%, por otro lado, se pesó 1 kg de alimento, el cual fue cernido previamente para eliminar impurezas o grumos y colocado en un recipiente de plástico y se mezcló con la nueva solución.
De manera manual, fueron mezclados el alimento y la solución, durante 10 a 15 minutos hasta obtener una masa uniforme. Luego, se extendió todo el alimento sobre una superficie de plástico y se le dejó secar durante 24 horas, para que se evapore el alcohol. El alimento se mantuvo en un lugar fresco y sin entrada de luz solar.
Finalmente, la dosis del alimento hormonado constó de 24 mg de MT/kg de alimento, el método empleado para suministrar el alimento a las larvas fue por vía oral, durante 28 días de tratamiento, con 6 raciones diarias (20 g/ración) cada dos horas.
Diferenciación sexual
Para la determinación de sexo, se sacrificó al 100% de los ejemplares muestreados, se colocaron las tilapias en anestésico para evitar el sufrimiento de los mismos. Posteriormente, se procedió a realizar un corte a través de la zona ventral para dejar libre la extracción de las gónadas con la ayuda de pinzas, se colocaron en el portaobjeto, y de ellas se obtuvieron secciones transversales, las que fueron teñidas con azul de metileno al 3%, luego se procedió al aplastado con el cubreobjeto a manera de presión de forma cuidadosa (técnica de squash), luego fueron evaluadas en microscopio Compuesto Binocular Olympus CX21FS1, para su observación, se realizó un barrido de ambas gónadas para evaluar la presencia de ovocitos o de tejido granular (testículos), teniendo en cuenta que, si se determinaba un tejido uniforme sin células redondeadas visibles corresponderían a un macho, si se observaban, células grandes, redondas y si todo el tejido presentaba oogonias corresponde-rían a una hembra. Las capturas fotográficas fueron realizadas con un teléfono celular modelo Huawei Y7 2018.
Las observaciones macroscópicas consistieron en observar el color y tamaño de las gónadas, así como la identificación del dimorfismo sexual.
Proporción sexual
El día 110 del cultivo se tomó una muestra de 105 individuos alimentados con la hormona MT, correspondientes al 10% de la población total. La proporción de machos y hembras fue calculada mediante la regla de Tres Simple Directa, en el programa Excel.
Parámetros de producción:
Se tomaron medidas de Peso (g), Longitud (cm) y Biomasa (g) al inicio (0 días), durante (10 y 28 días) y postratamiento (90 y 110 días), obteniendo el incremento de los mismos, con la variación de días, Así mismos, se realizó la comparación de medias, máximos y mínimos a través de la prueba de estadística al 95% de confianza, con el grafico de cajón con bigotes (H&H).
RESULTADOS Y DISCUSIÓN
Proporción sexual:
La proporción de machos resultó en 95,2 % (Tabla 1). Trejo et al. (2021), trabajaron con tilapia del Nilo, utilizando la hormona masculinizante 17α metiltestosterona, variando la cantidad de días de tratamiento (10, 15, 20 y 25 días), por lo cual, reportaron una proporción de machos más alta en todos los grupos que recibieron el esteroide, en comparación con la proporción de machos sin masculinizar (50% de machos), estas proporciones oscilaron entre 97 y 100% de efectividad de la hormona. Así mismo, Maroto (2019), indica que el efecto de la reversión sexual de la hormona 17 alfa metiltestosterona, fue de 99% de efectividad, indicando que la hormona MT es muy efectiva en este tipo de tratamientos, alcanzando en la presente investigación un porcentaje considerable (95,2%). De Alba et al. (2023) señalan que un choque térmico (36 °C) en alevinos criados con un régimen de temperatura ambiental, aumentó la proporción de machos sin necesidad de emplear ninguna hormona.
Vista microscópica
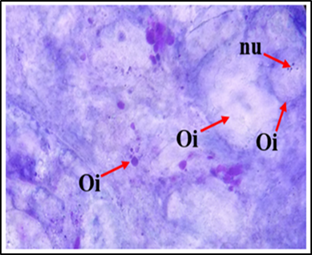
Las gónadas de las hembras mostraron los oocitos en diferentes etapas de desarrollo (Figura 2) desde oocitos inmaduros u “oocitos primarios” y los oocitos maduros u óvulos, asimismo, se observan los núcleos y los nucleolos de los oocitos, la capa folicular está visible en los oocitos en desarrollo y los óvulos.

Figura 2 Vista microscópica de células femeninas con tinción de Azul de Metileno. Oi: Oocito Inmaduro, Om: Oocito maduro, Nu: Núcleo, nu: nucleolo, TC: Tejido Conectivo, CF: Capa Folicular. (40X).
Las células femeninas en diferentes grados de desarrollo se caracterizan porque se tiñen más intensamente con azul de metileno en las fases iniciales, pueden verse los núcleos y los nucleolos (Figura 3).
En las gónadas de machos se observan los lóbulos que sostienen a las células masculinas (esperma-tocitos) (Figura 4).
Asimismo, en el tejido testicular se observaron células masculinas (espermatocitos) en diferentes fases de desarrollo (Figura 5).

Figura 5 Vista microscópica de células masculinas. Ec1: Espermatocitos en Primera fase, Ec2: Espermatocitos en Segunda fase (40X).
En las gónadas intersexo, pueden verse células femeninas (Figura 6) presentes en el tejido testi-cular. Estos oocitos están en estadíos primarios.

Figura 6 Vista microscópica de células femeninas y masculinas. Oi: Oocito Inmaduro, Ec: Espermatocitos. (40X)
Vega (2021) en la masculinización de alevinos de tilapia del nilo (Oreochromis niloticus) con la hormona de 17 alfa metiltestosterona reportó que en la observación de las gónadas se apreció la diferencia entre los tejidos de gónadas masculina, femenina e intersexo, en las gónadas masculinas se observaron los lóbulos testiculares con diferentes grados de desarrollo, en las gónadas de las hembras se visualizaron oocitos y en gónadas intersexo la presencia de oocitos distribuidas entre el tejido testicular. En los resultados obtenidos las gónadas de las hembras mostraron los oocitos en diferentes etapas de desarrollo desde oocitos inmaduros o “oocitos primarios” y los oocitos maduros u óvulos, asimismo, se observan los núcleos y los nucleolos de los oocitos, la capa folicular está visible en los oocitos en desarrollo y los óvulos. En las gónadas masculinas se observan los lóbulos que sostienen a las células masculinas (espermatocitos), en diferente fase de desarrollo. En las gónadas intersexo, pueden verse células femeninas presentes en el tejido testicular, estos oocitos están en estadios primarios, por el contrario, Jensi et al. (2016) no encontraron intersexo. De Alba et al. (2023) analizan los tejidos gonadales con la técnica Hematoxilina-eosina a través de un procesador de tejidos, a diferencia de este trabajo en el que se emplea el azul de metileno, mostrando una opción accesible para cualquier investigador. En la Libertad se encontró intersexo en Lebiasina bimaculata “charcoca” de aguas continentales de la provincia de Trujillo, una especie silvestre, se empleó H-E y en ejemplares de 3 cm y menos se observaron células germinales (Tresierra et al., 2002) en algunos ejemplares y en otros oogonias en tejido testicular.
Vista macroscópica
Para determinar la proporción sexual se realizó sexaje visual (Figura 7) al día 110 del cultivo de 100 alevinos del tratamiento mediante la observación directa en las papilas genitales, reportándose que el 2% de la muestra tenían características morfológicas correspondiente a un espécimen hembra, sin embargo, al momento de la disección y mediante el análisis microscópico, se encontraron células masculinas y femeninas.
Maroto (2019) menciona que él porcentaje de reversión de los alevines de tilapias, en dosis superiores a los 60 mg de hormona 17 alfa metiltestosterona por kg de pienso son capaces de producir una población de 100% peces machos. Asi mismo, Sarker et al. (2022) evidencias que con la dosis de 60 mg de 17α-MT por kg es la dosis más eficaz para producir tilapia macho monosexual de calidad (O. niloticus) e indicaron que la hormona 17α-MT mejora el rendimiento del crecimiento de la tilapia. El mayor número de machos se obtuvo con la dosis de 60 mg junto con el mayor peso y longitud. A su vez, Singh (2018) obtuvo que con una dosis más alta (70 mg/kg de alimento) de hormona se obtiene un porcentaje relativamente menor de peces machos, por lo que indica que la dosis óptima para obtener la población máxima masculina (100%) de tilapia en 50 y 60 mg TM/kg de alimento durante 30 días, por ello indica que, a menor dosis, podría generar una mayor proporción de población masculina y mejor crecimiento, sin embargo, esto no concuerda con la presente investigación, ya que la dosis utilizada ha sido de 24 mg/kg de alimento, obteniéndose resultados muy elevados de los esperados, indicando que se podría continuar con la investigación para encontrar la dosis adecuada.
Parámetros productivos
En cuanto a los parámetros productivos se evaluaron Peso total (g) y Longitud total (cm) (Tabla 2). La sobrevivencia fue determinada en dos etapas: Durante el tratamiento, que fue en su etapa larval siendo 76,7% de supervivencia, y Postratamiento, que se realizó al momento de separar la muestra del 10%, la cual presentó una supervivencia 96,33% (Tabla 3).
Tabla 2 Parámetrosproductivos de Oreochromis niloticus durante y después del tratamiento con la hormona masculinizante 17-Αlfa-Metil-Testosterona (MT)
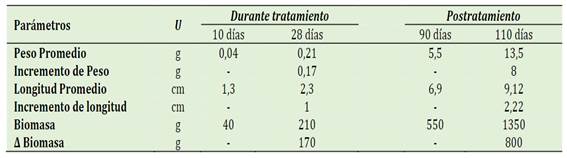
Tabla 3 Sobrevivenciade Oreochromis niloticus durante y después del tratamiento con la hormona masculinizante 17-Αlfa-Metil-Testosterona (MT)

Los alevinos de Tilapia inician su alimentación más o menos a los 3 días después de haber absorbido todo el saco vitelino, en ese momento aún no han desarrollado sus gónadas, es en ese momento, donde actúa el proceso de reversión sexual, es por ello que se considera suministrarles la hormona cuando tienen una longitud menor a 12 mm de LT, ya que, a una longitud superior, el tratamiento no tendría efecto, debido a que podrían tener el sexo definido. Sin embargo, Trejo et al. (2021), recomiendan que los alevines deben tener un tamaño menor a 10 mm antes de iniciar el proceso de masculinización, para asegurar porcentajes cercanos al 100%, y alimentarlos por 12 horas para mejorar la asimilación del esteroide.
A los 10 días de haber iniciado el tratamiento (Figura 8) el valor promedio de la longitud está más cerca del valor mínimo, indicando baja presencia de ejemplares grandes y finalizando el suministro de la hormona, es decir, a los 28 días del tratamiento con MT el valor medio está más cerca del valor máximo, mostrando menor frecuencia de ejemplares pequeños. Por otro lado, en la fase de postratamiento, a los 90 días (Figura 9) se observa una distribución casi simétrica y a los 110 días, aumenta la dispersión en la zona de ejemplares de mayor talla, expresando que hay pocos ejemplares grandes.

Figura 8 Diagramas de cajón de bigotes (Hubbs y Hubbs) que relacionan el desarrollo de máximos y mínimos de la longitud total (cm) a los 10, 20 y 28 dias de tratamiento. Ejes X: Días de Tratamiento. Ejes Y: Longitud (cm).

Figura 9 Diagramas de cajón de bigotes (Hubbs y Hubbs) que relacionan el desarrollo de máximos y mínimos de la longitud total (cm) a los 90 y 110 dias después del tratamiento. Ejes X: Días de Tratamiento. Ejes Y: Longitud (cm).
Hernández-Barraza et al. (2021) encontraron un 85% de supervivencia y Vega (2018), indica que la obtuvo una supervivencia promedio del 50%, recalcando que la mayor mortalidad en las unidades experimentales se observó a partir de la segunda semana y tercera semana siendo baja en la primera y última semana, contrastando con los resultados, se observó una mortalidad en las primeras semanas de vida. cuando los ejemplares estaban en la fase larval con un 23,3% de mortalidad, sin embargo, al pasar a la etapa de alevinaje, este se redujo al 3,67%.
Perera & Bhujel (2021) reportan que cuando se emplea la vitamina C como suplemento alimentario se observa una mejora en los valores de supervivencia, crecimiento y otros parámetros, lo que indica que hay aún mucho por investigar en esta especie.
Al realizar los cortes transversales en las gónadas sexuales y teñirlas con azul de metileno al 3%, se obtuvieron excelentes resultados al lograr observar la intersexualidad de la especie en estudio. Tresierra et al. (2002), indican que los estudios histológicos son actualmente una opción valiosa para validar las escalas de madurez sexual, así como para observar los cambios estructurales de los ovarios y los testículos. Palma & Arana (1996), indican que existen especies en las que coloración de la morfología externa de las gónadas no permiten diferenciar las células sexuales, ya que es muy similar en ambos sexos, por ello, la mejor opción es la observación microscópica de las gónadas, en las cuales se emplean tinciones que permiten observar diferencias importantes entre los sexos, tanto en la consistencia del tejido, como en la coloración de los frotis gonadales. En un estudio realizado con azul de metileno y hematoxilina-eosina, reporta que, los mejores resultados se obtuvieron en los frotis teñidos con azul de metileno.
CONCLUSIONES
Las células femeninas (oocitos maduros e inma-duros) y células masculinas (espermatocitos) estu-vieron presentes en diferentes fases de desarrollo; asimismo, se observaron especímenes intersexo. Macroscópicamente, el 2% de ejemplares mostraron características externas de ejemplares hembras.
En el tiempo de cultivo, presentaron una supervi-vencia de 76,7% en la etapa larval y un 96,33% en la etapa de alevín, así mismo, presenta un incremento de peso de 13,46 g y de longitud de 7,82 cm.
La hormona 17-Αlfa-Metil-Testosterona influyó en la sexualización de los ejemplares de tilapia, sin presentarse una disminución en la tasa de supervivencia, lo que beneficia a los acuicultores.
Se debe estudiar variar los niveles concentración hormonal para obtener una población cercana al 100% de machos, sin causar sobredosis que pueda traer problemas nocivos a los ecosistemas acuáticos.












 uBio
uBio