INTRODUCCIÓN
El banano orgánico, es un producto de gran demanda a nivel mundial por sus propiedades nutricionales y exquisito sabor (Reay, 2019; Manrique et al., 2021). Perú, con aproximadamente el 3% de la producción mundial de banano orgánico (Criollo et al., 2020), es uno de los principales proveedores de este producto al mercado estadounidense (Machovina & Feeley, 2013). Cuenta con 15000 hectáreas dedicadas a este cultivo; 12800 hectáreas están ubicadas en el Departamento de Piura, principalmente en la provincia de Sullana, seguido de Lambayeque, Tumbes y La Libertad (Minagri, 2019). El número total de productores dedicados a la producción de banano orgánico con altos estándares de calidad es de aproximadamente 9500 y la variedad de exportación es Cavendish Valery (Minagri, 2020). Perú inició sus exportaciones de banano orgánico a partir del año 2000, el aumento en sus exporta-ciones ha tenido un ascenso importante en los últimos años. De hecho, Perú se encuentra entre los principales productores exportadores de banano orgánico, con exportaciones de 221266 136 kg (US$ 152342846), siendo Europa, Estados Unidos y Asia los principales mercados (Minagri, 2020). Así, la región Piura se establece como el productor más importante en Perú, ubicándose dentro de los mayores proveedores a nivel mundial. En el 2020 certificó 121 423 toneladas de banano para Europa, Norteamérica y Asia sustentando más 9000 hectáreas de banano orgánico (Midagri, 2021). Sin embargo, la producción de banano orgánico, desde el 2010 se ve reducida por el daño conocido como la “Mancha Roja” (Arias et al., 2020), la presencia de este daño se manifiesta por lesiones en la epidermis de los frutos, inflorescencias y en hijuelos (Altabtabaee et al., 2016). Se observan manchas ovaladas de color café rojizo en la cáscara de la fruta (Bisane et al., 2018, Santosh et al., 2017) llegando a agrietarse en casos muy severos, lo que permite una invasión secundaria de fitopatógenos (Bisane et al., 2018) como: pudrición blanda causa-da por Pectobacterium chrysanthemi (Aguilar-Anccota et al., 2021). Este daño presenta alta incidencia en banano, reduciendo la productividad en campo, ocasionando el descarte de la fruta para exportación y paralizando el corte de la fruta en sectores con alta incidencia, lo que produce pérdidas económicas para los pequeños produc-tores, su rechazo en la cadena de valor y la subsecuente pérdida de la asociación de productores al incumplir los compromisos asumidos por la disminución en los volúmenes de exportación.
En el Perú, se ha calculado que esta plaga provoca un descarte del 70%, durante en la etapa de empacado. En un principio, este daño se reportaba durante la estación seca, en los meses de agosto a septiembre; sin embargo, actualmente se presenta durante todo el año con diferentes grados de severidad (Moscoso, 2020). Creemos que la mejor manera de afrontar este problema es mediante un Manejo Integrado de Plagas, por lo que es importante conocer primero cuál es el insecto plaga que ocasiona el daño o si se trata de un complejo; la información obtenida permitirá desarrollar estudios y generar un plan de control para reducir la “Mancha Roja” en el cultivo de banano. Por lo mencionado anteriormente se tiene como objetivo identificar taxonómicamente a la especie de thrips causante del daño conocido como “Mancha Roja” en banano en el Valle del Chira.
METODOLOGÍA
Recolección
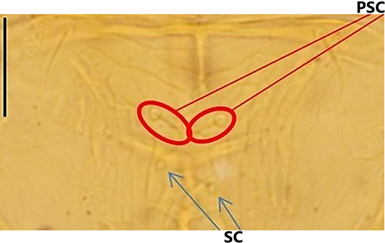
La colección de especímenes de thrips se realizó en Piura, Sullana, distritos de Querecotillo (Latitud: 4°50’17’’S y Longitud: 80°38’53’’W), Salitral
(Latitud: 4°51’40’’S y Longitud: 80°41’02’’W) y el centro poblado de Huangalá (Latitud 4°50’27’’ S y Longitud 80°36’07’’W) (Figura 1).

Figura 1 Ubicación de las zonas de captura de thrips (encerrados de color rojo), tanto de especímenes vivos para ensayos de laboratorio, y muertos en solución AGA para su preservación y posterior identificación taxonómica.
La fase de laboratorio se realizó en Laboratorio de Entomología de la Facultad de Agronomía de la Universidad Nacional de Piura.
Por el daño conocido como “Mancha Roja” que presenta tanto en hijuelos, pseudotallos y racimas (Bisane et al., 2017; Orellana, 2007; Padmanaban & Mani, 2020; Patil et al., 2015); se realizaron capturas en estas zonas específicas del cultivo. Se encontraron especies de thrips diferentes en la cucula y la racima de banano, se reportan a un complejo de insectos como los causantes de la “Mancha Roja”; para descartar tal idea se diseñó el ensayo de alimentación. Se recolectaron especí-menes vivos de thrips encontrados en racima con ayuda de un pincel cero previamente humedecido y puestos en frascos con su etiqueta (Mound & Pitkin, 1972).
En pseudotallo e hijuelos, se realizaron capturas en áreas donde se había producido el daño de veteado de “Mancha Roja” (McGuire & Northfield, 2021), como se aprecia en la Figura 2B y 2C, de forma manual utilizando un pincel húmedo fino. Se tomaron los thrips y se introdujeron en los tubos de captura. Se empleó la solución AGA (Alcohol etílico al 60%, glicerina y ácido acético en la proporción 6:1:1 respectivamente) (Mound & Pitkin, 1972) como conservante para colocar los especímenes de thrips muertos previo a realizar en laboratorio los montajes microscópicos, para su identificación taxómica.
Prueba de alimentación
Dedos limpios de banano, previamente desinfecta-dos, de la última semana de desarrollo fueron amarrados entre sí con una madeja para colgarlos por el pedúnculo en un frasco (de 25 cm de altura y de 24,5 cm de diámetro mayor y 19,6 de diámetro menor) con flujo constante de aire, suspendidos en posición vertical. Se introdujeron los thrips de los especímenes en estudio colectados (estos especí-menes se capturaron vivos empleando el mismo método con el que fueron introducidos en las manillas del ensayo de alimentación), en campo, con un pincel fino N° 0 humedecido previamente. Se dejó que pongan sus ovoposiciones y nazca la nueva generación, se tomó en cuenta una manilla de banano como control para el ensayo. El espécimen que causó una mancha en la cáscara, del banano, de aspecto oxidado característico de color rojo oscuro a café oscuro en los dedos de banano se identificó como el thrips causante de “Mancha Roja” (Bisane et al., 2018; Padmanaban & Mani, 2022: Poorani & Thanigairaj, 2019).
Identificación taxonómica
Para el examen al microscopio se procedió a macerar, deshidratar y montar en bálsamo de Canadá los especímenes en estudio; Mound & Kibby (1998) proporciona una exposición deta-llada de esta metodología. Para la identificación de las especies de thrips mediante el examen morfológico se utilizaron especímenes adultos, tomando en cuenta las claves descritas por Palmer et al. (1989), Goldarazena (1996), Mound & Marullo (1996).

Figura 2 A) Chaetanaphothrips signipennis (Bagnall) Hembra (parte superior) y macho (parte inferior) escala de barra = 500 µm = 0,5 mm, B) Daño producido por C. signipennis (Bagnall) en forma de vetas rojizas típicas ovaladas provocadas por alimentación desde hijuelos, C) Daño en pseudotallo, donde se encontraron adultos y ninfas, D) Daño entre bananos de racima por oviposición y alimentación.
RESULTADOS Y DISCUSIÓN
Prueba de alimentación
Durante el periodo de alimentación se identificó que una de las especies introducidas fue el thrips del género Frankliniella parvula, tanto adultos como ninfas, los que después de 2 semanas terminaron muriendo. Kuniyoshi (2013), en campos de banano, encontró a esta especie en la inflorescencia y Barreto et al. (2022), reportan que en frutos tiernos de banano colocan sus huevos. Esta especie, se encuentra en la planta hasta que la inflorescencia es cortada. Al no tener acceso a este alimento en los frascos murieron. Solo quedó la especie que causó el daño entre dedos conocido como “Mancha Roja”, al que identificamos como Chaetanaphothrips signipennis (Bagnall) (De López, 2019; Mound et al., 2022). Esto confirma que el daño no era causado por un complejo como se informan en la literatura local (Vilela et al., 2007), sino que es causado, en el caso del Valle del Chira, por esta especie.
Identificación
Palmer et al. (1989) informan que las especies de Chaetanaphothrips sp. son de colores claros con algunas zonas oscuras; principalmente sobre las alas. Los adultos de C. signipennis (Bagnall) exhiben una tonalidad parda dorado a crema (Figuras 2A, 3A y 3B) y en las alas se aprecian franjas transversales de color negro. La hembra es más grande que el macho, es decir, esta especie presenta dimorfismo sexual y su identificación taxonómica resulta un tanto difícil en vista de su tamaño pequeño (1,4 - 1,7 mm) y su parecido con otras especies amarillas o predominantemente amarillas de Chaetanaphothrips sp. (Orellana, 2007). Estas características son las mismas que fueron observadas por Valladolid et al. (2020) para Chaetanaphothrips signipennis.

Figura 3 Chaetanaphothrips signipennis presenta dimor-fismo sexual, la hembra es más grande que el macho A). Hembra B). Macho escala de barra = 500 µm = 0,5 mm.
Palmer et al. (1989) mencionan que C. signipennis tiene 8 segmentos antenales, Mound & Marullo (1996) refieren que los segmentos III y IV tienen sensores delgados y bifurcados, características que se aprecian en la antena de la especie en estudio, como se observa en las figuras 4A, 4B y 4C. Estas características son las mismas que observaron Valladolid et al. (2020) para Chaetanaphothrips signipennis.

Figura 4 Características morfológicas de Chaetana-phothrips signipennis. Antena A) vista ventral (barra: 100 µm), B) Vista dorsal del III segmento antenal con conos sensoriales bifurcados (CSB), C) Vista ventral del IV segmento antenal con conos sensoriales bifurcados (CSB) (barra: 10 μm).
Palmer et al. (1989) encuentran que C. signipennis presenta setas ocelares en el par I, a diferencia de C. orchidii. La Figura 5A presenta la cabeza de la especie en estudio, donde se aprecian las características antes mencionadas.
Entre tanto, Palmer et al. (1989) indica que C. signipennis presenta en el Pronotum un par de setas posteroangulares internas largas y setas posteroangulares externas discales como se observa en la figura 5B, el Pronotum de la especie en estudio presenta la característica reportada por Palmer para esta especie.

Figura 5 A) Cabeza con 3 pares de setas ocelares, (barra: 50 μm); SO p I: Seta ocelar par I, SO p II: Seta ocelar par II, SO p III: Seta ocelar par III dentro del triángulo ocelar, 4 SPO: 4 Setas postocelares, B) Pronoto SPAIM: Setas posteroangulares internas mayores (barra = 50 μm).
Mound & Marullo (1996) mencionan que el ala anterior es de color marrón pálido con bandas cruzadas en la base y en el medio. Se observa esta coloración en la especie en estudio (Figura 6). También indican con respecto al ala anterior, que la primera vena tiene tres setas sobre la media distal, mientras que la segunda vena presenta tres a cuatro setas. En la figura 6 se presenta una fotografía del ala anterior de la especie en estudio mostrando las setas de la primera vena marcadas de color amarillo y las setas de la segunda vena marcadas de color celeste, apreciando el rasgo característico mencionado anteriormente.

Figura 6 Ala anterior: Primera y segunda vena con setas distales, primera vena con 3 setas sobre la media distal y segunda vena con 4 setas (escala de barra: 30 μm).
Mound & Marullo (1996) y Palmer et al. (1989), mencionan que C. signipennis en el Metanotum presenta reticulación débil, setas medias pequeñas y ubicadas detrás del margen anterior. En la figura 7 se pueden observar las setas medias (marcadas de color rojo) ubicadas en el Pronotum además de apreciar las Sensilas campaniformes (señaladas de color azul) debajo de las setas medias.
Goldarazena (1996) informa que las hembras adultas de Thripinae generalmente no presentan áreas glandulares en los esternitos a diferencia de los machos, en los que son muy comunes. Además, en el caso de las hembras de C. signipennis presentan áreas glandulares pequeñas y trans-versales en el esternito III. Mound & Marullo (1996) mencionan que los machos de C. signipennis presentan áreas glandulares en los tergitos III a VII y que tanto los machos como las hembras no presentan setas discales en el esternito II. En la Figura 8 se aprecia la característica del esternito II y III en hembra de la especie en estudio, se observa el esternito II sin setas discales y área glandular en el esternito III de la hembra, de forma similar informa Sakimura (1975). En la Figura 9 se puede observar la zona de los esternitos II a VII de un macho de la especie en estudio; se observa presencia de las áreas glandulares en los esternitos III a VII del macho de la especie en estudio tal como lo reporta la literatura para C. signipennis.

Figura 8 AG, EIII: Esternito III de una hembra de la especie en estudio con área glandular, también se aprecie el esternito II sin setas discales. (barra: 100 μm)
Goldarazena (1996) reporta que las especies del género Chaetanaphothrips sp. presenta un área de escultura muy característica que se prolonga anteromedialmente a cada espiráculo en el tergito VIII, también Valladolid et al. (2020) observaron esta característica particular en Chaetanaphothrips signipennis. En otros thrípidos esta área no se observa en esta posición. Palmer et al. (1989) menciona además que en el tergito VIII el peine posteromarginal está representado por solo unas microtrichias o microvellosidades laterales, a esta estructura se le conoce como peine postero-marginal incompleto. En la Fgura 10 se observa las características antes mencionadas.

Figura 10 Tergito abdominal VIII vista ventral con PPMI: peine posteroangular incompleto de una hembra E: Espiráculo, ZE: Zona de escultura que rodea el espiráculo. (barra: 50 μm).
Una característica interesante que reportan Palmer et al. (1989) es que las hembras de la familia Thripidae tienen ovipositor aserrado dirigido hacia abajo, tal como se visualiza en la figura 11A de la especie en estudio. Mound & Marullo (1996), informan que C. signipennis presenta un par de setas gruesas en forma de espinas en el tergito IX y ubicadas detrás de estas estructuras presenta algunos tubérculos pequeños, estas estructuras están presentes en la especie en estudio como observamos en la Figura 11B.

Figura 11 A) Tergito VIII: Ovipositor aserrado (OA) dirigido hacia abajo (barra: 100 μm) L. B); Tergito IX con un par de setas gruesas (PSG) a manera de espinas y ubicadas tras estas estructuras algunos tubérculos pequeños (barra: 100 μm).
La especie en estudio se encontró haciendo daño en la racima y en el pseudotallo, de la misma manera reporta Orellana (2007) “[en] Chaetanaphothrips orchidii […] el daño es más evidente en la fruta, aunque en el caso de Chaetanaphothrips signipennis por alimentarse también en pseudotallo de hijos de 1 a 1.5 m de altura, provocan unas vetas rojizas típicas ovaladas (Figura 2B), que se van oscureciendo hasta convertirse en manchas rojizas típicas” (Figura 2C). En vista de que la especie C. orchidii no causa daño en pseudotallo, el perjuicio encontrado en esta parte de la planta es un dato que nos acerca más a la confirmación de la identificación de la especie en estudio (Hara et al., 2002); Iesa (2021) también reportó este daño característico para banano ocasionado por Chaetanaphothrips signipennis. Hara et al. (2002), a través de un estudio de biología de la especie C. orchidii, reportaron que no se observaron machos de esta especie, dado que se reproducen partenogenéticamente, tal como informa Orellana (2007). Teniendo en cuenta esto, la especie que encontramos en campo se reproduce sexualmente, como reportan Bisane et al. (2018) y como se puede apreciar en las figuras 2A, 3A, 3B, 11A y 11B, dato que nos ayuda a descartar a la especie C. orchidii como propuesta para la especie en estudio (Hara et al., 2002).
C. signipennis (Bagnall) llega a la inflorescencia por el raquis hasta alcanzar la bellota por la abertura que se forma cuando empieza a abrir (Arias et al., 2020), es aquí donde causa el daño entre los dedos de la racima (Figura 2D); provocado por la oviposición de las hembras de los especímenes adultos y la alimentación de las ninfas, después de emerger de sus huevos, raspando la epidermis de los frutos que se tornan de color rojiza debido a la oxidación del látex que emerge de las heridas, afectando la calidad de la fruta (Barreto et al., 2021; García-Rodríguez et al., 2014; Reyes et al., 2020; 2021a ), la cual es rechazada durante el proceso de selección del clúster para la exportación (Bisane et al., 2018). Cuando la fruta de banano afectada madura la mancha se extiende reduciendo su calidad. Por lo anterior se entiende que son las ninfas las que producen mayormente el daño, lo cual coincide con lo señalado por Bisane et al. (2018). Cuando las frutas son atacadas, el valor comercial se reduce, aunque la calidad de fruta no es afectada; sin embargo, los frutos dañados no sirven para la exportación (Bisane et al., 2018).
Durante el estudio de C. signnipenis en campo se observó que prefieren alojarse en el falso tallo de hijuelos, área de inserción de las hojas de la planta y en el tercio superior del pseudotallo. Esta especie se oculta a la presencia de luz, en las capas internas del pseudotallo, debido a su naturaleza lucífuga (Paredes, 2021).
Esta especie es cosmopolita geográficamente, debido a su gran capacidad para adaptarse a diversas zonas, ecosistemas y climas. Debido a esto su distribución es amplia y fue reportado en un gran número de países como: Australia, Brasil, China, Costa Rica, Fiji, Guatemala, Honduras, India, Indonesia, Jamaica, Malasia, México, Panamá, República Dominicana, Taiwán, Trinidad, Tobago, Sri Lanka y Surinam. En los EE. UU de Norteamérica también están presentes en Florida y Hawái; en Perú y Ecuador (Hara, 2002; Denmark & Osborne, 1985).
CONCLUSIONES
Según las características descritas por Palmer et al. (1989), Goldarazena (1996), Mound & Marullo (1996) para Chaetanaphothrips signipennis; se concluye que la especie en estudio es C. signipennis (Bagnall), es la única especie responsable del daño conocido como “Mancha Roja” en el cultivo de banano y no se trata de un complejo como informa la literatura local.












 uBio
uBio