INTRODUCCIÓN
El banano Musa spp. L. pertenece a la familia-Musaceae y al orden-Zingiberales, y es originario del Sudeste de Asia desarrollándose en regiones tropicales y subtropicales en más de 150 países en el mundo (Galecio-Julca et al., 2020; Aguilar Anccota et al., 2021a; Ayres, 2022). Este fruto tiene un gran valor nutricional por su alto contenido de hidratos de carbono y sales minerales como Mg, Fe y Zn; así como, K, vitaminas A, B1, B2, B6 y C (Souza et al., 2017; Cândido et al., 2022).
El 2021, se han reportado una producción mundial de 124,9 Millones de toneladas (Mt), siendo la India el principal productor con 32 (Mt), seguido de China (11,6 Mtn), Indonesia (8 Mtn), Brasil (6,7 Mtn), Ecuador (6,4 Mtn) (FAO, 2023). Este cultivo tiene gran importancia económica y social en países en desarrollo como: Perú, Ecuador, Colombia y Brasil (Donato et al., 2021).
El Perú se desarrollan alrededor de 160 mil hectáreas (mha) entre bananos y plátanos, el 70% de la produc-ción nacional se centra en la región amazónica. El 93% de la producción de banano orgánico, se centra en la región Piura con 9,5 mil hectáreas (mha) y un rendimiento de 13,9 t/ha seguido de Tumbes (1 214,60 ha), Lambayeque (3150 ha) y La Libertad (192,93 ha) (DRAT, 2021; MINAGRI, 2020, Rafael et al., 2022). Este cultivo permite generar bolsas de empleo y beneficios monetarios a los pequeños agricultores. En Piura, el “Valle del Chira” es la principal zona productora de banano orgánico, la cual le otorga las condiciones agro climáticas adecuadas que requiere el cultivo para su desarrollo, como una temperatura media de 26-28 °C, humedad relativa 70%-80%, (Matos et al., 2019: Távara, 2020).
Los principales mercados de destino son: Países Bajos con 30% de participación; Panamá con 20% y los Estados Unidos con 14% (AGROPERU, 2022). No obstante, frente a esta perspectiva positiva, el cultivo presenta importantes enfermedades como: la necrosis en los haces vasculares del pseudotallo causados por los patógenos: Fusarium oxysporum, F. verticillioides y F. solani (Aguilar-Anccota et al., 2021a) y la pudrición blanda causada por baterías patogénicas: Pectobacterium chrysanthemi y P. carotovorum subsp. Carotovorum (Aguilar-Anccota et al., 2021b); sin embargo, en la etapa de postcosecha se presenta una enfermedad de suma importancia económica en la comercialización del fruto como es la pudrición de la corona en el racimo de banano causada por un complejo de hongos como: “Colletotrichum musae, Lasiodiplodia theobromae, Thielaviopsis paradoxa, y Fusarium verticillioides” (Aguilar et al., 2013; Chero, 2020). La pudrición de la corona afecta la calidad del fruto limitando de esta manera su aceptación por parte del consumidor, y su comercialización; ya que el producto no es exhibido en los supermercados de destino, causando impor-tantes pérdidas económicas tanto a los agricultores como a los comercializadores (Chero, 2020; Kumah et al., 2020). Al ser un producto orgánico, se ve limitado y prohibido el uso de agroquímicos (fungicida). En investigaciones realizadas por Dias et al. (2022) y Hou et al. (2020), reportan el uso de extractos vegetales y aceites esenciales obtenidos a partir de plantas los cuales inhiben la germinación de las conidias y el desarrollo micelial del patógeno, reduciendo de esta manera la severidad del patógeno en frutos de post cosecha atacados con C. lindemuthianum. Por otro parte, los productos de origen vegetal no causan un impacto negativo en el medio ambiente, salud humana y en la salud de la planta y en el suelo. Por lo cual, se propuso realizar esta investigación cuyos objetivos son: evaluar la eficacia in vitro e in vivo de los biofungicidas comerciales frente a T. paradoxa y C. musae, patógenos relacionados con la pudrición de la corona en frutos de banano orgánico.
METODOLOGÍA
Lugar de ejecución
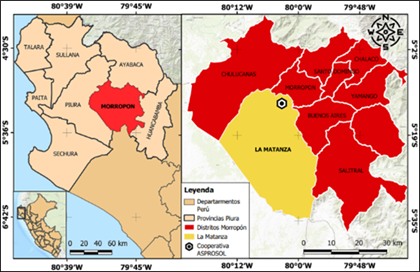
 La fase In vitro del ensayo se efectuó en el “laboratorio de Fitopatología del departamento de Sanidad Vegetal, Facultad de Agronomía de la Universidad Nacional de Piura-UNP” con latitud 5°10′ 49.14″S y longitud 80°37′ 5.84″W. La fase In vivo en frutos se llevó a cabo en la Cooperativa ASPROSOL-Asociación de Productores Orgánicos Solidarios Manuel Bruno Suarez, distrito de La Matanza, Provincia de Morropón; situada geográficamente entre las coordenadas 5° 12’ 23” de latitud sur y 80° 14’59” latitud oeste (Figura 1).
La fase In vitro del ensayo se efectuó en el “laboratorio de Fitopatología del departamento de Sanidad Vegetal, Facultad de Agronomía de la Universidad Nacional de Piura-UNP” con latitud 5°10′ 49.14″S y longitud 80°37′ 5.84″W. La fase In vivo en frutos se llevó a cabo en la Cooperativa ASPROSOL-Asociación de Productores Orgánicos Solidarios Manuel Bruno Suarez, distrito de La Matanza, Provincia de Morropón; situada geográficamente entre las coordenadas 5° 12’ 23” de latitud sur y 80° 14’59” latitud oeste (Figura 1).
Ensayo in vitro de biofungicidas
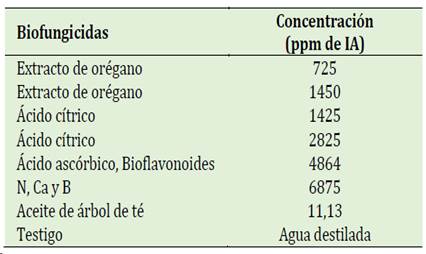
Se usó la técnica del “medio envenenado” (French & Hebert 1980) para evaluar la eficacia in vitro de los biofungicidas. Se preparó para cada tratamiento erlenmeyers conteniendo 100 ml de medio PDA (papa dextrosa agar) a punto de plaqueo (50 °C) homo-genizando la mezcla con su respectivo tratamiento (Tabla 1). Una vez solidificado el medio, se sembró un disco de agar de 0,6 mm de diámetro colonizado con micelio del patógeno. Los patógenos del estudio son: Thielaviopsis paradoxa y Colletotrichum musae fueron proveídas por la Micoteca del “Laboratorio de Fitopatología de la Facultad de Agronomía”, UNP. Se realizaron 4 repeticiones (1 repetición = 1 placa) por cada dosis de trabajo. Se empleó un testigo para cada patógeno sembrado en su respectiva placa de petri conteniendo PDA sin los biofungicidas, incubándose a 25 °C ± 1° durante 5 a 8 días (Pasiche, 2018). La eficacia de control de los patógenos se evaluó mediante la inhibición del crecimiento (PIC) micelial del hongo empleando la fórmula: PIC = ((C-T)/C)* 100%, donde T (crecimiento micelial del patógeno por tratamiento) y C (crecimiento micelial del testigo).
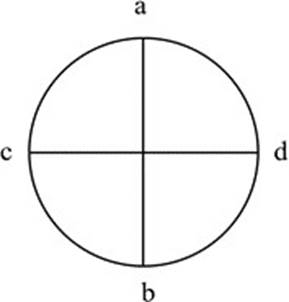
Para las evaluaciones, en cada placa se trazaron dos líneas perpendiculares, registrándose el crecimiento micelial en dos lados (a-b y c-d) (Figura 2). Se hicieron mediciones diarias, hasta que el testigo cubrió por completo la placa petri.
Análisis estadístico de datos
Se realizó un Diseño Completamente al azar (DCA) con siete tratamientos y un testigo. Los datos se analizaron mediante un análisis de varianza (ANVA) y una prueba de rango múltiples de Duncan (p ≤ 0,05) se empleó el software de análisis estadístico Statistical Analysis Systems 5.0 (SAS).
Ensayo in vivo en frutos
Preparación de inóculo fúngico
Placas de Petri con PDA colonizados con los patógenos T. paradoxa y C. musae con 7 a 10 días de crecimiento, se agregó 10 ml de ADE (agua destilada estéril), con ayuda de una espátula Drigalsky se desprendieron las conidias, filtrándolo cada patógeno sobre un algodón estéril, colocado dentro de un embudo de vidrio para separar los restos de micelio y obtener sólo la suspensión de conidias, la concentración empelada fue de 104 UFCmL-1 (Pasiche, 2018; Chero, 2020).
Biofungicidas y concentración
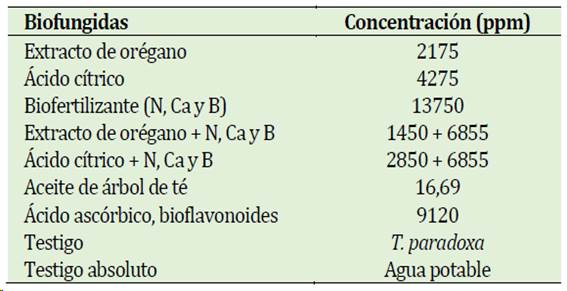
En la Tabla 2 se observan los tratamientos y las con-centraciones. Cada concentración de los biofungicidas se preparó en un vaso de vidrio de 200 ml conteniendo agua estéril. La suspensión de cada biofungicida se depositó en asperjadores manuales.
Inoculación de hongos y aplicación de biofun-gicidas
Clústers de banano en madurez fisiológica fueron otorgados por la Cooperativa ASPROSOL, los cuales fueron lavados y secados a temperatura ambiente; posteriormente, los frutos fueron inoculados con una suspensión de conidias a 104 UFC ml-1 con los patógenos mencionados. Además, los tratamientos (Tabla 2) fueron agregados con ayuda de un asperjador manual. Los frutos de banano se embalaron en bolsas polypak dentro cajas de cartón de 18,4 kg. Las cajas pasaron a incubación en una cámara de refrigeración a 13°C durante 18 días y en cámara de maduración con gas etileno durante 4 días.
Evaluación de severidad
Se evaluó la severidad de la enfermedad a los 22 ddi (días después de la inoculación) según Douglas et al. (1997), con las siguientes características: grado 0 = sin pudrición de la corona del fruto, grado 1= micelio visible en la corona, grado 2 = micelio cubriendo enteramente la corona e iniciando una decoloración, grado 3 = necrosis de la corona en un 40%, grado 4 = necrosis de la corona en un 80%, grado 5 = corona necrótica sin infección de pedicelos, grado 6 = corona totalmente con pudrición, pedicelos y parte de la cáscara del fruto con necrosis. Con los datos obtenidos se calculó Índice de Severidad (IS) (Mont, 2002).
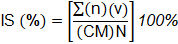
Donde n: número de frutos; v: grado de severidad; CM: categoría mayor; N: número total de frutos evaluados.
Análisis estadístico de datos
Se realizó un DCA (Diseño Completamente al Azar) con nueve tratamientos y ocho repeticiones (8 clusters de 4 a 5 dedos). Para calcular el ANVA y la prueba de rango múltiple de Duncan (P≤0.05) se empleó el software de análisis estadístico Statistical Analysis Systems 5.0 (SAS).
RESULTADOS Y DISCUSIÓN
Efecto de biofungicidas in vitro
El extracto de orégano (1450 ppm) y ácido cítrico (2825 ppm) fueron significativamente superior a los demás tratamientos, mostrando un PIC de 100% frente a T. paradoxa y C. musae (Tabla 3, Figura 3 y 4).
Tabla 3 Inhibición del crecimiento del micelio de Thielaviopsis paradoxa y Colletorrichum musae in vitro
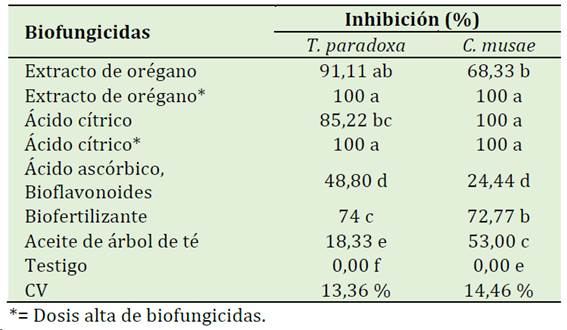
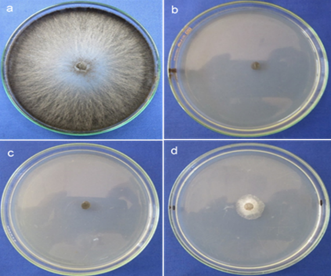
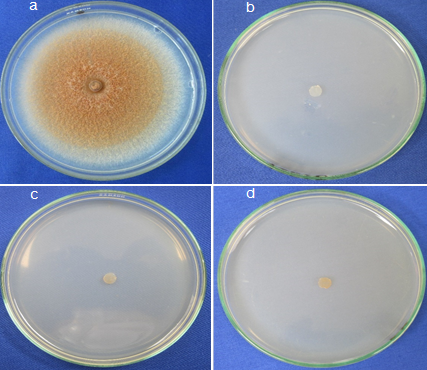
Figura 3 PIC (porcentaje de inhibición del crecimiento) de T. paradoxa in vitro a) Testigo b) Extracto de orégano* (1450 ppm), c) ácido cítrico a 2825 ppm y d) Extracto de orégano (725 ppm) inhibieron entre 91.11 % y 100%.
Índice de Severidad (IS %) en frutos
En la Tabla 4 el tratamiento con ácido cítrico a 4275 ppm registró el menor Índice de Severidad con 0% frente a los hongos T. paradoxa y C. musae (Figuras 5 y 6). Los tratamientos con el biofertilizante (N, Ca y B) (13750 ppm) y ácido cítrico + biofertilizante N, Ca y B (2850 ppm + 6855 ppm) alcanzaron 6,25 y 10,42% de IS respectivamente frente al patógeno T. paradoxa y frente a C. musae el tratamiento Ácido ascórbico, Bioflavonoides (9120 ppm) registró 16,67% de IS, superando significativamente (p ≤ 0,05) al resto de los tratamientos incluido a los testigos que alcanzaron 100% de IS (Figuras 7 y 8). En el tratamiento Testigo Absoluto, los frutos no evidenciaron ningún síntoma de pudrición.
Tabla 4 Eficacia de diferentes biofungicidas sobre el Índice de Severidad de la enfermedad en frutos causadas por T. paradoxa y C. musae
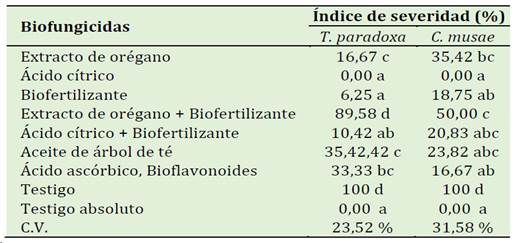

Figura 5 Efecto del tratamiento con ácido cítrico (4275 ppm) con índice de Severidad (IS) de 0,0% inoculadas con el hongo T. paradoxa.

Figura 6 Efecto del tratamiento con ácido cítrico (4275 ppm) con Índice de Severidad de 0,0% inoculadas con C. musae.

Figura 7 Tratamiento testigo, inoculados con el hongo T. paradoxa registrándose Índice de Severidad al 100%.
Resultados similares por Bhutia et al. (2016) quienes demostraron que los compuestos activos de algunas plantas como: α-curcumeno y zingerona del gengibre inhibía más del 80% el crecimiento de C. musae a una concentración de 5 mg/ml cuando en evaluaciones en in vitro y en in vivo los frutos de banano tratados con el extracto mostraron un bajo porcentaje de severidad de antracnosis de 2,2 después de cinco días de almacenamiento, en comparación con el testigo no tratado, que obtuvo una mayor puntuación de 4,8.
Este efecto inhibitorio de los biofungicidas evaluados en este estudio frente a T. paradoxa y C. musae, posiblemente se deba a los compuestos fitoquímicos que poseen, los cuales han sido confirmados por varias investigaciones. Se indica que las hojas de O. vulgare posee compuestos bioactivos monoterpenos como el thymol, carvacrol, y p-cimeno) destruyen la membrana celular, aumentan la permeabilidad de la célula, alteran la capacidad reproductiva y germinativa del patógeno (Papajani et al., 2015; Hou et al., 2020. En Citrus sp. los frutos y hojas presentan sustancias antimicrobianas en altas concentraciones, como: aceites esenciales, compuestos fenólicos como; etanol y metanol que ocasionan la inhibición de la germinación de las conidias (Irkin et al., 2015; Iglesias et al., 2017).
Tamayo-España et al. (2016) indican que el orégano posee metabolitos con la capacidad de impedir el desarrollo micelial del patógeno y la producción de conidias en concentraciones entre 50 y 40% a partir de extractos obtenidos de planta fresca como seca.
Según Vilaplana et al. (2018) los bananos tratados con 500 μL/L de aceite de tomillo mostraron una disminución de la pudrición del 46,4% en comparación con el fungicida Imazalil, que solo mostró el 29,4%. Los autores afirman que el efecto sinérgico del timol y el carvacrol del aceite de tomillo provocó el deterioro del tejido celular del hongo.
Meng et al. (2015) reportaron que el extracto de Camellia semiserrata, tiene una actividad fungicida, controló en in vitro el crecimiento de C. musae, ocasionando inhibición directa de la tasa de germinación de las conidias, ruptura de los micelios y elongación del tubo germinativo en un 88,7% y 68,4% respectivamente a 0,5 mg/ml, y una inhibi-ción completa del 100% por encima de 1 mg/ml.
Sanit (2020) evaluó el efecto treinta y cuatro extractos vegetales crudos, y obtuvo a O. vulgare inhibiendo el crecimiento micelial de C. gloeosporioides en 100% en todas las concentraciones.
Park et al. (2017) demostraron a nivel in vitro las actividades antifúngicas de aceites esenciales de orégano (Origanum vulgare), canela (Cinnamomum verum), y tomilho (Thymus vulgaris) en la germinación de conídias y el crecimento micelial de F. oxysporum.
Los extractos de orégano contienen fenoles y tienen potencial para ser utilizados en la agricultura sostenible frente a C. lindemuthianum, cuyos resultados in vivo se demostró la supresión de la antracnosis en judía común Phaseolus vulgaris L. (Dias et al., 2022).
Burbano-David et al. (2021) demostraron que la aplicación del extracto vegetal de Origanum vulgare disminuyó la esporulación y crecimiento micelial de aislamientos de Phytophthora infestans a una concentración de 10 mg ml-1. La actividad antifunguica de Origanum vulgare es el resultado de poseer terpenos como el carvacrol y timol, cuya acción implica un grupo hidroxilo presente en la estructura del metabolito, liberando protones en grandes cantidades. Esto genera la ruptura de las sustancias lipofilicas de la membrana, alteración del Ph y la gradiente de K+, ocasionando la disminución del ATP intracelular, deshidratación y muerte de la célula.
Andrade-Bustamante et al. (2018) encontraron que el uso de extracto de plantas como orégano (Lippia palmeri) a 0,05%y cachanilla (Pluchea serícea) a 1,0% inhibieron el crecimiento micelial de Aspergillus niger, en un 93 y 95% respectivamente, en frutos de tomate. Dicho efecto es originado por la presencia de sustancias secundarias con actividad antifúnguica como el Timol, Carvacrol, p-cimeno y cineol.
Ojeda et al. (2022) en su investigación se comprobó la acción sinérgica de la combinación de ácido ascórbico al 67%, ácido cítrico al 16,5% y ácido láctico al 16,5%, con un porcentaje de reducción del crecimiento micelial de 100% sobre los hongos F. verticillioides, A. fumigatus y A. flavus a una dosis de 1000 mgL-1. Sauceda (2011) menciona que dentro de los ácidos orgánicos se encuentra el ácido benzoico y ácido cítrico, estos actúan como antimicrobianos naturales que influyen en el balance acido-base de los agentes patógenos. Los hongos crecen normalmente a un pH neutro y sus sistemas biológicos dependen de ese equilibrio; sin embargo, los ácidos orgánicos mediante la destrucción de estructuras microbianas como los fosfolípidos, proteínas y ácidos nucleicos conllevan a alterar el pH y romper la homeostasis de estos agentes dañinos. Por otro lado, el ácido ascórbico es un bioactivo con propiedades microbianas, cuyo efecto se debe a su capacidad de retener proteínas y metales, alterando el funcionamiento de agentes fitopatógenos. Además, en su composición se encuentran los taninos y otros compuestos fenólicos como la galanginina que afecta la ADN girasa de estos microorganismos (Siller-Sánchez, Alvarez-Pérez, Aguilar, & Rojas, 2013).
De Dios-Delgado (2006) demostraron en plantas de lechuga inoculadas con mildiu Bremia lactucae, al aplicarse fertilizantes foliares a base de N y Ca a una concentración de 0,5% y 1% mejoraron la calidad postcosecha mediante el retardo del envejeci-miento del color de las hojas y la reducción de lesiones ocasionadas por el patógeno en un 10%. La aplicación de biofertilizante a base macro y micronutrientes predispone a mejorar sus defen-sas contra el ataque de hongos fitopatógenos, ya que aporta una formulación balanceada para que el cultivo realice sus actividades sin ni una deficiencia de nutrimentos. El Ca es uno de los elementos que genera rigidez de la pared de las células, alargando la vida postcosecha de los frutos.
CONCLUSIONES
A nivel in vitro los tratamientos con extracto de orégano (1450 ppm) y ácido cítrico (2825 ppm) obtuvieron PIC de 100% frente Thielaviopsis paradoxa y Colletotrichum musae y a nivel in vivo en frutos de banano el tratamiento con ácido cítrico (4275 ppm) registró el menor Índice de Severidad con 0,0%.












 uBio
uBio