Introducción
Las cardiopatías congénitas son las malformaciones congénitas más frecuentes y afectan entre 6 a 20 de cada 1000 recién nacidos a nivel mundial, constituyendo un problema de salud pública 1. Las cardiopatías congénitas críticas representan 25% de las cardiopatías congénitas y se definen así ya que necesitan cirugía o intervenciones vía cateterismo en el primer año de vida 2. Son responsables del 10% de muertes infantiles y 46% de las muertes relacionadas con malformaciones congénitas 3. Estas cardiopatías pueden ser ductodependientes y/o cianóticas. Típicamente, las lesiones ductodependientes se clasifican en tres grupos 2:
En el primer grupo están los defectos obstructivos del lado izquierdo, en los cuales el flujo sistémico es ducto-dependiente. Estos defectos suelen presentarse con choque cardiogénico e incluyen coartación aórtica crítica, síndrome de corazón izquierdo hipoplásico, arco aórtico interrumpido, estenosis aórtica crítica, ventrículo único con estenosis aórtica severa o atresia aórtica y/o atresia mitral, variantes de complejo Shone.
En el segundo grupo están los defectos obstructivos derechos, en los cuales el flujo pulmonar es ducto dependiente. Estos defectos se presentan con cianosis e incluyen: tetralogía de Fallot severa, atresia pulmonar con septo interventricular intacto o con comunicación interventricular, estenosis pulmonar crítica, anomalía de Ebstein severa, ventrículo único con estenosis o atresia pulmonar, y atresia tricúspide
En el tercer grupo están los defectos de los tractos de salida en los cuales la mezcla sanguínea es ducto dependiente. Estos defectos se presentan con cianosis y falla cardiaca e incluye la dextrotransposición de grandes arterias.
En ausencia de un diagnóstico temprano, se estima que el 50% de los pacientes con cardiopatías congénitas críticas fallecen prematuramente 4. La detección temprana de las cardiopatías congénitas críticas se puede hacer mediante ecocardiografía fetal, examen físico neonatal y la oximetría de pulso. Lamentablemente en nuestro país, la ecocardiografía fetal no está disponible en todas las regiones ya que requiere equipos de ultrasonido y ginecoobstetras especializados y con experiencia. Además, el examen físico tiene limitada sensibilidad para detectar cardiopatías congénitas críticas ya que muchas veces la hipoxemia neonatal no es visible al ojo humano y los soplos cardíacos pueden escucharse en un gran porcentaje de recién nacidos sanos 2.
La oximetría de pulso es una técnica indirecta, simple y no invasiva que se utiliza para medir saturación de oxígeno en la sangre a través de la diferencia de absorción de luz entre la oxihemoglobina y la hemoglobina desoxigenada (Ley de Lambert-Beer). En el año 2012, las autoridades de salud locales estadounidenses, el Departamento de Salud y Servicios Humanos de los Estados Unidos, la Academia Americana de Pediatría, el Colegio Americano de Cardiología, la Asociación Americana del Corazón, la Marcha de Dimas y la Fundación Newborn recomendaron que la oximetría de pulso sea añadida al Panel de Tamizaje Uniforme Rutinario 5, logrando que en el 2018 todos los Estados Unidos adopten su uso.
En el Perú, el tamizaje neonatal de cardiopatías congénitas críticas universal no es una realidad y el objetivo de este documento es recomendar su implementación de manera urgente y a nivel nacional para mejorar la salud neonatal.
Guía de procedimiento para el tamizaje neonatal de cardiopatías congénitas críticas
1. Objetivos
• Detectar recién nacidos con algún grado de hipoxia, cuya causa podría ser una cardiopatía congénita crítica, mediante la oximetría de pulso, a partir de las 24 h de nacido o antes de ser dado de alta.
• Inicio del tratamiento precoz y traslado oportuno a un centro de referencia con capacidad resolutiva para mejorar los resultados cardiopulmonares y neurológicos.
• Disminuir la mortalidad neonatal.
2. Codificación
Es importante codificar adecuadamente los diagnósticos ya que estos son las bases de estudios epidemiológicos que permiten la asignación de recursos.
• Códigos CIE-10 de las principales cardiopatías congénitas:
a) Q20 Malformaciones congénitas de las cámaras y conexiones cardiacas.
b) Q21 Malformaciones congénitas de los tabiques cardiacos.
c) Q22 Malformaciones congénitas de las válvulas pulmonar y tricúspide.
d) Q23 Malformaciones congénitas de las válvulas aórtica y mitral.
e) Q24 Otras malformaciones congénitas cardiacas.
f) Q25 Malformaciones congénitas de las grandes arterias.
g) Q26 Malformaciones congénitas de las grandes venas.
h) Q27 Otras malformaciones congénitas del sistema vascular periférico.
i) Q28 Otras malformaciones congénitas del aparato circulatorio.
• Código CPMS (Catálogo de Procedimientos Médicos y Sanitarios del Sector Salud) del tamizaje cardiaco neonatal: 94760 (6.
3. Indicaciones
En todos los recién nacidos de 34 semanas de edad gestacional, o más, que se encuentren aparentemente sanos y tienen por lo menos 24 h de vida o van a ser dados de alta.
5. Responsables
• Enfermero (a) capacitado (a) del servicio de Alojamiento Conjunto u Hospitalización en Neonatología.
• Médico pediatra, médico neonatólogo o médico cirujano encargado del servicio de alojamiento conjunto u hospitalización en neonatología.
• Médico cardiopediatra o en su defecto cardiólogo de adultos con experiencia en cardiopatías congénitas.
6. Material e insumos
• Equipo de pulsioximetría calibrado y validado en recién nacidos en situaciones de movimiento, baja perfusión y altura geográfica del centro de salud.
• Sensor neonatal.
• Computadora.
• Mesa de procedimientos y material de escritorio.
• Cuna o camilla pediátrica y/o incubadora
• Jabón, alcohol gel, algodón, alcohol 70°, papel toalla.
• Formatos de registros: historia clínica neonatal.
7. Procedimiento
El primer paso es informar del procedimiento de tamizaje a la madre, padre o responsable legal del recién nacido, explicar en qué consiste la prueba y los beneficios de esta, aclarando que no implica ningún riesgo para el recién nacido. Luego, registrar los datos y verificar la identidad del paciente, preparar materiales y realizar la higiene de manos antes y después de cada procedimiento.
Para iniciar el procedimiento de la oximetría de pulso el recién nacido debe estar en un ambiente con temperatura adecuada y con aire ambiental (de preferencia sala de procedimientos o, en su defecto, junto a su madre en las salas de alojamiento conjunto, sin oxígeno suplementario). El recién nacido debe estar despierto, calmado, sin llorar ni amamantando al momento del procedimiento. Tanto la mano derecha como los pies no deben estar fríos y la piel debe estar limpia y seca (sin tintes ni sustancias de pigmentación oscura).
Para realizar el procedimiento se debe usar un oxímetro que esté calibrado, validado en recién nacidos, en condiciones de baja perfusión y sea tolerante al movimiento. Los sensores por usar pueden ser descartables o reutilizables y tener la medida apropiada para un neonato. Es imprescindible limpiar los sensores reutilizables antes de cada uso para minimizar el riesgo de infección. El emisor de luz del sensor del oxímetro de pulso debe colocarse en la parte dorsal de la región hipotenar de la mano derecha (saturación preductal) y en la cara lateral del dorso de uno de los pies (saturación posductal) y el fotodetector directamente opuesto al emisor de luz. Esto puede ser en serie (uno por uno) o en paralelo (simultáneamente).
Se puede iniciar con la saturación posductal para evitar la irritación que provoca abrir la mano del neonato. Una vez colocado el sensor no debe haber espacios entre el sensor y la piel del neonato. El responsable debe asegurarse que el sensor quede ubicado correctamente (Figura 1) 7. Es recomendable fijar el sensor con el adhesivo o la cinta de espuma recomendados por el vendedor, evite usar cinta adhesiva sobre la piel del neonato o sostener el sensor con su mano, para no interferir con la señal.
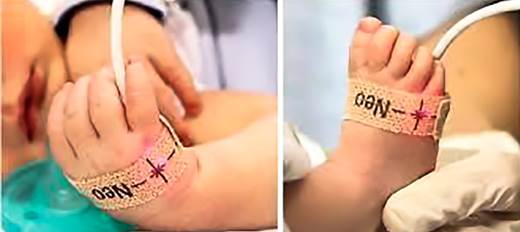
Figura 1 Colocación adecuada del sensor neonatal en la mano derecha (emisor de luz en la parte dorsal de la región hipotenar y fotorreceptor en la zona opuesta) y cualquiera de los pies (emisor de luz en la cara lateral del dorso del pie y fotorreceptor en la zona opuesta) (6) .
Se debe evitar la interferencia de fuentes de luz externa (por ejemplo, luz de fototerapia) durante la toma de oximetría. Además, el sensor debe colocarse el tiempo suficiente (usualmente entre 30 a 60 s) que permita obtener una curva pletismográfica estable, y en ese momento se consignará el valor de saturación que registra el equipo en la pantalla. Es importante motivar la participación de la madre para causar comodidad en el neonato y la educación de la madre mientras se obtiene la lectura.
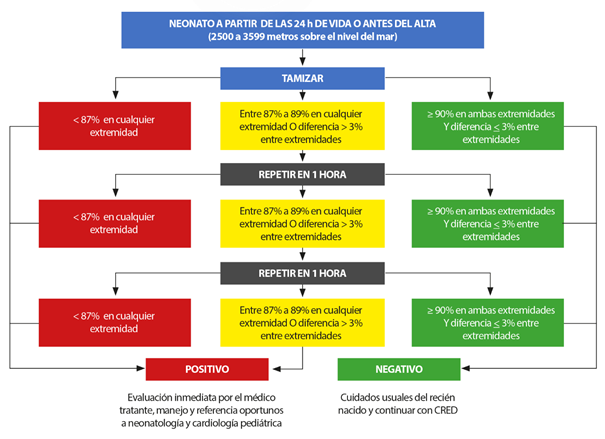
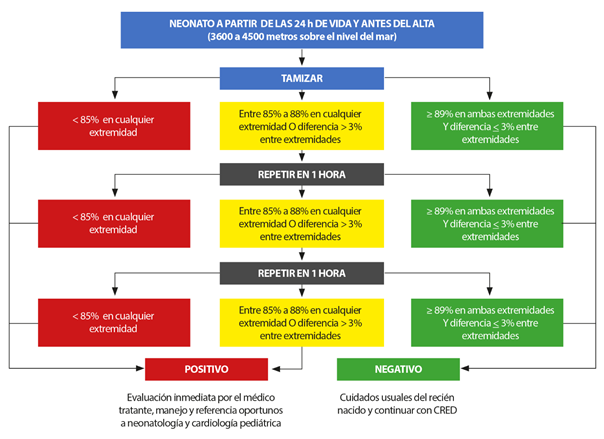
Anotar los resultados de la oximetría en la historia clínica neonatal con los valores encontrados de saturación pre y posductal, fecha y hora de las saturaciones: 1.o, 2.o y 3.o, si se repitieron. Calcular la oximetría diferencial, que consiste en la resta del valor de oximetría de la mano derecha y uno de los pies. Hay que tener en cuenta que, generalmente, la saturación preductal es mayor que la posductal, excepto en algunas condiciones como el drenaje pulmonar venoso anómalo total, la dextrotransposición de grandes arterias con ductus arterioso persistente e interrupción del arco aórtico o en la dextrotransposición de grandes arterias con ductus arterioso persistente e hipertensión pulmonar; en estos casos se restara el mayor valor de saturación (del pie) menos el menor valor (mano derecha). El resultado y su interpretación serán ingresados en las hojas de evolución de la historia clínica de acuerdo con el algoritmo correspondiente a la altura donde se ubica el establecimiento de salud (Figuras 2, 3 y 4).
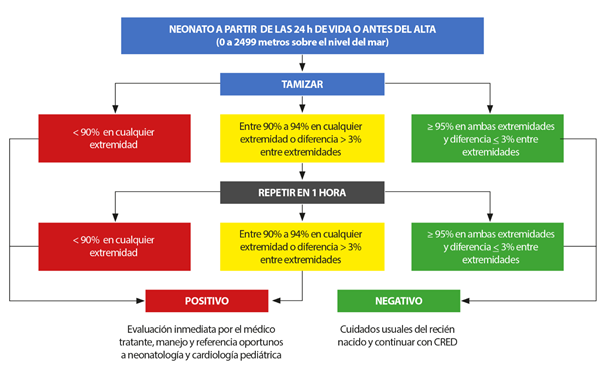
Figura 2 Algoritmo de tamizaje de cardiopatías congénitas críticas de 0 a 2499 m s.n.m. (30) . En moderadas alturas a partir de1600 m s.n.m se ha propuesto disminuir el punto de corte de 95 a 93% para reducir los falsos positivos (31) .
8. Interpretación de los resultados y pasos siguientes
La interpretación de los valores numéricos obtenidos de la pulsioximetría dependerá de la altura sobre el nivel del mar en la que la prueba se realiza, dichos valores están especificados en las Figuras 2, 3 y 4.
• Negativo: extremadamente baja probabilidad de presentar cardiopatía congénita crítica, sepsis o neumonía. Continuar con los cuidados de rutina del recién nacido.
• Positivos: alta probabilidad de presentar cardiopatía congénita crítica, sepsis, neumonía u otra patología pulmonar. Requiere la evaluación inmediata del médico tratante, realizar examen físico completo (auscultar presencia de soplos, taquipnea, presión arterial en cuatro extremidades, evaluar pulsos, etc.), radiografía de tórax, biometría hemática y marcadores de infección, entre otros. Si se identifica una causa respiratoria o infecciosa se debe brindar tratamiento de acuerdo con el nivel de atención donde se encuentre el recién nacido, así como referencia oportuna. Si el establecimiento de salud no cuenta con la capacidad para realizar una ecocardiografía pediátrica se debe realizar una referencia al establecimiento más cercano que cuente con ecocardiógrafo y referirlo a un cardiólogo pediátrico (o en su defecto, cardiólogo de adultos con experiencia en cardiopatías congénitas), quien debe establecer el diagnóstico definitivo cardiológico e indicar el tratamiento a seguir. En ninguna circunstancia se debe dar de alta al recién nacido con tamizaje neonatal de cardiopatías congénitas críticas positivo sin la evaluación especializada. Informar a los padres y brindar orientación según el resultado obtenido.
Sensibilidad, especificidad y costo-efectividad del tamizaje neonatal de cardiopatías congénitas críticas
En una revisión sistemática que incluyó 13 estudios, con datos de 229 421 recién nacidos, se halló que la sensibilidad de la oximetría de pulso para la detección temprana de cardiopatías congénitas críticas es de 76,5% y la especificidad de 99,9% 8. En nuestro país, al tamizar 5321 recién nacidos en el Hospital Edgardo Rebagliati Martins, la oximetría de pulso logró una sensibilidad de 80%, especificidad de 99,92% y tasa de falsos positivos menor a 1% 9. Estos resultados demuestran que la oximetría de pulso cumple los criterios técnicos para que sea un tamizaje universal de cardiopatías congénitas críticas en recién nacidos a nivel mundial.
La implementación nacional del tamizaje neonatal de cardiopatías congénitas críticas mediante oximetría de pulso es altamente costo-efectiva y reduce los gastos en salud. La Sociedad Iberoamericana de Neonatología ha recomendado su uso desde el 2016 para poder disminuir las muertes neonatales en Latinoamérica, donde se estima que el 60% de ellas son prevenibles 10. El Comité Mexicano para el Tamiz Neonatal Cardíaco estimó un ahorro de 75 000 dólares americanos para el gobierno mexicano por cada detección oportuna de cardiopatías congénitas críticas 11. Asimismo, se estimó que en los 5 primeros años de su implementación a nivel nacional se podría lograr un ahorro de 700 millones de dólares americanos hasta antes del tratamiento correctivo 11. Esto se debe a que, a pesar de invertir en recursos humanos, oxímetros y ecocardiografías, existe un ahorro significativo proveniente de la menor duración de la estancia hospitalaria en la unidad de cuidados intensivos, así como menor cantidad de días de uso de prostaglandinas.
En Colombia se estima que los costos del examen físico neonatal y la oximetría de pulso alcanzan los 102 dólares americanos, siete dólares más que el examen físico neonatal solo 12. Adicionalmente, un estudio de costo-efectividad comparando el examen físico solo, con el examen físico combinado con la oximetría de pulso estimó que la oximetría de pulso detecta 32 casos adicionales de cardiopatías congénitas críticas por cada 10 000 recién nacidos tamizados, con un costo incremental de ocho dólares americanos por cada tamizaje 13.
Impacto del tamizaje neonatal de cardiopatías congénitas críticas en la mortalidad neonatal
El tamizaje neonatal de cardiopatías congénitas críticas mediante oximetría de pulso ha logrado disminuir la mortalidad neonatal e infantil en países donde ha sido adoptado a nivel nacional 14 ya que no solo detecta tempranamente cardiopatías congénitas críticas, sino también sepsis, neumonías y otros problemas pulmonares 15. La detección y tratamiento antibiótico oportunos tanto de la sepsis como de las neumonías llevan a la curación de dichas enfermedades 15. En el caso de las cardiopatías congénitas críticas, la detección temprana y el tratamiento oportuno puede conllevar a una ganancia de 40 años de vida o más 16, lo cual es una proeza de la medicina moderna.
Situación actual del tamizaje neonatal de cardiopatías congénitas críticas en el Perú
En nuestro país, las cirugías y procedimientos intervencionistas cardíacos congénitos se dan en diversos hospitales del MINSA y EsSalud, pero la mayoría de los pacientes que logra acceder a una cirugía o procedimiento son diagnosticados de manera tardía 17, llegando a presentarse en condiciones críticas (posparo cardiorrespiratorio) o con comorbilidades asociadas a la espera (sepsis), por lo que necesitan cirugía o procedimientos intervencionistas de emergencia, los cuales conllevan un peor pronóstico y mayor índice de ocupación de camas en las unidades de cuidados intensivos. Esto afecta psicológica, emocional y financieramente a los padres, quienes sufren el impacto y enfrentan con dolor e incertidumbre las barreras del sistema de salud, la falta de información con respecto a las cardiopatías congénitas, el proceso perioperatorio y las consecuencias de este diagnóstico tardío en el desarrollo de su vida infantil. Estas consecuencias tan nefastas pueden ser mitigadas con un tamizaje neonatal de cardiopatías congénitas críticas universal.
En el año 2013, según el Decreto Supremo 014-2013-SA, se aprobó en el Perú la Ley 29885 que declara el interés nacional de la creación del Programa de Tamizaje Neonatal Universal, que permite detectar las siguientes enfermedades: hipotiroidismo congénito, hiperplasia suprarrenal congénita, fenilcetonuria, fibrosis quística, hipoacusia, y catarata congénita 18. Desafortunadamente, las cardiopatías congénitas (enfermedad congénita más frecuente a nivel nacional, que afecta a 1% de recién nacidos) no fueron incluidas en esta ley y, por ende, en julio del 2022 nuestro equipo, sumado a la asociación de pacientes Amigos de Corazón, solicitamos al Congreso de la República del Perú una modificación del Programa de Tamizaje Neonatal Universal. Al incorporar el tamizaje neonatal de cardiopatías congénitas críticas al Programa de Tamizaje Neonatal Universal con la Ley 31975 publicada en enero de 2024 19 se estaría tomando el primer paso para cambiar la altísima mortalidad que experimentan los pacientes con cardiopatías congénitas en el Perú, estimada en 17,6 por 100 000 habitantes, más de cuatro veces mayor a la mortalidad global (3,9 por 100 000 habitantes) y similar a la mortalidad vista en países como Sudán y Afganistán 20. Esto, en contraste con países desarrollados donde 97% de los pacientes con cardiopatías congénitas llega a la adultez luego de tener una detección oportuna y tratamiento adecuado 21.
Importancia de la altura en la implementación del tamizaje neonatal de cardiopatías congénitas críticas
A mayor altitud de residencia disminuye la presión parcial de oxígeno y, por ende, también los valores obtenidos mediante oximetría de pulso. Este efecto es marcado en alturas de más de 2500 metros sobre el nivel del mar (m s.n.m.) 22. El tamizaje neonatal de cardiopatías congénitas críticas en la altura trae retos fisiológicos a tomar en cuenta, ya que la respuesta ventilatoria hipóxica es menor en poblaciones andinas, los niveles de hemoglobina y volúmenes pulmonares son mayores, la gradiente alveolo arterial es muy estrecha y existe una respuesta vasoconstrictora pulmonar hipóxica menos marcada 23. Asimismo, en la altura la saturación de oxígeno del recién nacido es menor cuando este duerme o se amamanta 24, por eso es importante realizar el tamizaje neonatal de cardiopatías congénitas con el recién nacido despierto, calmado, sin llorar ni amamantando al momento del procedimiento. Además, en la altura existe mayor incidencia de comunicaciones interatriales y ductus arteriosos persistentes 25. En este contexto los algoritmos que se aplican a nivel del mar tienen una mayor tasa de falsos positivos en alturas mayores a 2500 m s.n.m. 26-29. Para resolver este problema, en el estudio A New algorithm DEtectS critical Congenital Heart Disease: ANDES-CHD, se desarrollaron dos algoritmos a partir de datos de cinco regiones del Perú que puedan ser aplicables a alturas de más de 2500 m s.n.m. en nuestro país y que sean compatibles con valores clínicamente aceptables 30.
Basado en el estudio ANDES-CHD 30, los valores para la interpretación del tamizaje neonatal difieren basados en la altura en la cual se realiza la prueba:
• De 0 a 2499 m s.n.m.: se considerarán pruebas positivas a valores de saturación de oxígeno arterial <90% en cualquier extremidad o valores entre 90 a 94% en cualquier extremidad, o una diferencia >3% entre extremidad en dos oportunidades separadas por una hora (Figura 2). En moderadas alturas a partir de 1600 m s.n.m se ha propuesto disminuir el punto de corte de 95 a 93% para reducir los falsos positivos (31.
• De 2500 a 3599 m s.n.m.: se considerarán pruebas positivas a valores <87% en cualquier extremidad o valores entre 87 y 89% en cualquier extremidad, o una diferencia >3% entre extremidad en tres oportunidades separadas por una hora (Figura 3).
• De 3600 a 4500 m s.n.m.: se considerarán pruebas positivas a valores <85% en cualquier extremidad o valores entre 85 y 88% en cualquier extremidad, o una diferencia >3% entre extremidad en tres oportunidades separadas por una hora (Figura 4) 30.
Etapas del tamizaje neonatal de cardiopatías congénitas críticas
1. Captación
El personal de la salud responsable de la atención del recién nacido en el establecimiento de salud que realice el tamizaje neonatal de cardiopatías congénitas críticas debe captar a todo neonato aparentemente sano de por lo menos 34 semanas de edad gestacional:
2. Aplicación de prueba de tamizaje neonatal de cardiopatías congénitas críticas
En todos los recién nacidos captados debe realizarse la oximetría de pulso a partir de las 24 h de nacido o antes de ser dados de alta (ver sección Guía de procedimiento para el tamizaje neonatal de cardiopatías congénitas críticas).
3. Emisión y comunicación de resultados
Los resultados deben registrarse en la historia clínica, el carné de crecimiento neonatal y en la base de datos del programa de tamizaje. Si el resultado es negativo, se recomendará seguir con su control de crecimiento y desarrollo, informándose al responsable del neonato y a la madre.
Si el resultado es positivo, el recién nacido no debe ser dado de alta y debe ser evaluado inmediatamente por el médico tratante, quien determinará los siguientes pasos a seguir (véase la siguiente sección).
El responsable del tamizaje neonatal de cardiopatías congénitas críticas verificará que los informes de resultado queden registrados en las historias clínicas y el carné de crecimiento neonatal, a fin de ser verificado durante las atenciones posteriores.
4. Seguimiento de casos con sospecha de cardiopatía congénita crítica
El neonato en el que se identifique un tamizaje positivo, será evaluado inmediatamente por el médico tratante. Si el médico tratante encuentra una causa respiratoria o infecciosa deberá elaborar un plan de trabajo e iniciar tratamiento de acuerdo con su nivel de atención y solicitar la inmediata referencia a una unidad de cuidados neonatales.
Si el establecimiento de salud no cuenta con la capacidad para realizar una ecocardiografía pediátrica se debe realizar una referencia al establecimiento más cercano que cuente con ecocardiógrafo y cardiólogo pediátrico (o en su defecto, cardiólogo de adultos con experiencia en cardiopatías congénitas), quien debe establecer el diagnóstico definitivo cardiológico e indicar el tratamiento a seguir.
5. Tratamiento para las cardiopatías congénitas críticas
Establecida la sospecha de cardiopatía congénita crítica se debe iniciar prostaglandina E132,33 prontamente en el establecimiento de origen (Tablas 1, 2 y 3) y mantener dicha infusión durante la hospitalización y referencia al centro quirúrgico. No se debe esperar la evaluación por el cardiólogo pediatra (o en su defecto cardiólogo de adultos con experiencia en cardiopatías congénitas). La referencia debe iniciarse lo más rápidamente posible y debe considerarse el traslado en ambulancia aérea con un equipo especializado.
Tabla 1 Lesiones dependientes del ductus arterioso que requieren estabilización con prostaglandina E1*
| Indicación | Flujo pulmonar ductus-dependiente | Flujo sistémico ductus-dependiente | Mezcla sanguínea ductus-dependiente |
|---|---|---|---|
| Síntoma de presentación | Cianosis | Choque cardiogénico | Cianosis y falla cardíaca |
| Lesiones | Tetralogía de Fallot severa Atresia pulmonar con septo interventricular intacto o con comunicación interventricular Estenosis pulmonar crítica Anomalía de Ebstein severa Ventrículo único con estenosis o atresia pulmonar Atresia tricúspide | Coartación aórtica crítica Síndrome de corazón izquierdo hipoplásico Arco aórtico interrumpido Estenosis aórtica crítica Ventrículo único con estenosis aórtica severa o atresia aórtica y/o atresia mitral Variantes de complejo Shone | Transposición de grandes vasos |
Tabla 2 Guía rápida para la administración de prostaglandina E1*
* Adaptado de la Guía de uso de prostaglandinas en cardiopatías congénitas ductusdependiente. 2022. Instituto Nacional de Salud del Niño de San Borja. Perú.
Tabla 3 Efectos adversos de la administración de prostaglandina E1
| Efecto Adverso | Frecuencia | Conducta |
|---|---|---|
| Apnea | Frecuente | Estimulación del paciente. Apoyo con bolsa de resucitación. Considerar intubación y ventilación mecánica según estado clínico del paciente Disminución de la dosis. Considerar uso de aminofilina en pacientes con peso menor a 2 kg. Dosis de inicio: 6 mg/kg endovenoso Mantenimiento 2 mg /kg endovenoso cada 8 h |
| Miocionías, agitación | Frecuente | Disminución de la dosis. Considerar sedación |
| Hipotensión | Frecuente | Bolo de 10 mL/kg de NaCI 0,9% o haemacell. Considerar dopamina a dosis presora. |
| Hipertermia | Frecuente | Disminución de la dosis. Medios físicos. No utilizar AINES. Excluir sepsis como causa. |
| Vasodilatación cutánea | Frecuente con la vía arterial umbilical | Preferir vía venosa central |
| Taquicardia | Frecuente | Excluir otras patologías como causa |
| Diarrea | Poco frecuente | Mantener buena hidratación. Disminución de la dosis. |
| Hiperplasia antral | Infrecuente | Ecografía diagnóstica. Colocación de sonda nasoyeyunal. |
| Alteraciones electrolíticas | Infrecuente | Mantener buen aporte hidroelectrolítico. Disminuir dosis de diuréticos si se administran de forma concomitante. |
| Hiperostosis cortical | Poco frecuente | Monitorear fosfatasa alcalina. |
| Radiografía de huesos largos para descarte. | ||
| Descartar osteomielitis, cubrir con antibióticos. | ||
| Analgésicos. | ||
| Puede mantenerse varios meses luego de la suspensión del fármaco. |
* Adaptado de la Guía de uso de prostaglandinas en cardiopatías congénitas ductusdependiente. 2022. Instituto Nacional de Salud del Niño - San Borja. Perú.
Protocolo de uso de prostaglandina E1
El alprostadil o prostaglandina E1 (PGE1) es un derivado del metabolismo del ácido araquidónico mediado por la ciclooxigenasa. Sus principales efectos farmacológicos son la apertura y mantenimiento de la permeabilidad del ductus arterioso, su efecto máximo ocurre entre los 15 min y las 4 h de iniciada su administración. El mecanismo de efecto no está bien establecido. Produce disminución de la resistencia vascular por vasodilatación y también actúa como inhibidor de la agregación plaquetaria y como estimulante del músculo liso intestinal y uterino.
Esta indicado en el diagnóstico prenatal de cardiopatía congénita ductusdependiente, en el recién nacido cianótico estable y sin acidosis; en el recién nacido con ausencia de pulso femoral, estable, sin acidosis y en el recién nacido inestable o con acidosis.
Su uso está contraindicado en cardiopatías que presenten obstrucción al flujo de las venas pulmonares (drenaje venoso anómalo de venas pulmonares tipo obstructivo) puesto que su uso en estos casos ocasiona empeoramiento del estado del paciente.
La respuesta se evalúa mediante la visualización ecocardiográfica de la patencia del ductus o en ausencia de ecocardiografía: pulsos palpables, resolver la acidosis y aclaramiento de lactato menor 2 mmol/L, mejora de la saturación hasta 75-85%.
Direcciones a futuro
Con el objetivo de cambiar la gran mortalidad por cardiopatías congénitas previamente descrita se necesita la creación de un Programa Nacional de Cardiopatías Congénitas ya que de esta manera se podrá evaluar constantemente las necesidades existentes en las diferentes regiones, diseñar intervenciones que cubran las brechas halladas (infraestructura, equipamiento y recursos humanos competentes) y monitorear el efecto de estas intervenciones a corto, mediano y largo plazo. Este programa debe ser multidisciplinario e integral, y tomar en cuenta la coordinación entre los múltiples sistemas de salud de nuestro país, así como el sistema de referencias. Es necesario recalcar que el óptimo manejo de los pacientes con cardiopatías congénitas es símbolo indirecto del desarrollo de los países y, en este sentido, se necesita una coordinación multisectorial que vaya más allá del Ministerio de Salud para incluir a los ministerios de Educación, Mujer y Poblaciones Vulnerables y Economía, entre otros.