Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Arnaldoa
versão impressa ISSN 1815-8242versão On-line ISSN 2413-3299
Arnaldoa vol.25 no.1 Trujillo jan./abr. 2018
http://dx.doi.org/http://doi.org/10.22497/arnaldoa.251.25115
ARTÍCULOS ORIGINALES
Determinación de la actividad inhibidora de proteasas del extracto acuoso de los órganos vegetativos y reproductivos de Ismene amancaes (Ker Gawl.) Herb. (Amaryllidaceae) "amancaes" endémica del Perú
Determination of the protease inhibitory activity of the aqueous extract of the vegetative and reproductive organs of Ismene amancaes (Ker Gawl.) Herb. (Amaryllidaceae) "amancaes" endemic to Peru
Diana Alburqueque Andrade & Mario Zapata Cruz1, Ludisleydis Bermúdez Díaz2, Segundo Leiva González3
1 Laboratorio de Proteómica, Universidad Privada Antenor Orrego. Trujillo, PERÚ. diana_16065@hotmail.com
2 Instituto para el Desarrollo de la Investigación, Emprendimiento e Innovación (IPDIE). Lima, PERÚ.
3 Herbario Antenor Orrego (HAO), Museo de Historia Natural, Universidad Privada Antenor Orrego, Casilla Postal 1075, Trujillo, PERÚ. cleivag@upao.edu.pe/segundo_leiva@hotmail.com
Resumen
Se determina la actividad inhibidora de proteasas del extracto acuoso de los órganos vegetativos y reproductivos de Ismene amancaes (Ker Gawl.) Herb. (Amaryllidaceae) "amancaes" endémica del Perú. Se hizo un extracto homogenizado de los órganos vegetativos y reproductivos de la planta, utilizando diferentes tampones o buffers de extracción. Después de preparados los extractos vegetales, pasaron por el proceso de liofilización, donde se obtuvieron los diferentes liofilizados, los cuales se resuspendieron en dos tampones distintos. Dichos tampones fueron buffer Tris HCl 100 mM pH 8,0 (números pares) y EDTA +DTT (números impares), resuspendiéndose en la dilución de 1:10, por cada gramo de liofilizado se agregaba 10 ml del tampón. A cada uno de estos extractos acuosos se les realizó el método de clarificación con TCA 2,5 y 5% y se les determinó el porcentaje de concentración de proteínas presente. Finalmente, se determinó la actividad inhibidora de tripsina a los diferentes extractos obteniéndose resultados nulos para los extractos.
Palabras clave: actividad inhibitoria, proteasas, Ismene amancaes, Amaryllidaceae.
Abstract
We determined the protease inhibitory activity of the aqueous extract of the vegetative and reproductive organs of Ismene amancaes (Ker Gawl.) Herb. (Amaryllidaceae) "amancaes" endemic to Peru. We prepared an homogenized extract of the vegetative and reproductive organs of the plant, using different extraction buffers. After preparing the plant extracts, they went through a lyophilization process, where different lyophilisates were obtained, which were resuspended in two different buffers. These buffers were Tris HCl 100 mM pH 8.0 (even numbers) and EDTA + DTT (odd numbers), resuspended at the 1:10 dilution, 10 ml of the buffer for each gram of lyophilisate. To each one of these aqueous extracts was applied the clarification method with TCA 2.5 and 5% and the percentage of protein concentration was determined. Finally, the trypsin inhibitory activity was determined at the different extracts getting null results.
Keywords: inhibitory activity, proteases, Ismene amancaes, Amaryllidaceae.
Introducción
La familia Amaryllidaceae tiene 73 géneros con alrededor de 1605 especies originarias de las regiones tropicales y calurosas de Europa, y especialmente Asia, el Sur de África y los Andes (Stevens & Hilary, 2017). En el Perú habitan unos 24 géneros y 138 especies (Brako & Zarucchi, 1993; Ulloa et al., 2004), reportándose 54 especies endémicas en 15 géneros (León et al., 2006). Entre las especies endémicas de los Andes, y especialmente del Perú destaca Ismene amancaes (Ker Gawl.) Herb., "amancay" (AP, CA, CU, LI, LL) (León et al, 2006).
Ismene amancaes (Ker Gawl.) Herb., App. Bot. Reg. 46, 1821, (Fig 2.)
Hierba 40-50 (-60) cm de alto. Raíces numerosas, blanco cremosas, suculentas, sinuosas, 20-30 cm de longitud. Bulbos globosos, blanco cremosos, compactos, crasos, 7-8 cm de largo por 6-6,5 cm de diámetro; rodeados por varias capas de escamas o catáfilas, concéntricas, membranáceas, marrón claro, se desprenden y rompen con facilidad, glabras. Hojas arrosetadas; sésiles; láminas ampliamente lineares, ligeramente curvadas hacia la superficie abaxial, cuculentas, verde oscuro, lustrosas la superficie adaxial, verde claro la superficie abaxial, glabras en ambas superficies, ligeramente sobresalientes las nervaduras principales en la superficie abaxial, agudas en el ápice, ligeramente cuneadas en la base, enteras en los bordes, 30-35 (-50) cm de largo por 4,8-5 cm de ancho. Inflorescencias con 3-6 flores dispuestas en pseudoumbelas, no sincronizadas; escapo ancipital, verde, suculento, lustroso, quebradizo, poroso, glabro en ambas superficies, erecto, 25-35 cm de longitud; brácteas membranáceas, papiráceas, cremosas o ligeramente amarillentas, glabras que envuelven la base de las flores, marscesentes; pedicelos trígonos ampliándose ligeramente hacia el área distal, verdes, suculentos, glabros, lustrosos, ancipitales, ligeramente curvados hacia la superficie abaxial, 0,8-1,2 cm de longitud. Flores trímeras, actinomorfas, bisexuales; Perianto homoclamídeo, corolino, infundibuliforme ampliándose ligeramente hacia el área distal, verde externamente, verdoso interiormente, suculento, glabro externa e interiormente, 5-costado, ligeramente curvado hacia la superficie abaxial, 8,4-8,8 cm de largo por 1-1,3 cm de diámetro en el área distal; tépalos externos 3, largamente triangulares, amarillo intenso y verde intenso en el área distal externa e interiormente, glabros externa e interiormente, membranáceos a ligeramente suculentos, reflexos o involutos en el ápice, 7,6-7,9 cm de largo por 8,4-8,7 cm de ancho; 9-10,3 cm de diámetro del limbo en la antésis; tépalos internos 3, largamente triangulares, amarillo intenso externa e interiormente, verde el ápice externamente, glabro externa e interiormente, membranáceos a ligeramente suculentos, erectos, nunca reflexos, nunca revolutos en los bordes, ligeramente sobresalientes las nervaduras principales, 7,5-7,7 cm de largo por 1-1,3 cm de ancho; tubo 8,6-8,7 cm de largo por 1-1,3 cm de diámetro; 9-11 cm de diámetro del limbo en la antésis. Paracorola crateriforme o ligeramente campanulada, suculenta, amarillo intenso externa e interiormente, verde intenso las nervaduras principales interiormente, glabra externa e interiormente, fimbriada en el borde, 6-6,3 cm de largo por 8,4-9,2 cm de diámetro. Estambres 5, apostémonos, criptostémonos, insertos a 5,4-5,6 cm o en el ¼ distal del interior de la paracorola; filamentos estaminales homodínamos; área libre de los filamentos estaminales filiformes ampliándose ligeramente hacia el área basal, amarillos, glabros, erectos, introrsos, lustrosos, dorsifijos, 1,9-2,2 cm de longitud; área soldada aplanada, verde intenso, glabra, lustrosa; anteras lineares, ligeramente curvadas, amarillas, sin mucrón apical, glabras, 11-12,1 mm de largo por 2-2,3 mm de diámetro. Ovario ínfero, piriforme, trígono, verde oscuro, lustroso, glabro, 1,5-1,8 cm de largo por 0,8-1 cm de diámetro; estilo exerto, filiforme ampliándose ligeramente hacia el área distal, verdoso, lustroso, glabro, 15,7-15,8 cm de longitud; estigma semigloboso, verde oscuro, rodeada con papilas, suculento, 2,4-2,6 mm de diámetro. Cápsula erecta, tricoca, amarillenta a la madurez, 2,9-3,2 cm de alto por 2,5-3 cm de diámetro. Semillas 6-8 por cápsula a lo largo de 6 placentas, globosas, lustroso brillante, coriáceas, verdes, glabras, 15-18 mm de largo por 13-15 mm de diámetro.
Material adicional examinado
PERÚ. Región La Libertad, prov. Otuzco, distrito Salpo, El Tablón (ruta Salpo-Rayampampa), flores amarillas, 8o01’17,6" S y 78o39’43,8" W, 2141 m, 22-I-2017, S. Leiva & D. Albuqueque 6400 (HAO, HUT).
Distribución y ecología: Especie con distribución limitada y aparentemente quedarían los últimos refugios naturales en el Perú; hasta el momento, es la única área geográfica donde vive en la región La Libertad, en la cual es abundante. A pesar de haberse efectuado recolecciones aledañas, solamente ha sido encontrada en los alrededores del lugar denominado El Tablón (ruta Salpo-Rayampampa) al oeste de Salpo, distrito Salpo, prov. Otuzco, región La Libertad, Perú, alrededor de los 8o01’17,6" S y 78o39’43,8" W, alrededor de los 2141 m de elevación, como un integrante de la vegetación herbácea y arbustiva de las laderas, bordes de caminos, entre rocas. Es una especie psicrófila ya que crece en lugares relativamente fríos; heliófila es decir, requiere abundante luz del sol; es higrófila, porque prefiere suelos húmedos; también es argilícola ya que prospera en suelos arcillosos, también es psamófila, ya que crece muy bien en suelos arenosos; así también, es rupícola porque habita entre rocas; es eutrofa, ya que prefiere suelos con abundantes nutrientes y vive asociada con plantas de Eriotheca ruizi (K, Schum.) A. Robyns "pate" (Malvaceae); Caesalpinia spinosa (Feuillée ex Molina) Kuntze "taya" (Malvaceae); Carica candicans A. Gray "papaya silvestre" "odeque" (Caricaceae); Apodanthera ferreyrana Mart. Crov. "chiclayito" (Cucurbitaceae); Lycianthes lycioides (L.) Hassl. "tomatito del valle", Nicandra physalodes (L.) Gaertn. "capulí cimarrón"; Nicandra john-tyleriana S. Leiva & Pereyra "capulí cimarrón" (Solanaceae), entre otras.
Fenología: Es una especie perenne, que brota con las primeras lluvias de noviembre o diciembre, para luego florecer y fructificar desde el mes de enero hasta finales de febrero.
Estado actual: Utilizando los criterios del IUCN (IUCN 2012; 2017) Ismene amancaes es considerada en peligro crítico (CR). La extensión de su rango de distribución es de un radio menor a 100 km2 en los alrededores de El Tablón (ruta Salpo-Rayampampa), siendo ésta la única localidad donde se ha recolectado (Criterio B1). Asimismo, se han encontrado unos 200 individuos maduros en la población (Criterio D), siendo influenciada directamente por el centro urbano que transita por la ruta entre Salpo hacia Rayampampa o Platanar. Sin embargo, no se ha evaluado si existe una declinación del rango de distribución y del área de ocupación, siendo de necesidad urgente de un estudio en profundidad de la ecología, estructura poblacional y distribución de esta especie, para esclarecer su estado de conservación.
Nombre vulgar: "amancae", "cebolla de gallinazo" (En boleta, S. Leiva & D. Albuqueque 6400, HAO).
Usos: Las plantas muy bien pueden ser usadas en floricultura, por el color amarillo intenso de sus flores.) Los estudios fitoquímicos realizados a los bulbos, evidenciando en los extractos etanólicos, extractos acuosos y extracto de diclorometano los siguientes fitoconstituyentes: alcaloides, compuestos fenólicos, flavonoides, antocianinas, catequininas, taninos, triterpenos y esteroides, cardenólidos, quinonas, saponinas, azúcares reductores, aceites y grasas, aminoácidos, resinas y micílagos Soto & Leiva (2015).
Las plantas sintetizan constitutivamente inhibidores específicos contra diferentes clases de proteasas, como un sistema de defensa a patógenos (Babu et al., 2010; Da Silva et al., 2014). Diversas investigaciones demuestran la efectividad de los inhibidores de proteasas (=IPs) en el control de diferentes insectos plagas (Babu et al., 2010; Zhang et al., 2014). Las capacidades defensivas de los IPs están relacionadas con la inhibición de las proteasas del intestino de los insectos plagas, provocando una reducción de la biodisponibilidad de aminoácidos que conlleva a una deficiencia nutricional, afecta el crecimiento, desarrollo y fecundidad del insecto, y les causa finalmente la muerte (Jamal et al., 2014).
Las proteasas
Según Barberis et al., 2002, las enzimas son polímeros de aminoácidos que dirigen la actividad catalítica en distintos sistemas biológicos, gracias a su capacidad de acelerar reacciones químicas. Durante los últimos años, su utilidad en la industria ha adquirido gran relevancia; siendo las proteasas el grupo de enzimas de mayor importancia industrial y comercial a escala internacional.
Las peptidasas o proteasas son enzimas que rompen los enlaces peptídicos de las proteínas. Para ello, utilizan una molécula de agua por lo que se clasifican como hidrolasas.
Las proteasas se encuentran presentes en todos los seres vivos en los cuales participan tanto en la hidrólisis de proteínas no deseadas, así como, en la regulación de diferentes procesos fisiológicos.
Proteasas vegetales
En los vegetales las hidrolasas están involucradas en procesos metabólicos vitales para el crecimiento, desarrollo y mantenimiento de los mismos. La mayoría de estas enzimas se encuentran presentes en el látex de muchas especies. El látex es una de las características más sobresalientes de las familias Apocynaceae, Euphorbiaceae y Moraceae (Rajesh et al., 2005).
La presencia de látex ha sido registrada en al menos 12 000 especies de plantas, pertenecientes a 900 géneros. Las enzimas detectadas en látex, tales como, proteasas y quitinasas, sugieren un rol en el mecanismo de defensa de las plantas contra patógenos, parásitos y herbívoros (Freitas et al., 2007).
Inhibidores de proteasas presentes en las plantas.
Según Rajesh et al., 2005, muchas plantas contienen inhibidores para enzimas, principalmente hidrolasas, inhibidores que generalmente son proteínas. Estos inhibidores forman complejos con las enzimas, bloqueando el sitio catalítico o modificando la conformación de la enzima, lo cual trae como consecuencia la reducción de la actividad catalítica.
Se han descrito inhibidores presentes en plantas que actúan selectivamente sobre amilasas de insectos sin afectar amilasas de mamíferos. Esta característica, es una de las más importantes para considerar la utilización de un inhibidor natural como pesticida.
Estos inhibidores son responsables de la toxicidad de algunas plantas hacia insectos, y su conocimiento es relativamente reciente.
La presencia, evolución, tipos y potenciales aplicaciones en la lucha contra insectos y patógenos de inhibidores de proteasas en diversas especies de plantas, han sido ampliamente revisados. Una de las fuentes de inhibidores de proteasas más estudiadas es la bacteria Bacillus thuringiensis. Inhibidores de proteasas, obtenidos de esta bacteria ya son aplicados de manera directa, o bien, los genes que codifican a los inhibidores son transferidos a las plantas de interés. Distribuidas en diversas especies de plantas, existen al menos 10 familias de inhibidores de proteasas, específicos para una de las cuatro clases características de proteasas (serín-, cisteín-, aspartil- y metalo proteasas), que son sintetizados a causa de una herida, por una serie de genes involucrados en sanar estas heridas y prevenir futuros ataques. Debido a que las plagas de importancia económica como los órdenes Lepidoptera, Diptera y Coleóptera, utilizan serín- y cisteín proteasas en sus sistemas digestivos para degradar proteínas que ingieren en el alimento, se han realizado esfuerzos para desarrollar plantas transgénicas utilizando clases de inhibidores que actúen sobre estas proteasas.
El objetivo de este trabajo es determinar la actividad inhibidora de proteasas de diferentes clases mecanísticas en extractos acuosos de los órganos vegetativos y reproductivos de Ismene amancaes (Ker Gawl.) Herb., "amancay" (Amaryllidaceae) especie endémica del Perú.
Material y métodos
Material biológico
El material estudiado corresponde a las recolecciones efectuadas en la expedición realizada por los autores a los alrededores del lugar denominado El Tablón (ruta Salpo-Rayampampa), al oeste de Salpo, distrito Salpo, provincia Otuzco, región La Libertad, Perú, entre las coordenadas geográficas 8o01’17,6" LS y 78o39’43,8" LO, 2134 m, 12-II-2017, S. Leiva & D. Alburqueque 6406 (HAO). Las recolecciones se encuentran depositadas principalmente en los Herbarios: HAO y HUT. Además, el estudio está basado en la revisión de material de estas instituciones botánicas, cuyas determinaciones registradas en las etiquetas han sido efectuadas por especialistas a través del tiempo, como: Meerow (U. S. A.) y Ravenna (Chile). Adicionalmente, se revisó los portales de instituciones extranjeras que alojan colecciones botánicas para las especies peruanas, tales como: Tropicos-Base de datos del Missouri Botanical Garden Herbarium (MO) (Tropicos, 2018) y The Field Museum (F) (The Field Museum, 2018).
La contrastación específica se efectuó con el "Catálogo de las Angiospermas y Gimnospermas del Perú" en el capítulo de Amaryllidaceae (Brako & Zarucchi, 1993) y sus adiciones (Ulloa et al., 2004). Así también, con el apoyo del "Catálogo de las Plantas Vasculares del Ecuador" (Jørgensen & León-Yánez, 1999). Para el caso de endemismos se consultó el "Libro rojo de las plantas endémicas del Perú" (León et al., 2006) y el "Libro Rojo de las Plantas Endémicas del Ecuador" (Valencia et al., 2000).
Para la especie se presenta fotografías, cuyos créditos pertenecen a los autores de este trabajo; asimismo, datos de su distribución geográfica y ecología, fenología, estado actual de conservación y usos. La distribución de la especie en el Perú se abrevia por región (=departamento) de acuerdo a los topónimos utilizados en Brako & Zarucchi (1993): AP= (Apurimac, CA=Cajamarca, CU= Cuzco, LI=Lima, LL=La Libertad.
La lista completa de sinónimos para la especie si las tuviera, así como la confirmación del nombre científico y nombres de los autores, pueden consultarse en el "Catálogo de las Angiospermas y Gimnospermas del Perú" y en los portales de internet: The Plant List (The Plant List, 2018) y Tropicos-Base de datos del Missouri Botanical Garden Herbarium (MO) (Tropicos, 2018). Los detalles completos de las publicaciones de la especie se encuentra en este último portal y en The International Plant Names Index (IPNI) (IPNI, 2017).
Los acrónimos de los herbarios son citados según Thiers (2018).
La especie se encuentra distribuida en la zona fitogeografica Amotape-Huancabamba en su parte sureña (Weigend, 2002, 2004). El estado de conservación de la especie presentada se encuentra en CITES Apendice II.
Metodología en la preparación de extractos acuosos a partir de plantas
Los análisis se realizaron en el Laboratorio de Proteómica de la Universidad Privada Antenor Orrego (UPAO) de la ciudad de Trujillo, Perú (Fig. 2., 3, 4, 5).
Los extractos acuosos son preparados mediante la homogenización de bulbos, hojas, escapos y flores en tampón apropiado (según la enzima) en una relación 1:2 (m:v).
Los homogenizados fueron centri-fugados a 18 000 g a 4°C durante 20 minutos y filtrados a través de lana de vidrio. Se determinó la concentración de proteínas a todos los extractos preparados y luego fueron liofilizados y conservados a -20°C hasta su utilización.
Clarificación de los extractos
A partir de los extractos acuosos obtenidos en la etapa anterior, se tomaron 1 muestra de cada uno de ellos y se clarificaron mediante el método de ácido tricloroacético. A todos los extractos clarificados, se les determinó la concentración de proteínas y actividad inhibitoria de tripsina.
a) Tratamiento ácido
Se evaluaron diferentes concentraciones de ácido tricloroacético (TCA), por ejemplo 2,5% y 5%. El tratamiento consistió en incubar durante 10 minutos y en agitación los extractos con una concentración final de TCA al 2,5% o 5%. La mezcla se dejó en reposo durante 1 hora y se centrifugó por 15 minutos a 10000 g a una temperatura de 4oC. El sobrenadante fue neutralizado hasta pH 7,0 con NaOH (2 mol/L). Para eliminar el TCA, la muestra fue dializada frente al agua bidestilada con membranas de diálisis de 1000 Da de tamaño de poro.
- Determinación de la concentración de proteínas
Mediante el método de ácido bicinconínico (BCA) (Smith et al., 1985).
Durante la purificación, se siguió la concentración de proteínas mediante la medición de la absorbancia a 280 nm con la utilización de 2 un coeficiente de extinción arbitrario igual a la unidad, para una concentración de proteínas de 1mg/ml y espesor de cubeta de 1 cm (Scopes, 1987).
- Determinación de la actividad inhibidora de proteasas de los extractos sin clarificar y los clarificados frente a proteasas de las 2 clases mecanísticas mediante combinación de métodos cinéticos e Intensity fading MS.
- Se determinó actividad inhibidora de proteasas a 6 muestras (2 de extractos acuosos sin clarificar, y 4 clarificados por tratamiento ácido) frente a proteasas de las 4 clases mecanísticas, por métodos cinéticos e Intensity fading MS.
Resultados y discusión
A continuación, se presenta la Fig. 1. de la determinación de la actividad proteolítica de los extractos crudos y clarificados de Ismene amancaes. Donde cada número significa lo siguiente:
Esto se debe a que normalmente a pH 8,0 se encuentran activas enzimas tanto serino como cisteino proteasa que son capaces de degradar el sustrato BAPA.
Para eliminar la actividad proteolítica presente en los extractos acuosos, se realizó el método de clarificacion con ácido TCA a dos concetraciones distintas a 2,5 y a 5%.
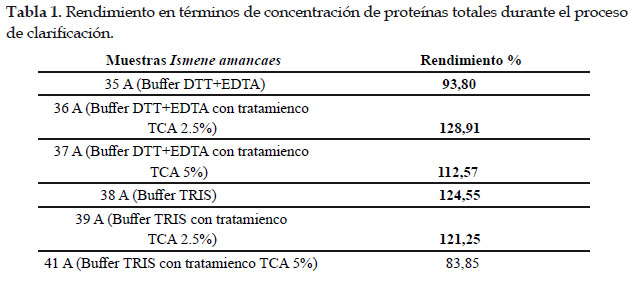
En la Tabla 1 se presenta la concentración de proteínas totales presentes en los extractos después de realizado el método de clarificación.
Como se puede observar en la tabla, los datos resaltados en negrita son aquellos extractos que son estables a los tratamientos realizados, en terminos de proteinas totales. Existen algunos que no resistieron los tratamientos por lo que, para obtener moléculas a partir de ellos no se deben realizar estos tratamientos.
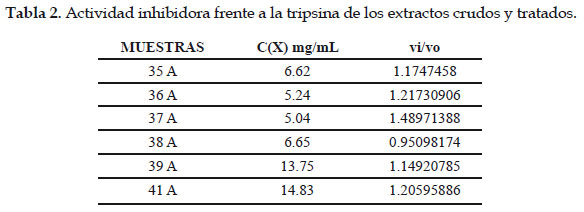
A continuación, se presenta la tabla sobre los resultados de la actividad inhibidora de los extractos acuosos.
Donde vi es la velocidad de la reacción en presencia del extracto y vo la velocidad de la reacción del ensayo control (sin extracto).
Como se puede observar en las tablas, ninguno de los extractos analizados presenta actividad inhibidora de tripsina, pues los resultados obtenidos fueron mayores a 0,8 de vi/vo en las condiciones trabajadas.
Conclusiones
- Los extractos presentaron actividad proteolítica frente a sustrato BAPA evaluado a pH 8,0.
- No se encontraron inhibidores de tripsina y, por lo tanto, tampoco de quimiotripsina en los tratamientos en estudios.
Agradecimientos
Los autores expresan su reconocimiento a las autoridades de la Universidad Privada Antenor Orrego de Trujillo, Perú, por su constante apoyo y facilidades para la realización de las expediciones botánicas. Asimismo, nuestra gratitud a Concytec que, gracias a su financiamiento económico (contrato n° 107-2015-FONDECYT), hizo posible la realización de la expedición a Salpo y, con ello, concluir este trabajo.
Contribución de los autores
D. A.: Exploraciones de campo, análisis de laboratorio y redacción del manuscrito original; M. Z.: Análisis de laboratorio y redacción del manuscrito original; L. B.: Análisis de laboratorio, análisis de resultados y redacción del manuscrito original. S. L.: Exploraciones de campo, toma de fotografías, redacción del manuscrito original: Los autores hemos leído el manuscrito final y autorizamos su publicación
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Literatura citada
Babu, S. R. & B. Subrahmanyam. 2010. Bio-potency of serine proteinase inhibitors from Acacia senegal seeds on digestive proteinases, larval growth and development of Helicoverpa armigera (Hübner). Pestic. Biochem. Physiol., 98: 349–358. [ Links ]
Barberis, S. E.; E. Quiroga; M. C. Arribére & N. Priolo. 2002. "Peptide synthesis in aqueous-organic biphasic systems catalyzed by a protease isolated from Morrenia brachystephana (Asclepiadaceae)". Journal of Molecular Catalysis B: Enzymatic, 17(1):39-47. [ Links ]
Brako, L. & J. Zarucchi. 1993. Catalogue of the flowering plants & gymnosperms of Peru. (Monographs in Systematic Botany vol. 45) Missouri Botanical Garden, St. Louis, MO. Pp1-1286. [ Links ]
Da Silva, D.; C. F. R. de Oliveira; J. R. P. Parra; S. Marangoni & M. L. R. Macedo. 2014. Short and long-term antinutritional effect of the trypsin inhibitor ApTI for biological control of sugarcane borer. Journal of Insect Physiology, 61: 1–7. [ Links ]
Freitas, C. D. T.; J. S. Oliveira, M. R. A. Miranda; N. M. R. Macedo; M. P. Sales; L. A. Villas-Boas & M. V. Ramos. 2007. "Enzymatic activities and protein profile of latex from Calotropis procera" Plant Physiology and Biochemistry, 45: 781-789. [ Links ]
IPNI. 2017. The International Plant Names Index. Disponible en: http://www.ipni.org/. Acceso: 30 de noviembre del 2017. [ Links ]
IUCN. 2012. The IUCN Red List of threatened species, version 2012.1. IUCN Red List Unit, Cambridge, UK, Available from: http://www.iucnredlist.org/ (accessed: 16 abril 2016). [ Links ]
IUCN Standards and Petitions Subcommittee. 2017. Guidelines for Using the IUCN Red List Categories and Criteria, versión 13. Prepared by the Standards an Petitions Subcommitee. Disponible en: http://www.iucnredlist.org/documents/Red List Guidelines.pdf. Acceso 30 de noviembre 2017. [ Links ]
Jamal, F.; D. Singh & P. K. Pandey. 2014. Negative Effects of a Nonhost Proteinase Inhibitor of 19.8 kDa from Madhuca indica Seeds on Developmental Physiology of Helicoverpa armigera (Hübner). BioMed Research International, 2014: 1-10. [ Links ]
Jørgensen, P. M. & S. León-Yánez. 1999. Catalogue of the Vascular Plants of Ecuador. Monogr. Syst. Bot. Missouri Bot. Garden. Vol. 75: 1-1181. [ Links ]
León B, A. Sagástegui, I. Sánchez, M. Zapata, A. Meerow & A. Cano. 2006. Amaryllidaceae endémicas del Perú. Rev. peru. biol. Número especial 13(2): 690s – 697. [ Links ]
Rajesh, R.; C. D. Raghavendra Gowda; A. Natarajo; B. L. Dhananjava; K. Kemparaju & B. S. Vishwanath. 2005. "Procoagulant activity of Calotropis gigantea latex associated with fibrin (ogen) olytic activity". Toxicon, 46: 84-92. [ Links ]
Scopes, R. 1987. Protein purification. Principles and practice. Springer- Verlag Series. [ Links ]
Smith, P.; R. Krohn; G. Hermanson; K. Mallia; H. Gartner; D. Provenzano; K. Fujimoto; M. Goeke; J. Olson & C. Klenk. 1985. Measurement of protein using bicinchoninic acid Anal Biochem. 150: 76–85. [ Links ]
Soto, M. & M. Leiva. 2015. Estudio exomrfológico y fitoquímico de los bulbos de dos especies endémicas del Perú de la familia Amarylledaaceae. Arnaldoa 22 (1): 269-288. [ Links ]
Stevens, P. & D. Hilary. 2017. Angiosperm Phylogeny Wetsite, version 13. http://www.mobot.org/MOBOT/research/APweb./. (Visitado 16 de noviembre del 2017). [ Links ]
The Field Museum. 2018. The Field Museum. Disponible en: http://emuweb.fieldmuseum.org/botany/detailed.php. Acceso: 12 de setiembre del 2016. [ Links ]
The Plant List. 2018. The Plant List. A working list of all plant species. Versión 1.1. 2016. Disponible en: http://www.theplantlist.org. Acceso: 22 de agosto del 2016. [ Links ]
Thiers, B. 2018. Index Herbariorum: A global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium. Disponible en: http://sweetgum.nybg.org/ih/. Acceso: 1 de agosto del 2016.
Tropicos. 2018. Tropicos.org. Missouri Botanical Garden. Disponible en: http://www.tropicos.org. Acceso: 18 de agosto del 2016. [ Links ]
Valencia, R.; N. Pitman; S. León-Yánez & P. M. Jørgensen (editores). 2000. Libro Rojo de las Plantas Endémicas del Ecuador. Herbario QCA, Pontificia Universidad Católica del Ecuador, Quito. 1–489 pp. [ Links ]
Ulloa, C.; J. Zarucchi & B. León. 2004. Diez años de adiciones a la flora del Perú: 1993-2003. Edición Especial de la revista Arnaldoa. [ Links ]
Valencia, R.; N. Pitman; S. León-Yánez & P. M. Jørgensen (editores). 2000. Libro Rojo de las Plantas Endémicas del Ecuador. Herbario QCA, Pontificia Universidad Católica del Ecuador, Quito. 1–489 pp. [ Links ]
Weigend, M. 2002. Observations on the Biogeography of the Amotape-Huancabamba Zone in Northern Peru. In: K. Young et al., Plant Evolution and Endemism in Andean South America. Bot. Review 68(1): 38–54. [ Links ]
Weigend, M. 2004. Additional observations on the biogeography of the Amotape-Huancabamba zone in Northern Peru: Defining the South-Eastern limits. Rev. per. biol. 11(2): 127-134. [ Links ]
Zhang, X.; Y. Li; J. Romeis; X. Yin; K. Wu & Y. Peng. 2014. Use of a Pollen-Based Diet to Expose the Ladybird Beetle Propylea japonica to Insecticidal Proteins. PLoS ONE, 9(1): e85395. [ Links ]
ANEXOS
Recibido 8-I-2018; aceptado: 28-II-2018; publicado online: 15-III-2018; publicado impreso: 30-IV-2018.