Introducción
Las comunidades biológicas se consideran sistemas porque las especies coexisten e interactúan en un espacio-tiempo determinado (partes e interacciones), en su sentido más clásico, que a su vez sus dinámicas evolucionan y cambian con el tiempo (Begon et al., 2006; Sebastián-Gonzáles et al., 2013). Estas últimas características son propias de un sistema adaptativo complejo debido a su capacidad para generar patrones emergentes a través de la auto organización de sus subsistemas y adaptación a lo largo del tiempo, resultado de procesos evolutivos (Kay et al., 1999; Earls, 2006; Cumming, 2011). A partir de esta capacidad inherente, estos tipos de sistemas evidencian patrones peculiares tales como múltiples estados alternativos o atractores, anidamiento de subsistemas, cambios poco predecibles, comportamientos no lineales, entre otros (Kay et al., 1999).
Estos patrones comunitarios, que dependen de la historia de ensamblaje de especies, pueden ser expresados a través de la diversidad y la estructura comunitaria. La diversidad de especies es el resultado de procesos de selección y adaptación mutua, así como de la persistencia de la composición de especies dentro de un ecosistema (Margalef, 2002). Un caso particular es la diversidad beta (o similitud de la estructura entre sitios), que evidencia el número efectivo de comunidades locales distintas de una región, es denominado como estados alternativos (Fukami & Nakajima, 2011). Estos estados alternativos tienden a permanecer dentro de un dominio determinado debido a ciertas combinaciones de parámetros que el sistema puede experimentar (Beisner et al., 2003; Cumming, 2011). Mediante estos patrones se pueden analizar en diferentes escalas espaciales y temporales que permitan una exploración de los mecanismos relacionados con su distribución, discutir posibles tendencias y establecer conjeturas ecológicas (Begon et al., 2006; Maestre & Escudero, 2008).
Los estudios de comunidades biológicas, desde el enfoque de sistemas complejos adaptativos, se han realizado generalmente en comunidades acuáticas donde están dominadas por las condiciones del agua (Petraitis & Dudgeon, 2004; Fung et al., 2011; Sánchez & Quinteros, 2017) y en comunidades vegetales asociadas a efectos del uso de suelos (Westoby et al, 1989; Laycock, 1991), con la finalidad de reconocer sus estados alternativos y comportamientos complejos de las comunidades biológicas a través del tiempo. En el caso de las aves terrestres, aunque no se han experimentado estos estudios desde esta perspectiva, podrían aportar conjeturas sobre los cambios de la estructura en la fauna en ecosistemas terrestres. Las aves serían buenos indicadores de cambios ambientales debido a su selección espacial y temporal de hábitats idóneos con respecto a las condiciones ambientales utilizadas como áreas de refugios, anidación y alimentación de aves (Cody, 1985, citado por Gibbons et al., 2016; Villegas & Garitano-Zavala, 2008). Asimismo, la alta diversidad y abundancia de aves en los ecosistemas altoandinos y la vasta información sobre su biología e historia natural de la mayoría de especies de aves (Fjeldså & Krabbe, 1990; Billerman et al., 2022) ayudan a plantear las interacciones con su medio.
En ese sentido, la presente investigación tuvo por objetivo principal reconocer las características de un sistema complejo adaptativo en la comunidad de aves a través de sus patrones espacio-temporales en un agroecosistema de la vertiente centro-occidental de los Andes (distrito de Cajatambo, provincia Cajatambo - Lima). El análisis se realizó a nivel temporal y espacio-temporal, a través de la diversidad y estados alternativos de la comunidad de aves, desde la perspectiva ecosistémica de los estados alternativos (cambio de régimen del sistema en respuesta a cambios en los parámetros del paisaje) según Beisner et al. (2003). La determinación de los patrones ayudará a sugerir procesos ecológicos importantes para la organización de las comunidades de aves, obtenidos desde el enfoque de sistemas complejos adaptativos.
Materiales y métodos
Estudio de caso
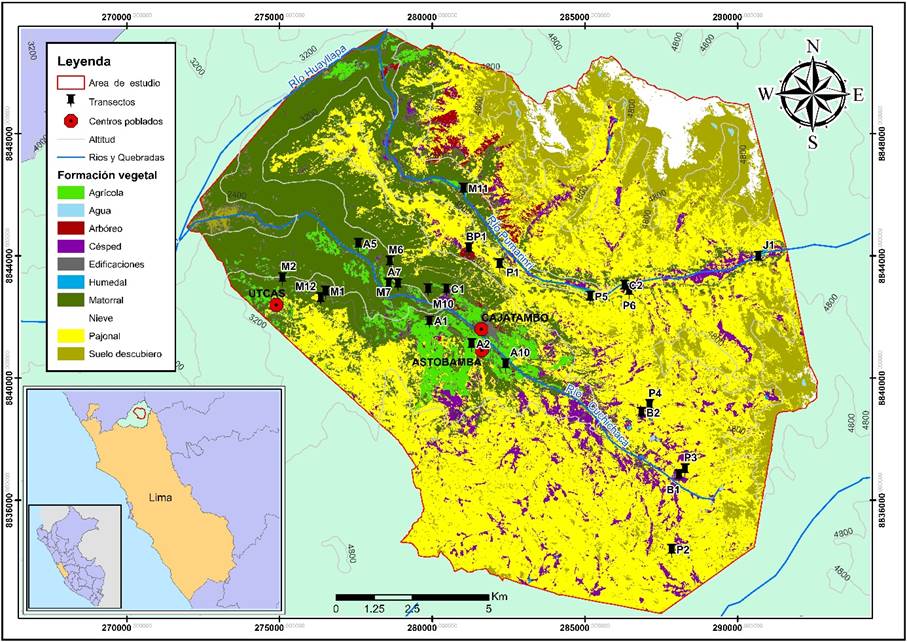
El estudio de caso está ubicado en el distrito de Cajatambo, perteneciente a la provincia de Cajatambo del departamento de Lima / Perú, al noreste de la ciudad capital (10°28' S, 76°59' O). Posee un área aproximada de 246.37 km2 y una variación altitudinal de 1 950 hasta 5 600 msnm, dentro de las cuencas principales del distrito, que son: Cuchichaca y Pumarinri. El distrito colinda al norte con la Zona Reservada Cordillera Huayhuash y el Área de Conservación Privada Huayllapa. El clima del distrito puede definirse por época lluviosa (diciembre - abril) y época seca (mayo - noviembre), y por cuatro tipos climáticos como lluvioso con otoño e invierno secos - frío, semiseco con otoño e inviernos secos; semiseco con invierno seco - frío y templado; semiárido con invierno seco - templado (SENAMHI, 2020). El área de estudio está presente en 2 de 15 ecorregiones, según Britto (2017): “Meso-Andina”, ubicado en las vertientes occidentales, laderas de valles interandinos y el altiplano, entre 2 500 a 3 800 msnm; y “Puna Húmeda-Seca”, incluye la franja andina de Arequipa a La Libertad, entre 3 800 y 4 200 msnm. En cuanto a las formaciones vegetales, se establecieron hasta 10 tipos, que destacan por su extensión el pajonal, los matorrales y campos agrícolas.
Los agroecosistemas del distrito de Cajatambo atraviesan cambios de cobertura vegetal por abandono, dado que la tendencia de las actividades agropecuarias no intensivas va en descenso en las áreas rurales (Quinteros & Sánchez, 2017). Walsh Perú (2009) reconoce abandonos de tierras agrícolas en las laderas del distrito, probablemente relacionado a diferentes procesos sociales y económicos que atravesó el distrito en las últimas décadas (Miranda, 2011). Este escenario permitió continuar las dinámicas naturales en las coberturas vegetales, tanto de persistencia y retorno (Castro, 2019), expresados en el desarrollo de la diversidad vegetal (y por extensión a otros grupos biológicos), en tanto las actividades humanas lo limite ((Quinteros & Sánchez, 2017).
Variables de la comunidad de aves
El registro de aves fue por observación directa mediante el método de transectos con franjas limitadas a 30 m en ambos lados y con una longitud aproximada de 500 m, considerando evitar los sesgos metodológicos como, por ejemplo, las condiciones atmosféricas extremas, el cambio de hábitat, la velocidad y el esfuerzo del muestreo (Bibby et al., 1992). En cada evaluación, se realizaron 24 transectos muestreados durante dos años: lluviosa y seca de los años 2015 y 2016. La cantidad de muestras fue determinada a partir de la delimitación de las formaciones vegetales, y sus respectivas superficies en el área de estudio, mediante el uso de un muestreo estratificado con afijación proporcional al área. En ese sentido, cada transecto fue circunscrito a las principales formaciones vegetales (Agrícola “A”, Matorral “M”, Pajonal “P”, Césped “C”, Bofedal “B”, Juncal “J” y Bosque de Polylepis “BP”), Figura 1. Las abundancias relativas de las especies fueron determinadas por el Índice de Abundancia Relativa al Espacio (IARE), como número de individuos observados en cada 100 m (Quinteros et al., 2002).
Análisis de datos
El análisis de los patrones temporales se realizó mediante los datos totales de cada evaluación (lluviosa 2015, seca 2015, lluviosa 2016, seca 2016), sin considerar la identificación de los transectos; mientras que, los patrones espacio-temporales se consideraron los datos de cada transecto según evaluación. Estos patrones fueron analizados a partir de la diversidad de especies y los estados alternativos comunitarios, según nivel de análisis:
La diversidad temporal fue comparada con los perfiles de diversidad de Renyi de cada evaluación. Estos perfiles muestran gráficamente las principales familias de índices de diversidad ordenadas según su sensibilidad a las especies raras hasta las dominantes mediante el parámetro α, los cuales tienen relación con los principales índices de diversidad como la riqueza (parámetro α = 0), Shannon (parámetro α = 1) y Simpson (parámetro α = 2), y permite una comparación visual del comportamiento de las diversidades de acuerdo al mencionado parámetro α (Tóthmérész, 1995; Hammer, 2019). La diversidad espacio-temporal fue analizada por la relación del promedio del índice de diversidad Inversa de Simpson y su coeficiente de variación temporal de todos los transectos, modificando el método de Véliz et al. (2002), al reemplazar el índice de Shannon-Wiener. El resultado de este análisis fue un gráfico de dispersión que permite interpretar patrones de la diversidad espacial a nivel de transecto y sus cambios a través del tiempo (Figura 5).
Los estados alternativos comunitarios fueron determinados a partir de Análisis de Conglomerados (índice de Bray-Curtis) y Análisis de Componentes Principales (ACP), contrastado por la prueba de Análisis de Variancia Multivariado No Paramétrico (NP-MANOVA) para confirmar estadísticamente la separación de las agrupaciones, de acuerdo a la metodología que proponen Sánchez & Quinteros (2017), incluyendo la corroboración del supuesto de Homogeneidad de Dispersión Multivariada (“Permutation test”) con el paquete “vegan” (Oksanen & Minchin, 2020). Asimismo, se proponen especies indicadoras a las que más contribuyen a la formación del estado alternativo, mediante el análisis de Porcentaje de Similitud (SIMPER). Estos análisis fueron realizados en el programa estadístico PAST 3.25 (Hammer, 2019).
Adicionalmente, el análisis espacio-temporal se representó mediante un Modelo de Estado-Transición que muestra de manera cuantitativa y gráfica las dinámicas de una comunidad biológica, reconociendo permanencias y cambios (reversibles e irreversibles) entre sus estados alternativos (Westoby et al., 1989). Con esta herramienta se determinaron las probabilidades de cambio y permanencia de estados alternativos, como sugiere Malpartida (2015), considerando como unidad de evaluación cada transecto y sus clasificaciones de estado alternativo a través del tiempo. El modelo de Estado-Transición de las comunidades de aves fue representado con los estados alternativos de la comunidad de aves y sus probabilidades de cambio con polígonos y flechas, respectivamente (Figura 2).
Resultados
Se registraron 97 especies de aves pertenecientes a 27 familias de 12 órdenes. Las especies con más IARE promedio en todas las evaluaciones fueron Zonotrichia capensis y Geospizopsis plebejus, con 0.5726 ind/100 m y 0.5620 ind/100 m por evaluación, respectivamente (Tabla 1).
Tabla 1 Lista de especies de aves registradas en la evaluación cuantitativa y sus respectivos Índices de Abundancias Relativas (IARE) por evaluación y total, entre los años 2015 y 2016
| Orden | Familia | Especie | Nombre común | IARE por evaluación (ind/100 m) | IARE total (ind/100 m) | |||
| Lluviosa 2015 | Seca 2015 | Lluviosa 2016 | Seca 2016 | |||||
| Apodiformes | Apodidae | Aeronautes andecolus | Vencejo Andino | 0.0450 | 0.0424 | 0.0000 | 0.2521 | 0.0855 |
| Apodiformes | Trochilidae | Aglaeactis cupripennis | Rayo-de-Sol Brillante | 0.1171 | 0.0085 | 0.0833 | 0.0000 | 0.0513 |
| Passeriformes | Tyrannidae | Agriornis montanus | Arriero de Pico Negro | 0.0090 | 0.0085 | 0.0417 | 0.0168 | 0.0192 |
| Passeriformes | Tyrannidae | Anairetes flavirostris | Torito de Pico Amarillo | 0.0000 | 0.0085 | 0.0000 | 0.0336 | 0.0107 |
| Passeriformes | Tyrannidae | Anairetes reguloides | Torito de Cresta Pintada | 0.0090 | 0.0932 | 0.0333 | 0.0252 | 0.0406 |
| Anseriformes | Anatidae | Anas flavirostris | Pato Barcino | 0.0180 | 0.0000 | 0.2250 | 0.0000 | 0.0620 |
| Passeriformes | Motacillidae | Anthus furcatus | Cachirla de Pico Corto | 0.0180 | 0.0508 | 0.0167 | 0.0840 | 0.0427 |
| Passeriformes | Furnariidae | Asthenes humilis | Canastero de Garganta Rayada | 0.0180 | 0.0000 | 0.0000 | 0.0420 | 0.0150 |
| Passeriformes | Furnariidae | Asthenes modesta | Canastero Cordillerano | 0.0000 | 0.0085 | 0.0000 | 0.0000 | 0.0021 |
| Passeriformes | Furnariidae | Asthenes pudibunda | Canastero de Quebradas | 0.0090 | 0.1356 | 0.0250 | 0.0756 | 0.0620 |
| Passeriformes | Passerellidae | Atlapetes nationi | Matorralero de Vientre Rojizo | 0.0090 | 0.0424 | 0.0000 | 0.0000 | 0.0128 |
| Passeriformes | Passerellidae | Atlapetes seebohmi | Matorralero de Corona Baya | 0.0631 | 0.0424 | 0.0500 | 0.0840 | 0.0598 |
| Psittaciformes | Psittacidae | Bolborhynchus orbygnesius | Perico Andino | 0.0000 | 0.0000 | 0.0250 | 0.0000 | 0.0064 |
| Passeriformes | Tyrannidae | Camptostoma obsoletum | Mosquerito Silbador | 0.0000 | 0.0424 | 0.0000 | 0.0000 | 0.0107 |
| Passeriformes | Thraupidae | Catamenia analis | Semillero de Cola Bandeada | 0.0000 | 0.2288 | 0.0583 | 0.0588 | 0.0876 |
| Passeriformes | Thraupidae | Catamenia inornata | Semillero Simple | 0.0270 | 0.0169 | 0.0333 | 0.1765 | 0.0641 |
| Charadriiformes | Laridae | Chroicocephalus serranus | Gaviota Andina | 0.0000 | 0.0000 | 0.0000 | 0.0084 | 0.0021 |
| Passeriformes | Furnariidae | Cinclodes albiventris | Churrete de Ala Crema | 0.2613 | 0.1780 | 0.2417 | 0.2605 | 0.2350 |
| Piciformes | Picidae | Colaptes atricollis | Carpintero de Cuello Negro | 0.0000 | 0.0085 | 0.0250 | 0.0000 | 0.0085 |
| Piciformes | Picidae | Colaptes rupicola | Carpintero Andino | 0.0450 | 0.0593 | 0.0500 | 0.0252 | 0.0449 |
| Apodiformes | Trochilidae | Colibri coruscans | Oreja-Violeta de Vientre Azul | 0.4955 | 0.0339 | 0.4917 | 0.0000 | 0.2500 |
| Passeriformes | Thraupidae | Conirostrum cinereum | Pico-de-Cono Cinéreo | 0.0360 | 0.0593 | 0.0583 | 0.0000 | 0.0385 |
| Passeriformes | Thraupidae | Diglossa brunneiventris | Pincha-Flor de Garganta Negra | 0.0000 | 0.0424 | 0.0167 | 0.0252 | 0.0214 |
| Passeriformes | Thraupidae | Diglossa sittoides | Pincha-Flor de Pecho Canela | 0.0000 | 0.0000 | 0.0167 | 0.0000 | 0.0043 |
| Passeriformes | Icteridae | Dives warczewiczi | Tordo de Matorral | 0.0901 | 0.0339 | 0.0917 | 0.0588 | 0.0684 |
| Falconiformes | Falconidae | Falco femoralis | Halcón Aplomado | 0.0000 | 0.0254 | 0.0250 | 0.0000 | 0.0128 |
| Falconiformes | Falconidae | Falco peregrinus | Halcón Peregrino | 0.0000 | 0.0000 | 0.0000 | 0.0168 | 0.0043 |
| Falconiformes | Falconidae | Falco sparverius | Cernícalo Americano | 0.0360 | 0.0847 | 0.0417 | 0.0252 | 0.0470 |
| Charadriiformes | Scolopacidae | Gallinago andina | Becasina de la Puna | 0.0180 | 0.1186 | 0.0417 | 0.0924 | 0.0684 |
| Passeriformes | Furnariidae | Geocerthia serrana | Bandurrita Peruana | 0.0090 | 0.0000 | 0.0000 | 0.0084 | 0.0043 |
| Passeriformes | Furnariidae | Geositta saxicolina | Minero Andino | 0.0541 | 0.0932 | 0.0250 | 0.0672 | 0.0598 |
| Passeriformes | Furnariidae | Geositta tenuirostris | Minero de Pico Largo | 0.0000 | 0.0085 | 0.0000 | 0.0504 | 0.0150 |
| Accipitriformes | Accipitridae | Geranoaetus melanoleucus | Aguilucho de Pecho Negro | 0.0270 | 0.0085 | 0.0000 | 0.0168 | 0.0128 |
| Accipitriformes | Accipitridae | Geranoaetus polyosoma | Aguilucho Variable | 0.1081 | 0.0508 | 0.0083 | 0.0420 | 0.0513 |
| Passeriformes | Grallariidae | Grallaria andicolus | Tororoi de Cabeza Listada | 0.0180 | 0.0169 | 0.0083 | 0.0168 | 0.0150 |
| Passeriformes | Furnariidae | Leptasthenura pileata | Tijeral de Corona Castaña | 0.0180 | 0.0085 | 0.0083 | 0.0504 | 0.0214 |
| Apodiformes | Trochilidae | Lesbia nuna | Colibrí de Cola Larga Verde | 0.0270 | 0.0000 | 0.0000 | 0.0000 | 0.0064 |
| Anseriformes | Anatidae | Lophonetta specularioides | Pato Crestón | 0.0000 | 0.0000 | 0.0083 | 0.0000 | 0.0021 |
| Apodiformes | Trochilidae | Metallura phoebe | Colibrí Negro | 0.0180 | 0.0339 | 0.0583 | 0.0420 | 0.0385 |
| Apodiformes | Trochilidae | Metallura tyrianthina | Colibrí Tirio | 0.0000 | 0.0085 | 0.0333 | 0.0084 | 0.0128 |
| Columbiformes | Columbidae | Metriopelia ceciliae | Tortolita Moteada | 0.0450 | 0.0254 | 0.3417 | 0.0756 | 0.1239 |
| Columbiformes | Columbidae | Metriopelia melanoptera | Tortolita de Ala Negra | 0.0450 | 0.1102 | 0.0667 | 0.1176 | 0.0855 |
| Passeriformes | Tyrannidae | Muscisaxicola cinereus | Dormilona Cinérea | 0.0000 | 0.0169 | 0.0000 | 0.0168 | 0.0085 |
| Passeriformes | Tyrannidae | Muscisaxicola flavinucha | Dormilona de Nuca Ocrácea | 0.0000 | 0.0000 | 0.0000 | 0.0084 | 0.0021 |
| Passeriformes | Tyrannidae | Muscisaxicola griseus | Dormilona de Taczanowski | 0.0360 | 0.0000 | 0.0250 | 0.0336 | 0.0235 |
| Passeriformes | Tyrannidae | Muscisaxicola juninensis | Dormilona de la Puna | 0.0090 | 0.0339 | 0.0417 | 0.0336 | 0.0299 |
| Passeriformes | Tyrannidae | Muscisaxicola maculirostris | Dormilona Chica | 0.0000 | 0.0000 | 0.0083 | 0.0588 | 0.0171 |
| Passeriformes | Tyrannidae | Muscisaxicola rufivertex | Dormilona de Nuca Rojiza | 0.0000 | 0.0169 | 0.0667 | 0.0000 | 0.0214 |
| Passeriformes | Tyrannidae | Myiarchus tuberculifer | Copetón de Cresta Oscura | 0.0090 | 0.0000 | 0.0083 | 0.0000 | 0.0043 |
| Passeriformes | Tyrannidae | Myiotheretes striaticollis | Ala-Rufa de Garganta Rayada | 0.0360 | 0.0085 | 0.0000 | 0.0084 | 0.0128 |
| Apodiformes | Trochilidae | Myrtis fanny | Estrellita de Collar Púrpura | 0.0000 | 0.0085 | 0.0000 | 0.0168 | 0.0064 |
| Tinamiformes | Tinamidae | Nothoprocta ornata | Perdiz Cordillerana | 0.0270 | 0.0085 | 0.0000 | 0.0000 | 0.0085 |
| Tinamiformes | Tinamidae | Nothoprocta pentlandii | Perdiz Andina | 0.0000 | 0.0085 | 0.0000 | 0.0000 | 0.0021 |
| Passeriformes | Tyrannidae | Ochthoeca leucophrys | Pitajo de Ceja Blanca | 0.0180 | 0.0169 | 0.0333 | 0.0504 | 0.0299 |
| Passeriformes | Tyrannidae | Ochthoeca oenanthoides | Pitajo de d’Orbigny | 0.0000 | 0.0000 | 0.0000 | 0.0084 | 0.0021 |
| Passeriformes | Thraupidae | Conirostrum binghami | Pico-de-Cono Gigante | 0.0180 | 0.0000 | 0.0000 | 0.0000 | 0.0043 |
| Apodiformes | Trochilidae | Oreotrochilus estella | Estrella Andina | 0.0000 | 0.0169 | 0.0167 | 0.0084 | 0.0107 |
| Anseriformes | Anatidae | Oressochen melanopterus | Cauquén Huallata | 0.0000 | 0.1864 | 0.0417 | 0.0588 | 0.0726 |
| Passeriformes | Hirundinidae | Orochelidon andecola | Golondrina Andina | 0.0360 | 0.0593 | 0.0000 | 0.0168 | 0.0278 |
| Passeriformes | Hirundinidae | Orochelidon murina | Golondrina de Vientre Pardo | 0.0000 | 0.0000 | 0.0000 | 0.0672 | 0.0171 |
| Columbiformes | Columbidae | Patagioenas fasciata | Paloma de Nuca Blanca | 0.0000 | 0.0000 | 0.0083 | 0.0000 | 0.0021 |
| Apodiformes | Trochilidae | Patagona gigas | Colibrí Gigante | 0.1441 | 0.0847 | 0.1083 | 0.0420 | 0.0940 |
| Falconiformes | Falconidae | Phalcoboenus megalopterus | Caracara Cordillerano | 0.0811 | 0.0847 | 0.0167 | 0.1008 | 0.0705 |
| Passeriformes | Cardinalidae | Pheucticus chrysogaster | Picogrueso Dorado | 0.0631 | 0.0085 | 0.0167 | 0.0000 | 0.0214 |
| Passeriformes | Thraupidae | Rhopospina alaudina | Fringilo de Cola Bandeada | 0.0000 | 0.0000 | 0.0083 | 0.0000 | 0.0021 |
| Passeriformes | Thraupidae | Rhopospina fruticeti | Fringilo de Pecho Negro | 0.3604 | 0.3051 | 0.2750 | 0.2353 | 0.2927 |
| Passeriformes | Thraupidae | Geospizopsis plebejus | Fringilo de Pecho Cenizo | 0.2342 | 0.8983 | 0.3917 | 0.7059 | 0.5620 |
| Passeriformes | Thraupidae | Phrygilus punensis | Fringilo Peruano | 0.0180 | 0.0847 | 0.0250 | 0.3025 | 0.1090 |
| Passeriformes | Thraupidae | Geospizopsis unicolor | Fringilo Plomizo | 0.0541 | 0.1356 | 0.0000 | 0.0336 | 0.0556 |
| Passeriformes | Thraupidae | Rauenia bonariensis | Tangara Azul y Amarilla | 0.0180 | 0.0339 | 0.0167 | 0.0000 | 0.0171 |
| Passeriformes | Thraupidae | Pipraeidea melanonota | Tangara de Pecho Anteado | 0.0270 | 0.0000 | 0.0000 | 0.0000 | 0.0064 |
| Passeriformes | Cardinalidae | Piranga flava | Piranga Bermeja | 0.0090 | 0.0085 | 0.0083 | 0.0168 | 0.0107 |
| Pelecaniformes | Threskiornithidae | Plegadis ridgwayi | Ibis de la Puna | 0.0000 | 0.5339 | 0.0000 | 0.2773 | 0.2051 |
| Passeriformes | Tyrannidae | Cnemarchus rufipennis | Ala-Rufa Canelo | 0.0090 | 0.0000 | 0.0000 | 0.0084 | 0.0043 |
| Apodiformes | Trochilidae | Polyonymus caroli | Cometa de Cola Bronceada | 0.0000 | 0.0424 | 0.0000 | 0.0672 | 0.0278 |
| Passeriformes | Thraupidae | Poospiza hispaniolensis | Monterita Acollarada | 0.0000 | 0.0000 | 0.0000 | 0.0168 | 0.0043 |
| Psittaciformes | Psittacidae | Psittacara wagleri | Cotorra de Frente Escarlata | 0.0901 | 0.0000 | 0.0000 | 0.0000 | 0.0214 |
| Apodiformes | Trochilidae | Rhodopis vesper | Colibrí de Oasis | 0.0000 | 0.0254 | 0.0000 | 0.0000 | 0.0064 |
| Passeriformes | Thraupidae | Saltator aurantiirostris | Saltador de Pico Dorado | 0.0270 | 0.0085 | 0.0333 | 0.0084 | 0.0192 |
| Passeriformes | Thraupidae | Sicalis olivascens | Chirigüe Verdoso | 0.0270 | 0.3559 | 0.0917 | 0.0000 | 0.1197 |
| Passeriformes | Thraupidae | Sicalis uropygialis | Chirigüe de Lomo Brillante | 0.1892 | 0.3644 | 0.1833 | 0.7815 | 0.3825 |
| Passeriformes | Fringillidae | Spinus atratus | Jilguero Negro | 0.0180 | 0.0085 | 0.1083 | 0.0840 | 0.0556 |
| Passeriformes | Fringillidae | Spinus magellanicus | Jilguero Encapuchado | 0.1351 | 0.0847 | 0.0750 | 0.5210 | 0.2051 |
| Passeriformes | Thraupidae | Sporophila simplex | Espiguero Simple | 0.0000 | 0.0000 | 0.0000 | 0.0084 | 0.0021 |
| Apodiformes | Apodidae | Streptoprocne zonaris | Vencejo de Collar Blanco | 1.0541 | 0.0000 | 0.0000 | 0.0420 | 0.2607 |
| Apodiformes | Trochilidae | Thaumastura cora | Colibrí de Cora | 0.0000 | 0.0085 | 0.0000 | 0.0000 | 0.0021 |
| Charadriiformes | Thinocoridae | Thinocorus orbignyianus | Agachona de Pecho Gris | 0.0180 | 0.0000 | 0.0000 | 0.0168 | 0.0085 |
| Passeriformes | Thraupidae | Thlypopsis ornata | Tangara de Pecho Rufo | 0.0450 | 0.0000 | 0.0083 | 0.0000 | 0.0128 |
| Passeriformes | Troglodytidae | Troglodytes aedon | Cucarachero Común | 0.2703 | 0.2373 | 0.1333 | 0.1261 | 0.1902 |
| Passeriformes | Turdidae | Turdus chiguanco | Zorzal Chiguanco | 0.2252 | 0.2119 | 0.2583 | 0.2101 | 0.2265 |
| Passeriformes | Turdidae | Turdus fuscater | Zorzal Grande | 0.0090 | 0.0000 | 0.0000 | 0.0000 | 0.0021 |
| Passeriformes | Furnariidae | Upucerthia validirostris | Bandurrita de Pecho Anteado | 0.0090 | 0.0000 | 0.0250 | 0.0084 | 0.0107 |
| Charadriiformes | Charadriidae | Vanellus resplendens | Avefría Andina | 0.0000 | 0.0169 | 0.0000 | 0.0000 | 0.0043 |
| Cathartiformes | Cathartidae | Vultur gryphus | Cóndor Andino | 0.1351 | 0.0339 | 0.0333 | 0.0336 | 0.0577 |
| Passeriformes | Thraupidae | Xenodacnis parina | Azulito Altoandino | 0.0450 | 0.0339 | 0.0083 | 0.1765 | 0.0662 |
| Columbiformes | Columbidae | Zenaida auriculata | Tórtola Orejuda | 0.0721 | 0.0085 | 0.0000 | 0.0504 | 0.0321 |
| Passeriformes | Passerellidae | Zonotrichia capensis | Gorrión de Collar Rufo | 0.5766 | 0.4407 | 0.3333 | 0.9412 | 0.5726 |
Nota: Lista taxonómica actualizada según la Lista de aves del Perú (Plengue, 2024).
Análisis de patrones temporales
La diversidad temporal no presentó diferencias entre las cuatro evaluaciones debido al entrecruzamiento de los perfiles de diversidad (Tóthmérész, 1995), aunque existió una tendencia de mayor diversidad por las especies raras (α = 0) y por dominancia de especies (α = 2) en las épocas secas y lluviosas, respectivamente (Figura 2). La diversidad por dominancia es explicada por las altas abundancias relativas de individuos juveniles y adultos de especies gregarias en las épocas secas que afectan inversamente en los valores de diversidad.
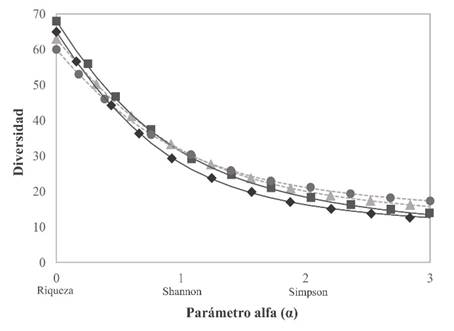
Triangulo = lluviosa 2015, cuadrado = seca 2015, círculo = lluviosa 2016, rombo = seca 2016. Parámetro α relacionado a los principales índices de diversidad.
Figura 2 Perfil de diversidad temporal de Renyi en las diferentes evaluaciones.
A partir del análisis de conglomerados (Figura 3) se evidenciaron dos posibles estados alternativos comunitarios temporales asociados a las épocas lluviosas y secas; sin embargo, no registraron diferencias significativas por la prueba NP-MANOVA (FBray-Curtis = 2.284, p-valorBray-Curtis= 0.340). Este resultado estadístico exploratorio evidenció la variación de la composición de especies registradas, por medio de los dos primeros componentes principales del ACP (Figura 4):
El componente 1 (% var. = 61.298 evidenció la separación de las evaluaciones según la época lluviosa y seca. La especie Colibri coruscans (coco) estuvo asociada a las épocas lluviosas debido a que tiene preferencia de flores, especialmente de eucalipto (Schulenberg et al., 2010); mientras en las épocas secas, la abundancia de esta especie disminuye debido a que presenta desplazamientos locales (Zerda-Ordoñez, 1994). Las especies Sicalis uropygialis (siur) y Geospizopsis plebejus (geple) fueron asociadas a las épocas secas debido a sus comportamientos gregarios post-reproductivos (Fjeldså & Krabbe, 1990), ya que se registraron junto con individuos juveniles.
En el componente 2 (% var. = 28.738), los datos sugieren que existen variaciones composicionales de la comunidad de aves en las épocas secas debido a alguna variable temporal y/o patrones caóticos aún no determinados. Este componente evidenció una correlación positiva de la evaluación seca 2015 con las especies Sicalis olivaceus (siol) y Geospizopsis plebejus (geple), mientras la evaluación seca 2016 con Zonotrichia capensis (zoca) y Spinus magellanicus (spima).
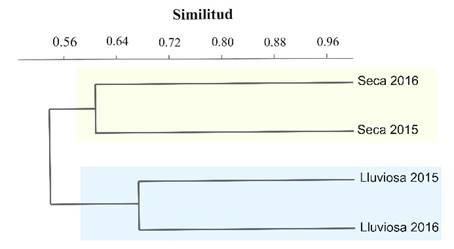
Figura 3 Asociación temporal de las comunidades de aves, mediante el análisis de conglomerados (índice de similitud de Bray-Curtis).
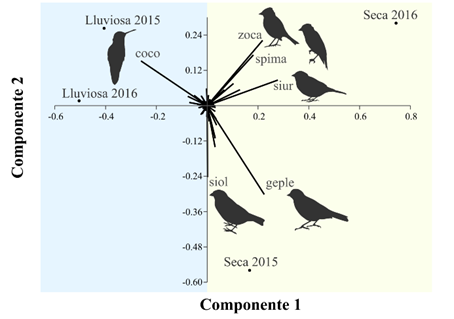
Figura 4 Componentes principales temporales de la comunidad de aves, incluyendo las especies con mayor peso (“loading”) en el ACP.
Mediante este resultado se sugiere que el atractor temporal de la comunidad de aves en la época seca posee mayor redundancia funcional que la época lluviosa debido a su variabilidad de composición temporal de especies. Esta sugerencia fue asociada principalmente a que estas especies poseen similares características funcionales, ya que son aves de tamaño mediano-pequeño, con alimentación principalmente granívora y de estrato bajo (Clement, 2020; Jaramillo & Kirwan, 2020; Jaramillo, 2020; Rising & Jaramillo, 2020; Schulenberg, 2020). Este patrón es considerado como un mecanismo de reemplazo de especies con similares características funcionales, como respuesta a cambios externos, sin alterar los procesos ecológicos en el sistema (Sánchez, 1992).
Análisis de patrones espacio-temporales
A partir de la relación de la diversidad alfa promedio (Inversa de Simpson) y su respectivo coeficiente de variación (%) espacio-temporal evidenció la importancia de las formaciones vegetales, a nivel de promedios de la diversidad (Figura 5). Los transectos con alta diversidad fueron asociados a bosque de Polylepis, incluso ciertos matorrales y campos agrícolas, mientras que los transectos con baja diversidad fueron asociados al césped y juncal. Este patrón a grandes rasgos coincide con lo propuesto por Sevillano-Ríos (2020) que la menor biodiversidad de aves en la vertiente centro-occidental de los andes peruanos se encuentra en los pisos altitudinales bajos y altos debido al factor de la aridez.
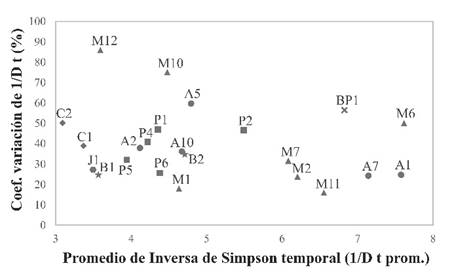
Formación vegetal: campo agrícola (círculo), matorral (triángulo), bosque de Polylepis (aspa), pajonal (cuadrado), bofedal (estrella), césped (rombo), juncal (hexágono).
Figura 5 Relación de la diversidad temporal promedio y su coeficiente de variación de cada transecto.
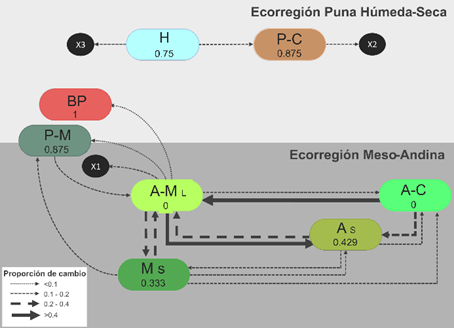
En cuanto a los estados alternativos espacio-temporales de la comunidad de aves, se explicita la diferenciación de su configuración en dos escalas: estados alternativos de macro-escala y meso-escala, denominados por su agrupación dependiendo de su escala espacial, ya que abarcan a nivel de pisos ecológicos altitudinales y formaciones vegetales, respectivamente. En total se determinaron dos estados alternativos de macro-escala, asociados a la complejidad de estructura vegetal matriz y gradiente altitudinal, y ocho estados alternativos de meso-escala que están relacionados a una o más formaciones vegetales y la variación temporal de la comunidad (Figura 6), además de sus especies indicadoras según el análisis SIMPER (Tabla 2). Los resultados de NP-MANOVA (FBray-Curtis = 9.024, p-valorBray-Curtis = 0.001, Tabla 3) y su respectiva prueba de homocedasticidad de dispersiones multivariada (Permutación = 999, F = 0.951, p-valor = 0.444) corroboran dichos estados alternativos, dejando de lado a los transectos que no se asociaron a estas clasificaciones.
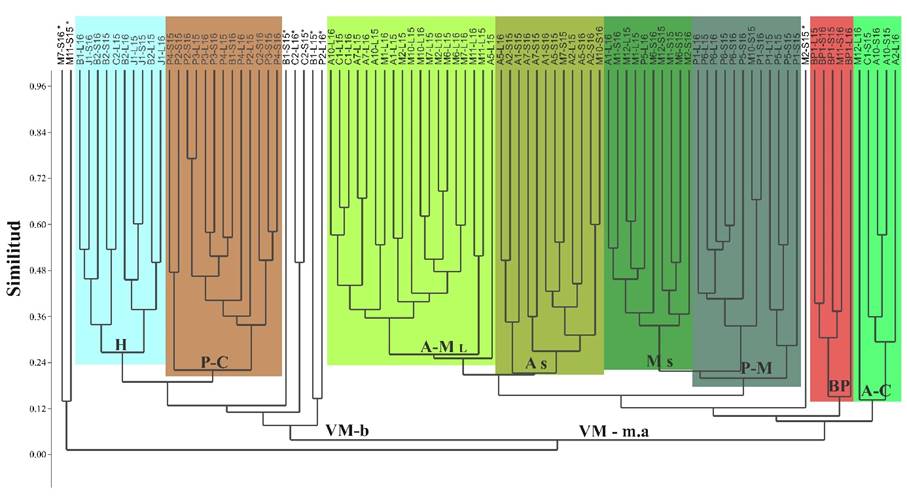
Los códigos de los transectos en la parte superior fueron identificados por su época y año, agregándole: L = época lluviosa, S = época seca, 15 = año 2015 y 16 = año 2016. Los nombres de las siglas del gráfico se encuentran en la Tabla 2. *Transectos no agrupados
Figura 6 Estados alternativos espacio-temporales de la comunidad de aves a nivel de macro-escala (base) y meso-escala (ramas) a partir del análisis de conglomerados.
Tabla 2 Propuesta de especies indicadoras (E.I) según cada estado alternativo comunitario, mediante el análisis SIMPER.
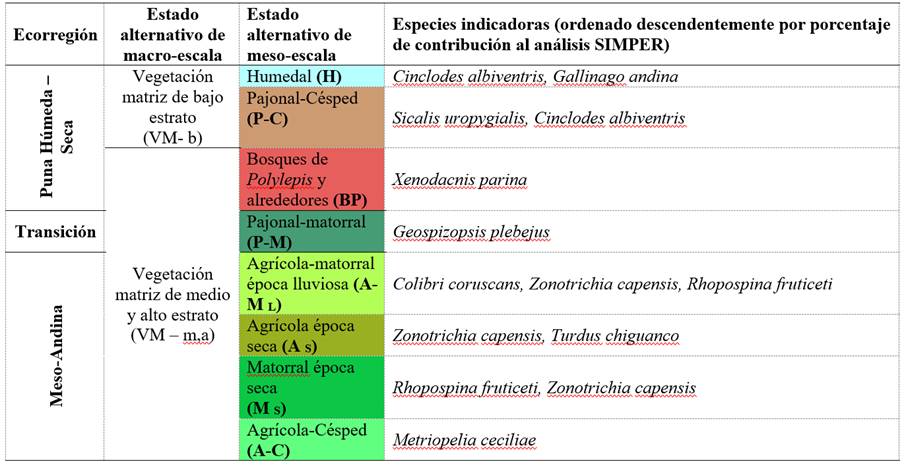
Tabla 3 NP-MANOVA de los estados alternativos a nivel de meso-escala (derecha: p-valor mediante la significancia secuencial de Bonferroni, izquierda: valores de F)
| Estados alternativos | A-C | A-M L | M S | A S | BP | P-M | H | P-C |
| A-C | 0 | 0.0004 | 0.0012 | 0.0004 | 0.0081 | 0.0007 | 0.0016 | 0.0007 |
| A-M L | 6.131 | 0 | 0.0001 | 0.0001 | 0.0001 | 0.0001 | 0.0001 | 0.0001 |
| M s | 8.236 | 8.271 | 0 | 0.0001 | 0.0004 | 0.0001 | 0.0001 | 0.0001 |
| A s | 4.546 | 6.231 | 6.265 | 0 | 0.0003 | 0.0001 | 0.0001 | 0.0001 |
| BP | 4.879 | 6.925 | 6.185 | 4.72 | 0 | 0.0002 | 0.0007 | 0.0002 |
| P-M | 6.554 | 10.9 | 5.346 | 7.84 | 4.505 | 0 | 0.0001 | 0.0001 |
| H | 7.576 | 15.72 | 12.82 | 10.96 | 6.532 | 9.091 | 0 | 0.0001 |
| P-C | 8.938 | 19.95 | 14.75 | 13.72 | 7.519 | 8.51 | 6.532 | 0 |
Estados alternativos de la comunidad de aves: agrícola - césped (A-C), agrícola - matorral en temporada lluviosa (A-M L), matorral en temporada seca (M S), agrícola en temporada seca (A S), Bosque de Polylepis y alrededores (BP), pajonal-matorral (P-M), humedal (H) y pajonal-césped (P-C).
En el estado alternativo a nivel de macro-escala “Vegetación matriz de bajo estrato” (VM - b) se determinaron dos estados alternativos a nivel de meso-escala:
“Humedal” (H): comunidad asociada principalmente a bofedales y juncales, y ciertas zonas que temporalmente pueden tener esta condición muy húmeda en la puna (Gibbons et al., 2016)
“Pajonal-césped” (P-C): comunidad relacionada a la matriz principal de la puna que conforman el pajonal y césped, con cierto grado de humedad, denominados también praderas de puna (Gibbons et al., 2016).
En el estado alternativo a nivel de macro-escala “Vegetación matriz de medio y alto estrato” (VM - m,a) se determinaron seis estados alternativos a nivel de meso-escala:
“Bosque de Polylepis y alrededores” (BP): comunidad relacionada a los bosques de Polylepis, compuestos a su vez por arbustos generalmente del género Gynoxis, con una alta presencia de Xenodacnis parina, como especie parcialmente especialista de estas formaciones vegetales (Schulenberg et al., 2010), además de contar con especies de matorral y pajonal de sus alrededores.
“Pajonal-matorral” (P-M): comunidad asociada a pajonal-césped con especies arbustivas, denominado como estado alternativo intermedio entre la ecorregión Puna Húmeda-Seca y Meso-Andina (Britto, 2017), siendo una transición de la composición de aves.
“Agrícola-matorral época lluviosa” (A-M L): comunidad relacionada a la agrupación de diferentes campos agrícolas y matorrales en las épocas lluviosas, destacando Colibri coruscans.
“Agrícola época seca” (A S): representa a la comunidad de campos agrícolas en la temporada seca; generalmente son campos de cultivos para forraje (p.e. Cenchrus clandestinum “kikuyo” y Medicago sativa “alfalfa”) y agricultura familiar, con bordes de cobertura arbustiva seca y arvenses que crecen en la temporada de barbecho.
“Matorral época seca” (M S): conformado por la comunidad de matorral arbustivo en las evaluaciones de la temporada seca o de ambientes secos, que incluyen especies vegetales xerofíticas, también denominado matorrales montanos áridos (Stotz et al., 1996).
“Agrícola-césped” (A-C): representa a la comunidad de campos agrícolas poco densos o césped, generalmente con cultivos para forraje de ganados con pocos o sin bordes arbustivos, asociándose aves de hábitats abiertos y secos, por ejemplo, Metriopelia ceciliae (Schulenberg et al., 2010).
A partir de la determinación de los estados alternativos, se propone un modelo de estado transición de las comunidades de aves de acuerdo a la persistencia/cambio de estados alternativos por transectos (Figura 7). Las proporciones de persistencia fueron mayores en estados alternativos ubicados en la ecorregión Puna Húmeda-Seca que en la ecorregión Meso-Andina, caso contrario, en la conectividad y proporción de flujo de configuración de aves. Entre los estados alternativos con mayor persistencia está la comunidad de aves de “Bosque de Polylepis y alrededores” registrado en un solo transecto, la que refleja una alta resiliencia por mantenerse en el mismo estado alternativo. Caso contrario, los estados alternativos de las comunidades de aves “Agrícola-Matorral en época lluviosa” y “Agrícola-Césped” obtuvieron proporciones sin persistencia que evidencia su presencia temporal. Cabe señalar que, se incluyeron los transectos que no fueron asociados a algún estado alternativo, que podrían denominarse como “estados alternativos transitorios” (símbolo X) ya que las comunidades no han alcanzado un estado estable y varían su estructura (composición y abundancia de especies) debido al historial de inmigración variable y otros procesos estocásticos (Fukami & Nakajima, 2011).
Discusión
De la interpretación de los patrones espacio-temporal emergieron diferentes patrones de las comunidades de aves relacionándolos con características de Sistemas Complejos Adaptativos (CAS), según Kay et al. (1999) y Earls (2006). (1) La autoorganización fue determinada por la presencia de constricciones por una o más formaciones vegetales y su temporalidad, así también por la redundancia funcional de especies en las épocas secas. (2) El incremento de la complejidad (heterogeneidad entre los elementos) por la mayor cantidad de estados alternativos comunitarios en algunas formaciones vegetales que en otras. (3) Los patrones caóticos fueron determinados en la variación de la composición temporal en las épocas secas y las dinámicas inesperadas de cambio de estados alternativos espacio-temporal (un caso especial son los estados alternativos transitorios). (4) El anidamiento de sistemas (en este caso de comunidades de aves) en diferentes escalas espaciales y temporales expresadas en sus estados alternativos de macro-escala y meso-escala. (5) La presencia de múltiples estados alternativos en las comunidades de aves, tanto en el análisis espacio-temporal (ocho estados alternativos de meso-escala), como probablemente en el análisis temporal (dos estados alternativos asociados a la época lluviosa y seca). Mediante estas características se pueden proponer ciertos factores ecológicos que influyen en la comunidad de aves dentro del agroecosistema del distrito de Cajatambo.
La disponibilidad de agua es un factor importante en las comunidades silvestres y antrópicas en zonas áridas o semi-áridas debido a su aporte en el desencadenamiento de diferentes funciones ecosistémicas (Martínez, 2006). En general, se registró que las descargas de agua del nivel freático al superficial y aguas de escorrentía tienen gran importancia para las aves como bebederos, especialmente en épocas secas. En el caso los estados alternativos de la ecorregión Meso-Andina, se pueden describir dos tipos de retroalimentaciones, según Chapin et al. (2009), debido al régimen hídrico entre épocas, específicamente la dinámica del estado alternativo Agrícola-Matorral en época lluviosa (A-M ll) a otros estados alternativos en las épocas secas. Las épocas lluviosas causaron una retroalimentación estabilizadora para la configuración de la comunidad de aves en las áreas de matorral y campos agrícolas, ya que tienden a reducir las fluctuaciones en las velocidades del proceso de formación de estados alternativos; en cambio, las épocas secas causaron una retroalimentación amplificadora, ya que aumentaron los cambios en las tasas de proceso (mayor proporción de cambios de estado alternativo) y tienden a desestabilizar a la comunidad, dividiendo hasta tres estados alternativos temporales más comunes. Esta retroalimentación amplificadora se podría evidenciar también en su mayor redundancia funcional de especies en esta época, de acuerdo a lo sugerido anteriormente. Mientras en los estados alternativos de la ecorregión Puna Húmeda-Seca, el factor hídrico (como almacenamiento de agua) es muy importante, ya que muchas especies están asociadas a humedales, expresándose en el estado alternativo de comunidades de humedales (“H”). La importancia ecológica de los humedales altoandinos es relevante para los procesos reproductivos de las especies de aves y/o como oasis en la puna frecuentemente seca (Gibbons et al., 2016).
Otro factor importante para la comunidad de aves en los agroecosistemas es la complejidad de la estructura vegetal en el paisaje (Klein et al., 2023). Esta complejidad vegetal cobra mayor relevancia en las épocas secas, por ejemplo, el bosque de Polylepis tiene una función importante para las comunidades de matorral adyacente en épocas secas ya que es un hábitat que mantiene la humedad y protege del calor a las especies de aves (Sevillano, 2016). En cambio, los campos agrícolas con baja cobertura vegetale arbustiva y césped (asociados al estado alternativo agrícola-césped) obtuvieron baja diversidad y permanencia nula en el estado alternativo, sobre todo en épocas secas, debido a la mayor exposición al sol. En ese sentido, la conservación y uso sostenible de los ambientes con cobertura arbórea y arbustiva silvestre es importante para la comunidad de aves en las zonas áridas.
La diversidad de especies es considerada como indicador de la complejidad y estabilidad de los agroecosistemas (Sans, 2007; Salinas et al., 2007), dejando de lado los procesos y flujos de la configuración de la comunidad de aves, que se podría evidenciar mediante la determinación de sus estados alternativos. Incluir el modelo de estado-transición de las comunidades espacio-temporales de aves podrían aportar adicionalmente en la definición de la complejidad de las comunidades biológicas, reconociendo sus interacciones asociadas a sus principales factores ecológicos. Por ejemplo, el reconocimiento de múltiples estados alternativos espacio-temporales (variedad de reorganización de la comunidad), alta diversidad espacio-temporal (variedad de especies) y las proporciones de persistencia-cambio entre estados alternativos (variedad de intensidad de flujos en la configuración comunitaria) en las formaciones vegetales de matorral y campos agrícolas evidenciaron una mayor complejidad a diferencia de otras comunidades, según la escala establecida en el área de estudio. Se sugiere que estas variables podrían describir la complejidad de manera exploratoria en los patrones espacio-temporales comunitarios, ya que está relacionada directamente con la información del sistema (Earls, 2006). En resumen, acorde a la Ley de Ashby (“la complejidad del sistema tiene que ser mayor o igual a la complejidad de su ambiente”), la complejidad de las comunidades de aves de la ecorregión Meso-Andina, a diferencia de la comunidad de la ecorregión Puna Húmeda-Seca, podría tener mayor adaptabilidad a la estocasticidad ambiental debido a que posee una mayor cantidad de estados alternativos y alta proporción de cambios entre sí.
Conclusiones
Se describieron las características de sistemas complejos adaptativos en las comunidades de aves del distrito de Cajatambo, tales como la auto-organización, incremento de la complejidad, patrones caóticos, comportamiento de sistemas (comunidades) anidados, y múltiples estados alternativos, que ayudan a comprender su organización y dinámica en las escalas temporales y espacio-temporales.
Los patrones temporales de las comunidades de aves del distrito no presentaron significancia estadística; sin embargo, se sugieren dos estados alternativos temporales dadas las épocas lluviosas y secas, en el que sugiere una mayor redundancia funcional en la época seca por especies granívoras y pequeñas.
En el caso de los patrones espacio-temporales, las comunidades de aves presentaron dos estados alternativos de macro-escala y dentro de ellas ocho estados alternativos de meso-escala con sus respectivas especies indicadoras. Estos estados alternativos estuvieron asociados a una o dos formaciones vegetales predominantes y temporalidad. Los estados alternativos con mayor dinámica fueron los relacionados a matorrales y campos agrícolas, mientras que los que obtuvieron mayor persistencia fueron los relacionados con bosque de Polylepis, pajonales y humedales.
Los factores ecológicos importantes para la comunidad de aves, a partir de la determinación de estados alternativos, fueron la disponibilidad de agua y la estructura vegetal presente en el agroecosistema en estudio. La disponibilidad de agua promovió la reorganización de las comunidades de aves de la ecorregión Meso-Andina, evidenciándose retroalimentaciones relacionadas por su menor y mayor tasa de cambio de estados alternativos en la época lluviosa y seca, respectivamente. Asimismo, la estructura vegetal, expresada en la variedad de formaciones vegetales, estuvieron asociadas a los estados alternativos de las comunidades de aves, incluso obteniendo mayores valores de diversidad en las formaciones vegetales con mayor complejidad de estructura vegetal, tales como bosques de Polylepis y algunos matorrales y campos agrícolas.
Dada la alta diversidad espacio-temporal, variedad de estados alternativos y altos cambios en la configuración de las comunidades de aves en la ecorregión Meso-Andina (generalmente las áreas de matorrales y campos agrícolas), estas comunidades podrían tener mayor complejidad y adaptabilidad que las de la ecorregión Puna Húmeda-Seca.












 uBio
uBio