Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Anales de la Facultad de Medicina
versión impresa ISSN 1025-5583
An. Fac. med. v.71 n.3 Lima jul./dic. 2010
TEMA DE REVISIÓN
Falla ovárica precoz
Premature ovarian failure
José Pacheco1a
1 Departamento Académico de Obstetricia y Ginecología, Facultad de Medicina, UNMSM. Lima, Perú.
a Profesor Principal
Resumen
La falla ovárica precoz es una amenorrea secundaria que se presenta en una mujer antes de los 40 años, que conlleva a hipoestrogenismo, infertilidad y las consecuencias de la menopausia prematura, como osteoporosis, enfermedad cardiovascular, trastornos neurovegetativos, entre otros. Se presenta agotamiento folicular, por dotación insuficiente de folículos o destrucción acelerada de los ovocitos. Las causas son varias, pero predominan las genéticas, autoinmunes y las iatrogénicas. Entre las causas genéticas, son frecuentes las deleciones Xq y Xp, las translocaciones, aberraciones numéricas (47,XXX, 45,X0), premutaciones de X frágil, entre otros. Entre las enfermedades autoinmunes son de importancia la insuficiencia poliglandular tipo I y II. Las iatrogenias pueden ser quirúrgicas en ovarios o trompas y, con la presencia del cáncer de mama en mujeres jóvenes, el tratamiento oncológico puede destruir las células germinales, por lo que hoy se sugiere utilizar técnicas de preservación de la función ovárica y de la fertilidad. En el manejo de la falla ovárica precoz, una vez determinada la causa, se sugiere el uso de terapia estrogénica, aunque no se ha hecho investigación en el tipo de hormona a utilizar, dosis y consecuencias a largo plazo. Tener presente la prevención y manejo de la osteoporosis y la enfermedad cardiovascular. Con relación a la infertilidad, se está realizando criopreservación de embriones y ovocitos para autodonación, así como criopreservación de tejido ovárico cortical para autotrasplante posterior, con éxitos y limitaciones. Los agonistas de GnRH podrían actuar en proteger los ovarios en casos de quimioterapia. Se observa con atención la terapia génica experimental en casos de falla ovárica precoz.
Palabras clave: Fallo ovárico prematuro; genética; inmunología; enfermedad iatrogénica; terapia de reemplazo hormonal; fertilidad.
Abstract
Premature ovarian failure is characterized by secondary amenorrhea affecting a woman before the age of 40, leading to hypoestrogenism, infertility, and consequences of premature menopause, such as osteoporosis, cardiovascular disease, neurovegetative alterations, and others. Follicular exhaustion is due to either follicles shortage or oocytes accelerated destruction. Main causes are genetic, autoimmune and iatrogenic. Among genetic causes Xq and Xp deletions, translocations, numeric aberrations (47,XXX, 45,X0), fragil X premutations are frequent. Type I and type II poliglandular insufficiency are important causes among autoimmune diseases. Iatrogenia may occur in surgery of the ovarios and Fallopian tubes and with oncologic treatment that destroys germinal cells in young women with breast cancer. Nowadays use of ovarian function and fertility preservation techniques are suggested. Once the cause is determined estrogens use is recommended although little research on hormone type, dosage and long term consequences has been done. Care must be placed in osteoporosis and cardiovascular disease prevention and treatment. In regards to infertility, there is already experience with embryos and oocytes cryopreservation for autodonation, and cortical ovarian tissue cryopreservation for posterior autotrasplantation, with success as well as limitations. GnRH agonists could protect the ovaries when chemotherapy is used. Attention is placed on experimental gene therapy in cases of premature ovarian failure.
Key words: Ovarian failure; premature; genetic; immunology; iatrogenic disease; hormone replacement therapy; fertility.
La falla ovárica prematura o precoz (FOP), también denominada insuficiencia ovárica prematura, hipogonadismo hipergonadotrópico o hipogonadismo, consiste en una amenorrea secundaria de más de seis meses, antes de los 40 años, con aumento de las hormonas estimulante folicular (FSH; más de 20 UI/L) y luteinizante (LH), además de la disminución de estrógenos. Se la considera una enfermedad genética compleja, con presentación familiar en 12% a 50%. Puede originarse de genes diferentes y diversas interacciones entre gen y ambiente (1).
La falla ovárica prematura afecta alrededor de una en cien mujeres menores de 40 años, una en 250 mujeres de 35 años, una en mil mujeres de 30 años y una en diez mil mujeres de 20 años de edad. No siempre significa que ya ocurrió una menopausia temprana, pues la mitad de ellas tendrá una función ovárica intermitente e impredecible por algunos años. Veremos que las causas son principalmente genéticas, autoinmunidad, tóxicos, drogas, radiación, infecciosas, entre otras (2).
EJE HIPOTÁLAMO-HIPÓFISIS-OVARIO
Recordaremos brevemente los componentes del eje hipotálamo-hipófisis ovario y cómo se desarrolla normalmente la actividad hormonal en una mujer en la edad reproductiva y cuáles son las modificaciones en la falla ovárica precoz.
En el hipotálamo, más o menos cada hora el núcleo arcuato libera la hormona liberadora de gonadotropinas (GnRH) en forma pulsátil al sistema porta hipofisario, lo que estimula la liberación de FSH y LH por la hipófisis. Las hormonas FSH y LH actúan sobre el ovario en la producción de estrógenos, la maduración folicular, la ovulación, con el objeto de lograr la reproducción. Esta frecuencia pulsátil del hipotálamo se altera en la premenopausia por cambios en la actividad de las células nerviosas del cerebro.
Por otro lado, las gonadotropinas actúan sobre el ovario a través de los receptores de membrana. Se conoce que la FSH estimula la síntesis de receptores para sí misma en la granulosa y para LH en la teca folicular. El aumento de LH inhibe la síntesis de receptores para LH. En la falla ovárica precoz (FOP) se ausenta la formación de receptores para gonadotropinas.
Conocemos de la esteroidogénesis del folículo en maduración, en el que la LH actúa sobre la teca para la formación de andrógenos y progesterona, mientras la FSH lo hace sobre la granulosa, para la producción de estrógenos. Finalmente, ambas teca y granulosa complementan sus productos. Ello lleva a las variaciones hormonales múltiples y que varían día a día en el ciclo menstrual.
Como tal, los ovarios tienen como funciones la esteroidogénesis, la selección y maduración de los folículos y los óvulos, la ovulación y la formación del cuerpo lúteo, entre otras, todo esto en pro de la reproducción.
El estradiol es un esteroide producido por el folículo en maduración. En la fase folicular aumenta hasta 5 a 6 días antes del pico de LH. Luego, el aumento es exponencial, más de 140%, para caer en 30% un día antes del pico de LH y hasta 40% el mismo día. Aumenta en la fase lútea para la llegada del embrión y, si hay embarazo, sigue aumentando. Si no hubiera gestación, disminuye conjuntamente con la progesterona el día 25 del ciclo y se produce la menstruación. Luego de la falla ovárica en la producción de esteroides, la mujer ingresa a una estrogenopenia.
DISFUNCIÓN OVÁRICA
La función ovárica anormal va a producir alteraciones de la menstruación, entre ellas la amenorrea y la hemorragia uterina disfuncional. La amenorrea puede ser primaria –si nunca hubo menstruación-, secundaria –si es que existió al menos una menstruación en la vida de la mujer- y fisiológica, como la que ocurre en el embarazo y lactancia. Mientras tanto, la hemorragia uterina disfuncional puede ser ovulatoria –en 10% de los casos- y anovulatoria.
La disfunción ovulatoria puede ocurrir en estados hipoestrogénicos e hiperestrogénicos, como se observa en la tabla 1. Así, podemos entender que la falla ovárica precoz se sitúa en la disfunción ovulatoria en un estado hipoestrogénico hipergonadotrópico, que puede ser por causa genética, iatrogénica, inmunológica, entre otras.
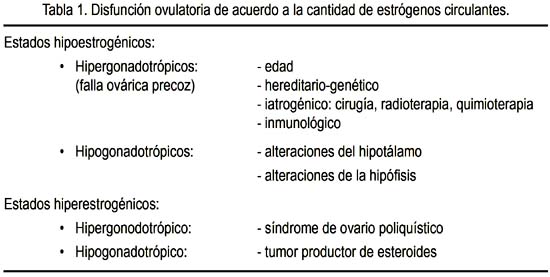
FALLA OVÁRICA PREMATURA
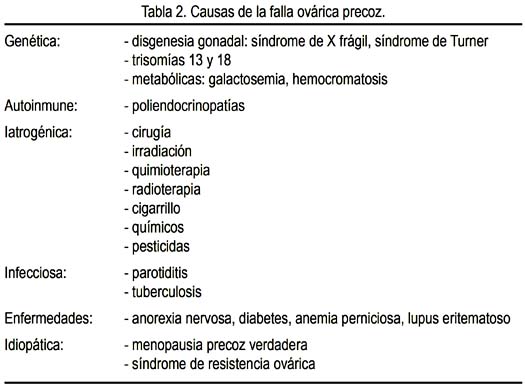
Como ya se ha expresado, la insuficiencia ovárica prematura ocurre en una mujer antes de los 40 años de edad. En ella puede existir agotamiento folicular o disfunción folicular, con alteración del mecanismo de maduración folicular. A su vez, el agotamiento folicular puede deberse a una dotación insuficiente de folículos, como ocurre en la disgenesia gonadal pura, o a una destrucción acelerada de ovocitos, como ocurre en las alteraciones cromosómicas numéricas, alteraciones cromosómicas estructurales, galactosemia (3), radioterapia, quimioterapia, cirugía, alteraciones inmunológicas y de manera idiopática. Por otro lado, la alteración del mecanismo de maduración folicular ocurre en ciertas alteraciones inmunológicas, en el déficit de ciertas enzimas, en las anormalidades de las gonadotropinas y el síndrome de ovario resistente, entre otras (figura 1). En la tabla 2 hemos tratado de ordenar las causas más frecuentes de la falla ovárica prematura.
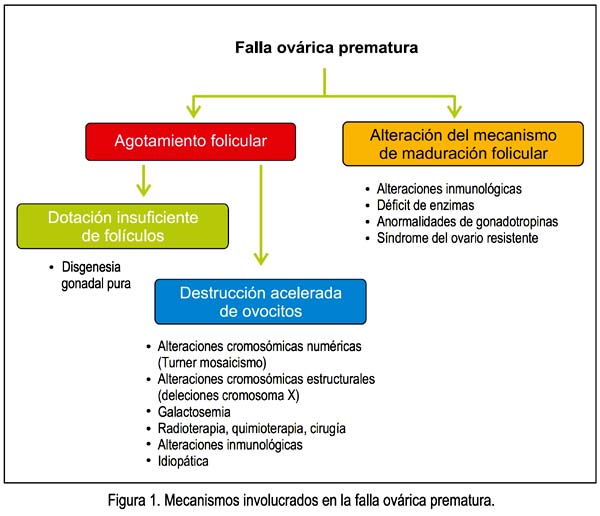
Causas genéticas
Se describe incontables causas genéticas de FOP, incluyendo las deleciones Xq y Xp (4), translocaciones (ej. 46,X,t(X;15) (q24;q26.3) (5,6), aberraciones numéricas, síndrome de Swyer, premutaciones de X frágil (7), galactosemia, cariotipo 47,XXX (8), polimorfismos del gen del receptor de FSH (9), variantes de la proteína morfogenética de hueso (BMP15) (10).
Los genes de significación en la falla ovárica precoz son (11):
-
- Los genes que regulan el eje hipotálamo-hipófisis-ovario, aunque no se conoce exactamente cómo.
-
- Las deleciones o translocaciones en el brazo Xq, también sin conocerse la manera.
-
- Loci específicos en la región crítica Xq, FOP1 y FOP2 y genes DIA, FMR1 y FMR2.
-
- Algunos genes que coordinan el desarrollo de la célula germinal a un estadio primordial, como GDF9, BMP15 y NGF.
-
- Mutación de los genes que regulan el desarrollo endocrinológico en etapas más tardías, como FSH y LH, y dan lugar a infertilidad y FOP.
-
- Probable relación entre el síndrome blefarofimosis-ptosis-epicanto inverso tipo 1-FOXL2 (12,13) y FOP. -Polimorfismos del receptor de estrógenos 1 (RE1), como PvuII, XbaI (14).
-
- Galactosemia, por efectos tóxicos de la galactosa o sus productos.
Entre las alteraciones estructurales del brazo corto del cromosoma X, tenemos 45,XXp, 46,XXp, entre otros. Pueden cursar con fenotipo del síndrome de Turner y talla baja; 25% de los casos muestra aspecto y funciones normales, ya que las alteraciones estructurales del brazo corto no suelen producir disfunción ovárica.
Las alteraciones más frecuentes son las deleciones intersticiales o terminales (15).
En cariotipos estándar, con resolución de 5 a 10 Mb, se ha identificado regiones cromosómicas críticas, especialmente localizadas en el brazo largo del cromosoma X. En un estudio en 99 mujeres, 8 tuvieron variaciones en el número de copias de ADN significativas: 1p21.1, 5p14.3, 5q13.2, 6p25.3, 14q32.33, 16p11.2, 17q12 y Xq28. De ellos, 5 genes están involucrados en la reproducción, siendo genes candidatos potenciales en la FOP (16).
De manera similar a las deleciones del brazo corto (Xp) del cromosoma X, las que comprometen el brazo largo del cromosoma X (Xq) varían en composición. Las deleciones más extensas se originan en Xq13 y se asocian con amenorrea primaria, falta de desarrollo mamario y falla ovárica completa. Por ello, se considera que Xq13 es la región eje para el mantenimiento del ovario y que contiene el centro de inactivación del X humano (CIX). La menstruación ocurre en deleciones de puntos de rotura Xq21 o más adelante.
Las mujeres Xq21 que menstrúan podrían haber retenido una región que contiene un gen de mantenimiento del ovario, lo que no ocurre con las mujeres Xq13 o 21, que cursan con amenorrea primaria, quienes pueden haber perdido tal locus. En la figura 2 podemos observar fenotipos asociados con varias deleciones terminales de Xq. En las deleciones Xq más distales, el fenotipo es gen de FOP, pero no hay amenorrea primaria. Entonces, el Xq distal es menos importante para mantener el ovario que el Xq proximal, a pesar que contiene regiones importantes para tal fin. En dicha figura se puede observar cómo varían los trastornos menstruales, desde las amenorreas primaria y secundaria hasta la fertilidad o menstruación regular, la que ocurre en las deleciones de la parte más distal del brazo largo del cromosoma X.
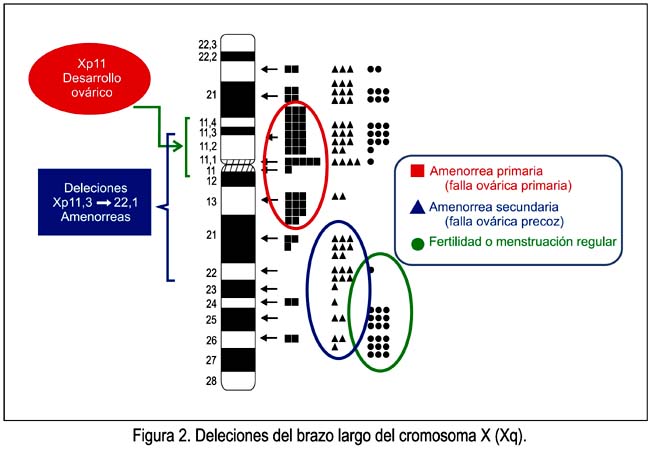
Por lo tanto, desde la región Xq13 hasta la región Xq26 es el área más importante para la función ovárica normal. Por otro lado, la deleción parcial del brazo largo [46,XX,del(X)(pter-q21.3::q27qter)] induce elevación de los niveles de gonadotropinas y FOP a los 30 a 40 años de edad. Además, dos genes -POF1 localizado en Xq21.3-q27 y POF2 localizado en Xq13.3-q21.1, de origen paterno- son responsables de FOP (15).
En el caso del cromosoma X frágil, el extremo del gen FMR1 situado en la banda Xq27.3 tiene un número excesivo de repeticiones del trinucleótido CGG (varios cientos en las mujeres afectadas, frente a 5 o 6 en las normales). La FOP ocurre con una frecuencia 3 veces mayor de lo normal, además de presentarse cierto retraso mental (17) y del crecimiento. La FOP puede deberse a menstruaciones múltiples que agotan los folículos prematuramente o a un menor número de ovocitos al nacimiento (15).
El síndrome de Turner (45,XO) consiste en la ausencia total o parcial de uno de cromosomas X normalmente presentes en las mujeres. Cursa con amenorrea primaria, fenotipo especial y gónadas en forma de cintillas. La ausencia de un cromosoma no impide la migración de las células germinales a la cresta gonadal, pero acelera la atresia, de manera que, al nacer, la gónada es disgenésica y carece de folículos. Los diversos mosaicos de Turner pueden llegar a menstruar y aún a gestar.
La anormalidad genética 47,XXX o de la supermujer es la más común en la mujer, 1/1 000. Sin embargo, solo se llega a diagnosticar el 10% de los casos, y la mujer puede ser fértil. Tiene talla alta, pliegues epicantos, hipotonía, clinodactilia, y puede presentar convulsiones, anormalidades renales y genitourinarias y FOP. Tiene tardanzas motoras y de lenguaje, déficit cognitivo, de aprendizaje y de atención, ansiedad y depresión. Resulta de la no disyunción durante la meiosis, aunque 20% tiene falta de disyunción poscigótica. El riesgo de que ocurra esta trisomía X aumenta con la edad materna avanzada. El fenotipo en la trisomía X se cree sea resultado de la sobreexpresión de genes que escapan a la inactivación de X, pero aún queda por definir la relaciones genotipo-fenotipo. El diagnóstico diferencial se realiza con X frágil, tetrasomía X, pentasomía X y mosaicismo de Turner. El diagnóstico prenatal se lleva a cabo por amniocentesis o biopsia corial. En todo caso, se recomienda la asesoría genética (18).
Se ha llegado a caracterizar una FOP familiar y una de ocurrencia esporádica. En un estudio se comparó 58 casos de FOP familiar con 142 de FOP esporádicos, no habiéndose encontrado diferencias en el fenotipo, excepto en la edad de la menopausia (41 versus 49,7, respectivamente) y los niveles bajos de globulina transportadora de hormona sexual (73,6 versus 55,2) (19).
FOP y enfermedad autoinmune
En una investigación pionera de 33 pacientes con FOP de causa no cromosómica y sin antecedente de recibir irradiación o quimioterapia, 39% (13/33) de las pacientes tenía trastorno autoinmune asociado, principalmente 11 de tiroides (5 de ellos Hashimoto), 1 vitíligo, 1 insuficiencia suprarrenal. Existía historia familiar de enfermedad autoinmune en 6/33 (18%). Concluyen los autores que se puede considerar que 40 a 50% de los casos FOP tienen enfermedad autoinmune asociada o evidencia de autoinmunidad (20).
En la tabla 3 podemos observar las enfermedades autoinmunes más frecuentemente asociadas a la FOP (21).

Alteraciones enzimáticas
Entre las alteraciones enzimáticas causantes de FOP se encuentran los déficits de galactosa-1-fosfato uridil transferasa y de 17α-hidroxilasa.
La enzima galactosa-1-fosfato uridil transferasa (GALT) es una enzima clave en el metabolismo de la lactosa, ocasionando galactosemia. El déficit de GALT es causal de retraso mental y retraso de crecimiento, hepatomegalia, disfunción tubular renal, cataratas y FOP. Existen numerosas mutaciones del gen que codifica la GALT.
La enzima 17α-hidroxilasa es una enzima implicada en la génesis de las hormonas sexuales. Su déficit se relaciona a hiperplasia suprarrenal asociada a amenorrea, aumento de las gonadotropinas y pérdida de los caracteres sexuales secundarios. La enzima es codificada por el gen CYP17 en el cromosoma 10.
Causas iatrogénicas
En este grupo se incluye los problemas quirúrgicos, quimioterapia, radioterapia y de otros tóxicos que pueden ocasionar menopausia precoz.
La cirugía de endometriomas no está exenta de daño ovárico posterior y disminución de su función hormonal. Es causa de controversias decidir si los endometriomas deben ser extirpados, evacuados o solo fulgurados o esclerosados (22). La endometriosis se encuentra prácticamente en toda mujer en edad reproductiva, pero generalmente no le causa problemas (23). Entre las complicaciones que se relacionan a la endometriosis se encuentran el dolor pélvico crónico y la infertilidad, por lo que se sugiere realizar hasta una cirugía extensa en casos necesarios. En infertilidad, se considera que la posibilidad de embarazo mejora con la eliminación de los endometriomas, mucho más en los casos de fertilización asistida de complejidad alta (24). Pero, dependiendo del tipo de cirugía realizada, de la experiencia del operador y la facilidad del procedimiento, puede ocasionarse disminución de la funcionalidad ovárica. Así, un estudio en 93 mujeres que tuvieron cirugía unilateral de endometriomas, se hizo seguimiento folicular por ultrasonido transvaginal y luego fertilización in vitro. Se observó que hubo ausencia de crecimiento folicular en 12 de las pacientes operadas, mientras el otro ovario sí respondió con crecimiento de folículos. La frecuencia del daño ovárico severo poscirugía fue considerado 13% (7 a 21%). En las conclusiones se señaló que se puede observar daño severo en ovarios operados por endometriomas (25). Creemos, por algunos casos de endometriosis, infertilidad y reproducción asistida observados en la práctica, que esta situación puede llevar a una mujer a disfunción ovárica prematura. Por ello, otros autores sugieren solo tratar los endometriomas mayores de 4 centímetros de diámetro (26).
Con relación al ciclo menstrual luego de esterilización tubárica, los coloquios de expertos nacionales encuentran que la situación es controvertida, desde ninguna afectación hasta compromiso de la función ovárica. En un estudio amplio en 5 070 mujeres que tuvieron esterilizaciones, 5 años después, 35% de las mujeres comunicó niveles altos de dolor menstrual, 49% tenía menorragia y 10% manchado entre reglas. Se menciona que en el primer año después de la esterilización, los síntomas fueron menores. Los autores concluyen que la esterilización tubárica puede alterar la función menstrual, pero los cambios pueden tomar tiempo en desarrollarse (27).
Se conoce desde hace algún tiempo que el fumar 20 o más cigarrillos por día se asocia con casi 4 veces más la ocurrencia de ciclos menores a 25 días (OR 3,8), con un promedio de 2,6 días más cortos, especialmente con la fase folicular más corta. Cuanto más se fumaba, había mayor riesgo de anovulación y fase lútea corta. Desde luego, estos hallazgos podrían explicar la asociación existente entre fumar y la presencia de subfecundidad y menopausia temprana (28).
Asimismo, en relación al efecto del cigarrillo, se ha encontrado que las concentraciones séricas de inhibina B son menores en las mujeres que fuman o fumaron (p=0,036). No se halló diferencia significativa en las concentraciones séricas de FSH u hormona antimülleriana (HAM), aunque hubo tendencia a menor HAM en las mujeres fumadoras. Por ello, se concluye que el cigarrillo parece producir antelación del envejecimiento del ovario (29).
CONSECUENCIAS DE LA FOP
Son consecuencias de la FOP las manifestaciones clínicas de depleción de estrógenos y pérdida de la fertilidad. Los niveles bajos de estrógenos se asocian con palpitaciones, intolerancia al calor, bochornos, sudoración nocturna, irritabilidad, ansiedad, depresión, fatiga, trastornos del sueño, disminución de la libido, cabello grueso, sequedad vaginal. En una persona joven, la hipoestrogenemia aumenta su riesgo de osteoporosis y trastornos cardiovasculares (30). Además, el déficit de hormonas sexuales representa un factor de riesgo importante de trastornos neurológicos, metabólicos o cardiovasculares frecuentes y severos, tales como enfermedad de Alzheimer, hipercolesterolemia o enfermedades isquémicas.
Las mujeres jóvenes que reciben tratamiento sistémico para cáncer de mama tienen una menopausia abrupta y síntomas vasomotores y disfunción sexual por la quimioterapia y supresión ovárica. La fertilidad se puede alterar, a pesar de continuar menstruando después de la quimioterapia, para después devenir en FOP. Y el estrés por la imposibilidad de gestar tiene un impacto a largo tiempo en la calidad de vida de la mujer (31).
SINTOMATOLOGÍA Y DIAGNÓSTICO DE LA FOP
En líneas generales, la sintomatología es similar a la de la premenopausia, aunque pudiera aparecer más bruscamente y sin síntomas apreciables. Las menstruaciones se vuelven irregulares y van hacia la amenorrea. Puede haber síntomas neurovegetativos, como sudores nocturnos, bochornos y otros, insomnio, irritabilidad, sequedad vaginal, disminución del deseo sexual, aumento del peso corporal, infertilidad.
El diagnóstico se realiza en una mujer menor de 40 años con amenorrea más de 3 meses, sintomatología neurovegetativa, signos de hipoestrogenismo. Se incorporará al estudio los valores hormonales en sangre, para determinar la reserva ovárica, encontrándose la FSH mayor de 25 mUI/mL, con disminución de la LH y del estradiol. En la ecografía pélvica, los ovarios muestran volumen disminuido y no se encuentra folículos o son muy escasos.
Las condiciones médicas asociadas a la FOP son la osteoporosis, la enfermedad cardiovascular, el hipotiroidismo, la enfermedad de Addison, la diabetes mellitus y la esterilidad. Se considera que las portadoras de X frágil son las más predispuestas a desarrollar falla ovárica prematura (32). Pensando en dichas condiciones médicas y los problemas devenidos del hipoestrogenismo, se medirá la presión arterial y se solicitará en el estudio de estas mujeres una densitometría de la masa ósea, perfil lipídico, anticuerpos suprarrenales, descartar tiroiditis, cariotipo y permutaciones del gen FMR1 (33,34), entre otros.
Se puede indicar pruebas de reserva ovárica con citrato de clomifeno, agonistas de GnRh, FSH, en casos de infertilidad. El Colegio Americano de Obstetras y Ginecólogos señala que si la falla ovárica es espontánea y el cariotipo es normal, 5 a 10% de las mujeres con FOP pueden gestar espontáneamente (32,35).
MANEJO DE LA FOP
Existen tres temas críticos en el manejo de las mujeres con FOP, que son el efecto del diagnóstico en la salud psicológica de la paciente, la infertilidad y los efectos a corto y largo plazo de la deficiencia de estrógeno por la falla de la función ovárica. No existe un tratamiento que restaure la función ovárica, una vez ocurrida.
Ante la presencia de hipoestrogenismo y las consecuencias a corto y largo plazo, la terapia de reemplazo hormonal (TH) debería ser el tratamiento a considerar (36-38), aunque la sintomatología también puede ser controlada con anticonceptivos orales, entre otros. Sin embargo, se desconoce la manera más conveniente de reemplazo estrogénico así como los efectos exactos de no dar tratamiento, pues existe poca investigación en esta área (39). Se describe que la TH puede inducir un embarazo (40).
Por la poca investigación al respecto, es bueno recordar lo que nos dicen las evidencias sobre el uso de TH y terapia con estrógenos (TE) a largo plazo. En una revisión sistemática de 19 ensayos aleatorios controlados, que incluyó 41 904 mujeres entre 26 y 91 años, se encontró en 11 estudios que, en mujeres sanas, la TH combinada continua aumenta el riesgo de tromboembolismo venoso, infarto cardiaco fatal o no fatal (con más de un año uso), apoplejía (uso por más de 3 años), cáncer de mama, enfermedad de la vesícula y demencia (en mujeres mayores de 65 años). También, la TE aumenta el riesgo de tromboembolismo venoso, la apoplejía y la enfermedad de la vesícula. En mujeres con enfermedad cardiovascular presente (6 estudios), la TH aumentó el tromboembolismo venoso, especialmente en los dos primeros años de uso, así como la enfermedad de la vesícula. La TH disminuyó el riesgo de fractura (no más que en las mujeres con mucho riesgo de fracturas) o el cáncer colorrectal, pero solo después de 4 a 5 años de tratamiento hormonal, cuando se conoce que el mayor riesgo de problemas cardiovasculares ocurre en el primer año del uso de la TH (41). Es posible que estas complicaciones sean eliminadas cuando, en lugar de los actuales estrógenos conjugados, estradiol beta sintético y tibolona, se llegue a descubrir un estrógeno más natural y fisiológico.
Los bochornos pueden ser tratados con venlaxafina, gabapentina o manejo del estrés. Se puede recomendar cremas estrogénicas o de estriol o promestrieno para la sequedad vaginal y dar la asesoría conveniente para aliviar su disfunción sexual.
En mujeres con FOP se encuentra niveles de triglicéridos significativamente elevados, colesterol HDL disminuido. El índice de andrógeno libre, la globulina trasportadora de hormonas sexuales y la testosterona tienen correlación significativa con los triglicéridos y/o el colesterol HDL. Como tal, la pérdida de la función ovárica en una mujer joven (FOP) coincide con cambios en el perfil lipídico. Los andrógenos son mejores marcadores de las modificaciones desfavorables de los lípidos comparados con los niveles de estrógenos o la duración de la deprivación de estrógeno en las mujeres con FOP. Los triglicéridos elevados en combinación con el aumento de andrógenos libres pueden ser una manifestación temprana de disminución de la sensibilidad a la insulina (42).
Otro aspecto preocupante en las mujeres con FOP es el aspecto cardiovascular. La TH con que contamos no mejora la salud cardiovascular (41). Cuando se comparó en 34 mujeres con FOP los efectos de regímenes fisiológicos (estradiol transdérmico y progesterona vaginal) y estándar (etinilestradiol y noretisterona vía oral) de esteroides sexuales por 12 meses sobre la salud cardiovascular, ambos regímenes causaron supresión similar de LH y FSH y mejoraron la sintomatología. En comparación con el régimen estándar, la TH fisiológica ocasionó presiones sistólicas (PAS) y diastólicas (PAD) de 24 horas menores durante los 12 meses de tratamiento (ANOVA; p<0,0001 para ambas): la PAS fue 7,3 mmHg menor y la PAD, 7,4 mmHg menor. La TH fisiológica redujo la angiotensina II y la creatinina séricas, sin alterar los valores de aldosterona. Ello indica que la TH fisiológica en mujeres con FOP resulta en menor presión arterial, mejor función renal y menor activación del sistema renina-angiotensina (43), lo que no todos los autores concuerdan (44).
Uno de los factores hormonales más importantes responsables de la salud ósea es el estradiol. El estradiol induce la activación de los factores de crecimiento, la inhibición de la producción del activador del receptor del ligando nuclear factor kappa B (RANKL), es decir, tiene actividad antirresortiva. La disgenesia gonadal y la FOP causan hipoestrogenismo. El tratamiento de la osteopenia y osteoporosis causadas por dicho hipoestrogenismo es esencial y multidireccional. Se señala que el rol crucial de esta terapia es obtener una concentración sérica de estradiol apropiada (45). Por ello, la TH o la terapia estrogénica son consideradas el tratamiento crucial (2). Sin embargo, otras medidas dramáticas están siendo experimentadas, tal como el trasplante alogénico de médula ósea, para la prevención de osteoporosis (46). Por otro lado, se señala cómo la quimioterapia tiene influencia deletérea en mujeres premenopáusicas con cáncer de mama sobre su salud ósea (47).
Las mujeres con FOP tienen menores niveles de andrógenos comparadas con mujeres que menstrúan regularmente. El añadido del parche transdérmico de testosterona 150 microg/día aplicado dos veces a la semana en el abdomen y acetato de medroxiprogesterona oral 10 mg/d los últimos 12 días de cada ciclo, producen niveles de testosterona libre que aproximan el límite superior de lo normal (48).
Existe literatura principalmente oriental sobre el empleo de hierbas medicinales en la FOP. La medicina tradicional China emplea concentrados de extractos de plantas como rehmannia cocida, name chino, fruta goji, shanzhuyu, niuxi, cuscuta china, goma de tortuga, yin yang hua y raíz de noni, que representan una modificación de la fórmula herbaria Zuogui-wan (49).
Fertilización asistida
En unos pocos casos, la subfertilidad podría ser corregida con los diversos inductores de la ovulación, en manos de expertos en reproducción. Cuando los resultados son frustrantes, se puede considerar en casos seleccionados la fertilización asistida.
La fertilización in vitro ha tenido avances importantes y es una metodología que se aplica en la FOP. Un caso descrito recientemente en la literatura es de la donación de ovocitos por una gemela a una mujer de 33 años con FOP (36). Generalmente, la fertilización in vitro en otros casos de FOP es hecha por donante anónima, conociéndose que el endometrio responde admirablemente a la progesterona exógena (50). No se ha encontrado diferencias entre la donación de ovocitos a mujeres con FOP y aquellas con menopausia fisiológica, pero las tasas de complicaciones parecen ser altas (51).
PRESERVACIÓN DE LA FERTILIDAD EN PACIENTES CON TRATAMIENTO DE CÁNCER
Las mujeres jóvenes que van a recibir tratamiento por cáncer hoy constituyen un grupo importante para ginecólogos y oncólogos, quienes están trabajando conjuntamente para preservar la fertilidad de esta mujer joven (52). Algunos llaman a este manejo oncofertilidad (53).
Un aspecto que actualmente es considerado primordial en la mujer joven con cáncer de seno y que va a recibir quimioterapia o radioterapia es la preservación de la producción de esteroides por sus ovarios y la fertilidad. La ciclofosfamida, por ejemplo, merma los folículos primordiales y potencialmente lleva a infertilidad; la adriamicina/citoxano también produce inmunotoxicidad en mujeres menores de 40 años (54), así como la doxorrubicina (55). Se ha encontrado que el riesgo de amenorrea incrementa con la edad (56). Para ello, la tecnología moderna permite mantener en frío de congelamiento tanto gametos como embriones –que luego pueden ser usados en la misma mujer con técnicas de fertilización asistida para procrear- y más recientemente tejido ovárico cortical, que después puede ser autotransplantado para que vuelva a producir hormonas. Estas técnicas las resumimos en la tabla 4, técnicas que aún tienen varias limitaciones (57-62). En otro trabajo experimental, el agonista de GnRH cetrorelix redujo la apoptosis en las células de la granulosa, al inhibir la apoptosis dependiente de mitocondrias que es acelerada por la quimioterapia (63).

La protección ovárica a la quimioterapia con agonistas de GnRH (GnRHa) se observa en un estudio de 22 mujeres, de edad media 31 años, en el que se administró GnRHa (leuprolida 3,75 mg) vía subcutánea cada 4 semanas, durante la quimioterapia por cáncer de mama. Seis meses después de la quimioterapia, los valores de FSH y LH fueron normales. No había síntomas menopáusicos y 81,8% recobró sus menstruaciones (64).
En una investigación sobre trasplante ovárico, 9 mujeres con FOP recibieron un ovario donado por su gemela monozigótica y en otras 16 jóvenes con cáncer se realizó criopreservación ovárica; dos de las receptoras de trasplante eran sobrevivientes de cáncer y estériles. Luego de cinco meses de la cirugía, la FSH retornó a la normalidad, así como las menstruaciones volvieron a ser regulares en todas las pacientes. Hubo 14 embarazos espontáneos, 8 nacidos vivos sanos y 2 embarazos en progreso. Las 3 jóvenes con trasplante de tejido congelado concibieron espontáneamente; una tuvo un parto normal y 2 embarazos proseguían. La sobrevida de ovocitos congelados fue 42% y, después de la vitrificación, 89%. Por eso, se considera que el trasplante ovárico en mujeres es un procedimiento factible, aún después de criopreservación, y la vitrificación pudiera ser más efectiva que el congelamiento lento (65).
TERAPIA GÉNICA EN FOP
Se ha determinado que la mutación homocigótica del gen C566T en el receptor de FSH (FSHR) se relaciona con la FOP. Esta enfermedad lleva a infertilidad a una mujer con cariotipo normal, aumentando la FSH y disminuyendo los estrógenos. A manera de modificar este estado anormal, se ha efectuado la inyección intraovárica bilateral de un adenovirus que expresa una copia normal de FSHR humana en el sistema reproductor de ratitas infértiles FORKO (ratitas que llevaban el gen FSHR mutado, llamado receptor de folitropina noqueado o FORKO, por sus siglas en inglés) de 6 a 10 semanas, obteniéndose modificaciones estrogénicas en la vagina, además de observarse 26 folículos en cada ovario y 8 en estadio antral, a comparación de solo 5 en estadio antral en el grupo control y sin que hubiera modificaciones en la vagina. También aumentó dos a tres veces el estradiol, la FSH disminuyó en 50% y no hubo cambios en la progesterona. Se detectó mARN del FSHR en los ovarios del grupo tratado. Finalmente, y como un buen dato pronóstico, no hubo diseminación sistémica viral o trasmisión vertical de la línea germinal del ADN del adenovirus a la descendencia (66).
Concluyendo, la falla ovárica precoz es una amenorrea secundaria que se presenta en una mujer antes de los 40 años, que conlleva a hipoestrogenismo, infertilidad y las consecuencias de la menopausia prematura, como osteoporosis, enfermedad cardiovascular, trastornos neurovegetativos, entre otros. Sus causas son varias, pero predominan las genéticas, autoinmunes y las iatrogénicas. Se presenta agotamiento folicular, por dotación insuficiente de folículos o destrucción acelerada de los ovocitos. Entre las causas genéticas, son frecuentes las deleciones Xq y Xp, las translocaciones, aberraciones numéricas (47,XXX, 45,X0), premutaciones de X frágil, entre otros. Entre las enfermedades autoinmunes son de importancia la insuficiencia poliglandular tipo I y II. Las iatrogenias pueden ser quirúrgicas en ovarios o trompas, por endometriosis, infertilidad y otros. En la presencia del cáncer de mama en mujeres jóvenes, el tratamiento oncológico puede destruir las células germinales, por lo que hoy se utiliza técnicas de preservación de la función ovárica y de la fertilidad.
En el manejo de la falla ovárica precoz, una vez determinada la causa, se sugiere el uso de terapia estrogénica, aunque no se ha hecho investigación en el tipo de hormona a utilizar, dosis y consecuencias a largo plazo. Tener presente la prevención y manejo de la osteoporosis y la enfermedad cardiovascular. Con relación a la infertilidad, se está realizando criopreservación de embriones y ovocitos para autodonación, así como criopreservación de tejido ovárico cortical para autotrasplante posterior, con éxitos y limitaciones. Los agonistas de GnRH podrían actuar en proteger los ovarios en casos de quimioterapia. Se observa con atención la terapia génica experimental en casos de falla ovárica precoz.
Conflictos de intereses:
Ninguno.
REFERENCIAS BIBLIOGRÁFICAS
1. Janse F, Knauff EA, Niermeijer MF, Eijkemans MJ, Laven JS, Lambalk CB, Fauser BC, Goverde AJ; On behalf of the Dutch Premature Ovarian Failure Consortium. Similar phenotype characteristics comparing familial and sporadic premature ovarian failure. Menopause. 2010;17(4:758-65.
2. Kokcu A. Premature ovarian failure from current perspective. Gynecol Endocrinol. 2010;26(8):555- 62.
3. Elsas LJ II. Galactosemia. En: Pagon RA, Bird TC, Dolan CR, Stephens K, editores. GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. 4 feb 2000 [actualizado 27 set 2007].
4. Ceylaner G, Altinkaya SO, Mollamahmutoglu L, Ceylaner S. Genetic abnormalities in Turkish women with premature ovarian failure. Int J Gynaecol Obstet. 2010;110(2):122-4.
5. Giacomozzi C, Gullotta F, Federico G, Colapietro I, Nardone AM, Cianfarani S. Premature ovarian failure, absence of pubic and axillary hair with de novo 46,X,t(X;15)(q24;q26.3). Am J Med Genet A. 2010;152A(5):1305-9.
6. Bertini V, Ghirri P, Bicocchi MP, Simi P, Valetto A. Molecular cytogenetic definition of a translocation t(X;15) associated with premature ovarian failure. Fertil Steril. 2010;94(3):1097.e5-8.
7. Conway GS. Premature ovarian failure and FMR1 gene mutations: an update. Ann Endocrinol (Paris). 2010;71(3):215-7.
8. Skatba P, Cygal A, Gierzynska Z. A case of premature ovarian failure (POF) in a 31-year-old woman with a 47,XXX karyotype. Endokrynol Pol. 2010;61(2):217-9.
9. Du J, Zhang W, Guo L, Zhang Z, Shi H, Wang J, Zhang H, Gao L, Feng G, He L. Two FSHR variants, haplotypes and meta-analysis in Chinese women with premature ovarian failure and polycystic ovary syndrome. Mol Genet Metab. 2010;100(3):292-5.
10. Tiotiu D, Mercadal BA, Imber t R, Verbist J, Demeestere I, De Leener A, Englert Y, Vassart G, Costagliola S, Delbaere A. Variants of the BMP15 gene in a cohort of patients with premature ovarian failure. Hum Reprod. 2010;25(6):1581-7.
11. Dixit H, Rao L, Padmalatha V, Raseswari T, Kapu AK, Panda B, Murthy K, Tosh D, Nallari P, Deenadayal M, Gupta N, Chakrabarthy B, Singh L. Genes governing premature ovarian failure. Reprod Biomed Online. 20100(6):724-40.
12. Ni F, Wen Q, Wang B, Zhou S, Wang J, Mu Y, Ma X, Cao Y. Mutation analysis of FOXL2 gene in Chinese patients with premature ovarian failure. Gynecol Endocrinol. 2010 Apr;26(4):246-9.
13. De Baere E, Fellous M, Veitia RA. The transcription factor FOXL2 in ovarian function and dysfunction. Folia Histochem Cytobiol. 2009;47(5):S43-9.
14. Yang JJ, Cho LY, Lim YJ, Ko KP, Lee KS, Yim SV, Chang SH, Park SK. Estrogen receptor-1 genetic polymorphism for the risk of premature ovarian failure and early menopause. J Womens Health (Larchmt). 2010;19(2):297-304.
15. Kauffman RP, Castracane VD. Premature ovarian failure associated with autoimmune polyglandular syndrome: pathophysiological mechanisms and future fertility. J Women's Health. 2003;12(5):513- 20.
16. Aboura A, Dupas C, Tachdjian G, Portnoi MF, Bourcigaux N, Dewailly D, Frydman R, Fause B, Ronci-Chaix N, Donadille B, Bouchard P, Christin- Maitre S. Array comparative genomic hybridization profiling analysis reveals deoxyribonucleic acid copy number variations associated with premature ovarian failure. J Clin Endocrinol Metab. 2009;94(11):4540-6.
17. Bourgeois JA, Coffey SM, Rivera SM, Hessl D, Gane LW, Tassone F, Greco C, Finucane B, Nelson L, Berry-Kravis E, Grigsby J, Hagerman PJ, Hagerman RJ. A review of fragile X premutation disorders: expanding the psychiatric perspective. J Clin Psychiatry. 2009;70(6):852-62.
18. Tartaglia NR, Howell S, Sutherland A, Wilson R, Wilson L. A review of trisomy X (47,XXX). Orphanet J Rare Dis. 2010;5(1):8.
19. Janse F, Knauff EA, Niermeijer MF, Eijkemans MJ, Laven JS, Lambalk CB, Fauser BC, Goverde AJ; On behalf of the Dutch Premature Ovarian Failure Consortium. Similar phenotype characteristics comparing familial and sporadic premature ovarian failure. Menopause. 2010;17(4):758-65.
20. Alper MM, Garner PR. Premature ovarian failure: its relationship to autoimmune disease. Obstet Gynecol 1985;66:27.
21. Molina MJ, Guillén C, Guirado M, Mora A, Carrato A. Síndrome pluriglandular autoinmune, An Med Int (Madrid). 2007;24(9):445-52.
22. Yazbeck C, Madelenat P, Ayel JP, Jacquesson L, Bontoux LM, Solal P, Hazout A. Ethanol sclerotherapy: a treatment option for ovarian endometriomas before ovarian stimulation. Reprod Biomed Online. 2009;19(1):121-5.
23. Pacheco J, Ángeles R, Bustamante S, Díaz F, Ishihara J, Orihuela P, Zúñiga C, Bazán Z. Endometriosis: Experiencia en un servicio de infertilidad. Ginecol Obstet (Perú). 2000;46(1):40-6.
24. Garcia-Velasco JA, Somigliana E. Management of endometriomas in women requiring IVF: to touch or not to touch. Hum Reprod. 2009;24(3):496- 501.
25. Benaglia L, Somigliana E, Vighi V, Ragni G, Vercellini P, Fedele L. Rate of severe ovarian damage following surgery for endometriomas. Hum Reprod. 2010;25(3):678-82.
26. Busacca M, Vignali M. Endometrioma excision and ovarian reserve: a dangerous relation. J Minim Invasive Gynecol. 2009;16(2):142-8.
27. Wilcox LS, Martinez-Schnell B, Peterson HB, Ware JH, Hughes JM. Menstrual function after tubal sterilization. Am J Epidemiol. 1992;135(12):1368-81.
28. Windham GC, Elkin EP, Swan SH, Waller KO, Fenster L. Cigarette smoking and effects on menstrual function. Obstet Gynecol. 1999;93(1):59-65.
29. Waylen AL, Jones GL, Ledger WL. Effect of cigarette smoking upon reproductive hormones in women of reproductive age: a retrospective analysis. Reprod Biomed Online. 2010;20(6):861-5.
30. Beeck-Peccoz P, Persani L. Premature ovarian failure. Orphanet J Rare Dis. 2006;1:9.
31. Schover LR. Premature ovarian failure and its consequences: vasomotor symptoms, sexuality, and fertility. J Clin Oncol. 2008;26(5):753-8.
32. ACOG medical student teaching module. Premature ovarian failure. 2009. Disponible en: www.acog.org/acog_districts/dist1jf/teachingmoduleprematureovarianfailure.ppt
- 2009-05-14. Obtenido el 7 de mayo de 2010.33. Rebar RW. Premature ovarian failure. Obstet Gynecol. 2009;113(6):1355-63.
34. Saul RA, Tarleton JC. FMR1-related disorders. En: Pagon RA, Bird TC, Dolan CR, Stephens K, editores. GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-1998 Jun 16 [actualizado 18 mayo 2010].
35. Liza A, Alik RZ, Murad A, Ghazali I. Spontaneous twin pregnancy in premature ovarian failure. Med J Malaysia. 2008;63(3):263-4.
36. Sills ES, Brady AC, Omar AB, Walsh DJ, Salma U, Walsh AP. IVF for premature ovarian failure: first reported births using oocytes donated from a twin sister. Reprod Biol Endocrinol. 2010;8:31.
37. Heinz M. Hormonal development therapy (HDT) in hypogonadism in long-term view. Best Pract Res Clin Obstet Gynaecol. 2010;24(2):149-55.
38. Kalantaridou SN, Vanderhoof VH, Calis KA, Corrigan EC, Troendle JF, Nelson LM. Sexual function in young women with spontaneous 46,XX primary ovarian insufficiency. Fertil Steril. 2008;90(5):1805-11.
39. Cartwright B, Robinson J, Rymer J. Treatment of premature ovarian failure trial: description of an ongoing clinical trial. Menopause Int. 2010;16(1):18-22.
40. Dragojevic-Dikic S, Rakic S, Nikolic B, Popovac S. Hormone replacement therapy and succesful pregnancy in apatient with premature ovarian failure. Gynecol Endocrinol. 2009;25(12):769- 72.
41. Farquhar C, Marjoribanks J, Lethaby A, Suckling JA, Lamberts Q. Long term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database of Systematic Reviews 2009, Issue 2. Ar t. No.: CD004143. DOI: 10.1002/14651858.CD004143.pub3.
42. Knauff EA, Westerveld HE, Goverde AJ, Eijkemans MJ, Valkenburg O, van Santbrink EJ, Fauser BC, van der Schouw YT. Lipid profile of women with premature ovarian failure. Menopause. 2008;15(5):919-23.
43. Langrish JP, Mills NL, Bath LE, Warner P, Webb DJ, Kelnar CJ, Critchley HO, Newby DE, Wallace WH. Cardiovascular effects of physiological and standard sex steroid replacement regimens in premature ovarian failure. Hyper tension. 2009;53(5):805-11. Comentario en: Hypertension. 2009;53(5):745-6.
44. Heinz M. Hormonal development therapy (HDT) in hypogonadism in long-term view. Best Pract Res Clin Obstet Gynaecol. 2010;24(2):149-55.
45. Meczekalski B, Podfigurna-Stopa A, Genazzani AR. Hypoestrogenism in young women and its influence on bone mass density. Gynecol Endocrinol. 2010;26(9):652-7.
46. Feng W, Cui Y, Zhan H, Shi M, Cui W, Guo K, Li Q, Song C, Zhang Y, Mori T, Gershwin ME, Abraham NG, Ikehara S. Prevention of premature ovarian failure and osteoporosis induced by irradiation using allogeneic ovarian/bone marrow transplantation. Transplantation. 2010;89(4):395-401.
47. Hadji P, Ziller M, Maskow C, Albert U, Kalder M. The influence of chemotherapy on bone mineral density, quantitative ultrasonometry and bone turnover in pre-menopausal women with breast cancer. Eur J Cancer. 2009;45(18):3205-12.
48. Kalantaridou SN, Calis KA, Mazer NA, Godoy H, Nelson LM. A pilot study of an investigational testosterone transdermal patch system in young women with spontaneous premature ovarian failure. J Clin Endocrinol Metab. 2005;90(12):6549-52.
49. Chao SL, Huang LW, Yen HR. Pregnancy in premature ovarian failure after therapy using Chinese herbal medicine. Chang Gung Med J. 2003;26(6):449-52.
50. Chen MJ, Chiue FL, Ho ES. Triplet pregnancy in premature ovarian failure after oocyte donation and in vitro fertilization: a case report and review of literature. Zhonghua Yi Xue Za Zhi (Taipei). 1993;51(4):304-8.
51. Ameratunga D, Weston G, Osianlis T, Catt J, Vollenhoven B. In vitro fertilisation (IVF) with donor eggs in post-menopausal women: are there differences in pregnancy outcomes in women with premature ovarian failure (POF) compared with women with physiological age-related menopause? J Assist Reprod Genet. 2009;26(9-10):511-4.
52. Schmidt KT, Larsen EC, Andersen CY, Andersen AN. Risk of ovarian failure and fertility preserving methods in girls and adolescents with a malignant disease. BJOG. 2010;117(2):163-74.
53. Chevalier N, Dewailly D, Fenichel P. [Oncofertility: a new focus in women health-care...] [Artículo en francés]. Ann Endocrinol (Paris). 2009;70 Suppl 1:S33-41.
54. Anchan RM, Ginsburg ES. Fertility concerns and preservation in younger women with breast cancer. Crit Rev Oncol Hematol. 2010;74(3):175-92.
55. Ben-Aharon I, Bar-Joseph H, Tzarfaty G, Kuchinsky L, Rizel S, Stemmer SM, Shalgi R. Doxorubicininduced ovarian toxicity. Reprod Biol Endocrinol. 2010;8:20.
56. Rosendahl M, Ahlgren J, Andersen J, Bergh J, Blomquist C, Lidbrink E, Lindman H, Mouridsen H, Bjerre K, Andersson M. The risk of amenorrhoea after adjuvant chemotherapy for early stage breast cancer is related to inter-individual variations in chemotherapy-induced leukocyte nadir in young patients: data from the randomised SBG 2000-1 study. Eur J Cancer. 2009;45(18):3198-204.
57. Gauthier T, Piver P, Durand LM, Donadel L, Pech JC, Roux C, Aubard Y. [Chemotherapy and women fertility preservation.] Presse Med. 2010;39(7- 8):786-93.
58. Jadoul P, Dolmans MM, Donnez J. Fer tility preservation in girls during childhood: is it feasible, efficient and safe and to whom should it be proposed? Hum Reprod Update. 12 may 2010. [Epub antes de impresión].
59. Levine J, Canada A, Stern CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol. 10 may 2010. [Epub antes de impresión].
60. Oktay K, Rodriguez-Wallberg KA, Sahin G. Fer tility preservation by ovarian stimulation and oocyte cryopreservation in a 14-year-old adolescent with Turner syndrome mosaicism and impending premature ovarian failure. Fertil Steril. 2010;94(2):753.e15-9.
61. Zervoudis S, Iatrakis G, Navrozoglou I. Reproduction after bresast cancer. Best Pract Res Clin Obstet Gynaecol. 2010;24(1):81-6.
62. Donnez J, Jadoul P, Squifflet J, Van Langendonckt A, Donnez O, Van Eyck AS, Marinescu C, Dolmans MM. Ovarian tissue cryopreser vation and transplantation in cancer patients. Best Pract Res Clin Obstet Gynaecol. 2010;24(1):87-100.
63. Zhao XJ, Huang YH, Yu YC, Xin XY. GnRH antagonist cetrorelix inhibits mitochondria-dependent apoptosis triggered by chemotherapy in granulosa cells of rats. Gynecol Oncol. 2010;118(1):69-75.
64. Park HJ, Koo YA, Im YH, Yoon BK, Choi D. GnRH agonist therapy to protect ovarian function in young Korean breast cancer patients. J Korean Med Sci. 2010;25(1):110-6.
65. Silber S, Kagawa N, Kuwayama M, Gosden R. Duration of fertility after fresh and frozen ovary transplantation. Fertil Steril. 18 feb 2010. [Epub antes de impresión].
66. Ghadami M, El-Demerdash E, Salama SA, Binhazim AA, Archibong AE, Chen X, Ballard BR, Sairam MR, Al-Hendy A. Toward gene therapy of premature ovarian failure: intraovarian imjection of adenovirus expressing human FSH receptor restores folliculogenesis in FSHR(-/-) FORKO mice. Mol Hum Reprod. 2010;16(4):241-50.
Manuscrito recibido el 6 de julio de 2010 y aceptado para publicación el 28 de setiembre de 2010.
Correspondencia:
Dr. José Pacheco Romero
jpachecoperu@yahoo.com














